痛风是由于嘌呤生物合成代谢增加、尿酸产生过多或因尿酸排泄不良而导致的一组异质性疾病。急性痛风性关节炎(acute gouty arthritis, AGA)为痛风的典型表现形式,也是其首发症状,由于尿酸盐结晶(monosodium urate, MSU)析出、沉淀于关节腔内,导致大量炎性细胞浸润,促使关节出现剧烈疼痛、红肿和功能障碍等炎症反应。以往认为该病在我国较为罕见,但随着人民生活水平的提高,饮食结构也发生显著变化,食物中嘌呤物质含量不断地增高使该病在我国发病也日益增加,给人们带来了极大痛苦及不便。髓样细胞表达激发受体(TREM)-1是近年来新发现的免疫球蛋白超家族成员之一,在炎症放大过程中发挥重要的作用[1],它的发现是炎症发生机制研究的重要进展。阻断TREM-1不仅有助于自身免疫性关节炎的病理变化,而且对其他炎症性疾病的器官有一定的保护作用[2-3],故TREM-1的阻断可能会成为治疗AGA的新靶标。电针用于AGA的治疗已有多年,并取得较好的疗效。有研究表明[4],电针对关节炎大鼠有显著的镇痛效果,故能进一步改善AGA的局部症状。本课题采用MSU溶液注射法建立AGA大鼠模型,其病理表现与临床上的AGA患者相似,是由中性粒细胞诱导的炎症。故本课题可通过研究电针对AGA大鼠模型受试踝关节滑膜组织TREM-1表达的影响,以期进一步了解其对AGA的治疗机制。
1 材料秋水仙碱片(昆明制药集团股份有限公司,批号:国药准字J20030017),尿酸钠晶体(Sigma),TNF-α及IL-1β ELISA试剂盒(南京建成生物工程研究所),S-P Rabbit HRP Kit(DAB)兔Streptavidin-HRP试剂盒(武汉博士德生物科技有限公司),TREM-1一抗(武汉博士德生物科技有限公司)、HM-6805-I型经穴治疗仪(恒明牌)0.35×13 mm毫针(华佗牌)等。
2 方法 2.1 分组与治疗40只SD雄性大鼠,由重庆医科大学实验动物中心提供[生产许可证号:SCXK (渝)2007-0001],随机分为正常组、模型组、西药组、电针组,每组各10只。
正常组:不造模,按20 ml/kg予以生理盐水灌胃,1次/d,连续9 d。模型组:造模,造模前2 d开始,按20 ml/kg予以生理盐水灌胃,1次/d,连续9 d。西药组:造模,造模前2 d开始,按1 mg/kg予以秋水仙碱溶液(生理盐水溶解、稀释)灌胃,1次/d,连续9 d。电针组:造模,造模前2 d开始,参照《实验针灸学》取右侧三阴交、解溪、昆仑,毫针直刺,平补平泻,进针后在此3个穴位上接经穴治疗仪,电压9V,电流强度1~3 mA,频率为1.5~2 Hz的疏密波,强度以大鼠局部皮肤肌肉微颤为度,留针20 min,1次/d,连续9 d。
2.2 造模方法根据文献[5]加以改进,大鼠腹腔注射10%水合氯醛溶液麻醉,由大鼠右踝关节后侧,6号注射针针口斜面与胫骨成45°夹角插入跟腱内侧直至踝关节腔,将配制好的0.2 ml MSU溶液(浓度为2.5 g/100 ml)注入关节腔内,以关节囊对侧鼓胀为注入标准。正常组以同样的方法注射同体积生理盐水。实验过程中对动物处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》。
2.3 功能障碍分析标准处死前1H对大鼠进行功能障碍分析。0级正常步态行走,0分;Ⅰ级轻微跛行,受试下肢略弯曲,1分;Ⅱ级中度跛行,受试下肢刚触及地面,2分;Ⅲ级重度跛行,受试下肢离开地面,三足着地行走,3分。
2.4 受试关节滑膜组织TNF-α及IL-1β的检测造模第7天颈椎脱臼处死大鼠,以踝关节为中心上下0.5 cm处剪断,取下受试关节及周围软组织,快速切取关节滑膜组织,称体重,按1:5比例加生理盐水稀释,4℃匀浆,4000 r/min离心5 min,取上清液,分装于Ep管中,按ELISA试剂盒说明,检测关节滑膜组织中TNF-α及IL-1β的含量。
2.5 受试关节滑膜组织TREM-1的表达检测 2.5.1 免疫组化大鼠颈椎脱臼处死后,取部分受试关节组织放入4%多聚甲醛中固定,石蜡包埋、切片。根据免疫组化试剂盒说明书,ABC染色,DBA显色,复染、脱水、透明、封片,以显微镜下细胞胞浆及胞膜内出棕色粒为阳性表达,免疫组化结果采用IHS(immunohistochemical scores)评分。
2.5.2 Western Blot大鼠处死后剪取部分受试踝关节滑膜组织,称重剪碎,按1:5加入0.9% Nacl溶液,4 ℃ 500 r/min离心5 min,弃上清液,反复3次后再按1:5加入蛋白裂解液,4 ℃裂解,4 ℃ 12 000 r/min离心30 min,取上清液,考斯亮蓝进行蛋白定量,后经灌胶,加样,电泳,转膜,一抗、二抗室温孵育2 h,显影,用分子生物学图像分析系统测定灰度值。
2.6 统计学处理采用SPSS 18.0软件对各组数据进行统计分析,数据以均数±标准差表示,差异分析采用t检验,P < 0.05表示差异具有统计学意义。
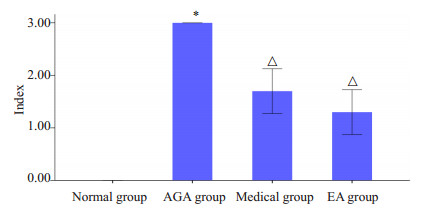
3 结果 3.1 功能障碍指数分析与正常组比较,模型组大鼠功能障碍指数显著增高(P < 0.01);与模型组比较,西药组与电针组大鼠功能障碍指数显著降低(P < 0.01);西药组与电针组比较,无显著差异(P > 0.05,图 1)。
|
图 1 各组大鼠功能障碍指数 Figure 1 The dysfunction index of every group (n=10). vs normal group *P < 0.01, vs AGA group △P < 0.01. |
与正常组比较,模型组大鼠受试踝关节滑膜组织中TNF-α及IL-1β含量增高(P < 0.05);与模型组比较,西药组与电针组大鼠受试踝关节滑膜组织中TNF-α及IL-1β含量明显降低(P < 0.05);西药组与电针组无显著差异(P > 0.05,表 1)。
| 表 1 各组大鼠受试踝关节滑膜组织TNF-α及IL-1β含量 Table 1 The content of TNF-αand IL-1β in ankle joint synovial tissue (n=10) |
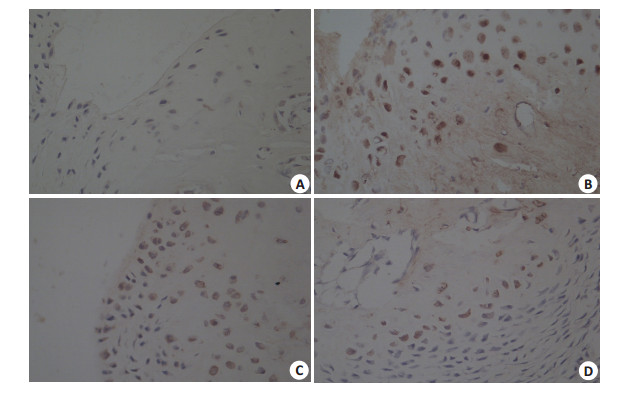
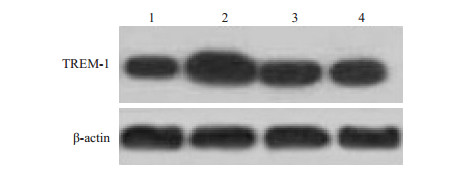
与正常组相比,模型组TREM-1表达量显著增加(P < 0.05);与模型组相比,西药组与电针组TREM-1表达显著减少(P < 0.05);而西药组与电针组之间无显著差异(P > 0.05,表 2,图 2,3)。
| 表 2 免疫组化各组大鼠受试关节滑膜组织TREM-1 IHS评分结果 Table 2 The result of TREM-1 in ankle joint synovial tissue by IHS (n=10) |
|
图 2 免疫组化检测各组大鼠受试踝关节组织TREM-1的表达 Figure 2 the expression of TREM-1 in ankle joint synovial tissue by immunohistochemistry (Original magnification: × 400). A: Normal group; B: AGA group; C: Medication group; D: EA group. |
|
图 3 WB检测各组大鼠受试踝关节组织TREM-1的表达 Figure 3 The expression of trem-1 in ankle joint synovial by WB. 1: Normal group; 2: AGA group; 3: Medication group; 4: EA group. |
急性痛风性关节炎(AGA)属中医“湿热痹”范畴,常因饮食不节伤及脾胃,脾失健运而湿浊内生,或平素体虚感受湿热之邪,邪气壅于经络,痹阻气血经脉,并滞留于关节筋骨,从而出现关节疼痛、肿大、活动不利等症状。本病属正虚邪实之候,治疗应从脾肾入手,采用补虚泻实法。《针灸甲乙经》云:“足下热痛不能久坐,湿痹不能行,三阴交主之”,三阴交位于脾经,又为足三阴经交会穴,有清热健脾利湿,补益肝肾之功;而解溪、昆仑分别为脾经和膀胱经的经穴,属五输穴,是沟通五脏与六腑表里所在,也是脏腑经络之气流注聚集于体表之所在,针刺解溪、昆仑能激发脾肾脏腑经气传导至疼痛关节,即“气至病所” [6]。且电针的镇痛效果较为明显,能进一步改善AGA的局部症状。
AGA是痛风的一种典型表现形式,也是其首发症状,是由于MSU晶体析出并沉积在骨关节组织,MSU能够诱导滑膜细胞、单核细胞-巨嗜细胞等产生TNF-α及IL-1β,从而引起关节及其周围组织遭到破坏及引起炎症反应[7-10],造成受累关节的肿胀、功能障碍等。本实验研究中,与正常组比较,模型组功能障碍指数显著增加(P < 0.01),TNF-α及IL-1β含量增高(P < 0.05),说明MSU注射法能够通过MSU晶体沉淀于关节腔内引起关节炎症及活动障碍而成功制备AGA模型。选择性地抑制IL-1β,能够减轻痛风患者的疼痛及炎症反应[10],同样TNF-α的合成减少,能够抑制AGA的关节炎症反应[11],从而减轻关节破坏引起的症状。西药组、电针组与模型组比较,功能障碍指数显著降低(P < 0.01),TNF-α及IL-1β含量降低(P < 0.05),西药与电针治疗可改善AGA的关节炎症及活动功能,从而抑制AGA的病程进展。
TREM-1是近期发现的一个细胞表面受体,主要表达于单核细胞和中性粒细胞,在急性和慢性疾病中起着重要作用[12]。TREM-1的结构分为胞外免疫球蛋白区、跨膜区和短胞质尾区,其胞外区可特异性地与其配体或单克隆体结合[13]。目前,TREM-1的配体尚未明确,但已知TREM-1可与其未知配体结合,在外界因子的刺激下,诱导TNF-α等炎症介质的分泌,中性粒细胞的脱粒和吞噬反应等,使炎症部位中性粒细胞和单核细胞的生存时间延长[14]。MSU能够诱导AGA大鼠腹膜中巨噬细胞和中性粒细胞中TREM-1的表达[15],且被激活的TREM-1能够诱导TNF-α、IL-1β等促炎因子的释放[16],而AGA关节炎症部位周围浸润着大量的巨嗜细胞及中性粒细胞等炎症细胞。本实验研究中,模型组大鼠踝关节组织TREM-1的表达明显高于正常组(P < 0.05)。由此可知,MSU诱导大鼠受试踝关节滑膜组织TREM-1出现高表达,可能通过增强其受试关节炎症的反应,进而促进了AGA大鼠模型的病情进展。TREM-1的表达同时受某些促炎因子及抗炎因子的影响,与其下游信号通路中的炎症细胞因子形成正反馈自分泌调节回路,因此,阻断TREM-1的信号通路可减轻炎症反应。而TREM-1的表达是非感染性炎症的一个重要标志[17],其表达量反映炎症反应的严重程度[18]。本实验研究中,西药组与电针组TREM-1的表达量显著低于模型组(P < 0.05),可能是通过西药与电针治疗,降低了AGA大鼠模型踝关节组织TREM-1的表达,从而抑制了TREM-1的下游信号的转导,减轻了踝关节的炎症反应,最终抑制AGA的病情进展。有研究显示,TREM-1可作为类风湿关节炎的治疗新靶点[2],而本实验研究发现TREM-1的表达随着AGA病情改变而改变,故TREM-1亦可作为AGA治疗新靶点,为今后临床治疗AGA提供理论依据。
本实验研究揭示,西药与电针治疗AGA大鼠模型,能够改善受试关节功能障碍、降低其受试踝关节滑膜组织中的TREM-1的表达量,从而能起到一定的治疗效果。然而,西药组与电针组关节功能障碍指数、踝关节组织TREM-1的表达均无明显差异(P > 0.05),表明西药与电针对AGA大鼠的疗效无显著差异。通过临床观察发现,长期服用西药会出现恶心、呕吐,严重者出现骨髓抑制、肾功能衰竭甚至死亡等毒副作用,限制了其临床应用。电针治疗AGA,简便廉效,疗效显著,且副作用小,有着西药无可替代的地位。本实验研究揭示电针对AGA大鼠的治疗效果,为今后临床开展电针治疗AGA提供了理论依据,而电针对AGA大鼠的具体治疗机制还需进一步深入研究。
| [1] | Pierobon D, Bosco MC, Blengio F, et al. Chronic hypoxia reprograms human immature dendritic cells by inducing a proinflammatory phenotype and TREM-1 expression[J]. Eur J Immunol,2013, 43 (4) : 949-66. DOI: 10.1002/eji.201242709. |
| [2] | Wai H, Kohsaka H. Blockade of triggering recepressed on myeloid cells-1 as a new therapy of arthritis[J]. Nihon Rinsho Meneki Gakkai Kaishi,2012, 35 (1) : 81-6. DOI: 10.2177/jsci.35.81. |
| [3] | Murakami Y, Akahoshi T, Aoki N, et al. Intervention of an inflammation amplifier, triggering receptor expressed on myeloid cells 1, for treatment of autoimmune arthritis[J]. Arthritis Rheum,2009, 60 (6) : 1615-23. DOI: 10.1002/art.v60:6. |
| [4] | 张皓, 王健, 陈新勇, 等. 电针对佐剂性关节炎大鼠镇痛作用及内啡肽影响[J]. 青岛大学医学院学报,2010, 46 (5) : 390-2. |
| [5] | 黄火高, 孙运峰, 胡明, 等. 大鼠急性痛风性关节炎模型的建立及特点[J]. 军事医学科学院院刊,2005, 29 (6) : 538-42. |
| [6] | 石焱, 陈华德. 五输穴与十二经脉脉气流注的关系[J]. 中华中医药学刊,2007, 25 (9) : 1971-2. |
| [7] | 孙菁, 周进祝. 内科学[M]. 北京: 科学出版社, 2003 : 830 -5. |
| [8] | 黄敬群, 孙文娟, 王四旺, 等. 尿酸钠致急性痛风性关节炎模型大鼠与槲皮素的抗炎作用[J]. 中国组织工程研究,2012, 16 (15) : 2815-9. |
| [9] | Sabina EP, Chandel S, Rasool MK. Inhibition of monosodium urate crystal-induced inflammation by withaferin a[J]. J Pharm Pharm Sci,2008, 11 (4) : 46-55. |
| [10] | Mylona EE, Mouktaroudi M, Crisan TO, et al. Enhanced interleukin-1β production of PBMCs from patients with gout after stimulation with Toll-like receptor-2 ligands and urate crystals[J]. Arthritis Res Ther,2012, 14 (4) : R158. |
| [11] | Miguelez R, Palacios I, Navarro F, et al. Anti-inflammatory effect of a PAF receptor antagonist and a new molecule with antiproteinase activity in an experimental model of acute urate crystal arthritis[J]. J Lipid Mediat Cell Signal,1996, 13 (1) : 35-49. DOI: 10.1016/0929-7855(95)00043-7. |
| [12] | Kim TH, Choi SJ, Lee YH, et al. Soluble triggering receptor expression on myeloid cells-1 as a new therapeutic molecule in rheumatoid arthritis[J]. Med Hypotheses,2012, 78 (2) : 270-2. DOI: 10.1016/j.mehy.2011.10.042. |
| [13] | 李慧娟, 李焱, 杨敬敬, 等. 类风湿关节炎患者可溶性髓样细胞表达的触发因子受体-1的表达及意义[J]. 中国医药导报,2013, 10 (26) : 71-5. |
| [14] | Radsak MP, Salih HR, Rammensee HG, et al. Triggering receptor expressed on myeloid cells-1 in neutrophil inflammatory responses: Differential regulation of activation and survival[J]. J Immunol,2004, 172 (8) : 4956-63. DOI: 10.4049/jimmunol.172.8.4956. |
| [15] | Murakami Y, Akahoshi T, Hayashi I, et al. Induction of triggering receptor expressed on myeloid cells 1 in murine resident peritoneal macrophages by monosodium urate monohydrate crystals[J]. Arthritis Rheum,2006, 54 (2) : 455-62. DOI: 10.1002/(ISSN)1529-0131. |
| [16] | Kuai J, Gregory B, Hill A, et al. TREM-1 expression is increased in the synovium of rheumatoid arthritis patients and induces the expression of pro-inflammatory cytokines[J]. Rheumatol (Oxford),2009, 48 (11) : 1352-8. DOI: 10.1093/rheumatology/kep235. |
| [17] | Cavaillon JM. Monocyte TREM-1 membrane expression in noninfectious inflammation[J]. Crit Care,2009, 13 (3) : 152. DOI: 10.1186/cc7882. |
| [18] | Murakami Y, Kohsaka H. Triggering receptor expressed on myeloid cells-1 as an inflammation amplifier[J]. Nihon Rinsho Meneki Gakkai Kaishi,2009, 32 (4) : 242-8. DOI: 10.2177/jsci.32.242. |
 2015, Vol. 35
2015, Vol. 35
