2. 贵州中医药大学基础医学院,贵州 贵阳 550025;
3. 广州中医药大学第一附属医院,广东 广州 510405;
4. 广州中医药大学第三附属医院,广东 广州 510240
2. Basic Medical School, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China;
3. Department of Neurology, First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510405, China;
4. Department of Neurology, Third Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510240, China
神经病理性疼痛(NP)患病率高,临床疗效有限,严重影响着患者的日常生活及行为功能[1-3]。慢性压迫性损伤(CCI)模型是最为经典的NP模型之一,痛觉过敏表现与人类相似,常作为机制研究及药物开发的基础模型[4-5]。该模型建立初期采用铬制肠线结扎坐骨神经造成部分损伤,但由于铬线材质稍硬,结扎时操作者不易控制线结松紧程度,故近年来有研究采用丝线进行造模[6-9]。值得注意的是,脊髓小胶质细胞核和星形胶质细胞在神经病理性疼痛形成过程中具有重要作用,尤其是在引起炎性细胞因子释放方面[10-12]。然而目前关于既往模型的研究未能分析不同材料造模所引发的痛觉过敏背后是存在胶质细胞激活差异及相关细胞因子释放差异。故本研究通过对比丝线与铬线制备的CCI模型,探究不同材料对该模型行为学及微观分子表达的影响,以期为广大研究者选择造模材料提供更具体的参考依据。
1 材料和方法 1.1 动物及主要材料SPF级170~200 g健康SD大鼠44只购于南方医科大学实验动物中心,许可证SYXK(粤)2016-0041。4-0编织丝线(上海金环),铬制羊肠线(山东博达),RIPA裂解液(弱)(上海碧云天),PMSF液(广州浩玛),BCA蛋白浓度测定试剂盒(上海碧云天),SDS(Sigma),丙烯酰胺(Sigma),蛋白marker预染(Therom Scientific),兔anti-CD11b、anti-GFAP(Abcam)、兔GAPDH(杭州贤至),羊抗兔IgG(北京博奥森)。Trizol(西安赫特),氯仿(上海麦克林)异丙醇、无水乙醇(上海麦克林),DEPC(Sigma),PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time)、TB Green® Premix Ex Taq™ Ⅲ(Tli RNaseH Plus)(TAKARA公司)。砂罗铬花青染液(广州化学试剂厂),10%硫酸铁铵(广州化学试剂厂),伊红(广州化学试剂厂)。2390系列von Frey电子测痛仪及390爪刺激痛觉测试仪,购于ⅡTC-Life Science。电泳仪、显影仪(Bio-Rad),多功能酶标仪(Therom Scientific)。基因扩增仪(珠海黑马医学仪器有限公司),7500PCR仪(ABI)。
1.2 实验方法 1.2.1 动物分组所有大鼠于室温23±2 ℃,湿度(50± 5)%的环境饲养5 d。完成基础值检测后按照随机数字表法分为:对照组(Control组)15只,丝线CCI组(SC组)15只,铬线CCI组(CC组)14只。
1.2.2 模型建立按照1988年Bennett和Xie[13]的结扎方法,采用两种不同的结扎材料制备CCI模型。10%的水合氯醛(350 mg/kg)麻醉后,保持左后肢和中线约45°,消毒固定。在左侧大腿中下1/3处用刀片划开皮肤,钝性分离并暴露左侧坐骨神经。分别采用丝线和铬线,在临近坐骨神经分叉处上5 mm进行4次结扎,每次间隔约1.0 mm。结扎强度以坐骨神经微微塌陷为宜,并由同一位研究者完成全部结扎,以提高线结松紧程度的一致性。结扎后逐层缝合并消毒。
1.2.3 行为学测定分别于造模前2 d及造模后的3、7、11、15 d对各组大鼠进行行为学测试,以评估术后机械痛及热痛觉过敏情况及药物治疗效果。每次行为学测试均在10:00 am至18:00 pm内进行,放置老鼠与测试分别由不同实验人员进行,以保证测试结果的准确性。每足均测量5次,每次间隔5 min,取5次平均值。
机械缩足反射阈值(MWT):测试前将大鼠置于底部为金属筛网的玻璃箱(22 cm×12 cm×22 cm)内安静30 min。用电子测痛仪垂直刺激大鼠术侧后肢足底中部,并逐渐加压直到其出现抬足或舔足行为,记录显示屏上的阈值。
热缩足反射阈值(TWL):测试前将大鼠置于底部为玻璃板的玻璃箱(20 cm×15 cm×18 cm)内安静30 min,待适应环境后开始测量。用热辐射测痛仪器测定,当大鼠感觉到疼痛现抬足时,按停止键,此时显示的时间为热痛阈值,每次照射时间不超过20 s以免灼伤。
1.2.4 组织取材造模后第15天进行取材,大鼠深度麻醉后,使用组织剪清除周围肌肉组织充分暴露脊柱,用咬骨钳清除椎板后暴露脊髓,剪断腰4-6段神经损伤侧的脊髓周围的前根和后跟将其取出。使用尖镊于PBS中将脊膜剥离。放入-80 ℃超低温冰箱备用。用组织剪剪开大鼠左侧下肢的皮肤及肌肉,将坐骨神经结扎处近端取出约长1 cm的神经组织,放入10%的福尔马林中固定,病理检测备用。
1.2.5 坐骨神经病理观察固定后的组织在通风橱内用手术刀将目的部位修正平整放入脱水盒内。依照75%酒精4 h、85%酒精2 h、90%酒精2 h、95%酒精1 h、无水乙醇Ⅰ 30 min、无水乙醇Ⅱ 30 min、100%乙醇ⅡⅠ 30 min、二甲苯Ⅰ 15~30 min、二甲苯Ⅱ 15~30 min、蜡Ⅰ 1 h、蜡Ⅱ 1 h、蜡Ⅲ 1 h的程序完成脱水。将浸好蜡的组织至于包埋机内,凝固后取出蜡块并进行修整。于石蜡切片机上进行切片,片厚4 μm。摊片烘干后备用。将切片依次放入二甲苯Ⅰ 20 min、二甲苯Ⅱ 20 min、无水乙醇Ⅰ 10 min、无水乙醇Ⅱ 10 min、95%酒精5 min、90%酒精5 min、80%酒精5 min、70%酒精5 min、蒸馏水洗。砂罗铬花青染液于切片上染15~20 min,10%硫酸铁铵分化1~5 min,流水冲洗5~10 min。伊红染10~30 s,水洗。梯度酒精脱水,二甲苯透明,晾干,中性树胶封片。
1.2.6 Western blot法检测胶质细胞表达情况脊髓组织中加入RIPA裂解液(含PMSF液)充分裂解后,震荡均有后取少量样品根据BCA蛋白定量试剂盒说明测定蛋白浓度。剩余蛋白加入5×蛋白上样缓冲液(4:1),100 ℃煮5 min,13 000×g,4 ℃离心5 min,取上清。-80 ℃保存备用。分别配制12%和8%的SDS-PAGE胶后开始加样。15 μg样品缓慢加入样品孔中,80 V进行浓缩胶电泳45 min,120 V在分离胶中电泳45 min。结束后开始转膜,0.2A转膜120 min后将膜浸在封闭液中室温封闭1 h后,取出放入anti-CD11b(1:1000)、anti-GFAP(1:10 000)、GAPDH(1:1000)中,4 ℃反应过夜;TBST洗膜,10 min×3次;将膜转入二抗(1: 4000)中,室温反应1 h;TBST洗膜,10 min×3次;用化学发光法显影。
1.2.7 RT-PCR检测胶质细胞及炎症因子变化脊髓组织加入Trizol(25~50 mg组织加入500 μL)后研磨粉碎,加入氯仿(1/5 Trizol体积),离心取上清,加入异丙醇(1/2 Trizol体积),离心后弃上清,加入75%乙醇(等于Trizol体积)后吹干。取少量RNA进行浓度测定。根据测定的浓度进行稀释,按照试剂盒说明进行去除基因组DNA反应后,进行20 μL体系的逆转录反应,反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 60 min。按照PCR试剂盒说明书中的Fast Real-time PCR System进行操作。采用50 μL体系,反应条件为:预变性条件:95 ℃ 30 s;PCR反应条件:40,95 ℃ 5 s,60 ℃ 30 s。以GAPDH为内参,采用2-△△CT法进行数据的相对定量分析,ΔΔCT=待测样品中目的基因ΔCT—参照样品中目的基因ΔCT,表示目的基因mRNA的相对表达量。引物序列如表 1。
| 表 1 引物序列 Tab.1 Sequences of the primers |
所有组别大鼠的行为学数据以均数±标准差表示, 使用SPSS 21.0统计软件,采用单因素方差分析法进行统计,其中满足方差齐性的数据组间比较采用LSD法,不满足方差齐性的数据采用Dunnett's T3法进一步分析组间差异。以P<0.05认为差异有统计学意义。
2 结果 2.1 行为学结果术前各组实验大鼠MWT及TWL基础值差异无统计学意义。于术后第3天,与对照组相比,铬线组及丝线组MWT及TWL均下降,差异有显著统计学差异(P<0.01);与铬线组相比,丝线组TWL值下降程度稍低(P<0.05)。术后7、11、15 d,铬线组及丝线组MWT及TWL值均维持很低水平,与对照组相比,差异有显著统计学意义(P<0.01);两组间MWT及TWL值差异则无统计学意义(P>0.05,图 1)。
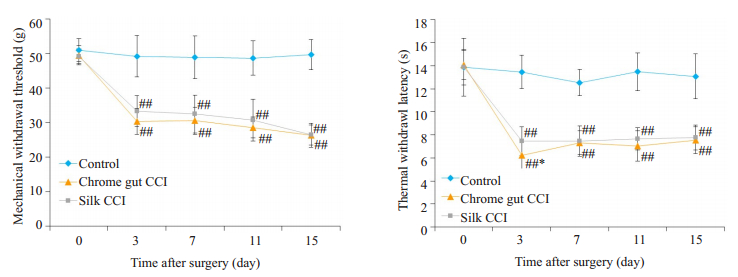
|
图 1 各组大鼠行为学测量结果 Fig.1 Results of behavioral test in each group. Compared with the control group, #P < 0.05; Compared with the control group, ##P < 0.01; Compared with the chrome group, *P < 0.05; Compared with chrome group, **P < 0.01. |
术后15 d对各组大鼠的坐骨神经进行砂罗铬花青染色,来观察不同大鼠髓鞘结构排列情况。结果显示对照组大鼠坐骨神经染色后髓鞘呈蓝色,神经细胞胞质等呈鲜红色,髓鞘完整,排列整齐,紧密的围绕在轴突周围。而丝线组和铬线组大鼠的坐骨神经染色后,均可见髓鞘结构紊乱,出现变性融合,髓鞘化程度低,神经束间隙变大,出现明显的神经损伤表现,且两组大鼠神经损伤程度相当(图 2)。
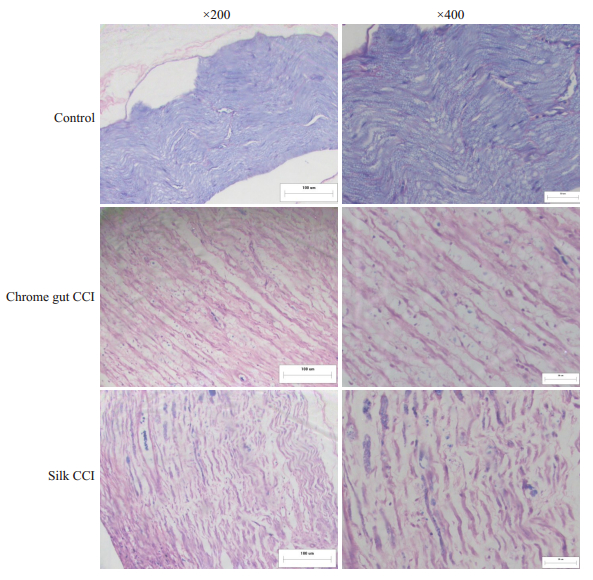
|
图 2 各组大鼠坐骨神经砂罗铬花青法染色结果 Fig.2 Pathological staining results of sciatic nerve in each group (Left, ×200; Right, ×400). |
采用Western blot法检测各组大鼠小胶质细胞标记物(CD11b)及胶质纤维状酸性蛋白(GFAP)表达情况。如图 3所示,与对照组相比,术后15 d铬线组及丝线组CD11b及GFAP表达均升高(P<0.05);但两组间差异无统计学意义(P>0.05)。
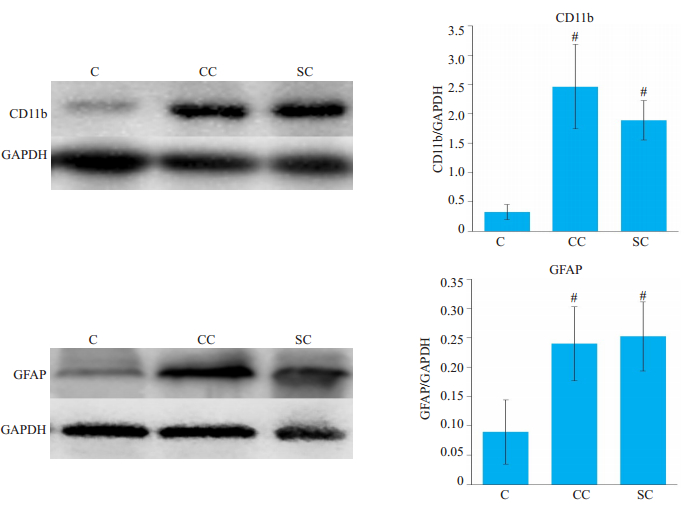
|
图 3 Western blot法检测各组大鼠CD11b、GFAP表达情况 Fig.3 CD11b and GFAP expressions in each group were tested by Western blot. #P < 0.05 vs control group; *P < 0.05 vs chrome group. |
采用RT-PCR法检测大鼠脊髓内胶质细胞及炎症因子mRNA转录情况。术后15 d,与对照组相比,铬线组及丝线组CD11b及GFAP mRNA表达均升高,差异有统计学意义(P<0.05);但两组间差异无统计学意义(P>0.05)。细胞因子表达术后15 d,与对照组相比,铬线组及丝线组TNF-α、IL-1β及IL-6 mRNA表达水平均升高(P<0.05);但组间IL-1β及TNF-α mRNA表达无统计学差异(P>0.05),铬线组IL-6则高于丝线组,差异有统计学意义(P<0.05,表 2)。
| 表 2 RT-PCR法各组大鼠胶质细胞及炎症因子mRNA变化情况 Tab.2 Changes of glial cells and inflammatory cytokines mRNA in each group tested by RT-PCR (Mean±SD) |
CCI模型是由Bennett和Xie于1988年所创立,方法简单且能够在不完全损伤神经的情况下较好地模拟人类临床中的机械痛觉及热痛觉过敏症状,故被广泛用于NP的基础研究。早期研究者多采用4-0铬制肠线结扎坐骨神经制备该模型,但铬线材料不易得,且质地较硬,打结时松紧程度不易掌握。后陆续有文献报道采用4-0丝线代替铬线造模,其中Van等[14]对不同材料制备的CCI模型行为学结果进行比较,认为丝线模型在丙酮测试、冷板测试和纤维丝测试中,评分结果优于铬线组。本课题组在前人研究的基础上,结合制备CCI模型过程中遇到的实际问题,进一步探究不同材料对该模型行为学的影响及可能相关的分子机制。
与Van研究不同之处在于,此次实验结果中铬线组只在术后早期较丝线组热痛觉阈值下降显著,这可能是由铬线所释放的铬离子对坐骨神经产生炎性刺激所引发[15]。甚至也有研究认为[16-17],由于存在这种炎症反应故铬线不适合制备CCI模型从而采用丝线造模。而随着时间的推移,两组大鼠机械痛觉阈值及热痛觉阈值均维持在较低水平且终趋于接近。我们分析,首先行为学中的纤维丝测试机械痛阈值与热板测试是检测热痛觉阈值的经典方法[18-19],已能够说明CCI模型的痛觉过敏与异常性疼痛表现,很多研究都将其用于CCI模型的行为学评估[20-22]。其次,与Van研究相比,热痛结果接近而纤维丝测试的机械痛结果存在差异。由于先前的研究采用的实验对象为6周龄C57BL小鼠,其坐骨神经的粗细程度及手术操作面积与大鼠相差较大,且结扎3次,那么每个线结的压迫程度在痛敏形成中的作用比例则增加。故我们猜想,铬线较硬的质地影响操作难度,使松紧度对模型痛阈的影响加大,故而出现了不同的行为学表现。为观察不同材料对大鼠坐骨神经结扎后产生的病理变化是否相同,进行了特殊染色进行观察。发现丝线结扎的大鼠的坐骨神经可与铬线结扎大鼠的坐骨神经产生相近的病理改变。说明无论是丝线还是铬线,均可以通过压迫作用使坐骨神经损伤脱髓鞘,从而出现NP症状。
为探究不同材料造成慢性压迫性损伤的分子机制是否相同,我们检测了脊髓中的小胶质细胞、星型胶质细胞以及其下游炎症因子等在疼痛形成及维持中有重要作用[23-25]的分子。早期已有研究认为可以通过抑制胶质细胞活化,从而减少许促炎性介质表达,而达到抑制疼痛的作用[26-27]。CD11b和GFAP分别为小胶质细胞和星形胶质细胞的标记物[28],多种NP模型中均可证实其二者的激活与机械痛觉过敏及热痛觉过敏表现有密切关系,同时激活后可释放TNF-α、IL-1β及IL-6等促炎性细胞因子[27, 29-30]。在本研究中,丝线和铬线制备的CCI模型其表达都高于对照组,说明两种材料结扎坐骨神经后均可引起大鼠脊髓背角的胶质细胞活化,且激活程度不因材料不同而有差异。两种胶质细胞激活后,会引起下游炎性细胞因子释放,故而我们也同时验证了不同细胞因子基因表达情况。从结果来看,差异主要存在于IL-6 mRNA,铬线制备CCI模型水平高于丝线组。但是而促炎性细胞因子的升高,仅是非特异性神经炎症的标记物,而其引发疼痛表现仍需上调多种下游炎症因子表达来实现[31-33],单独的IL-6升高的作用有可能会被其他的分子物质所抵消。若想要引起典型的NP表现,仍需要胶质细胞激活参与的免疫级联反应才能引发。所以,虽然我们的研究也证实了铬线具有更加强烈炎症反应的观点,但是不同结扎材料对NP形成中至关重要的胶质细胞活化并无影响。
综上所述,丝线与铬线均是理想的造模材料,可以通过压迫坐骨神经造成外周神经损伤激活脊髓背角的胶质细胞引发NP症状,但各有特点。其中铬线能释放铬离子,模型炎症反应强烈,但质地较硬打结手感不易掌握,造模材料也不易获得;丝线模型的优势为材料质软,材料易得,且可以较快掌握打结的手感从而降低造模失败率。因此,广大NP研究者在制备CCI模型时,可根据自己的研究内容并结合两种材料的特点来进行选择。
| [1] |
Bannister K, Sachau J, Baron R, et al. Neuropathic pain: Mechanism- Based therapeutics[J]. Annu Rev Pharmacol Toxicol, 2020, 60(8): 257-74. |
| [2] |
Vos T, Flaxman AD, Naghavi M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859): 2163-96. DOI:10.1016/S0140-6736(12)61729-2 |
| [3] |
O'connor AB. Neuropathic pain: quality-of-life impact, costs and cost effectiveness of therapy[J]. Pharmacoeconomics, 2009, 27(2): 95-112. |
| [4] |
Jaggi AS, Jain V, Singh N. Animal models of neuropathic pain[J]. Fundam Clin Pharmacol, 2011, 25(1): 1-28. |
| [5] |
Austin PJ, Wu A, Moalem-Taylor G. Chronic constriction of the sciatic nerve and pain hypersensitivity testing in rats[J]. J Vis Exp, 2012(61): 1-6. |
| [6] |
Onodera Y, Kanao-Kanda M, Kanda H, et al. Pregnancy suppresses neuropathic pain induced by chronic constriction injury in rats through the inhibition of TNF-alpha[J]. J Pain Res, 2017, 10(8): 567-74. |
| [7] |
Komirishetty P, Areti A, Yerra VG, et al. PARP inhibition attenuates neuroinflammation and oxidative stress in chronic constriction injury induced peripheral neuropathy[J]. Life Sci, 2016, 150(1): 50-60. |
| [8] |
Piotrowska A, Rojewska E, Pawlik K, et al. Pharmacological blockade of spinal CXCL3/CXCR2 signaling by NVP CXCR2 20, a selective CXCR2 antagonist, reduces neuropathic pain following peripheral nerve injury[J]. Front Immunol, 2019, 10(9): 2198. |
| [9] |
Sobeh M, Mahmoud MF, Rezq S, et al. Haematoxylon campechianum Extract Ameliorates Neuropathic Pain via Inhibition of NF-kappaB/ TNF-alpha/NOX/iNOS Signalling Pathway in a Rat Model of Chronic Constriction Injury[J]. Biomolecules, 2020, 10(3): 1-34. |
| [10] |
Ali U, Apryani E, Wu HY, et al. Low frequency electroacupuncture alleviates neuropathic pain by activation of spinal microglial IL-10/ beta-endorphin pathway[J]. Biomed Pharmacother, 2020, 125(5): 109898. |
| [11] |
Moraes TR, Elisei LS, Malta IH, et al. Participation of CXCL1 in the glial cells during neuropathic pain[J]. Eur J Pharmacol, 2020, 28(2): 173039. |
| [12] |
Soleimani M, Sheikholeslami MA, Ghafghazi S, et al. Analgesic effect of alpha-terpineol on neuropathic pain induced by chronic constriction injury in rat sciatic nerve:Involvement of spinal microglial cells and inflammatory cytokines[J]. Iran J Basic Med Sci, 2019, 22(12): 1445-51. |
| [13] |
Bennett GJ, Xie YK. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain, 1988, 33(1): 87-107. |
| [14] |
van der Wal S, Cornelissen L, Behet M, et al. Behavior of neuropathic pain in mice following chronic constriction injury comparing silk and catgut ligatures[J]. Springerplus, 2015, 15(5): 225. |
| [15] |
Maves TJ, Pechman PS, Gebhart GF, et al. Possible chemical contribution from chromic gut sutures produces disorders of pain sensation like those seen in man[J]. Pain, 1993, 54(1): 57-69. |
| [16] |
Kukkar A, Singh N, Jaggi AS. Neuropathic pain-attenuating potential of aliskiren in chronic constriction injury model in rats[J]. J Renin Angiotensin Aldosterone Syst, 2013, 14(2): 116-23. DOI:10.1177/1470320312460899 |
| [17] |
Kukkar A, Singh N, Jaggi AS. Attenuation of neuropathic pain by Sodium butyrate in an experimental model of chronic constriction injury in rats[J]. J Formos Med Assoc, 2014, 113(12): 921-8. DOI:10.1016/j.jfma.2013.05.013 |
| [18] |
Hargreaves K, Dubner R, Brown F, et al. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J]. Pain, 1988, 32(1): 77-88. |
| [19] |
Chaplan SR, Bach FW, Pogrel JW, et al. Quantitative assessment of tactile allodynia in the rat paw[J]. J Neurosci Methods, 1994, 53(1): 55-63. |
| [20] |
Li Z, Guo Y, Ren X, et al. HDAC2, but not HDAC1, regulates Kv1.2 expression to mediate neuropathic pain in CCI rats[J]. Neuroscience, 2019, 408(7): 339-48. |
| [21] |
Safakhah HA, Damghanian F, Bandegi AR, et al. Effect of crocin on morphine tolerance and serum BDNF levels in a rat model of neuropathic pain[J]. Pharmacol Rep, 2020, 72(2): 1-9. |
| [22] |
Murasawa H, Kobayashi H, Saeki K, et al. Anxiolytic effects of the novel alpha2delta ligand mirogabalin in a rat model of chronic constriction injury, an experimental model of neuropathic pain[J]. Psychopharmacology (Berl), 2020, 237(1): 189-97. |
| [23] |
Gao YJ, Ji RR. Targeting astrocyte signaling for chronic pain[J]. Neurotherapeutics, 2010, 7(4): 482-93. DOI:10.1016/j.nurt.2010.05.016 |
| [24] |
Popiolek-Barczyk K, Mika J. Targeting the microglial signaling pathways:new insights in the modulation of neuropathic pain[J]. Curr Med Chem, 2016, 23(26): 2908-28. DOI:10.2174/0929867323666160607120124 |
| [25] |
Nishihara T, Tanaka J, Sekiya K, et al. Chronic constriction injury of the sciatic nerve in rats causes different activation modes of microglia between the anterior and posterior horns of the spinal cord[J]. Neurochem Int, 2020, 134(3): 104672. |
| [26] |
Zheng Y, Hou X, Yang S. Lidocaine potentiates SOCS3 to attenuate inflammation in microglia and suppress neuropathic pain[J]. Cell Mol Neurobiol, 2019, 39(8): 1081-92. |
| [27] |
Sun JS, Yang YJ, Zhang YZ, et al. Minocycline attenuates pain by inhibiting spinal microglia activation in diabetic rats[J]. Mol Med Rep, 2015, 12(2): 2677-82. |
| [28] |
Ji RR, Berta T, Nedergaard M. Glia and pain:is chronic pain a gliopathy?[J]. Pain, 2013, 154 Suppl 1(1): S10-28. |
| [29] |
Chen G, Zhang YQ, Qadri YJ, et al. Microglia in pain:detrimental and protective roles in pathogenesis and resolution of pain[J]. Neuron, 2018, 100(6): 1292-311. DOI:10.1016/j.neuron.2018.11.009 |
| [30] |
Xu H, Dang SJ, Cui YY, et al. Systemic injection of Thalidomide prevent and attenuate neuropathic pain and alleviate neuroinflammatory response in the spinal dorsal Horn[J]. J Pain Res, 2019, 12(3): 3221-30. |
| [31] |
Pillarisetti S. Targeting interleukin-1beta for pain[J]. CNS Neurol Disord Drug Targets, 2011, 10(5): 571-5. DOI:10.2174/187152711796234998 |
| [32] |
Brazda V, Klusakova I, Hradilova SI, et al. Dynamic response to peripheral nerve injury detected by in situ hybridization of IL-6 and its receptor mRNAs in the dorsal root ganglia is not strictly correlated with signs of neuropathic pain[J]. Mol Pain, 2013, 9(8): 42. |
| [33] |
Olmos G, Lladó J. Tumor necrosis factor alpha: a Link between neuroinflammation and excitotoxicity[J]. Mediators Inflamm, 2014, 4(3): 861231. |
 2020, Vol. 40
2020, Vol. 40

