2. 广东省食管癌精准治疗工程技术研究中心,广东 广州 510080;
3. 广东药科大学附属第一医院科学研究中心,广东 广州 510080
2. Guangdong Provincial Engineering Research Center for Esophageal Cancer Precise Therapy, Guangzhou 510080, China;
3. Scientific Research Center, First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, China
2015年中国新诊断食管癌47.8万人,37.5万人死于食管癌,分别占2015年癌症新诊断人数和死亡人数的11.1%和13.3%[1]。对于食管癌的治疗,手术仍是主要治疗方法[2],大多数患者预后较差,5年生存率不到20%[3]。放、化疗仍是治疗食管鳞癌患者(ESCC)的主流方法,然而药物有效率低且并发症大[4-6]。近年来,以分子为靶标的治疗已发展成为食管癌中一种有希望的有效治疗方法。主要是抗EGFR抑制剂[5],很多药物仍处于临床试验阶段,对于ESCC患者是否安全有效仍有待评估。因此建立模拟患者来源的ESCC特异性的模型对临床前研究、药物评估、治疗和预后具有重要的转化意义。
目前已知的研究食管癌的动物模型不少,许多已进入主流研究平台[7-9]。患者来源的移植瘤(PDX)模型,PDX模型是将患者手术切除的肿瘤组织移植到免疫缺陷小鼠体内,这不仅能够高度保留患者肿瘤组织的异质性、病理特征,还保存了肿瘤细胞间相互作用及肿瘤微环境[10]。PDX模型可以直接携带患者身上肿瘤靶标的模型,并且药效反应与临床结果一致[11],因此PDX模型对于ESCC患者精准用药的筛选具有很大的优势。目前为止,对于ESCC PDX模型的建立所用到的小鼠品系有:无胸腺裸鼠,严重免疫缺陷(SCID)小鼠[12-13],非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠[14-15]以及敲除IL2Rγ的NOD/SCID小鼠(NSG/NOG)[16],然而,不同小鼠品系之间ESCC肿瘤成功率差异较大[17],但目前并未有不同小鼠品系之间建模成功差异的研究。
在本文研究中,使用了B-NDG®(NODPrkdcscidIL2rgtm1/Bcgen)(即NSG)小鼠,缺乏成熟的T、B和NK细胞,相较于常用的NOD/SCID小鼠来说,NSG鼠的免疫缺陷程度更高,适合人源细胞或组织的移植。目前未有研究报道哪一种小鼠品系进行ESCC PDX模型的移植成功效率更高。本研究使用NSG小鼠和BALB/c裸鼠建立ESCC PDX模型,通过比较肿瘤成瘤率,肿瘤成瘤时间,肿瘤的病理特征及基因表达,在NSG小鼠和BALB/c小鼠之间选择更优的小鼠品系来建立ESCC PDX模型,这将为以后食管癌个体化治疗及药物筛选提供更好的基础。
1 资料和方法 1.1 实验动物雌性4~6周龄NSG小鼠[百奥赛图,SCXK(苏)2016-0004)],体质量17~20 g。雌性4周龄BALB/c裸鼠购于广东省医学实验动物中心[实验动物合格证:SCXK(粤)2018-002]。饲养于屏障环境下,SPF级,湿度30%~50%,室温20~22 ℃。予以经过钴-60辐照灭菌的SPF级小鼠饲料饲养,3~4 d换1次垫料。
1.2 标本选择22例ESCC标本来自广东省人民医院及广东药科大学附属第一医院胸外科经手术治疗的病人,自2017年9月至2020年1月的22例患者,标本搜集均获得患者知情同意。纳入标准:①ESCC初治患者,术前未行化、放疗等相关治疗;②组织病理结果提示为ESCC;③提供的新鲜组织标本大小合适且质地较好。排除标准:①5年内患有其他肿瘤疾病;②术前已进行ESCC相关治疗。
1.3 ESCC PDX小鼠模型的建立将患者手术切除的ESCC肿瘤组织存放于磷酸盐缓冲液(PBS)中,在30~60 min内冰上运送至动物中心进行移植,用无菌器械将肿瘤切碎成约10~20 mg的组织块,在小鼠下肢背部用70%酒精消毒并剪一小缺口,将切碎的组织块(10~20 mg)塞入小鼠皮下,按压约2~ 3 min防止组织块漏出。每例标本接种3~5只小鼠。当形成异种移植物时,我们将这些肿瘤定义为P1代,一旦P1代肿瘤达到1000 mm3,取下肿瘤,进行下一代移植,此为第2代小鼠,定义为P2,依此类推。所有动物实验均得到广东药科大学附属第一医院动物护理和使用委员会的批准。整个实验在无菌条件下进行。从肿瘤接种到肿瘤生长至体积约为250 mm3所用时间定义为成瘤时间。如果在4个月内肿瘤体积长至1000 mm3,则表明该模型成功。
1.4 观察与计算公式移植后每3 d定期观测小鼠的活动状态,监测小鼠体重变化及肿瘤生长情况。通过游标卡尺每周2次测量肿瘤的大小,公式:(最长半径×最短半径2)/2[18]。
1.5 HE染色将小鼠颈椎脱臼后取下肿瘤,取部分放于4%多聚甲醛中固定24 h,然后常规石蜡包埋,6 μm厚度连续切片,脱蜡脱水后用苏木精染液染色3~5 min。水洗反蓝,依次置于85%、95%的梯度酒精脱水后,放入伊红染液中染色3~5 min。随后,用无水乙醇脱水和二甲苯透明并封片。
1.6 免疫组化切片2次二甲苯脱蜡后,无水乙醇不同浓度梯度(100%酒精-95%酒精-90%酒精-80%酒精-70%酒精)脱水,将切片置于柠檬酸盐缓冲液(0.01 mol/L,pH 6.0)中,将抗原回收溶液在高压锅中煮沸3 min。然后用5% BSA封闭,置于37 ℃温箱0.5 h,后将切片与一抗在4 ℃孵育过夜(Ki-67 1:500,P53 1:500)。然后,将切片与二抗(HRP标记)一起室温孵育1 h,并用DAB染色。最后,将切片用苏木精复染,脱水,然后固定。
1.7 RNA测序从组织中提取总RNA,获取mRNA方式:一是通过Oligo(dT)磁珠富集带有polyA尾的mRNA(真核生物),二是从总RNA中去除核糖体RNA,从而得到mRNA(原核生物)。以片段化的mRNA为模版,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成cDNA第一条链,随后用RNaseH降解RNA链,并在DNA polymerase Ⅰ体系下, 以dNTPs为原料合成cDNA第二条链。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选200 bp左右的cDNA,进行PCR扩增并再次使用AMPure XP beads纯化PCR产物,最终获得文库,把构建好的文库按照有效浓度及目标下机数据量的需求pooling后进行Illumina HiSeq测序。
1.8 统计分析使用SPSS 22.0软件分析所有数据。用卡方检验评估移植瘤成瘤率率与临床病理参数之间的关系。采用t检验比较NSG小鼠组和BALB/c裸鼠组成瘤率和成瘤时间,当P<0.05时,认为差异有统计学意义。
2 结果 2.1 组织标本基本情况本研究收集22例ESCC组织标本,其中,第1号病例即为ES01,第2号病例为ES02,以此类推。22例病例包括年龄在45~78岁之间的男性17例,女性5例,病例中位数年龄为67岁。Ⅰ期1例,Ⅱ期9例,Ⅲ期12例,Ⅳ期0例。对ESCC癌患者临床参数(年龄、性别、病理分期、分化程度和淋巴转移情况)与NSG小鼠和BALB/c裸鼠移植瘤模型是否成功进行统计学分析,如表 1,结果显示:年龄、性别、病理分期、分化程度及淋巴转移这些因素与NSG小鼠移植瘤成瘤率无明显相关性。在BALB/c裸鼠中,年龄、性别、病例分期、分化程度与BALB/c裸鼠移植瘤成瘤率无明显相关,淋巴结转移情况对BALB/c裸鼠的移植瘤成瘤率有显著影响(P=0.03)。
| 表 1 ESCC患者临床资料与NSG小鼠和BALB/c裸鼠移植瘤模型成瘤率的统计描述 Tab.1 Relationship between clinical characteristics of ESCC patients and tumor formation rate of NSG mice and BALB/c nude mice xenograft models |
22例患者标本接种到NSG小鼠后背部皮下,其中有11例标本的P1代小鼠移植瘤在4个月内体积可约达1000 mm3,提示移植瘤成功,NSG小鼠P1代移植瘤成瘤率为50%(11/22)。在移植后平均75.95 d,移植瘤体积可达到250 mm3大小,即NSG小鼠P1代成瘤时间平均为75.95 d。成瘤生长曲线如图 1。
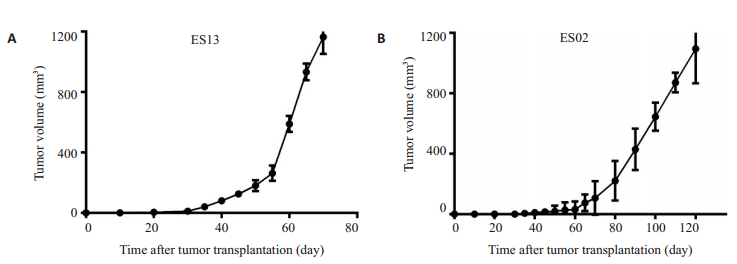
|
图 1 NSG小鼠肿瘤生长曲线 Fig.1 Tumor growth curve in NSG mice. A: The growth curve of ES13 NSG mice with the earliest tumor formation in P1 generation (n=4); B: The growth curve of ES02 NSG mice with the latest tumor formation in P1 generation (n=4). |
22例患者标本接种到BALB/c裸鼠后背部皮下,其中有4例标本的P1代小鼠移植瘤在4个月内体积约达1000 mm3,提示移植瘤成功,BALB/c裸鼠P1代移植瘤成瘤率为18.18%(4/22)。在接种平均91.67 d后,移植瘤体积可达到250 mm3大小,即NSG小鼠P1代成瘤时间平均为91.67 d。成瘤生长曲线如图 2。
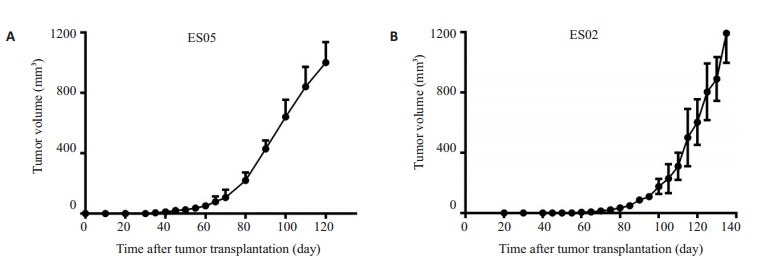
|
图 2 BALB/c裸鼠肿瘤生长曲线 Fig.2 Tumor growth curves in BALB/cmice. A: The growth curve of ES05 BALB/c nude mice with the earliest tumor formation in P1 generation (n=5); B: Growth curve of ES02 BALB/c nude mice with the latest tumor formation in P1 generation (n=4). |
在不同宿主小鼠中,NSG小鼠P1代肿瘤长至250 mm3平均需要75.95 d,比BALB/c裸鼠(平均91.67 d)所需时间更短(P<0.001)。NSG鼠的成瘤率(50%)高于BALB/c裸鼠(18.18%),差异具有统计学意义(P=0.027)。在BALB/c裸鼠移植成功的原代病人肿瘤组织标本在NSG小鼠中均能够成瘤,且同一例组织标本在NSG小鼠体内的成瘤时间明显快于BALB/c裸鼠(图 3)。
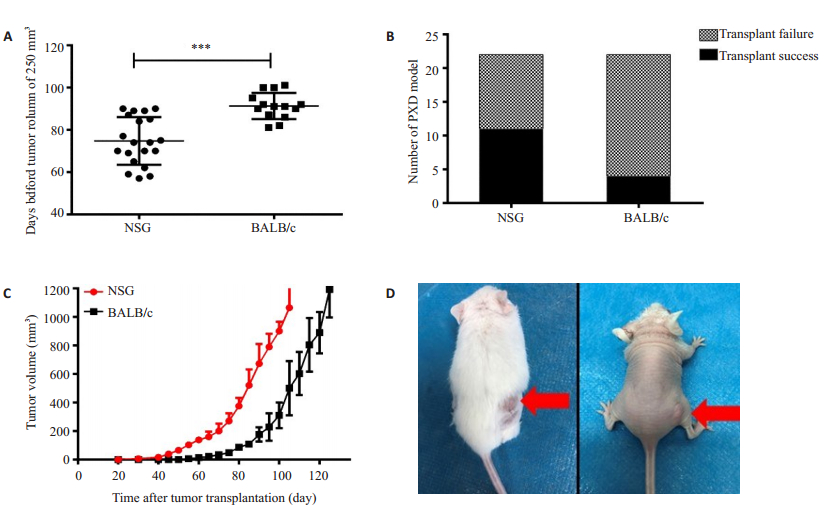
|
图 3 NSG小鼠与BALB/c裸鼠成瘤情况比较 Fig.3 Comparison of ESCC tumor formation between NSG mice and BALB/c nude mice. A: Average tumor formation time of NSG mice and BALB/c nude mice; B: Tumor formation rate of NSG mice and BALB/c nude mice (NSG: 50%, BALB/c:18.18%); C: Growth curve in NSG mice and NALB/c nude mice with ES05 patient tumor; D: The pictures of NSG mice and NALB/c nude mice with tumors. P values were calculated using an unpaired two-tailed Student's t test, ***P < 0.001. |
H & E染色结果显示,与原匹配的患者肿瘤组织相比,NSG小鼠和BALB/c裸鼠P1代移植瘤的病理形态均与患者组织形态相似。免疫组化Ki67和P53染色结果也表明,NSG与BALB/c小鼠P1代移植瘤与患者肿瘤组织均有相似阳性表达(图 4)。
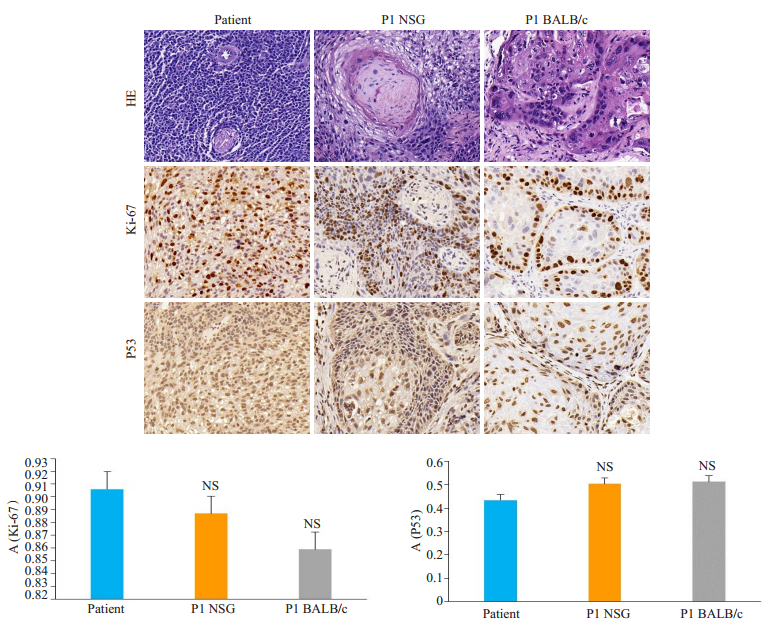
|
图 4 患者肿瘤组织与P1代NSG小鼠,BALB/c裸鼠组织病理学检测 Fig.4 Histopathology results of patient tumor tissues and tumor tissues in P1 of PDX models (HE staining and immumohistochemicalstaining of Ki67 and P53). Slides were stained with H & E and images were captured at × 400. AOD: Average optical density. NS: No significance. |
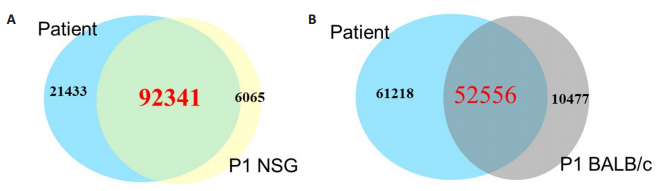
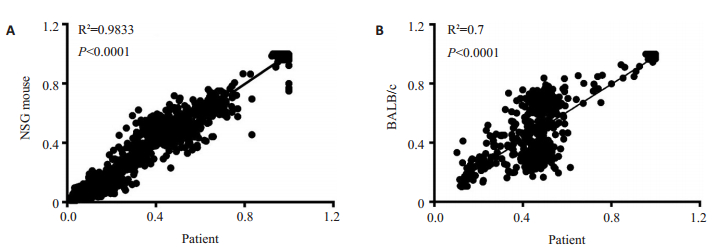
与亲代患者肿瘤基因突变数相比,NSG小鼠PDX模型与患者肿瘤重合基因数为98.34%,BALB/c裸鼠PDX模型与患者肿瘤重合基因突变数为83.34%(图 5)。测序结果表明NSG小鼠的肿瘤与原代患者肿瘤间的基因相似度更高(图 6)。
|
图 5 ES02例P1代NSG小鼠和BALB/c裸鼠与患者肿瘤组织重合基因突变数的比较 Fig.5 Gene sequencing results of patient tumor tissues and P1 of PDX models tumor tissues. Blue: Patients' tumor gene mutations. Yellow: P1 tumor gene mutations of ESCC PDX models in NSG mice. Grey: P1 tumor gene mutations of ESCC PDX models in BALB/c nude mice. |
|
图 6 RNA测序验证ES02例组织标本与P1代NSG小鼠和BALB/c裸鼠PDX模型之间的一致性 Fig.6 Consistency between ES02 patient'tumor tissue and P1 tumor tissue of PDX models in NSG mice and BALB/c nude mice by RNA sequencing. R2 is closer to 1, the degree of consistency is higher. |
ESCC是一种高度侵袭性肿瘤,晚期患者预后较差,治疗方法有限。因此,开发有效的临床前的模型迫在眉睫。本研究探索不同品系小鼠对动物模型的影响因素,对构建成瘤率更高,成瘤时间更短的临床前PDX动物模型具有重要意义,为ESCC患者的个体化治疗及药物研究评估与筛选提供了良好的平台。
PDX模型能稳定地保持原代肿瘤中的病理特征、肿瘤微环境和异质性[19],成为药物开发的优选的临床前工具[20],但其移植成功率和小鼠品系相关。不同小鼠品系免疫缺陷程度不同。常用的免疫缺陷鼠有:NOD/ SCID小鼠,缺乏几乎所有类型的免疫细胞;其次是缺乏B细胞和T细胞的SCID小鼠;然后是无T细胞的无胸腺裸鼠[21]。近几年出现了一种新的免疫缺陷鼠(NSG鼠),小鼠体内功能性T细胞B细胞缺失及NK细胞活性丧失,从而导致包括天然杀伤细胞分化在内的许多先天免疫功能异常[22-23]。本实验是将ESCC患者术中切除获取的新鲜肿瘤组织,接种到宿主NSG小鼠或BALB/c裸鼠背部皮下,来比较品系不同的鼠种对异种移植模型的影响。我们的结果显示,NSG小鼠的成瘤率为50%,与先前的报道34%~54%基本一致[12, 15, 24],而BALB/c裸鼠的成瘤率仅为18.18%,两者差异具有统计学意义(P=0.027)。相比较BALB/c裸鼠,我们发现NSG小鼠不仅成瘤率更高,在成瘤时间方面也更有优势,NSG小鼠(平均75.95 d)明显优于BALB/c裸鼠(平均91.67 d),因为NSG小鼠属于T、B、NK细胞联合免疫缺陷动物,是鼠种中免疫缺陷最为严重的品种,因而更容易接受异体移植。BALB/c裸鼠仅为单一T淋巴细胞功能缺陷,BALB/c裸鼠体内存在的B细胞和NK细胞发挥了一定的筛选作用,会导致BALB/c裸鼠对肿瘤的非特异性免疫力增强[25-26],降低了成瘤率,延长了成瘤时间,进而影响ESCC肿瘤皮下移植瘤模型的建立。
本研究还发现,在与原组织的匹配度上,NSG小鼠表现出了巨大优势,RNA测序结果显示,NSG小鼠的移植瘤与亲代的肿瘤突变基因重合数为98.34%,而BALB/c裸鼠与亲代肿瘤的突变基因重合数只占83.34%。基因测序结果也发现NSG小鼠移植瘤与原代患者组织的一致性更高。这表明,NSG小鼠比BALB/c裸鼠更适合进行ESCC PDX模型的建立。不足在于构建PDX模型需要大量小鼠,而NSG小鼠价格昂贵,虽然成瘤时间相比BALB/c有明显优势,但所需时间仍较长。尽管如此,由于PDX的独特性和如上所述的许多优势,它仍然被认为是值得临床前使用的工具。
本实验统计分析结果显示,移植模型的成瘤率与患者的年龄(NSG:P=0.853,裸鼠:P=0.456)、患者的性别(NSG:P=0.139,裸鼠:P=0.104)无显著性差异。与患者临床病理分期没有明显关系(NSG:P=0.412,裸鼠:P=0.174)。在淋巴结转移情况中,出现了不同的结果,NSG显示无显著性影响(P=0.416),BALB/c有显著影响(P=0.03)。经调查发现,Kim等[27]用102例手术切除的胰腺癌标本建立了PDX模型,通过多变量分析,发现患者的肿瘤移植成功率与肿瘤分化,淋巴结转移等因素无关。然而,有部分研究者的实验数据表明组织移植成功率与患者肿瘤分化,淋巴转移有联系,认为肿瘤组织的恶性程度越高,侵袭力越大,肿瘤组织更易于适应环境,成瘤率更高[28-29]。还有学者认为移植成功率与肿瘤复发时间有关[30],肿瘤复发时间在一定程度上代表该肿瘤的恶性程度,肿瘤复发时间越短,恶性程度越高,移植成功率更高。还有很多与PDX模型的移植成功率相关的其他因素,包括不同的肿瘤类型、肿瘤离体时间,肿瘤大小,移植部位等等,因此对于PDX模型的建立仍需要不断探索,大量样本的实验验证必不可少。
ESCC是一种高度侵袭性肿瘤,晚期患者预后较差,治疗方法有限。因此,开发有效的临床前的模型迫在眉睫。本研究探索不同品系小鼠对动物模型的影响因素,对构建成瘤率更高,成瘤时间更短的临床前PDX动物模型具有重要意义,为ESCC患者的个体化治疗及药物研究评估与筛选提供了良好的平台。
| [1] |
Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-32. DOI:10.3322/caac.21338 |
| [2] |
Yang J, Chen L, Ge K, et al. Efficacy of hybrid minimally invasive esophagectomy vs open esophagectomy for esophageal cancer: a meta-analysis[J]. World J Gastrointest Oncol, 2019, 11(11): 1081-91. DOI:10.4251/wjgo.v11.i11.1081 |
| [3] |
Kim T, Grobmyer SR, Smith R, et al. Esophageal cancer: the five year survivors[J]. J Surg Oncol, 2011, 103(2): 179-83. DOI:10.1002/jso.21784 |
| [4] |
Créhange G, Huguet F, Quero L, et al. Radiotherapy in cancers of the oesophagus, the gastric cardia and the stomach[J]. Cancer Radiother, 2016, 20(Suppl): S161-8. |
| [5] |
Hirano H, Kato K. Systemic treatment of advanced esophageal squamous cell carcinoma: chemotherapy, molecular-targeting therapy and immunotherapy[J]. Jpn J Clin Oncol, 2019, 49(5): 412-20. |
| [6] |
Domper Arnal MJ, Ferrández Arenas Á, Lanas Arbeloa Á. Esophageal cancer: Risk factors, screening and endoscopic treatment in Western and Eastern countries[J]. World J Gastroenterol, 2015, 21(26): 7933-43. DOI:10.3748/wjg.v21.i26.7933 |
| [7] |
邹晴晴, 陈斯泽, 管柳柳, 等. 食管癌动物模型研究进展[J]. 广东药科大学学报, 2018, 34(5): 656-60. |
| [8] |
Kapoor H, Lohani KR, Lee TH, et al. Animal models of barrett's esophagus and esophageal adenocarcinoma-past, present, and future[J]. Clin Transl Sci, 2015, 8(6): 841-7. DOI:10.1111/cts.12304 |
| [9] |
Rustgi AK. Esophagealcancersandmodelsystems[J]. Trans Am Clin Climatol Assoc, 2019, 130: 266-271. |
| [10] |
Jung J, Lee CH, Seol HS, et al. Generation and molecular characterization of pancreatic cancer patient-derived xenografts reveals their heterologous nature[J]. Oncotarget, 2016, 7(38): 62533-46. DOI:10.18632/oncotarget.11530 |
| [11] |
Day CP, Merlino G, van Dyke T. Preclinical mouse cancer models: a maze of opportunities and challenges[J]. Cell, 2015, 163(1): 39-53. |
| [12] |
Jiang YN, Wu Q, Yang XW, et al. A method for establishing a patient-derived xenograft model to explore new therapeutic strategies for esophageal squamous cell carcinoma[J]. Oncol Rep, 2016, 35(2): 785-92. |
| [13] |
Fan XM, Tao JY, Fredimoses M, et al. Eupafolin suppresses esophagus cancer growth by targeting T-LAK cell-originated protein kinase[J]. Front Pharmacol, 2019, 10: 1248. DOI:10.3389/fphar.2019.01248 |
| [14] |
Dodbiba L, Teichman J, Fleet A, et al. Appropriateness of using patient-derived xenograft models for pharmacologic evaluation of novel therapies for esophageal/gastro-esophageal junction cancers[J]. PLoS One, 2015, 10(3): e0121872. DOI:10.1371/journal.pone.0121872 |
| [15] |
Zou JL, Liu Y, Wang JY, et al. Establishment and genomic characterizations of patient-derived esophageal squamous cell carcinoma xenograft models using biopsies for treatment optimization[J]. J Transl Med, 2018, 16(1): 15. |
| [16] |
Liu AB, Zhu JR, Wu GY, et al. Antagonizing miR-455-3p inhibits chemoresistance and aggressiveness in esophageal squamous cell carcinoma[J]. Mol Cancer, 2017, 16(1): 106. |
| [17] |
Hudson WA, Li Q, Le C, et al. Xenotransplantation of human lymphoid malignancies is optimized in mice with multiple immunologic defects[J]. Leukemia, 1998, 12(12): 2029-33. DOI:10.1038/sj.leu.2401236 |
| [18] |
Naito S, von Eschenbach AC, Giavazzi R, et al. Growth and metastasis of tumor cells isolated from a human renal cell carcinoma implanted into different organs of nude mice[J]. Cancer Res, 1986, 46(8): 4109-15. |
| [19] |
卓莹, 吴一龙, 郭爱林, 等. 荷人肺癌小鼠皮下移植瘤模型的建立及其生物学特性初探[J]. 中国肺癌杂志, 2010, 13(6): 568-74. DOI:10.3779/j.issn.1009-3419.2010.06.020 |
| [20] |
Calles A, Rubio-Viqueira B, Hidalgo M. Primary human non-small cell lung and pancreatic tumorgraft models: utility and applications in drug discovery and tumor biology[J]. Curr Protoc Pharmacol, 2013, Chapter(14): Unit 14.26. |
| [21] |
Cho SY, Kang W, Han JY, et al. An integrative approach to precision cancer medicine using patient-derived xenografts[J]. Mol Cells, 2016, 39(2): 77-86. DOI:10.14348/molcells.2016.2350 |
| [22] |
Shultz LD, Lyons BL, Burzenski LM, et al. Human lymphoid and myeloid cell development in NOD/LTSZ-scid IL2R Gamma null mice engrafted with mobilized human hemopoietic stem cells[J]. J Immunol, 2005, 174(10): 6477-89. DOI:10.4049/jimmunol.174.10.6477 |
| [23] |
Nakajima H, Leonard WJ. Impaired peripheral deletion of activated T cells in mice lacking the common cytokine receptor Gamma-chain: defective Fas ligand expression in Gamma-chain-deficient mice[J]. J Immunol, 1997, 159(10): 4737-44. |
| [24] |
Wu XH, Zhang JC, Zhen RH, et al. Trastuzumab anti-tumor efficacy in patient-derived esophageal squamous cell carcinoma xenograft (PDECX) mouse models[J]. J Transl Med, 2012, 10: 180. DOI:10.1186/1479-5876-10-180 |
| [25] |
Ito M, Hiramatsu H, Kobayashi K, et al. NOD/SCID/Gamma(c) (null) mouse: an excellent recipient mouse model for engraftment of human cells[J]. Blood, 2002, 100(9): 3175-82. DOI:10.1182/blood-2001-12-0207 |
| [26] |
Bumgardner SA, Zhou Y, Jiang Z, et al. Genetic influence on splenic natural killer cell frequencies and maturation among aged mice[J]. Exp Gerontol, 2018, 104: 9-16. DOI:10.1016/j.exger.2018.01.010 |
| [27] |
Jun E, Jung J, Jeong SY, et al. Surgical and oncological factors affecting the successful engraftment of patient-derived xenografts in pancreatic ductal adenocarcinoma[J]. Anticancer Res, 2016, 36(2): 517-21. |
| [28] |
Zhao XM, Liu ZG, Yu LT, et al. Global gene expression profiling confirms the molecular fidelity of primary tumor-based orthotopic xenograft mouse models of medulloblastoma[J]. Neuro-oncology, 2012, 14(5): 574-83. DOI:10.1093/neuonc/nos061 |
| [29] |
钱丽萍, 余飞, 瞿叶清, 等. 人源非小细胞肺癌异种移植模型的建立和鉴定[J]. 实验动物与比较医学, 2018, 38(2): 117-21. DOI:10.3969/j.issn.1674-5817.2018.02.007 |
| [30] |
吴强.人源食管癌异种移植模型的建立及鉴定[D].合肥: 安徽医科大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10366-1019173835.htm
|
 2020, Vol. 40
2020, Vol. 40

