2. 湖南师范大学体适能与运动康复湖南省重点实验室,湖南 长沙 410006;
3. 湖南体育职业学院,湖南 长沙 410000
2. Key Laboratory of Physical Fitness and Exercise Rehabilitation of Hunan Province, Hunan Normal University, Changsha 410006, China;
3. Hunan Sports Vocational College, Changsha 410019, China
由于多种原因导致胆汁排泄受阻,胆红素逆流进入血液,使神经系统细胞内产生活性氧(ROS)的能力与机体抗氧化反应之间失衡,导致神经细胞的损伤[1],神经细胞接触氧化应激刺激时可通过诱导多种编码调节Ⅱ相解毒酶(主要为HO-1和NQO1)的基因表达[2]。研究发现,活化的Nrf2(NF-E2-related factor 2)可从Keap1解离进入细胞核,启动受ARE调控的Ⅱ相解毒酶等基因转录,发挥生物学效应[3]。目前从天然毒素中分离及开展神经保护的研究取得了较大进展,虎纹捕鸟蛛最具毒性的珍稀蛛种,其粗提物中丰富度属虎纹蜘蛛毒素-I(HWTX-I)最高,研究发现,HWTX-I对缺血性脑损伤的延迟伤害及神经保护具有重要作用[4]。而有氧运动作为一种简单且经济的临床康复治疗手段,能增强Nrf2抗氧化防御能力[5]。那么对于有氧运动联合HWTX-I对阻塞性黄疸导致的中枢神经系统氧化应激损伤是否具有改善作用,以及两者间作用效用关系如何值得探究。为此,本研究利用本课题组改建的胆总管悬挂72 h构建阻塞性黄疸小鼠模型,通过有氧运动及HWTX-I尾静脉注射干预,探讨有氧运动对阻塞性黄疸小鼠中枢神经系统的保护作用及可能的交互效应。
1 材料和方法 1.1 相关试剂及仪器试剂:Trizol(Inventragtion)、反转录试剂盒(TAKARA)、PCR m RNA引物(Wcgene Biotech)、Nrf-2抗体(Abcam)、HO-1抗体(Abcam)、NQO1抗体(Abcam)、TBIL、ALT、AST、5-HT、BDNF、S100B、NSE检测试剂盒(建成生物)。
仪器:YD-6D型生物组织石蜡包埋机、YD-A生物组织摊烤片机、LEICA RM2235切片机、WFG 7200型可见分光光度计、Bio-Rad CFX96Touch实时荧光定量PCR仪、倒置相差显微镜、高速低温离心机、099C K54型电动匀浆机、高性能超净工作台、电泳仪(百晶生物)、垂直电泳槽(BIO-TEK)、转移电泳槽(BIO-TEK)、凝胶成像系统BioSpectrum、Image-Pro Plus 4.1图像分析系统。
1.2 实验动物模型构建与分组成年健康雄性KM小鼠50只,体质量28~35 g,由湖南斯莱克景达实验动物中心提供[许可证SCXK(Xiang] 2016-0002)。室温23~25 ℃,湿度40%~60%的环境下适应性喂养1周。40只小鼠参照本课题组大鼠胆总管结扎方式并加以改进,采用一种新的胆总管悬挂72 h构建阻塞性黄疸模型[6]。操作如下:麻醉状态下,镊子轻轻夹起腹部皮肤,用眼科剪沿腹腔纵向开1~1.5 cm切口,暴露并拨开肝脏右叶,避开胰腺组织,在距肝门1 cm处分离胆总管,用4-0不可吸收手术线将胆总管直角悬挂于腹壁,组织归位并缝合。空白组小鼠于腹部开同等长度切口后缝合。小鼠放回饲养笼中,待其自然苏醒。72 h后剪断腹壁外固定线,解除悬挂,随机均分为模型组(M),有氧运动组(T),HWTX-I组(H),有氧运动联合HWTX-I组(TH),另设空白组(GO),每组10只。
1.3 干预方案解除悬挂后,确认小鼠运动能力基本正常,T组、TH组进行中等强度有氧运动跑台训练,为达到更好的运动效果,前期进行为期1周的适应性训练:第1~2天,设置运动跑台坡度为0o,速度6 m/min,训练25 min/d;第3~4天,设置运动跑台坡度为5o,速度8 m/min,训练40 min/d;第5~6天设置运动跑台坡度为8o,速度10 m/min,训练1 h/d。之后以第5~6天训练强度为标准,共训练7周。HWTX-I冻干粉剂获取于湖南师范大学生命科学学院蛋白质化学与分子生物学实验室,批号为010620,临用前用生理盐水进行稀释(10 μg/mL),现配现用,H组、TH组根据小鼠与人体体表面积比按0.05 μg/g浓度于尾静脉隔日注射0.15 mL毒素溶液。其它组注射同样体积的生理盐水,共7周。
1.4 标本取材7周后,各组小鼠禁食过夜,腹腔注射2%戊巴比妥钠(500 mg/kg)麻醉,无翻正能力后,剪去眼角周边毛发,摘取眼球取血于5 mL抗凝管中,低速离心获取上清液;-80 ℃冰箱冻存。开腹取肝右叶组织用于Illumina高通量测序,小鼠断头于冰上剥离头部皮肤,暴露颅骨,用眼科镊自枕骨大孔轻轻撬开颅骨,充分暴露脑组织,切取脑组织前额叶皮层10 mm3置于装有10%多聚甲醛溶液(0.1 moL,pH=7.4)固定12 h以上,用于nissl染色,随后小心剥离大脑左右剩余皮层,暴露出整个海马组织,玻璃分针剥离并取出海马,冰磷酸缓冲盐溶液(PBS)液冲洗,滤纸吸掉多余水分,称重后,分两管,一管用于提取总RNA,-80 ℃冻存备用;一管用于匀浆粉碎后,提取上清液用于ELISA检测蛋白含量,-80 ℃冻存备用。
1.5 一般行为学及Clark神经评估构建阻塞性黄疸模型后,每隔两周记录一次小鼠体质量、毛色、皮肤、排泄物等,Clark神经行为学评估主要由两大部分组成,一方面是局灶功能损伤评估,主要涉及小鼠步态、转圈实验、攀爬能力、胡须反应、强迫转圈实验等,另一方面是一般功能损伤评估,主要涉及小鼠耳朵是否下垂、眼睛分泌物、自主运动能力、体态状况等,每个项目分值范围为0~4分,0分代表正常,4分代表状态最差,分别于有氧运动及HWTX-I干预实验开始与结束时间段进行评估,共评估两次。
1.6 病理学观察脑组织前额叶皮层冠状面切片,厚度为4 μm,按常规nissl染色步骤,二甲苯、酒精梯度复水,1%甲苯胺蓝溶液(1 g: 100 mL蒸馏水),酒精梯度脱水,二甲苯,中性树胶封片。于光学显微镜(×200)下观察脑组织的形态。
1.7 肝功能与脑组织相关指标测定全自动生化分析仪检测血清中总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)含量,双抗体夹心法检测小鼠血清中神经生化标志物S100B及神经烯醇化酶(NSE)水平。酶联免疫吸附法检测脑组织中5-羟色胺(5-HT)、BDNF脑源性神经营养因子(BDNF)含量。
1.8 蛋白免疫印迹取少量冻存脑组织约100 mg,放入预冷的1000 μL细胞裂解液中,冰浴剪碎、匀浆,4 ℃离心,超声裂解、离心,吸取上清,BCA蛋白定量试剂盒测定组织上清液蛋白浓度,以每个样品的总蛋白为20 μg上样,先后进行SDS-PAGE凝胶电泳、电转移至PVDF膜30 min,Ⅰ抗4 ℃过夜,辣根过氧化物酶(HRP)标记的Ⅱ抗山羊抗兔IgG室温孵育1 h,反复洗膜后进行显色及X胶片显影、定影。Quantity One凝胶软件分析系统测定光密度值,以目的蛋白条带光密度和内参光密度的比值代表蛋白的含量。
1.9 Real time-PCR及高通量测序 1.9.1 脑组织总RNA提取根据脑组织RNA提取说明书严格执行操作,选取试剂盒SYBR® Premix Ex Taq™ Ⅱ,购买于TaKaRa公司,将小鼠脑组织放入冰预冷的玻璃匀浆器中,加入1 mL Trizol裂解液,充分匀浆,使组织细胞裂解,按操作步骤依次加入氯仿、异丙醇提取脑组织总RNA,利用逆转录酶逆转录得到cDNA。然后利用各目的基因序列设计特异性引物(表 1),进行荧光定量PCR实验。以GAPDH为内参,反应条件为94 ℃ 2 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,反应共进行40个循环,每个待测样本设置3个平行管,根据各反应孔的CT值,计算各组目的基因的相对表达量。表达量=2-ΔΔCt,其中ΔΔCt= [目的基因的Ct值(样本组)-管家基因的Ct值(样本组)] -[目的基因的Ct值(校正组)-管家基因的Ct值(校正组)]。
| 表 1 m RNA基因引物序列 Tab.1 Gene primers |
为了解模型构建及干预效应对小鼠相关基因的影响,本实验对M组、GO组、T组及TH组进行高通量测序,步骤如下:检测待测样本总RNA纯度合格后,用带有Oligo(dT)的磁珠富集mRNA,加入Fragmentation Buffer,将获得的mRNA片段合成短片段,并以此为模板,利用六碱基随机引物合成cDNA第一链,加入缓冲液、dNTPs、RNaseH和DNA Polymerase I合成cDNA第二链,根据QIAQuick PCR试剂盒说明书操作进行纯化,EB缓冲液洗脱,双链cDNA末端修复,加入碱基A及测序接头处理,琼脂糖凝胶电泳回收目的大小片段并进行PCR扩增,文库制备完成,采用用Illumina HiSeq 2500进行测序。测序策略为SE50,DEGseq基因表达分析不同组别测序结果的差异性,选取|log2Ratio|≥1与q<0.05的差异表达基因,获取上下调差异表达基因。
1.10 统计学分析本次实验所获数据用SPSS 20.0软件统计分析,均数±标准差表示,Bartlett检验其数据方差齐性后,采用单因素方差分析,组间内比较用LSD检验。有氧运动与HWTX-I间相互效应用多因素方差分析,且进行简单效应分析。P<0.05为差异有统计学意义。
2 结果 2.1 一般情况在模型构建过程中,建模小鼠均未出现由手术或其他原因造成的死亡情况。梗阻48 h,小鼠嗜睡,精神萎靡,行动迟缓,毛发杂乱、无光泽,尿色变黄。梗阻72 h,小鼠尾巴和耳尖开始出现局部发黄,大便色浅、量少,个别小鼠呈现便秘状态。由表 2可知,第1次Clark神经行为学评估中,相比GO组,各构模小鼠局灶性神经功能和一般神经功能得分显著升高(P<0.01),且组间无显著性差异(P>0.05);相比第1次评估得分,第2次评估GO组、M组神经行为学得分无显著性差异(P>0.05),T组、H组、TH组得分显著降低(P<0.01),且有氧运动与HWTX-I间对小鼠局灶性神经功能及一般神经功能的恢复存在协同效应。
| 表 2 Clark神经行为学评估结果 Tab.2 Clark neurobehavioral evaluation results (Mean±SD, n=10) |
HE染色结果(图 1)显示,GO组小鼠脑组织的细胞大多数呈圆形,形状规则。而M组大脑皮质神经细胞排列不规则,多数细胞变形、坏死,细胞周围出现空隙,且尼氏小体大量丢失,层次混乱。相比之下,T组、H组中,大脑皮质神经细胞只有极少数出现变形,不规则,神经元少数丢失,TH组无明显神经元丢失现象,胞质中尼氏小体清晰且均匀分布于胞浆内。
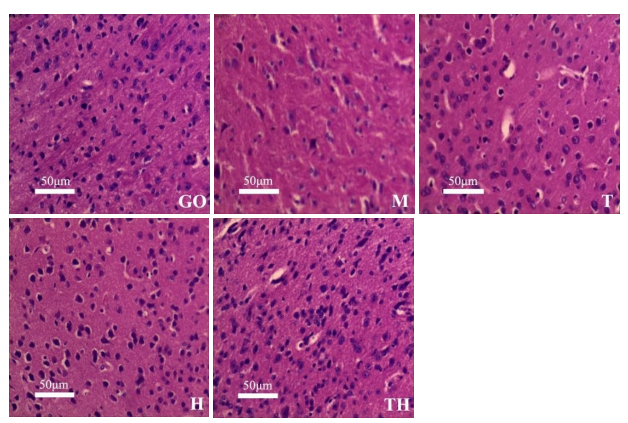
|
图 1 各组小鼠脑组织病理切片HE染色图 Fig.1 HE staining of pathological sections of brain tissue of mice in each group. M: Model group; GO: Blank control group; T: Aerobic exercise group; H: HWTX-I group; TH: Aerobic exercise group combined with HWTX-I group. |
M组小鼠血清肝功能指标含量最高(P<0.01),相比M组,T组、H组上述肝功能指标含量显著下降(P<0.01);相比T组、H组,TH组血清中ALT、AST、TBIL和TBA含量降低(P<0.01)。但对于肝功能指标的含量的变化,有氧运动与HWTX-I间不存在交互效应(图 2)。
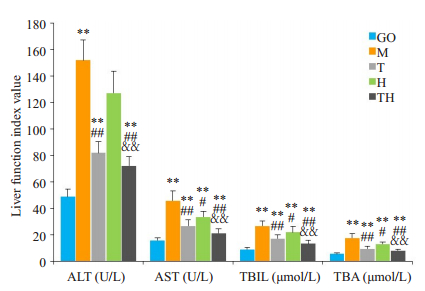
|
图 2 各组小鼠血清肝功能指标检测 Fig.2 Serum liver function indicators of mice in each group. **P < 0.01 vs the GO group; #P < 0.05, ##P < 0.01 vs the M group; && P < 0.01 vs the T、H group. M: Model group; GO: Blank control group; T: Aerobic exercise group; H: HWTX-I group; TH: Aerobic exercise group combined with HWTX-I group. |
血清神经指标检测结果,相比GO组,其余各组S100B、NSE含量显著上升(P<0.01),相比M组,T组、H组、TH组S100B、NSE含量显著降低(P<0.01),相比T组、H组,TH组S100B、NSE含量显著降低(P<0.01)。海马组织神经指标检测结果,相比M组,T组、H组、TH组5-HT和BDNF含量显著上升(P<0.01),同时明显高于GO组(P<0.01),相比T组、H组,TH组5-HT和BDNF含量呈上升趋势(P<0.01)。且有氧运动与HWTX-I间对于S100B、NSE、5-HT和BDNF的含量变化存在协同作用(图 3)。
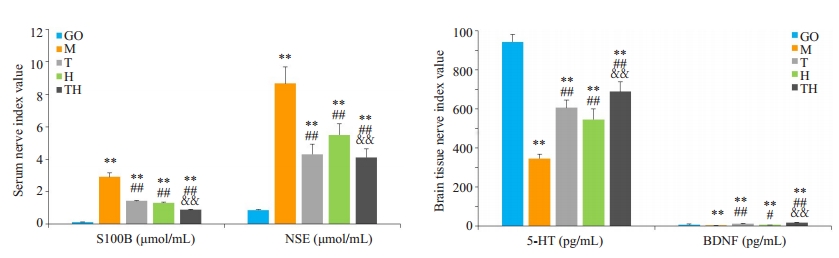
|
图 3 各组小鼠血清及海马组织神经损伤指标检测 Fig.3 Serum and hippocampal nerve injury indicators of mice in each group. **P < 0.01 vs the GO group; #P < 0.05, ##P < 0.01 vs M group; &&P < 0.01 vs T and H groups. M: Model group; GO: Blank control group; T: Aerobic exercise group; H: HWTX-I group; TH: Aerobic exercise group combined with HWTX-I group. |
相比GO组,M组脑组织中Nrf2、HO-1蛋白表达增高,NQO1蛋白表达下降(P<0.01,P<0.05),相比M组,T组、H组及TH组脑组织中Nrf2、HO-1、NQO1蛋白表达显著上升(P<0.01,P<0.05),相比T组、H组,TH组脑组织中Nrf2、HO-1、NQO1蛋白表达显著增加,具有非常显著性差异(P<0.01)。且有氧运动与HWTX-I间对于NRF2、HO1和NQO1蛋白表达的变化存在协同作用,有氧运动联合HWTX-I干预效果最佳(图 4)。
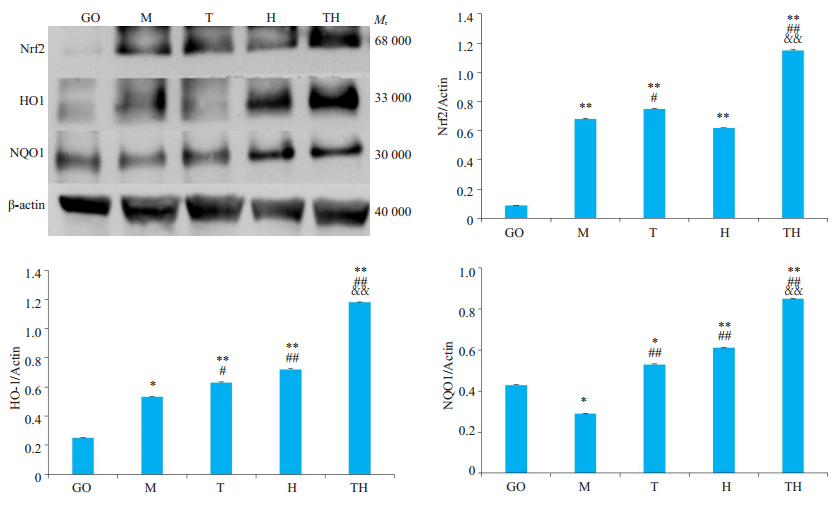
|
图 4 小鼠脑组织NRF2、HO1和NQO1蛋白表达结果 Fig.4 Expression of NRF2, HO1 and NQO1 proteins in mouse brain. *P < 0.05, **P < 0.01 vs the GO group; #P < 0.05, ##P < 0.01 vs M group; &&P < 0.01 vs the T and H groups. M: Model group; GO: Blank control group; T: Aerobic exercise group; H: HWTX-I group; TH: Aerobic exercise group combined with HWTX-I group. |
实验为探究不同组别样本转录组间差异,对GO组、M组、T组、TH组间肝组织的差异表达基因进行筛选,共鉴定出11 487个差异表达基因,含8460个上调基因,3027个下调基因,其中含有4273个上调基因经炎性途径致神经损伤后诱发,与组织炎症反应及神经损伤密切相关,同时还涉及神经损伤后修复基因及相关蛋白的激活,主要参与调控细胞增殖分化、细胞损伤修复和心血管神经变性等。高通量测序结果显示361个差异基因富集于18个KEGG通路,具有显著性差异表达因子主要富集于神经活性配体-受体相互作用、GABA能突触、多巴胺能突触、突触小泡循环及轴突指导等神经调控通路,涉及组织细胞神经细胞信号转导、凋亡抑制、免疫反应、毒性等。
2.7 各组小鼠脑组织Nrf2、HO-1、NQO1 mRNA检测结果相比GO组,M组脑组织中NRF2基因表达显著降低,HO1和NQO1基因表达微幅度上调(P<0.01,P<0.05),T组、H组、TH组脑组织中NRF2、HO1和NQO1基因表达显著上升(P<0.01);相比M组,H组、TH组脑组织中NRF2、HO1和NQO1基因表达显著上升(P<0.01),T组NRF2和HO1基因表达具有显著性差异(P<0.01,P<0.05),NQO1基因表达无明显差异(P>0.05);相比T组、H组,TH组脑组织中NRF2、HO1和NQO1基因表达显著增高(P<0.01,表 3)。且有氧运动与HWTX-I间对于NRF2、HO1和NQO1基因表达变化存在协同作用。
| 表 3 各组脑组织中NRF2、HO1、NQO1 mRNA表达量 Tab.3 Expression levels of NRF2, HO1 and NQO1 mRNA in the brain tissue of each group |
阻塞性黄疸(OJ)在普通外科学中是一种很常见的临床症状群,可引起远端组织及器官的损害。较多研究发现OJ时的高胆红素血症对神经细胞有较强的毒性作用并诱发中枢神经细胞损伤[7]。而轴突的指导是神经元网络形成的关键阶段,关于OJ的发病机理与脑组织神经细胞间的相互关系备受研究者的关注,那么理想的OJ动物模型是实验进展的关键。Yilmaz等[8]采用永久性胆总管结扎构建阻塞性黄疸模型,探讨肝脏和远端器官的保护作用机制中发现,小鼠水迷宫实验定向航行和空间探索能力显著下降,此模型见效快,症状明显,但随着时间延长,胆总管永久阻塞对其它脏器可造成极大损害,存活率低。Yamashita等[9]研究神经细胞损伤后的修复和发生过程中发现,神经细胞发育与轴突连接路线中具有吸引或排斥作用的导向分子的表达密切相关,且神经细胞损伤后轴突的纤维投射与延伸及细胞迁移能力显著下降。本实验中,高通量测序轴突指导KEGG分析可知,阻塞性黄疸小鼠轴突指导分子Netrins、Semaphorins、Slits、Ephrins及其相对应的下游调控因子均出现下调,提示细胞间突触联系、中枢神经特异投射及回路形成出现紊乱,神经损伤修复、再生能力下降。相比GO组,M组Clark神经损伤评估得分显著增高,一般行为观察黄疸症状严重,同时血清肝功能指标及神经损伤指标蛋白含量增加,结合显微结构观察神经元尼氏小体大量丢失、坏死结果。提示,阻塞性黄疸小鼠构模成功,并已导致中枢神经损伤,但尚未确定是否与阻塞性黄疸后抑制Ⅱ相解毒酶功能,使毒性物质代谢障碍,诱发中枢神经损伤有关。
3.2 阻塞性黄疸小鼠通过Keap1-Nrf2-ARE途径抑制Ⅱ相解毒酶功能Ⅱ相反应是体内毒性物质的真正解毒或清除途径,其主要解毒酶是HO-1和NQO1。目前研究认为[10-11],Ⅱ相解毒酶的表达水平与Nrf2-Keap1-ARE信息通路关系密切,正常的生理状态下,Nrf2和Keap1结合并且锚定于细胞浆中的肌动蛋白上,当有诱导物存在时,Nrf2- Keap 1复合物的解离,实现Nrf2向胞核内的转移,与ARE及Maf蛋白结合,启动ARE编码的Ⅱ相酶基因转录。Neis等[12]研究发现HO-1蛋白与肝脏损伤致脑损伤疾病有密切的关系,能显著提高神经病理状况下的抗氧化防御能力,促进体内5-HT和BDNF水平,其他研究发现外伤性脑损伤后Nrf2/ARE通路被激活[13]。本实验中,相比GO组,M组脑组织中NRF2、HO1、NQO1 mRNA表达升高,表明可能由于阻塞性黄疸促进体内毒性物质的堆积,使机体解毒代谢应激启动,结合血清及海马组织神经损伤指标检测及病理显微结构观察结果,表明自发性的应激启动Keap1-Nrf2-ARE途径调节Ⅱ相解毒酶,对中枢神经的保护不显著。结合蛋白免疫印迹结果,提示毒性物质的循环堆积抑制Keap1-Nrf2-ARE途径使Ⅱ相解毒酶功能下降,促进中枢神经的损伤。结合高通量测序结果,进一步表明毒性物质代谢障碍使轴突指导的相关蛋白分子下调,抑制神经活性配体-受体相互作用,促使小鼠神经毒性损伤。
3.3 有氧运动联合HWTX-I介导Ⅱ相解毒酶调控途径的抗神经损伤效应许多研究表明,作为非药物疗法的中小强度有氧运动对多种原因造成的神经元损伤具有保护作用,其抗氧化效应可能是通过Nrf2实现的[14]。同时研究证实天然毒素提取物对神经的保护具有独特作用,对于从最具毒性珍稀蛛种中提取的虎纹蜘蛛毒素-I的研究具有重要意义[15]。Wang等[16]研究显示,急性运动能够增加小鼠骨骼肌Nrf2基因表达。Mao等[17]研究发现,HWTX-I在小鼠因脑缺血至中枢神经损伤模型中,可通过调控Notch信号传导通路,对神经元进行保护作用。本实验中,采用7周有氧运动和HWTX-I尾静脉注射干预后,一般情况观察黄疸症状明显改善,Clark神经损伤评估得分显著降低,且有氧运动和HWTX-I对局灶性神经功能及一般神经功能的恢复存在协同效应;血清肝功能指标及神经损伤指标S100B、NSE含量显著降低,海马组织5-HT、BDNF含量上升,且有氧运动与HWTX-I对于神经损伤指标、5-HT、BDNF含量变化具有协同效应;脑组织前额叶皮层神经元丢失显著降低。表明有氧运动与HWTX-I对阻塞性黄疸后小鼠中枢神经元的损伤具有保护作用,且彼此存在协同效应。高通量测序结果分析,有氧运动和HWTX-I可促进轴突指导相关蛋白分子的上调,促进轴突的分支、延伸及神经细胞迁移,引导联合神经元的表达,结合脑组织NRF2、HO1、NQO1基因表达及蛋白显著升高结果,且有氧运动与HWTX-I间存在协同效应,提示有氧运动、HWTX-I可通过Keap1-Nrf2-ARE途径促进Ⅱ相解毒酶对毒性物质的代谢作用,缓解或减轻阻塞性黄疸后因毒性物质的堆积导致的中枢神经损伤,且联合干预效果更佳。
综上所述,Keap1-Nrf2-ARE途径介导Ⅱ相解毒酶对阻塞性黄疸小鼠致中枢神经的毒性损伤具有重要调控作用,7周有氧运动与HWTX-I尾静脉注射可激活Keap1-Nrf2-ARE途径使Ⅱ相解毒酶HO-1和NQO1高表达,促进毒性物质的代谢作用,对中枢神经的毒性损伤发挥了较明显的保护作用,且有氧运动与水飞蓟宾间存在协同效应,联合干预效果更佳。
| [1] |
Wu JL, Dougherty JJ, Nichols RA. Dopamine receptor regulation of Ca2+ levels in individual isolated nerve terminals from rat striatum: comparison of presynaptic D1-like and D2-like receptors[J]. J Neurochem, 2006, 98(2): 481-94. DOI:10.1111/j.1471-4159.2006.03901.x |
| [2] |
Liu Y, Zhang L, Liang JJ. Activation of the Nrf2 defense pathway contributes to neuroprotective effects of phloretin on oxidative stress injury after cerebral ischemia/reperfusion in rats[J]. J Neurol Sci, 2015, 351(1/2): 88-92. |
| [3] |
Inoue H, Kobayashi K, Ndong M, et al. Activation of Nrf2/Keap1 signaling and autophagy induction against oxidative stress in heart in iron deficiency[J]. Biosci Biotechnol Biochem, 2015, 79(8): 1366-8. DOI:10.1080/09168451.2015.1018125 |
| [4] |
Deng MC, Luo X, Xiao YC, et al. Huwentoxin-XVI, an analgesic, highly reversible mammalian N-type calcium channel antagonist from Chinese tarantula Ornithoctonus huwena[J]. Neuropharmacology, 2014, 79: 657-67. DOI:10.1016/j.neuropharm.2014.01.017 |
| [5] |
Jiang LP, Deng MC, Duan ZG, et al. Molecular cloning, bioinformatics analysis and functional characterization of HWTX-XI toxin superfamily from the spider Ornithoctonus huwena[J]. Peptides, 2014, 54: 9-18. DOI:10.1016/j.peptides.2014.01.001 |
| [6] |
Zhou YX, Ni Y, Liu YB, et al. Histone preconditioning protects against obstructive jaundice-induced liver injury in rats[J]. Exp Ther Med, 2014, 8(1): 15-20. DOI:10.3892/etm.2014.1697 |
| [7] |
Cui JM, Guo YL, Yang WY, et al. Effects of exercise on learning and memory, oxidative stress and nNOS expression in marginal Division of striatum of ovariectomized rats[J]. J Sports Med Phys Fitness, 2018, 58(3): 356-65. |
| [8] |
Yilmaz EE, Arikanoğlu Z, Turkoğlu A, et al. The protective effects of pomegranate on liver and remote organs caused by experimental obstructive jaundice model[J]. Eur Rev Med Pharmacol Sci, 2016, 20(4): 767-72. |
| [9] |
Yamashita M. Retinal strip culture for studying ganglion cell axon growth[J]. Methods Mol Biol, 2020, 2092: 55-64. |
| [10] |
Zhang Y, Wang GY, Wang TR, et al. Nrf2-Keap1 pathway-mediated effects of resveratrol on oxidative stress and apoptosis in hydrogen peroxide-treated rheumatoid arthritis fibroblast-like synoviocytes[J]. Ann N Y Acad Sci, 2019, 1457(1): 166-78. DOI:10.1111/nyas.14196 |
| [11] |
Zuo R, Wang YQ, Li J, et al. Rapamycin induced autophagy inhibits inflammation-mediated endplate degeneration by enhancing Nrf2/ Keap1 signaling of cartilage endplate stem cells[J]. Stem Cells, 2019, 37(6): 828-40. DOI:10.1002/stem.2999 |
| [12] |
Neis VB, Rosa PB, Moretti M, et al. Involvement of heme oxygenase-1 in neuropsychiatric and neurodegenerative diseases[J]. Curr Pharm Des, 2018, 24(20): 2283-302. DOI:10.2174/1381612824666180717160623 |
| [13] |
Rensing H, Bauer I, Datene V, et al. Differential expression pattern of heme oxygenase-1/heat shock protein 32 and nitric oxide synthase-Ⅱ and their impact on liver injury in a rat model of hemorrhage and resuscitation[J]. Crit Care Med, 1999, 27(12): 2766-75. DOI:10.1097/00003246-199912000-00027 |
| [14] |
Song CY, Liu B, Xu P, et al. Emodin ameliorates metabolic and antioxidant capacity inhibited by dietary oxidized fish oil through PPARs and Nrf2-Keap1 signaling in Wuchang bream (Megalobrama amblycephala)[J]. Fish Shellfish Immunol, 2019, 94: 842-51. DOI:10.1016/j.fsi.2019.10.001 |
| [15] |
Aguiar AS Jr, Duzzioni M, Remor AP, et al. Moderate-intensity physical exercise protects against experimental 6-hydroxydopamineinduced hemiparkinsonism through Nrf2-antioxidant response element pathway[J]. Neurochem Res, 2016, 41(1/2): 64-72. |
| [16] |
Wang P, Li CG, Qi ZT, et al. Acute exercise stress promotes Ref1/ Nrf2 signalling and increases mitochondrial antioxidant activity in skeletal muscle[J]. Exp Physiol, 2016, 101(3): 410-20. |
| [17] |
Mao HF, Xie J, Chen JQ, et al. Aerobic exercise combined with huwentoxin-I mitigates chronic cerebral ischemia injury[J]. Neural Regen Res, 2017, 12(4): 596-602. DOI:10.4103/1673-5374.205099 |
| [18] |
Iulianella A, Stanton-Turcotte D. The Hedgehog receptor Patched1 regulates proliferation, neurogenesis, and axon guidance in the embryonic spinal cord[J]. Mech Dev, 2019, 160: 103577. DOI:10.1016/j.mod.2019.103577 |
| [19] |
Li SG, Ding YS, Niu Q, et al. Grape seed proanthocyanidin extract alleviates arsenic-induced oxidative reproductive toxicity in male mice[J]. Biomed Environ Sci, 2015, 28(4): 272-80. |
| [20] |
Jadeja RN, Jones MA, Abdelrahman AA, et al. Inhibiting microRNA- 144 potentiates Nrf2-dependent antioxidant signaling in RPE and protects against oxidative stress-induced outer retinal degeneration[J]. Redox Biol, 2020, 28: 101336. DOI:10.1016/j.redox.2019.101336 |
| [21] |
Done AJ, Gage MJ, Nieto NC, et al. Exercise-induced Nrf2-signaling is impaired in aging[J]. Free Radic Biol Med, 2016, 96: 130-8. DOI:10.1016/j.freeradbiomed.2016.04.024 |
| [22] |
Li YH, Darwish WS, Chen Z, et al. Identification of lead-produced lipid hydroperoxides in human HepG2 cells and protection using rosmarinic and ascorbic acids with a reference to their regulatory roles on Nrf2-Keap1 antioxidant pathway[J]. Chem Biol Interact, 2019, 314: 108847. DOI:10.1016/j.cbi.2019.108847 |
| [23] |
Feng RB, Wang Y, He CW, et al. Gallic acid, a natural polyphenol, protects against tert-butyl hydroperoxide-induced hepatotoxicity by activating ERK-Nrf2-Keap1-mediated antioxidative response[J]. Food Chem Toxicol, 2018, 119: 479-88. DOI:10.1016/j.fct.2017.10.033 |
| [24] |
Karoly HC, Stevens CJ, Thayer RE, et al. Aerobic exercise moderates the effect of heavy alcohol consumption on white matter damage[J]. Alcohol Clin Exp Res, 2013, 37(9): 1508-15. DOI:10.1111/acer.12135 |
| [25] |
Kang DS, Yang YR, Lee C, et al. Netrin-1/DCC-mediated PLCγ1 activation is required for axon guidance and brain structure development[J]. EMBO Rep, 2018, 19(11): e46250. |
| [26] |
Vemuganti R, Silva VR, Mehta SL, et al. Acute liver failure-induced hepatic encephalopathy s associated with changes in microRNA expression rofiles in cerebral cortex of the mouse[J]. Metab Brain Dis, 2014, 29(4): 891-9. DOI:10.1007/s11011-014-9545-0 |
| [27] |
Lin L, Cai WM, Qin CJ, et al. Intervention of TLR4 signal pathway cytokines in severe liver injury with obstructive jaundice in rats[J]. Int J Sports Med, 33(7): 572-9.
|
| [28] |
Heinonen I, Kalliokoski KK, Hannukainen JC, et al. Organ-specific physiological responses to acute physical exercise and long-term training in humans[J]. Physiology (Bethesda), 2014, 29(6): 421-36. |
| [29] |
Hu ME, Lin YC, Chang HM, et al. Obstructive jaundice activates nitroxidergic neurons of the vago-vagal neural circuit that regulates the hepatobiliary system in rabbits[J]. Cells Tissues Organs, 2012, 195(3): 272-86. |
 2020, Vol. 40
2020, Vol. 40

