2. 南加州大学洛杉矶儿童医院,洛杉矶 90027
2. Los Angeles Children's Hospital, University of Southern California, Los Angeles, 90027, USA
α7烟碱型乙酰胆碱受体(α7nAChR)是烟碱型胆碱能受体之一,许多研究表明该受体在炎症调控中具有重要作用[1-2],可与多种共病因子协同作用,破坏血脑屏障,引发中枢神经系统炎症[3-4],但该受体上调具有促进还是抑制炎症的作用目前尚有争议[5-7]。研究证实α7nAChR与神经认知损伤相关[8-9],但具体机制尚不明确。α-银环蛇毒素是一种碱性多肽蛇毒素,能够竞争性结合烟碱型乙酰胆碱受体,且具有高度亲和力和不可逆性,是研究乙酰胆碱受体结构的理想探针,也是从组织中分离和纯化乙酰胆碱受体的重要工具[10-11]。
目前研究发现HIV包膜蛋白gp120,可促进神经元β-淀粉样蛋白(Aβ)沉积,引起神经元凋亡[12];也可激活小胶质细胞、星型胶质细胞,释放炎症因子,造成中枢神经系统炎症反应,加速神经细胞凋亡[13-16]。此外,在HIV患者脑组织纹状体中检测到α7nAChR受体高表达,而纹状体是HIV感染脑部受损主要区域[17-18],这提示α 7nAChR可能在HIV患者神经损伤中发挥重要作用,但具体机制尚不明确。本研究拟通过体外初步探索gp120所引起的小胶质细胞炎症中表达情况,分析α 7nAChR在gp120引起的小胶质细胞炎症通路中的作用,并建立敲除α7nAChR和过表达gp120的双基因编辑动物模型,为后续深入的机制研究提供实验基础。
1 材料和方法 1.1 材料α7 nAChR基因敲除小鼠(Stock Number: 003232,Strain Name: B6.129S7- Chrna7tm1Bay/J)购于美国Jackson实验室,并委托南方模式生物公司代购托运至南方医科大学,一雄两雌,均为α7 nAChR基因敲除纯合子,其遗传背景为C57BL/6J。HIV-1 gp120转基因小鼠由南加州大学黄胜和教授惠赠,该小鼠以GFAP为启动子在星形胶质细胞中高表达可溶性的HIV-1 LAV gp120(X4)蛋白。野生型C57小鼠(南方医大实验动物),小鼠均饲养于南方医科大学SPF级实验动物中心。生物素包被的抗gp120抗体、大鼠抗α7 nAChR抗体(Abcam);山羊抗兔二抗、山羊抗大鼠二抗、生物素二抗(鼎国生物);α-银环蛇毒素荧光染料(Biotium);gp120引物和α7 nAChR引物(生工)。体外实验所用的永生化小胶质细胞(BV2,国家中心细胞库);细胞处理试剂α7 nAChR抑制剂MLA(MedChemExpress);全长HIV-1 LAV gp120蛋白质(Meriden, CT)。ELISA试剂盒(三鹰)。
1.2 方法 1.2.1 动物模型构建(1)小鼠饲养:将小鼠置于SPF级层流动物房内,室温控制为18~22 ℃,湿度控制在40%~ 60%,12 h循环光照和黑暗环境。鼠盒、垫料及饲料均经过消毒,饮水经过高温高压灭菌处理。全程饲养过程中,饲料、水及时补充,垫料每3 d更换1次,并由南方医科大学SPF级实验动物中心专业饲养人员完成;(2)模型构建:gp120转基因小鼠(gp120+)与α7nAChR基因敲除纯合子小鼠(α7R-/-)进行杂交,记为F0,首先得到α 7nAChR基因杂合子(α7R+/-/gp120+或α7R+/-/gp120-)的F1。然后经基因型鉴定后选取α7R+/-/gp120+的小鼠进行自由交配,获得F2代小鼠。理论上F2代小鼠可能具有3种不同基因型(α7R+/-/gp120+或α7R+/+/gp120+或α7R-/-/ gp120+),最后经基因型鉴定后选取α7R-/-/gp120+基因型的小鼠作为双转基因模型构建成功的个体。实验整体的构建思路如图 1所示。
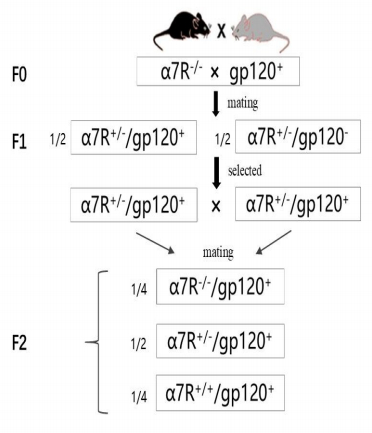
|
图 1 双基因编辑小鼠构建示意图 Fig.1 Schematic illustration of the construction of a doublegene modified mouse. |
(1)鼠尾DNA提取:血液/细胞/组织基因组DNA提取试剂盒(DP304)提取鼠尾DNA。取不同组小鼠鼠尾,并进行编号,充分剪碎。根据试剂盒操作说明进行组织DNA提取;(2)PCR引物及反应程序:α7R-/-小鼠和gp120+小鼠基因型鉴定所需的PCR因为序列如表 1。
| 表 1 α7R-/-小鼠和gp120+小鼠基因型鉴定的PCR引物设计 Tab.1 PCR primers for identifying α7R-/- or gp120+ mice |
Gp120反应条件:94 ℃,3 min,94 ℃,15 s,53 ℃,15 s,72 ℃,30 s,重复后3个步骤35次,72 ℃~10 min,4 ℃维持。α7 nAChR反应条件:94 ℃,3 min,94 ℃,15 s,60 ℃,15 s,72 ℃,20 s,重复后3个步骤35次,72 ℃,10 min,4 ℃维持。(3)采用PCR核酸琼脂糖凝胶电泳,Tanon- 1600凝胶成像仪(上海天能科技有限公司)观察结果。各个基因型的电泳条带分别为:α7 nAChR基因敲除纯合子(α7R-/-):187 bp,野生型(α7R+/+):390 bp,杂合子(α7R+/-):187 bp和390 bp双条带;gp120阳性基因型(gp120+):220 bp,阴性基因型(gp120-)没有条带。
1.2.3 gp120与α7nAChR蛋白表达检测取各组小鼠脑部组织,4%多聚甲醛中固定后,按照免疫组化标准方案,将石蜡切片脱蜡后再水化,抗原修复后,一抗gp120与α7nAChR(1: 1000)分别孵育过夜。PBS漂洗3遍,二抗室温孵育2 h,显色封片后镜下观察脑组织中gp120包膜蛋白、α7nAChR的表达情况。
1.2.4 α7 nAChR与银环蛇毒的相互作用分别提取α 7nAChR基因敲除小鼠(α7R-/-)和野生型小鼠(WT)脑部组织,4%多聚甲醛中固定后,行冰冻切片,孵育荧光α-银环蛇毒素,用DAPI染液进行核染,使用荧光显微镜观察结果,检测脑组织中α7nAChR与α-银环蛇毒素的相互作用情况。
1.2.5 细胞培养与干预小胶质细胞系(BV2)常规使用含10%胎牛血清的1640基本培养基,于5% CO2、37 ℃细胞培养箱中培养。待细胞长满后用胰酶消化,铺于6孔细胞培养板中。待细胞长至70%~90%时,使用无血清的1640培养基换液。体外实验分为4组:gp120组,MLA组,gp120+MLA组以及对照组。其中MLA组和gp120+MLA组使用MLA(10 μg/mL)预处理10 min,然后gp120组和gp120+MLA组采用0.1 μg/mL的HIV-1 LAV gp120蛋白处理24 h,对照组不作处理。最后收集细胞上清和通过ELISA检测IL-1β和TNF-α的表达量。
2 结果 2.1 F0小鼠基因型的鉴定通过PCR和琼脂糖凝胶电泳对F0小鼠进行基因型鉴定,结果显示,以α7nAChR敲除为亲本的雌性小鼠1~5号在187 bp处均有条带,提示基因型均为α7R-/-的纯合子;以gp120转基因为亲本的雄性小鼠Ⅰ~Ⅳ号在220 bp处均有条带,Ⅴ号小鼠在220 bp处无条带,表示Ⅰ~Ⅳ号基因型为gp120+,Ⅴ号小鼠基因型为gp120-(图 2),剔除Ⅴ号,选取其余小鼠作为亲本。
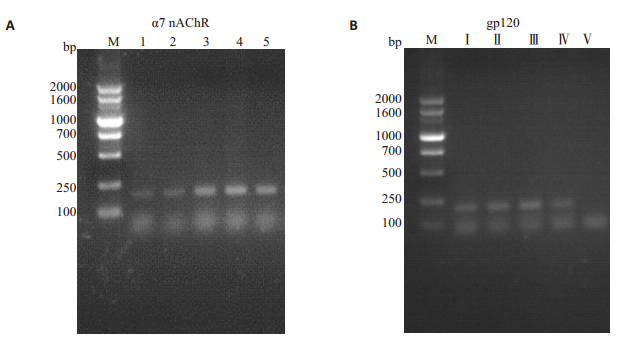
|
图 2 F0代α7 nAChR基因敲除小鼠(A)和gp120转基因小鼠(B)基因型鉴定 Fig.2 Genotype identification of α7nAChR knockout mice (A) and gp120 transgenic mice (B) in F0 mice. |
F0两种不同基因型小鼠交配后生产了3只F1小鼠,编号为1、2、3。PCR和琼脂糖凝胶电泳鉴定3只小鼠α7nAChR和gp120基因型,α7nAChR基因型鉴定结果显示3只小鼠存在187 bp和390 bp双条带,gp120基因型鉴定结果显示,1、2号小鼠存在220 bp条带,3号小鼠220 bp处无条带。综上,F1小鼠的基因型分别为1号:α7R+/-/gp120+,2号:α7R+/-/gp120+,3号:α7R+/-/gp120-,符合预期(图 3)。其中1号为雄性小鼠,2号、3号为雌性小鼠。按照之前计划的构建思路,将1号和2号小鼠合笼,其繁殖出的新生小鼠为F2代。
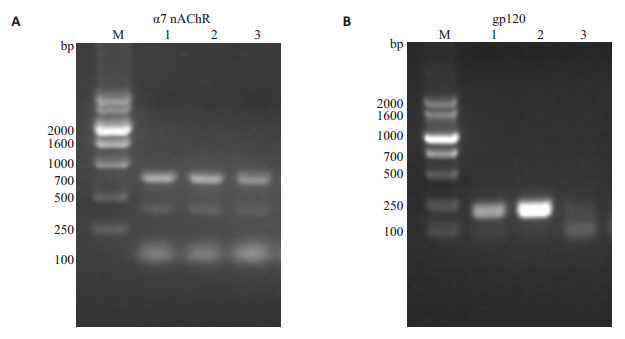
|
图 3 F1小鼠α7nAChR(A)和gp120(B)基因型的鉴定 Fig.3 Identification of α7nAChR(A) and gp120 (B) genotypes in F1 mice. |
F1代α7R+/-/gp120+和α7R+/-/gp120+基因型小鼠交配后生产了7只F2小鼠,编号分别为3~9号。选取2只C57野生型小鼠作为对照,编号1、2号。对上述9只小鼠进行α7nAChR和gp120基因型鉴定,鉴定结果显示:1号野生型小鼠基因型为α7R+/+/gp120-,2号小鼠α7nAChR基因型未能成功鉴定,F2中α7R-/-/gp120+基因型小鼠有8号和9号,α7R+/+/gp120+基因型小鼠有3号,4号和7号,α7 R+/-/gp120+基因型小鼠有5号和6号,如图 4。
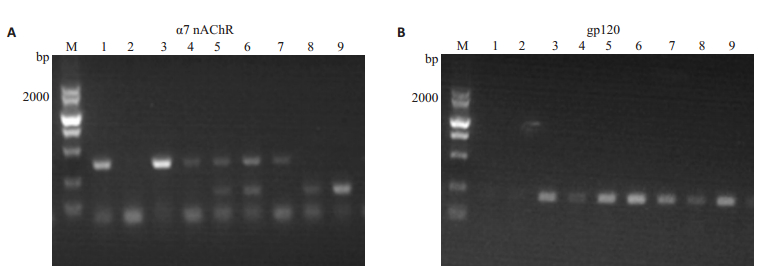
|
图 4 F2小鼠α7nAChR(A)和gp120(B)基因型的鉴定 Fig.4 Identification of α7nAChR (A) and gp120 (B) genotypes in F2 mice. |
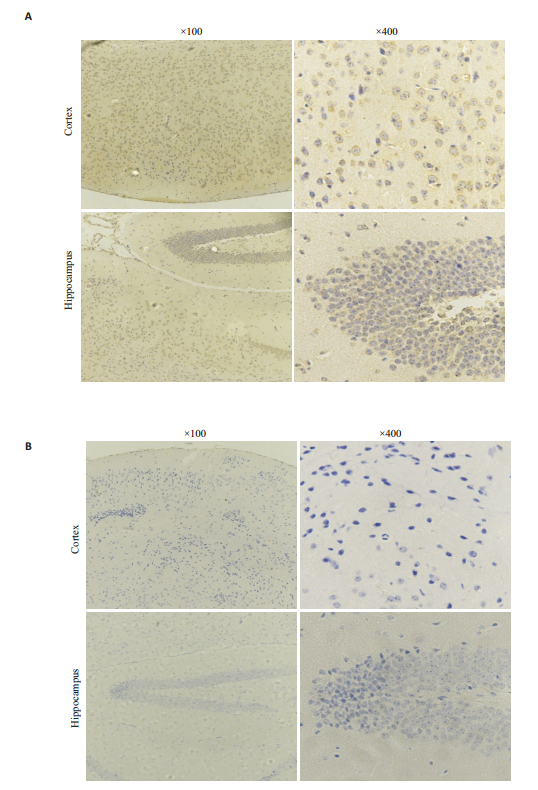
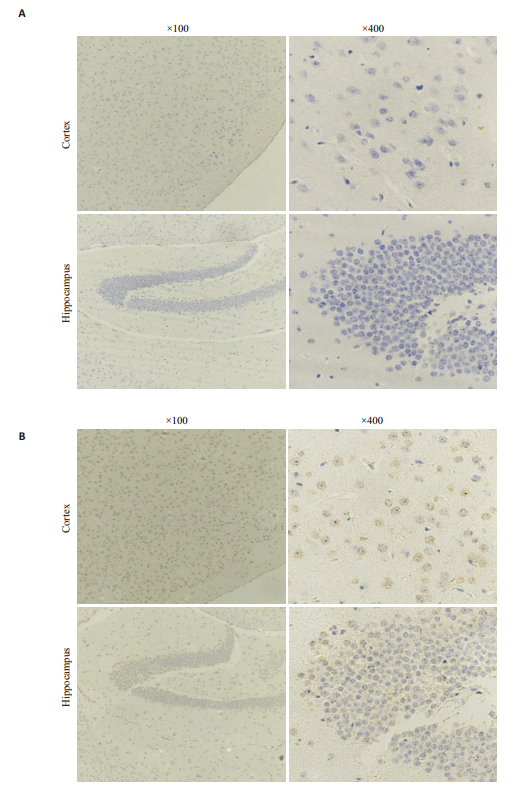
由上述结果显示1号为野生型小鼠,F2中8和9号为双基因编辑小鼠,取1号和8号小鼠脑组织,免疫组化验证α7nAChR和gp120蛋白的表达情况(图 5、6)1号小鼠基因型检测结果为α7R+/+/gp120-,免疫组化结果显示小鼠皮层与海马中有高表达α7nAChR,但没有gp120蛋白表达,与PCR鉴定结果一致。8号小鼠基因型为α 7R-/-/gp120+,结果显示小鼠海马与皮层中高表达gp120蛋白,但不表达α7nAChR,也与PCR鉴定结果一致。证明gp120转基因在三代小鼠中能够稳定遗传,并且α7nAChR表达缺陷。
|
图 5 野生型小鼠α7nAChR(A)和gp120(B)蛋白的鉴定 Fig.5 Identification of α7nAChR (A) and gp120 (B) proteins in Wild type mice. |
|
图 6 F2小鼠(α7R-/-/gp120+)α7nAChR(A)和gp120(B)蛋白的鉴定 Fig.6 Identification of α7nAChR (A) and gp120 (B) proteins in F2 mice (α7R-/-/gp120+). |
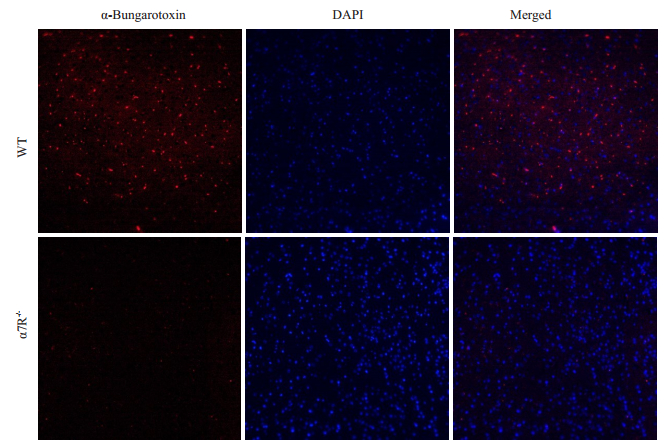
取野生型小鼠(WT)和α7nAChR基因敲除小鼠(α7R-/-)脑组织行α-银环蛇毒素和DAPI双荧光染色,在荧光显微镜下可见:在表达α7nAChR蛋白的野生型小鼠脑组织中,α-银环蛇毒素与其大量结合;而α7nAChR基因敲除小鼠(α7R-/-)脑组织中缺乏α7nAChR蛋白表达,镜下可见罕有α-银环蛇毒素结合(图 7)。
|
图 7 野生型和α7nAChR敲除小鼠脑组织的α-银环蛇毒素荧光染色 Fig.7 Fluorescence staining of α-Bungarotoxin in the brain tissue of wild-type and α7nAChR gene knockout mice (Original magnification: ×100). |
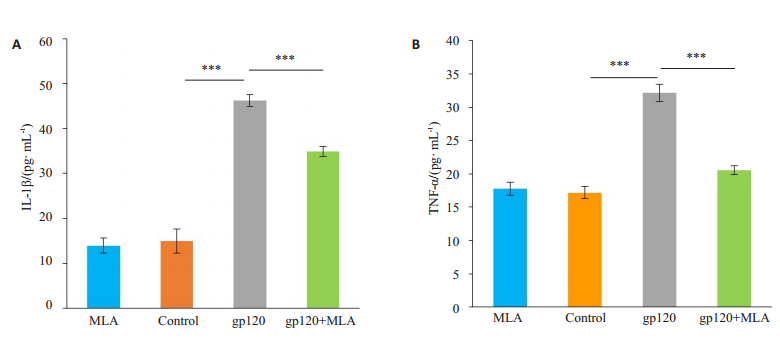
通过ELISA检测细胞上清液中的IL-1β与TNF-α的含量,我们发现小胶质细胞在gp120蛋白的刺激下,IL-1β与TNF-α分泌明显上升。加入MLA预处理BV2细胞抑制α7nAChR受体后,gp120诱导的IL-1β表达一定程度上减少,但仍高于对照组;TNF-α的表达量明显减少,与对照组相差不大。MLA的单独处理对IL-1β与TNF-α的分泌几乎无影响(图 8)。
|
图 8 BV2细胞IL-1β(A)与TNF-α(B)的表达情况 Fig.8 Expression of IL-1β (A) and TNF-α (B) in BV2 cells. ***P < 0.001. |
基因编辑技术、受精卵原核注射法和杂交繁殖技术是建立转基因动物模型常用的技术手段,最早建立且发展较成熟的转基因动物模型就是转基因小鼠,其繁殖方便,周期相对较短,成本低等一系列优点使得转基因小鼠模型的构建更加省时省力[19]。本次研究主要利用杂交繁殖技术构建了双基因修饰小鼠模型(α7R-/-/ gp120+),通过基因检测证明α7nAChR基因敲除成功,且gp120显示过表达。分析F0到F2代小鼠的基因型可以看出,α7nAChR敲除基因和gp120转基因均能稳定遗传。进一步,免疫组化检测发现在小鼠脑组织中α7nAChR蛋白未表达,gp120蛋白高表达,从基因水平和蛋白表达水平上均证明双基因编辑小鼠模型(α7R-/-/ gp120+)构建成功。为初步探索α7nAChR受体的功能,本研究使用α-银环蛇毒素荧光染料对野生型和α7nAChR敲除小鼠的脑组织进行了染色。结果提示α7nAChR可与α-银环蛇毒素结合,且进一步说明α7nAChR敲除成功,从α7nAChR结合功能方面对小鼠进行了鉴定。本次实验中使用的α7nAChR纯合敲除小鼠具有生存率高,无明显脑形态异常的特点。该模型小鼠是通过同源重组技术造成小鼠胚胎干细胞的7 kb基因片段缺失。该缺失片段包括了α7nAChR最后三个外显子(8~10个外显子),这些外显子负责编码α7nAChR第二跨膜结构域(MII),形成离子通道和第三、第四跨膜结构域[20]。且经实验证实该小鼠脑组织中缺乏高亲和力的α-银环蛇毒素结合位点。
烟碱型乙酰胆碱受体在生物学、生理学和病理学等方面都发挥着重要作用,与感觉、认知、疼痛和递质释放等密切相关。α7nAChR是烟碱型胆碱能受体之一,能调控炎性反应细胞释放细胞因子[14-15, 18],与神经系统疾病如阿尔兹海默症[21-22]、帕金森病[23]、精神分裂症[24-25]以及与炎症反应有关的危重症[26]等多种疾病相关。目前认为α7nAChR的抗炎作用可通过核转录因子-κB和Janus活化激酶2信号传感器和转录激活子3两条细胞内信号通路实现[17, 27],也有研究证明激活α7nAChR可以增强单核/小胶质细胞的自噬[28],从而抑制神经炎症。
HIV的感染不仅会因为慢性和持续性炎症影响外周器官[29-30],还会损害患者的认知功能,可出现认知障碍等不同程度的表现[5-6]。目前临床上尚无针对HIV相关的明确疗法。在HIV感染过程中,游离的gp120蛋白可单独作为病原物质引起机体产生免疫应答,可用作HIV感染的生物标志物。因此,HIV-1gp120转基因小鼠非常适合研究gp120蛋白的长期、慢性作用和由HIV诱发的中枢神经系统损伤的致病机制。既往研究发现gp120转基因小鼠至少在3月龄以上时大脑皮层中会出现神经元树突丢失等神经病理学特征和神经炎症指标上升;在6月龄以上时会出现行为改变或损害如游泳速度降低,记忆缺陷和焦虑行为[31-32]。综上,利用α7 nAChR基因敲除gp120转基因小鼠模型研究α7nAChR在gp120引起的神经毒性作用也将是一个长期过程,应使用老年期小鼠进行研究。本课题组前期已证实gp120可通过诱导小胶质细胞释放炎症因子而损伤神经元突触[16]。在前期工作中,我们亦比较了野生型(WT)小鼠和gp120小鼠经α7 nAChR抑制剂MLA处理后血液中cBMECs水平,通过伊文思蓝法(EB)检测小鼠大脑功能,同时还检测了脑脊液中UCHL1、Tau蛋白和Slurp1水平。实验证明gp120刺激能造成小鼠脑脊液中UCHL1、Tau蛋白、Slurp1和cBMEC细胞标记物水平升高,且该过程可被α7 nAChR抑制剂阻断。上述结果表明α7nAChR在由HIV-1 gp120引起的CNS炎症和BBB疾病中起着重要作用。本次研究通过gp120作用于小胶质细胞结果显示,gp120可促进小胶质细胞释放炎症因子,而抑制α7nAChR后炎症因子表达降低,提示gp120引起的小胶质细胞活化以及细胞因子的表达可能由α7nAChR介导。利用建立成功的双基因编辑动物模型可以深入验证这一机制。
此外,研究还表明[33, 13],使用α7nAChR的抑制剂可一定程度的改善由gp120蛋白引起的学习和运动缺陷,说明α7nAChR受体有望成为治疗HAND的有效靶点。本研究成功构建了双基因编辑小鼠模型(α7R-/-/ gp120+),不仅为研究HIV-1所介导神经损伤中α7nAChR作用提供了有效的技术支持,对后续药物研发也具有重要价值。
| [1] |
Gougeon ML. Alarmins and central nervous system inflammation in HIV-associated neurological disorders[J]. J Intern Med, 2017, 281(5): 433-47. |
| [2] |
Piccinelli AC, Morato PN, Dos Santos Barbosa M, et al. Limonene reduces hyperalgesia induced by gp120 and cytokines by modulation of IL-1 β and protein expression in spinal cord of mice[J]. Life Sci, 2017, 174: 28-34. |
| [3] |
Liu R, Wu C, Li L, et al. CD48 and α7 nicotinic acetylcholine receptor synergistically regulate FimH-mediated Escherichia coli K1 penetration and neutrophil transmigration across human brain microvascular endothelial cells[J]. J Infect Dis, 2019, 219(3): 470-9. |
| [4] |
Zhang B, Yu JY, Liu LQ, et al. Alpha7 nicotinic acetylcholine receptor is required for blood-brain barrier injury-related CNS disorders caused by Cryptococcus neoformans and HIV-1 associated comorbidity factors[J]. BMC Infect Dis, 2015, 15: 352. |
| [5] |
Song LM, Pei L, Yao SL, et al. NLRP3 inflammasome in neurological diseases, from functions to therapies[J]. Front Cell Neurosci, 2017, 11: 63. |
| [6] |
Shi S, Liang DL, Bao M, et al. Gx-50 inhibits neuroinflammation via α7 nAChR activation of the JAK2/STAT3 and PI3K/AKT pathways[J]. J Alzheimers Dis, 2016, 50(3): 859-71. |
| [7] |
Krafft PR, McBride D, Rolland WB, et al. α7 nicotinic acetylcholine receptor stimulation attenuates neuroinflammation through JAK2-STAT3 activation in murine models of intracerebral hemorrhage[J]. Biomed Res Int, 2017, 2017: 8134653. |
| [8] |
Yan W, Zhong-Yi Z. Expression of α7-nAChR on rat hippocampal astrocytes in vivo and in vitro[J]. J Southern Med Univ, 2007, 27(5): 591. |
| [9] |
Wang Y, Liu L, Wang S, et al. Temporal and spatial changes of α 7nAChR and nNOS in cerebral cortex and Hippocampus of Aβ -induced cognitive dysfunction rats[J]. Acta Physiol Sin, 2016, 68(6): 775-82. |
| [10] |
Mulcahy MJ, Paulo JA, Hawrot E. Proteomic investigation of murine neuronal α7-nicotinic acetylcholine receptor interacting proteins[J]. J Proteome Res, 2018, 17(11): 3959-75. |
| [11] |
Chan T, Williams E, Cohen O, et al. CHRFAM7A alters binding to the neuronal alpha-7 nicotinic acetylcholine receptor[J]. Neurosci Lett, 2019, 690: 126-31. |
| [12] |
Broz P, Dixit VM. Inflammasomes: mechanism of assembly, regulation and signalling[J]. Nat Rev Immunol, 2016, 16(7): 407-20. |
| [13] |
Capó-Vélez CM, Morales-Vargas B, García-González A, et al. The alpha7-nicotinic receptor contributes to gp120-induced neurotoxicity: implications in HIV-associated neurocognitive disorders[J]. Sci Rep, 2018, 8(1): 1829. |
| [14] |
Ramos FM, Delgado-Vélez M, Ortiz {L, et al. Expression of CHRFAM7A and CHRNA7 in neuronal cells and postmortem brain of HIV-infected patients: considerations for HIV-associated neurocognitive disorder[J]. J Neurovirology, 2016, 22(3): 327-35. |
| [15] |
Eggers C, Arendt G, Hahn K, et al. HIV-1-associated neurocognitive disorder: epidemiology, pathogenesis, diagnosis, and treatment[J]. J Neurol, 2017, 264(8): 1715-27. |
| [16] |
He XL, Yang WJ, Zeng ZJ, et al. NLRP3-dependent pyroptosis is required for HIV-1 gp120-induced neuropathology[J]. Cell Mol Immunol, 2020, 17(3): 283-99. |
| [17] |
Chen NC, Partridge AT, Sell C, et al. Fate of microglia during HIV-1 infection: From activation to senescence?[J]. Glia, 2017, 65(3): 431-46. |
| [18] |
Heneka MT, McManus RM, Latz E. Inflammasome signalling in brain function and neurodegenerative disease[J]. Nat Rev Neurosci, 2018, 19(10): 610-21. |
| [19] |
马微, 赵伟, 李丹, 等. 后基因组时代转基因小鼠在生命科学中的研究进展[J]. 医学综述, 2011, 17(9): 1286-9. |
| [20] |
Orr-Urtreger A, Göldner FM, Saeki M, et al. Mice deficient in the alpha7 neuronal nicotinic acetylcholine receptor lack alphabungarotoxin binding sites and hippocampal fast nicotinic currents[J]. J Neurosci, 1997, 17(23): 9165-71. |
| [21] |
Dziewczapolski G, Glogowski CM, Masliah E, et al. Deletion of the α7 nicotinic acetylcholine receptor gene improves cognitive deficits and synaptic pathology in a mouse model of Alzheimer's disease[J]. J Neurosci, 2009, 29(27): 8805-15. |
| [22] |
Wang HY, Trocmé-Thibierge C, Stucky A, et al. Increased Aβ42-α 7-like nicotinic acetylcholine receptor complex level in lymphocytes is associated with apolipoprotein E4-driven Alzheimer's disease pathogenesis[J]. Alzheimers Res Ther, 2017, 9(1): 54. |
| [23] |
Quik M, Zhang DH, McGregor M, et al. Alpha7 nicotinic receptors as therapeutic targets for Parkinson's disease[J]. Biochem Pharmacol, 2015, 97(4): 399-407. |
| [24] |
Wong DF, Kuwabara H, Horti AG, et al. Brain PET imaging of α 7-nAChR with[J]. Int J Neuropsychopharmacol, 2018, 21(7): 656-67. |
| [25] |
Lin H, Hsu FC, Baumann BH, et al. Cortical parvalbumin GABAergic deficits with α7 nicotinic acetylcholine receptor deletion: implications for schizophrenia[J]. Mol Cell Neurosci, 2014, 61: 163-75. |
| [26] |
Ren C, Tong YL, Li JC, et al. The protective effect of alpha 7 nicotinic acetylcholine receptor activation on critical illness and its mechanism[J]. Int J Biol Sci, 2017, 13(1): 46-56. |
| [27] |
Mangan MSJ, Olhava EJ, Roush WR, et al. Targeting the NLRP3 inflammasome in inflammatory diseases[J]. Nat Rev Drug Discov, 2018, 17(9): 688. |
| [28] |
Shao BZ, Ke P, Xu ZQ, et al. Autophagy plays an important role in anti-inflammatory mechanisms stimulated by Alpha7 nicotinic acetylcholine receptor[J]. Front Immunol, 2017, 8: 553. |
| [29] |
Delgado-Vélez M, Báez-Pagán CA, Gerena Y, et al. The α7-nicotinic receptor is upregulated in immune cells from HIV-seropositive women: consequences to the cholinergic anti-inflammatory response[J]. Clin Transl Immunology, 2015, 4(12): e53. |
| [30] |
Capó-Vélez CM, Delgado-Vélez M, Báez-Pagán CA, et al. Nicotinic acetylcholine receptors in HIV: possible roles during HAND and inflammation[J]. Cell Mol Neurobiol, 2018, 38(7): 1335-48. |
| [31] |
万宇, 杨伟军, 龚泽龙, 等. HIV-1包膜蛋白gp120在神经元损伤诱发认知障碍中的作用[J]. 中华微生物学和免疫学杂志, 2020, 40(1): 32-7. |
| [32] |
Thaney VE, Sanchez AB, Fields JA, et al. Transgenic mice expressing HIV-1 envelope protein gp120 in the brain as an animal model in neuroAIDS research[J]. J Neurovirol, 2018, 24(2): 156-67. |
| [33] |
Ballester LY, Capó-Vélez CM, García-Beltrán WF, et al. Upregulation of the neuronal nicotinic receptor α7 by HIV glycoprotein 120: potential implications for HIV-associated neurocognitive disorder[J]. J Biol Chem, 2012, 287(5): 3079-86. |
 2020, Vol. 40
2020, Vol. 40

