2. 兰州大学口腔医院修复科,甘肃 兰州 730000;
3. 兰州大学口腔医院正畸科,甘肃 兰州 730000;
4. 兰州大学口腔医院颌面外科,甘肃 兰州 730000
2. Department of Prosthodontics, Hospital of Stomatology, Lanzhou University, Lanzhou 730000, China;
3. Department of Orthodontics, Hospital of Stomatology, Lanzhou University, Lanzhou 730000, China;
4. Department of Oral and Maxillofacial Surgery, Hospital of Stomatology, Lanzhou University, Lanzhou 730000, China
正畸力是促进颌骨重塑改建以及牙齿有效移动的重要利器,这构成正畸牙移动的生物力学基础[1]。龋白斑是正畸治疗过程最常见的并发症[2-3],其发病率为2%~ 96% [4-6],临床上主要表现为脱矿后釉质表层下形成孔隙结构,发生釉质脱矿但未形成龋洞,在平滑面上可表现为不透明的乳白色[7]。有报道指出24%患者的龋白斑会发展成龋损[3]。而口腔卫生差、正畸治疗周期长的患者发生龋白斑的概率会倍增[8]。正畸加力过程中,不可避免地需要在牙冠表面粘固正畸托槽或其附件[9],在托槽周围的牙体组织发生脱矿和形成龋白斑是正畸过程中普遍存在的问题[5, 10-11]。这不仅有利于菌斑的堆积,而且也阻碍口腔的自洁作用,如口腔肌肉的运动和唾液的冲刷,导致釉质脱矿-再矿化平衡被打破,脱矿占据主导地位,釉质中的矿物质流失,进而导致龋白斑甚至龋洞形成[7]。有研究表明,力学因素可能参与了牙釉质层微观结构的改变,使得牙齿对于龋病易感[12-13]。考虑临床中不当正畸牵引力的使用可能会破坏釉质结构的完整性,造成釉质表面微裂纹的形成,使得菌斑易于堆积,最终导致龋损的发生并且可能引起局部牙釉质层微观结构的改变。但目前对于牵引力作用于牙体组织结构所产生的影响,以及力学因素与龋病发生的相关研究,尚无报道。因此,本文提出假说正畸牵引力加载会造成牙釉质微结构的变化,从而造成细菌更易入侵而发生龋白斑。实验中设置了长期加力组和短时大力组模拟临床正畸力的加载作用,研究加力后牙釉质层微观结构的变化,进行力学作用介入的分析,为临床上正畸力的合理加载提供理论依据。
1 材料和方法 1.1 实验材料与仪器离体牙、MBT直丝弓托槽、酸蚀剂(Gluma Etch 35 Gel CE0197)、齿科粘结剂GLUMA、3M ESPE树脂材料(3M)、牙齿粘合树脂液剂(西湖生物材料有限公司)、牙齿粘合树脂糊剂(西湖生物材料有限公司)、砝码(蓬莱市水玲砝码厂)、直丝(Rectangular S.S Straight wire 215×28)、结扎丝、硬组织切片机(Leica2500E)、万能试验机(AG-IS SHIMADZU)、FEG-450热场发射扫描电子显微镜(SEM)-能谱仪(EDS)(Quanta)、JPK原子力学显微镜(Bruker)。
1.2 方法 1.2.1 试样制备离体牙选取正畸治疗中拔除的健康前磨牙,刮匙及橡皮杯彻底去除表面牙石、残留牙周组织,以600#、800#、1000#、2000#以及3000#的水砂纸依次梯度打磨抛光牙齿颊面釉质表面后,保存于无菌生理盐水中。
离体牙纳入标准[14-15]:牙体解剖形态正常、无龋坏、无隐裂、无折裂、无釉质发育不全、非四环素牙、非氟斑牙、牙体牙髓未经任何治疗。
1.2.2 实验分组剪切力实验随机分为6组,每组8颗。A组为空白对照组,仅使用光固化粘接法粘接正畸托槽,不加任何力。B1、B2、B3组均使用光固化粘接法粘接正畸托槽,分别加载50 g力持续6月,200 g力持续6月和200 g力持续1月。C1、C2组分别使用光固化粘接和化学固化粘接技术粘接托槽。之后离体牙样本以不脱钙环氧树脂法包埋,使用硬组织切片机制备厚度为2 mm的试样圆片,作为SEM、AFM和EDS检测的试样。
1.2.3 粘接剂残余指数评价当托槽脱离粘接后,检查牙釉质表面,确定牙齿残余粘接剂留在釉质上的量,按照牙面粘接剂残余指数(ARI)[16]进行计分评估(评估标准:0分,牙面上无残留;1分,牙面上有面积小于1/2粘接面积的残留;2分,牙面上残留粘接剂面积大于黏结面积的1/2;3分,所有粘接剂均残留在牙面上,且粘接剂表面有托槽底板压痕)观察釉质表面结构破坏的情况
1.2.4 剪切力加载持续力加载:取32颗离体牙,使用慢速手机磨除牙周组织后吹干15 s,酸蚀剂酸蚀30 s后冲洗吹干,涂抹齿科粘结剂GLUMA于托槽与粘接面上,使用探针勾取适量3M ESPE树脂材料于托槽,粘接托槽并去除多余的粘接剂。VALO光固化机标准模式于中端和远端光固化20 s。
加载长期力利用砝码重力实现,自行设计了一款模拟长期力的加载装置(图 1)。力加载装置中将超硬树脂置于木盒盖子顶端,为牙齿提供附着点。用0.30 mm结扎丝悬挂砝码,砝码(50 g,200 g)重力进行模拟长期力的加载。

|
图 1 长期力加载装置示意图 Fig.1 Photograph of the long-term force-loading device. |
短时力加载:选取16颗离体牙,随机分为光固化和化学固化组。模拟正畸矫治过程产生过大矫治力的情况。光固化粘接同上述步骤,化学固化组牙釉质表面使用酸蚀剂酸蚀20 s,用蒸馏水冲洗15 s,然后吹干15 s。用一次性粘接棒涂抹牙齿粘合树脂液剂于托槽与粘接面,取少量牙齿粘接树脂糊剂于托槽上,粘接托槽。使用自凝树脂包埋牙体,使粘接面与拉伸方向垂直。采用“剪切力实验”进行短时大力的加载,将试样用试验机的夹具固定,拉伸方向与试样纵轴方向平行且重合。加载速度为1 mm/min,直到试件断裂,记录载荷峰值(N)。临床常用的直丝对托槽进行卡位,0.30 mm的结扎丝固定,采用万能试验机进行剪切力实验,分别对C1和C2组的试样进行检测。以1 mm/min的速度拉断,记录此过程的断裂力值(N)。
1.2.5 SEM与EDS表征将环氧树脂包埋切片后的试样截面依次以600#、800#、1000#、2000#以及3000#的水砂纸梯度打磨抛光,然后超纯水超声清洁。将样本用氮气干燥、喷金,使用FEG-450热场SEM-EDS观察分析试样的微观形貌和元素分布。
1.2.6 AFM形貌与力学性质测量采用JPK原子力学显微镜对拉伸后试样的硬组织切片进行微纳米尺度牙釉质层微结构和其组织力学性质检测。扫描范围设定为50 μm×50 μm和10 μm×10 μm,以轻敲模式在空气相中使用弹性系数为42 N/m的探针(NCH, NANOWORLD)测量牙面微观结构以及力学性质。对于获得的力学数据使用JPK SPM Data Processing软件(version 5.1.8)进行数据处理。
1.2.7 统计分析所有数据均采用SPSS 22.0统计学软件进行数据处理,计量资料以均数±标准差表示,两样本组间比较采用t检验,多组样本比较采用单因素方差分析。P<0.05认为差异具有统计学意义。
2 结果 2.1 粘接剂残余指数评价结果将所有实验组的托槽脱离粘接后,检查牙体釉质表面,根据粘接剂残余指数评价方法进行分析,空白对照组ARI指数为2。加载不同力值大小和时间的实验组B1、B2和B3的ARI指数分别为3、2和3。光固化粘接组的ARI指数为3,化学粘接组的ARI指数为0。其中光固化粘接组的ARI明显高于化学粘接组。当使用光固化粘接时,在不同持续时间和大小力值的力加载下,牙体表面ARI无明显差别。
2.2 剪切力强度比较粘接剂的剪切力强度,如剪切力-时间关系曲线(图 2)所示,光固化粘接组的剪切力强度(载荷峰值78.05 N,断裂力值73.68 N)大于化学粘接组(载荷峰值22.14 N,断裂力值20.92 N)(P<0.05)。表明经过光固化粘接要比化学粘接更加牢固。
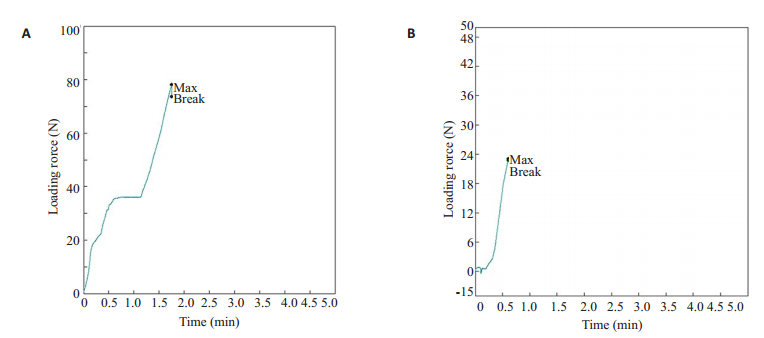
|
图 2 剪切力-时间关系曲线 Fig.2 Shear force-time curve of the teeth in Group C1 (A) and Group C2 (B). |
SEM观察釉质表面与树脂界面处形貌结构的改变(图 3)。低倍(1000倍)各组试件表面均可见釉质表面和树脂材料的明显界线,可见不同材质的形貌结构像。A组和其他实验组表面形貌相比具有明显差异。A组的试样表面平整,无明显的裂隙,釉柱排列较规则,偶见不规则的小球状矿物质沉积。加力组B1、B2、B3、C1、C2组表面出现的微裂纹明显多于不加力的A组。放大5000倍时,加力组的釉质表面结构位于釉质表面与粘接剂交界处,出现较多的不规则凹陷或突起。B1组釉质表面有圆形或椭圆形的晶体小颗粒沉积,密集、紧凑,略显隆起,B2组小颗粒沉积较多,出现与打磨方向垂直的微裂纹,B3组出现了片状、条状等无定形的晶体颗粒沉积物生长。C1和C2组试样表面出现了不同于釉质结构方向的微裂隙,C2组釉质表面出现明显空隙结构。

|
图 3 釉质在不同正畸力和时间加载下的扫描电镜的结构形态 Fig.3 Dental enamel structure of the teeth under different orthodontic forces and loading time. A: Morphological structure of the blank control group (Original magnification: ×1000); B: Morphological structure of the blank control group (×5000); C: Group C1 appearance (×1000); D: Group C1 appearance (×5000); E: Group C2 appearance (×1000); F: Group C2 appearance (×5000); G, H: The structure of group B1 (×1000, ×5000); I, J: The structure of group B2 (×1000, ×5000); K, L: The structure of group B3(×1000, ×5000). A, C, E, G, I and K all show a clear dividing line in the center with enamel on the left and resin material on the right. |
基于EDS分析,检测试样中钙、磷、氧及硅主要元素的面总占比(图 4)。各组试件中主要通过元素硅、钙、磷等元素区别粘接树脂区和牙体组织区。粘接树脂区的硅元素明显高于牙体组织区,但钙和磷元素的含量明显低于牙体组织区,其中牙本质区钙和磷元素明显低于牙釉质区含量,钙、磷元素均匀分布在牙体组织区。A组Ca含量21.7%,P含量10.6%,O含量67.7%。C1组Ca含量17.3%,P含量8.1%,O含量74.5%,Si含量0.1%。C2组Ca含量8.0%,P含量5.1%,O含量45.8%,Si含量8.0%。B1组Ca含量14.3%,P含量3.6%,O含量61.2%,Si含量20.9%。B2组Ca含量23.3%,P含量11.5%,O含量65.2%。B3组Ca含量11.1%,P含量7.7%,O含量67.4%,Si含量11.9%。显然对牙体组织区和粘接树脂区,钙、磷、氧及硅主要元素均匀分布其间。
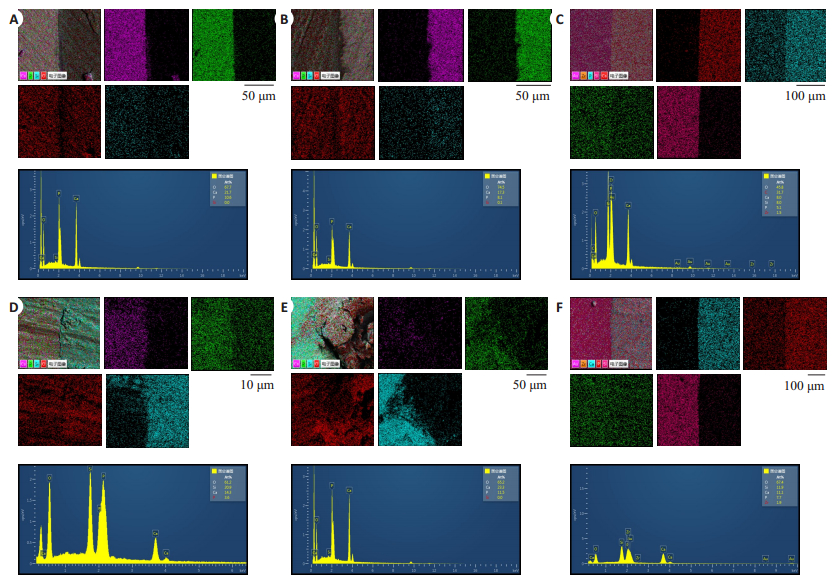
|
图 4 釉质在不同时间和不同正畸力下EDS的元素分析 Fig.4 Elemental analysis of EDS in dental enamel after loading with different orthodontic forces and different loading time. A: Element distribution and content in blank control group; B, C: Element distribution and content in dental specimens after light curing bonding and chemical bonding, respectively; D, E, F: Element distribution and content in dental tissues after loading with 50 g force for 6 months, 200 g force for 6 months, and 200 g force for 1 month, respectively. |
通过AFM测量获得每组样本表面微形貌和力学性质(图 5)。对比正常空白未受力组界面形貌观察可见牙釉质颗粒排列紧致有序,有明显排列整齐的釉柱晶体结构。当样本受过大力后,釉质颗粒排列无序,表面可见散在分布的孔隙,釉柱结构出现破坏,界面处微裂隙也显著增多。此外,试件均为粗糙表面,具有凹凸不平的峰谷结构。A组对照组均方根粗糙度为639.3±135.13 nm,C1光固化粘接组均方根粗糙度为502.5±231.51 nm,C2化学粘接组均方根粗糙度为143.6±59.54 nm(A vs C2,P<0.05)。A组对照组的峰谷间距为3.79±0.39 μm,C1光固化粘接组为2.42 ± 0.77 μm,C2化学粘接组为763.37±365.76 nm(A vs C2,C1 vs C2,P<0.05)。加力组的试件峰谷间距更大,加力组牙釉质的表面粗糙度明显高于对照组。
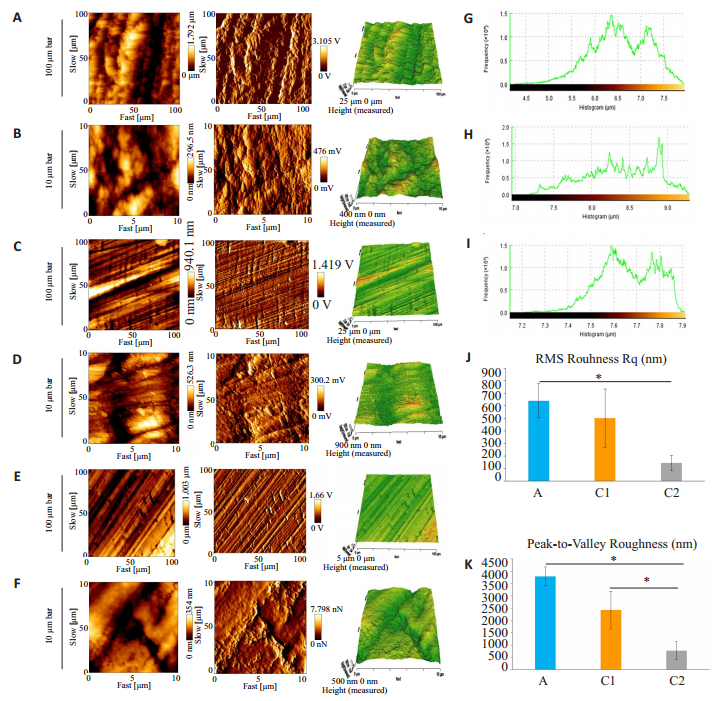
|
图 5 使用不同粘接方法加力作用下的釉质表面AFM形态 Fig.5 AFM morphology of the enamel surface of the teeth with different bonding methods. A: AFM image (height measured, vertical deflection and 3D) of Group A (100 μm); B: AFM image (height measured, vertical deflection and 3D) of Group A (10 μm); C: AFM image (height measured, vertical deflection and 3D) of Group C1; D: AFM image (height measured, vertical deflection and 3D) of Group C1 (10 μm); E: AFM image (height measured, vertical deflection and 3D) of Group C2 (100 μm); F: AFM image (height measured, vertical deflection and 3D) of Group A (10 μm); G: Frequency of group A; H: Frequency of group C1; I: Frequency of group C2; J: RMS Roughness Rq for groups A, C1 and C2; K: Peak-to-valley roughness Rt for groups A, C1 and C2. *P < 0.05. |
使用Comsol multiphysics5.3仿真软件模拟牙釉质和树脂突的范式等效应力,模拟的树脂材料硬度小于牙体的硬度,两者均简化为线弹性体,树脂突简化为圆柱体形状,载荷均匀分布在圆柱体的整个截面上。当树脂突在牙釉质表面形成时,在树脂突与牙体组织相交处出现明显的应力集中区域。
3 讨论正畸治疗以矫正患者的错颌畸形,实现稳定的咬合关系、改善颜面部美学和恢复良好的咀嚼功能为主要目标[17]。良好的牙齿排列可以简化口腔卫生维护措施,降低龋病、牙周病等疾病的发生[1]。但在正畸治疗的过程中,最常见的并发症是龋白斑[3, 18]。目前主流观点认为托槽、附件以及粘接树脂周围容易聚集、定殖细菌[19],同时矫治装置阻碍了口腔卫生清洁措施以及影响颊、舌和唾液对牙面的自洁作用[3]。与固定矫治器相比,隐形矫治器不存在托槽,患者能自行摘戴和清洁,但患者仍然易感龋病[20],这提示可能有其他因素参与了龋坏的发生过程。以往研究发现在正畸治疗结束后去除托槽的过程中,施加的力会造成牙釉质内部结构的破坏[21]。还有研究表明外力会造成牙齿内部羟基磷灰石晶体排列的改变,不同方向和强度的力甚至会造成晶体内部结构的破坏[22],这表明力学因素可能参与了牙釉质层微观结构的改变,使得牙齿易感龋病。那么,探讨力学作用影响釉质微观结构改变和釉质脱矿过程,造成龋病易感,及其在龋白斑的发生过程中是否发挥重要作用。本实验通过两步法酸蚀牙面,使用不同方法粘接托槽,设置长期加力组和短时大力组模拟临床正畸力的加载作用,研究加力后釉质层微观结构的变化,进行力学作用介入分析,旨在为临床上合理加载正畸力提供理论依据。
本实验模拟长期力的加载试验,选择轻力(<50 g),中力(100~300 g),重力(>300 g),为临床较为常用的正畸力大小,自制的实验加力装置较好的模拟了临床正畸中牙齿的被动受力。结果表明,与对照组相比,实验组离体牙粘合剂残余指数较大,SEM观察到牙釉质表面出现微裂纹和空隙结构,AFM观察到不同粘接方式的釉质表面形成与打磨方向呈角度的微裂纹。托槽上加的力值越大,实验组牙釉质界面微裂隙越多,试件峰谷间距更大,并且其牙釉质的表面粗糙度明显高于对照组(P<0.05)。上述结果提示正畸加力过程中力学作用对釉质微观结构产生微裂隙方式破坏,从而参与釉质脱矿发生,但临床正畸治疗过程中由于口腔微环境的复杂性,牙釉质表面可处在脱矿-再矿化的动态平衡中,因此其表面虽然产生微小裂纹,但没有出现明显的扩展和破坏。
正畸治疗中出现釉质脱矿是普遍存在的,对正畸医师而言,脱矿导致龋白斑不仅破坏了牙齿结构的完整性,也产生一系列美学问题[23-24]。而龋白斑是正畸治疗过程中最常见的并发症之一[25]。固定矫治器放置后在未防范的情况下,牙釉质脱矿的发生率高达50% [26]。此外,口腔优势菌群、托槽的材质、种类和表面形态也会影响致龋菌在牙表面的粘附能力[27-29]。本实验中正畸力作用使牙体组织结构受到一定的破坏,以微裂纹为主要特点。结果发现力学作用是影响牙体在微环境下发生脱矿的促进因素之一。在临床操作中,光固化粘接技术是在酸蚀后去除牙体表面的玷污层、形成树脂突,加强机械力固位,使树脂材料更好的与牙体组织结合[30]。然而形成树脂突的同时,釉柱结构遭到了破坏,在同样大小的外力作用下,力的传导方向也发生了变化。正常情况下牙体表面受力,力直接作用于牙体,沿釉柱的方向传导,但当力作用于树脂表面进行传导时,其大小和方向均发生了改变,这和树脂突的形成和材料的性质有关。树脂突结构很有可能导致正畸力方向和大小的改变,从而增大釉柱所受到的侧向力,进而增加釉质结构破坏的可能性,使牙体发生脱矿。本实验进一步通过有限元方法对树脂突部位受力进行力学模拟分析,发现树脂突结构的存在导致其与牙体组织界面上存在较大的等效应力分布(图 6)。
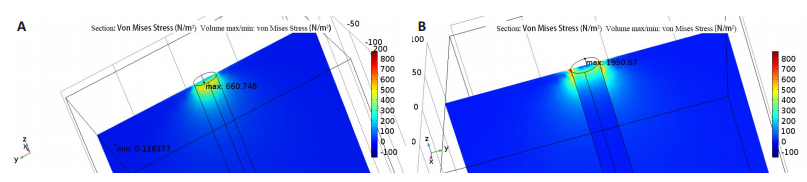
|
图 6 树脂突对牙体的范式等效应力分布模拟图 Fig.6 Simulation diagram of the Von Mises stress distribution of the resin protrusion on the tooth body. A: Size and range of stress distribution in the dental tissue in blank control group; B: Size and range of the stress distribution in the dental tissue after the formation of the resin protrusion. |
综上,在不当正畸力加载作用下,会造成牙体微结构的改变,通常以微裂纹的形式参与釉质脱矿-再矿化平衡,多形成龋白斑,导致牙体易感龋病。本实验没有验证在正畸力的情况下致龋菌如何对牙体表面产生影响,如增加牙表面粘附力、增加产酸、增加致病能力等;此外,正畸力是否会改变宿主龋易感情况,还需考虑唾液流量和组成、饮食习惯和频率等,这些不足需在后续试验进一步研究。
| [1] |
Zotti F, Dalessandri D, Salgarello S, et al. Usefulness of an app in improving oral hygiene compliance in adolescent orthodontic patients[J]. Angle Orthod, 2016, 86(1): 101-7. DOI:10.2319/010915-19.1 |
| [2] |
Leeper DK, Noureldin A, Julien K, et al. Risk assessments in orthodontic patients developing white spot lesions[J]. J Investig Clin Dent, 2019, 10(4): e12470. |
| [3] |
Srivastava K, Tikku T, Khanna R, et al. Risk factors and management of white spot lesions in orthodontics[J]. J Orthod Sci, 2013, 2(2): 43-9. |
| [4] |
Heymann GC, Grauer D. A contemporary review of white spot lesions in orthodontics[J]. J Esthet Restor Dent, 2013, 25(2): 85-95. DOI:10.1111/jerd.12013 |
| [5] |
Julien KC, Buschang PH, Campbell PM. Prevalence of white spot lesion formation during orthodontic treatment[J]. Angle Orthod, 2013, 83(4): 641-7. DOI:10.2319/071712-584.1 |
| [6] |
Zachrisson BU, Zachrisson S. Caries incidence and orthodontic treatment with fixed appliances[J]. Scand J Dent Res, 1971, 79(3): 183-92. |
| [7] |
Indrapriyadharshini K, Madan Kumar PD, Sharma K, et al. Remineralizing potential of CPP-ACP in white spot lesions - A systematic review[J]. Indian J Dent Res, 2018, 29(4): 487-96. DOI:10.4103/ijdr.IJDR_364_17 |
| [8] |
Brown MD, Campbell PM, Schneiderman ED, et al. A practicebased evaluation of the prevalence and predisposing etiology of white spot lesions[J]. Angle Orthod, 2016, 86(2): 181-6. DOI:10.2319/041515-249.1 |
| [9] |
Millett DT, Glenny AM, Mattick RC, et al. Adhesives for fixed orthodontic bands[J]. Cochrane Database Syst Rev, 2016, 10: CD004485. |
| [10] |
Enaia M, Bock N, Ruf S. White-spot lesions during multibracket appliance treatment: a challenge for clinical excellence[J]. Am J Orthod Dentofacial Orthop, 2011, 140(1): e17-e24. DOI:10.1016/j.ajodo.2010.12.016 |
| [11] |
Richter AE, Arruda AO, Peters MC, et al. Incidence of caries lesions among patients treated with comprehensive orthodontics[J]. Am J Orthod Dentofacial Orthop, 2011, 139(5): 657-64. DOI:10.1016/j.ajodo.2009.06.037 |
| [12] |
Chen CS, Hsu ML, Chang KD, et al. Failure analysis: enamel fracture after debonding orthodontic brackets[J]. Angle Orthod, 2008, 78(6): 1071-7. DOI:10.2319/091907-449.1 |
| [13] |
DeHoff PH, Anusavice KJ, Wang Z. Three-dimensional finite element analysis of the shear bond test[J]. Dent Mater, 1995, 11(2): 126-31. DOI:10.1016/0109-5641(95)80047-6 |
| [14] |
Majithia U, Venkataraghavan K, Choudhary P, et al. Comparative evaluation of application of different fluoride varnishes on artificial early enamel lesion: an in vitro study[J]. Indian J Dent Res, 2016, 27(5): 521-7. DOI:10.4103/0970-9290.195642 |
| [15] |
Nasiri M, Mirhashemi AH, Etemadi A, et al. Evaluation of the shear bond strength and adhesive remnant index in debonding of stainless steel brackets assisted with Nd: YAG laser irradiation[J]. Front Dent, 2019, 16(1): 37-44. |
| [16] |
Zou DX, Wang ZM, Guo HM, et al. Bond strengths of customized titanium brackets manufactured by selective laser melting[J]. Chin J Stomatol, 2013, 48(7): 419-22. |
| [17] |
Lapenaite E, Lopatiene K. Interproximal enamel reduction as a part of orthodontic treatment[J]. Stomatologija, 2014, 16(1): 19-24. |
| [18] |
Chapman JA, Roberts WE, Eckert GJ, et al. Risk factors for incidence and severity of white spot lesions during treatment with fixed orthodontic appliances[J]. Am J Orthod Dentofacial Orthop, 2010, 138(2): 188-94. DOI:10.1016/j.ajodo.2008.10.019 |
| [19] |
Cantekin K, Celikoglu M, Karadas M, et al. Effects of orthodontic treatment with fixed appliances on oral health status: a comprehensive study[J]. J Dent Sci, 2011, 6(4): 235-8. DOI:10.1016/j.jds.2011.09.010 |
| [20] |
Moshiri M, Eckhart JE, McShane P, et al. Consequences of poor oral hygiene during aligner therapy[J]. J Clin Orthod, 2013, 47(8): 494-8. |
| [21] |
Alessandri Bonetti G, Zanarini M, Incerti Parenti S, et al. Evaluation of enamel surfaces after bracket debonding: an in-vivo study with scanning Electron microscopy[J]. Am J Orthod Dentofacial Orthop, 2011, 140(5): 696-702. DOI:10.1016/j.ajodo.2011.02.027 |
| [22] |
Xia J, Tian ZR, Hua LC, et al. Enamel crystallite strength and wear: nanoscale responses of teeth to chewing loads[J]. J R Soc Interface, 2017, 14(135): 20170456. DOI:10.1098/rsif.2017.0456 |
| [23] |
Lapenaite E, Lopatiene K, Ragauskaite A. Prevention and treatment of white spot lesions during and after fixed orthodontic treatment: a systematic literature review[J]. Stomatologija, 2016, 18(1): 3-8. |
| [24] |
Tasios T, Papageorgiou SN, Papadopoulos MA, et al. Prevention of orthodontic enamel demineralization: a systematic review with meta-analyses[J]. Orthod Craniofac Res, 2019, 22(4): 225-35. DOI:10.1111/ocr.12322 |
| [25] |
Meeran NA. Iatrogenic possibilities of orthodontic treatment and modalities of prevention[J]. J Orthod Sci, 2013, 2(3): 73-86. DOI:10.4103/2278-0203.119678 |
| [26] |
Mehta A, Paramshivam G, Chugh VK, et al. Effect of light-curable fluoride varnish on enamel demineralization adjacent to orthodontic brackets: an in-vivo study[J]. Am J Orthod Dentofacial Orthop, 2015, 148(5): 814-20. DOI:10.1016/j.ajodo.2015.05.022 |
| [27] |
Ahn SJ, Lee SJ, Lim BS, et al. Quantitative determination of adhesion patterns of cariogenic streptococci to various orthodontic brackets[J]. Am J Orthod Dentofacial Orthop, 2007, 132(6): 815-21. DOI:10.1016/j.ajodo.2005.09.034 |
| [28] |
Ahn SJ, Lim BS, Yang HC, et al. Quantitative analysis of the adhesion of cariogenic streptococci to orthodontic metal brackets[J]. Angle Orthod, 2005, 75(4): 666-671. |
| [29] |
Mei L, Busscher HJ, van der Mei HC, et al. Oral bacterial adhesion forces to biomaterial surfaces constituting the bracket-adhesiveenamel junction in orthodontic treatment[J]. Eur J Oral Sci, 2009, 117(4): 419-426. DOI:10.1111/j.1600-0722.2009.00648.x |
| [30] |
Gwinnett AJ, Matsui A. A study of enamel adhesives, the physical relationship between enamel and adhesive[J]. Arch Oral Biol, 1967, 12(12): 1615-20. DOI:10.1016/0003-9969(67)90195-1 |
 2020, Vol. 40
2020, Vol. 40

