2. 发育疾病研究教育部重点实验室//国家儿童健康与疾病临床医学研究中心//儿科发育重大疾病国家国际科技合作基地//儿科学重庆市重点实验室,重庆 400014
2. Ministry of Education Key Laboratory of Child Development and Disorders//National Clinical Research Center for Child Health and Disorders//China International Science and Technology Cooperation Base of Child Development and Critical Disorders//Children's Hospital of Chongqing Medical University//Chongqing Key Laboratory of Pediatrics, Chongqing 400014, China
神经母细胞瘤(NB)是儿童最常见的颅外实体肿瘤,占儿童肿瘤死亡人数的15%[1],高危神经母细胞瘤的长期生存率不足50%[2]。目前NB的主要治疗方法为手术和放化疗,但后者因副作用大、并发症多对处于生长发育期的儿童病人有一定伤害。因此,如何进一步提高NB的诊治效果,是临床医生需解决的难题之一,也是研究的热点。
在前期研究中,本课题组发现“肿瘤患儿应该如何正确饮食”是家长们关注的焦点问题之一,而“常规营养支持治疗配方是否适合肿瘤患儿”也是临床疑问之一,故探索适合儿童肿瘤的饮食配方很有必要。文献复习后发现:生酮饮食(KD)在成人肿瘤治疗方面已有较广泛研究[3-6],但对儿童肿瘤研究较少[6-9]。KD是一种饮食配方,通过调整脂肪和碳水化合物的供应比例来迫使机体细胞从利用碳水化合物产能转向利用酮体[10]。酮症状态下,肿瘤细胞因线粒体功能障碍不能利用酮体产能,但这并不影响正常细胞酮体代谢,故KD可对正常细胞带来最小限度影响[11]。上述研究表明,KD作为一种饮食配方,可抑制肿瘤生长,提示其具有良好的临床运用前景,但针对肿瘤患儿,其有效性和安全性仍待进一步论证。
目前,葡萄糖摄入量的显著减少是KD抗肿瘤的基本机制[12]。另外,还有:(1)调节线粒体功能[13];(2)调节哺乳动物雷帕霉素靶蛋白(mTOR)途径[14];(3)改善免疫应答抑制[15];(4)抗血管生成[16]等机制。研究表明:细胞自噬与肿瘤发生、发展和耐药等密切相关[17, 18],但尚不能明确其是否也是KD的抗肿瘤机制之一。当细胞能量缺乏时,AMP/ATP比值升高,激活了AMP活化的蛋白激酶(AMPK),再逐级影响mTOR活性,进一步影响细胞自噬,致使细胞形成自噬体,后与溶酶体融合成自噬溶酶体,最终实现内环境稳态和物质再循环。但是,过度的自噬会引起细胞死亡[19]。
本研究拟建立人神经母细胞瘤裸鼠模型,观察KD对裸鼠肿瘤生长的影响,验证KD的有效性和安全性,并初步探究其可能的抗肿瘤机制,为临床寻求一种有效、安全且易被家长接受的饮食辅助疗法提供理论依据,具有独特的创新性。
1 材料和方法 1.1 主要材料与试剂人神经母细胞瘤细胞株SH-SY5Y(ATCC);DMEM高糖培养基、胰蛋白酶及澳洲胎牛血清(Gibco);一抗β-actin、P62、caspase3、caspase8(武汉三鹰);一抗LC3A/B、Beclin1(Cell);一抗Ki67、固定液(武汉赛维尔);山羊抗兔IgG、封闭用正常山羊血清、兔二步法检测试剂盒、DAB显色试剂盒(北京中杉金桥);ECL发光盒(Millipore);PVDF膜(北京索莱宝);BCA蛋白定量试剂盒、SDS上样缓冲液(江苏凯基);12.5%配胶试剂盒(上海雅酶);一抗稀释液、封闭液(江苏碧云天);血糖血酮仪、试纸(Abbott);酶标仪(BioTek);生酮饲料(南通特洛菲饲料TP201421);环磷酰胺(Baxter)。
1.2 实验方法 1.2.1 建立人神经母细胞瘤裸鼠模型(1)细胞接种:人神经母细胞瘤细胞株SH-SY5Y用含10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素的DMEM培养基于37 ℃、饱和湿度、5% CO2条件下培养。取对数生长期的人神经母细胞瘤细胞株SH-SY5Y,用胰蛋白酶消化离心重悬后细胞计数。按每只鼠接种细胞量5.0×106、接种体积150 μL取所需细胞量,用PBS重悬后于裸鼠右前肢背侧皮下接种。24只5周龄无特定病原体级BALB/c-nu雌性裸鼠[动物质量合格证号为SCXK(京)2016-0002]均由斯贝福(北京)生物技术有限公司提供。
(2)实验分组:①待裸鼠移植瘤体积约250 mm3时,将24只荷瘤裸鼠按随机数字表法随机分为标准饮食组(SD)、生酮饮食组(KD),环磷酰胺联合生酮饮食组(CP+KD),每组8只。②CP+KD组在生酮饮食第1天喂养前腹腔注射1次环磷酰胺(CP),60 mg/(kg·d),连续3 d;SD和KD组以相同标准腹腔注射灭菌PBS。
1.2.2 饲料配方及喂养裸鼠分组前均以标准饲料喂养,而后SD组给予标准饲料,KD和CP+KD组给予生酮饲料,均自由饮食,不限热卡。每100 kcal的标准饲料中碳水化合物、蛋白质、脂肪的供能比例分别为58%、13%、29%,而生酮饲料为3%、10%、87%,其中脂肪以长链脂肪酸为主[饲料许可证号为苏饲证(2019)06092]。裸鼠于恒温25±2 ℃、恒湿45%~50%的无菌净化屏障系统内饲养[饲养设施合格证号为SYXK(渝)2017- 0012],12 h光照和12 h黑夜交替。所用垫木、饮水、饲料及其与动物接触的物品均经高压灭菌处理。
1.2.3 分析肿瘤生物学效应(1)HE染色观察肿瘤细胞形态:在种瘤后第28天(即生酮饮食第19天)或满足实验终止标准(健康状况不良、肿瘤有溃疡或体积>3600 mm3)时,用戊巴比妥钠(4.0×10-2 mg/g)腹腔麻醉,取材后固定或速冻保存。将10%福尔马林固定24 h后的肿瘤标本取出后常规制片,行HE染色。
(2)IHC检测细胞增殖蛋白Ki67:按照免疫组化试剂盒的操作步骤进行检测。高倍镜下选取3个视野,依据半定量积分法判定结果,具体如下:①细胞阳性率:0分——无阳性细胞,1分——阳性率<10%,2分——阳性率10%~50%,3分——阳性率50%~80%,4分——阳性率>80%;②染色强度:无着色——0分,淡黄色——1分,棕黄色——2分,棕褐色——3分;③最终评分:二者乘积在0~1分为阴性(-),2~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
(3)Western blot检测细胞凋亡蛋白caspase3、caspase8:剪碎肿瘤组织后加入适量RIPA裂解液,用组织研磨器于冰上反复研磨约10次,至肉眼所见无较大组织块,后转移至EP管10 000 r/min、4 ℃、离心5 min,取上清液用BCA法测定蛋白质浓度。备12.5% SDSPAGE,电泳60 V转120 V,转膜105 V、105 min,封闭15 min,一抗4 ℃过夜,二抗室温孵育1 h,ECL发光显影;Image Lab5.1软件分析条带灰度值。
1.2.4 制作肿瘤生长曲线观察肿瘤生长情况,每3 d用游标卡尺测量瘤体长径(a)和短径(b),根据公式V=(a×b2)/2计算瘤积(V)。
1.2.5 检测裸鼠代谢指标测量体质量、血糖、血酮体(β-羟基丁酸)水平(喂养前测量)。肝细胞脂肪变性:裸鼠肝脏组织经10%福尔马林固定24 h后常规制片,行HE染色。镜下(400×)观察肝细胞脂肪变性程度,记录评分(5个视野):无肝细胞脂肪变为0分,偶见肝细胞脂肪变为1分,整个视野灶状肝脏脂肪变性<1/3为2分,而整个视野灶状肝脏脂肪变性>1/3为3分,肝细胞弥漫性脂肪变为4分。最终取评分平均值行统计学分析。观察裸鼠的精神状态和活动能力。
1.2.6 检测细胞自噬(1)透射电镜观察自噬体:在肿瘤组织离体1 min内用双面刀片切选体积1 mm3大小的瘤体组织放入4%戊二醛固定液中,4 ℃冰箱保存,择期送往透射电镜实验室进行透射电镜观察。(2)IHC和Western blot检测自噬蛋白Beclin1、LC3A/B、P62:方法同前。
1.3 统计学分析计量资料以均数±标准差表示,用SPSS22.0软件分析数据,多组比较数据满足正态分布和方差齐性的条件时采用单因素方差分析,两两比较采用Dunnett's检验,不满足条件则采用非参数检验;计数资料采用秩和检验;生存资料分析采用Long-rank test;两组间比较采用t检验;检验水准P<0.05。
2 结果 2.1 人神经母细胞瘤裸鼠模型的建立在细胞接种第10天(即生酮饮食第1天),肉眼可见移植瘤如黄豆大小或略大,且各组裸鼠成瘤率100%(图 1)。取材肿瘤标本时肉眼可见:肿瘤组织包膜完整,与正常组织交界清楚,呈结节状,切面呈烂鱼肉状、部分可见出血灶、偶见坏死组织。
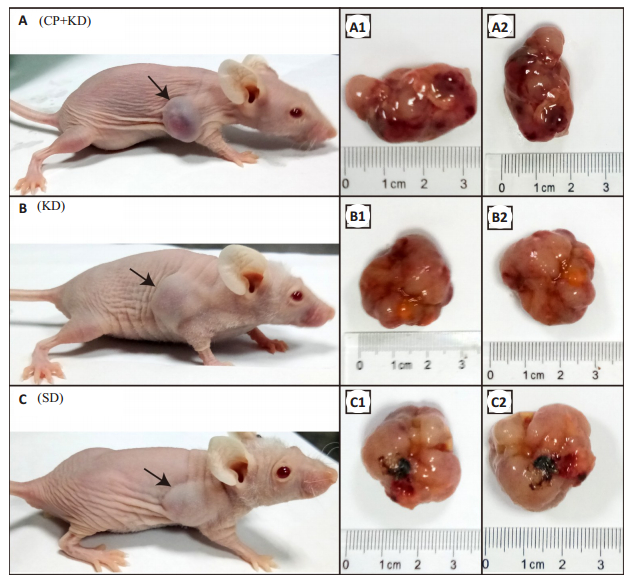
|
图 1 生酮饮食前裸鼠移植瘤及取材后对应瘤体照片 Fig.1 Images of neuroblastoma (NB) xenografts in BALB- nu mice and the corresponding tumor specimens after sacrifice. A1, A2, NB xenografts of A in CP+KD group; B1, B2, NB xenografts of B in KD group; C1, C2, NB xenografts of C in SD group; black arrow, NB xenografts CP, cyclophosphamide; KD, ketogenic diet; CP+KD, combination between cyclophosphamide and ketogenic diet; SD, standard diet. |
镜下各组肿瘤细胞排列无序,大小不一,核深染,可见病理性核分裂(图 2)。
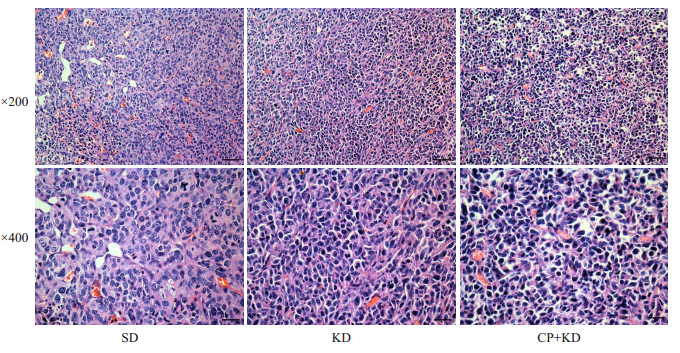
|
图 2 移植瘤的HE染色结果 Fig.2 Results of HE staining on neuroblastoma xenografts. |
瘤体组织经Ki67染色后,镜下可见阳性染色呈淡黄、棕黄或棕褐色,主要定位于细胞核,各组肿瘤组织中均表达。Ki67蛋白在SD、KD和CP+KD组中的最终评分分别为8.7±0.6、6.0±0.0和5.0±1.7,表达分别呈强阳性(+++)、中度阳性(++)和中度阳性(++)(图 3)。
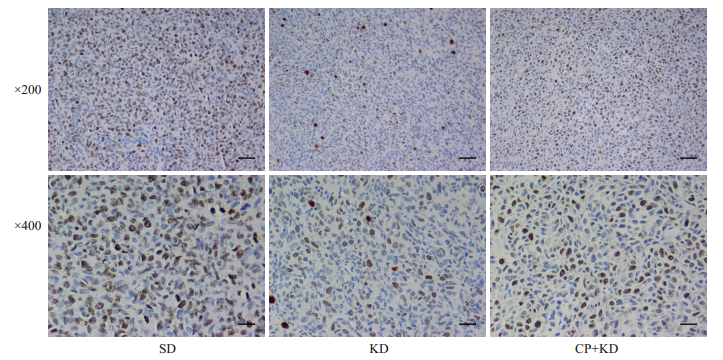
|
图 3 移植瘤Ki67的IHC(DAB染色)结果 Fig.3 Results of IHC (DAB staining) for Ki67 on NB xenografts. |
各组肿瘤组织中凋亡蛋白Cleaved-caspase3、Full-length caspase3和caspase8均表达。与SD组比,CP+KD组的Full-length caspase3和caspase8的表达增加(P=0.019,P=0.047),Cleavedcaspase3表达明显增加(P=0.005);KD组的Cleavedcaspase3和Full-length caspase3的表达增加(P=0.014,P=0.028),caspase8无显著变化(P=0.068)(图 4)。
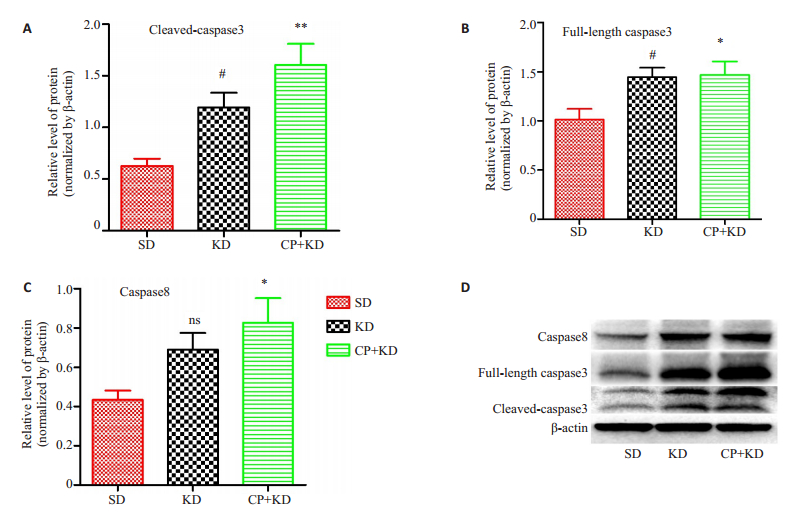
|
图 4 凋亡蛋白的Western blot结果 Fig.4 Analysis of the apoptosis proteins expression by Western blot. A: Cleaved-caspase3; B: Full-length caspase3; C: Caspase8; D: The protein strip pictures of Western blot; #P < 0.05 vs KD group; *P < 0.05, **P < 0.01 vs CP+KD group. |
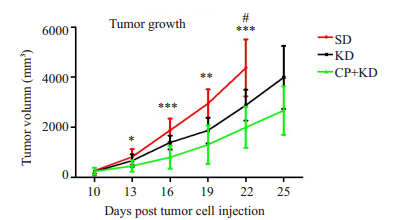
接种第22天,KD组瘤积小于SD组(P<0.05);接种第13天,CP+KD组瘤积小于SD组(P<0.05),而接种第16、19、22天,CP+KD组瘤积明显小于SD组(P<0.01,表 1、图 5)。
| 表 1 实验中各组裸鼠瘤积 Tab.1 Tumor volume of three groups (Mean±SD, mm3) |
|
图 5 肿瘤生长曲线 Fig.5 Curves of tumor growth. #P < 0.05 vs KD group; *P < 0.05, **P < 0.01, ***P < 0.001 vs CP+KD group. |
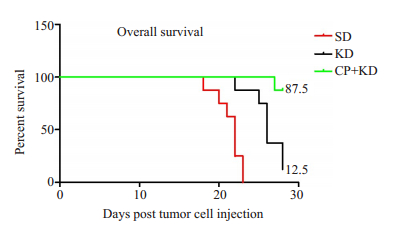
种瘤后第28天时,SD组、KD组和CP+KD组的裸鼠生存率分别为0%、12.5%和87.5%。SD组的裸鼠平均肿瘤生长期为21.4±1.7 d。当SD组裸鼠全部达到实验终止条件时,KD组有1只裸鼠满足实验终止条件,而CP+KD组是0只。Kaplan——Meier生存曲线显示,与SD组比,KD、CP+KD组裸鼠肿瘤生长期显著延长(χ2=20.72,P<0.001,图 6)。
|
图 6 生存曲线 Fig.6 Survival curves. |
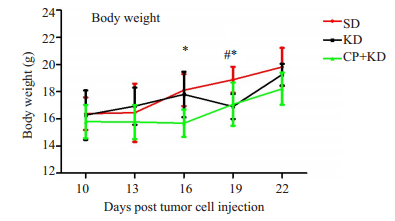
细胞接种第10天的各组裸鼠体质量无显著差异(P>0.05);接种第16天,SD组裸鼠体质量较CP+KD组重(P<0.05);接种第19天,KD、CP+KD组裸鼠体质量均较SD组减轻(P<0.05,表 2、图 7)。
| 表 2 生酮饮食后各组裸鼠体质量变化 Tab.2 Body weight of tumor-bearing mice after ketogenic diet (Mean±SD, g) |
|
图 7 生酮饮食对神经母细胞瘤裸鼠模型体重的影响 Fig.7 Effects of ketogenic diet on body weight in BALB/c-nu mouse model. #P < 0.05 vs KD group; *P < 0.05 vs CP+KD group. |
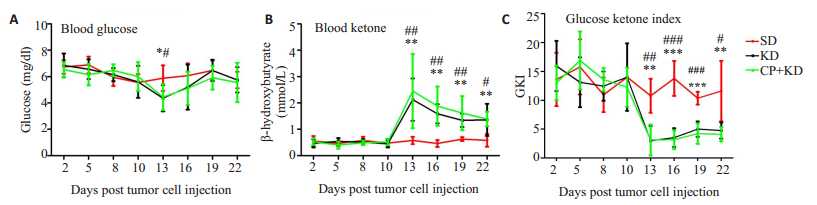
生酮饮食前各组裸鼠血糖、血酮、GKI值均无显著差异(P>0.05,表 3,图 8);改变饮食后KD组、CP+KD组血糖均先下降后复升至对照组相近水平,即在接种第13天,KD组、CP+ KD组血糖比SD组低(P<0.05);改变饮食后,实验组裸鼠血酮体水平升高,即接种第13、16、19天,CP+KD组和KD组的血酮体水平均较SD组升高(P<0.05),同时GKI值低于SD组(P<0.05,表 4~6、图 8);同时实验组裸鼠的精神状态、活力保持良好,特别是实验末期,明显优于对照组裸鼠。
| 表 3 生酮饮食前各组裸鼠代谢指标 Tab.3 Metabolic indices of tumor-bearing mice before ketogenic diet (Mean±SD) |
|
图 8 生酮饮食对神经母细胞瘤裸鼠模型的影响 Fig.8 Effects of ketogenic diet on blood glucose (A), ketone (B) and glucose ketone index (C) in the tumor-bearing mice. #P < 0.05, ##P < 0.01, ###P < 0.001 vs KD group; *P < 0.05, **P < 0.01, ***P < 0.001 vs CP+KD group. |
| 表 4 生酮饮食后各组裸鼠血糖 Tab.4 Blood glucose of three groups after ketogenic diet (Mean±SD, mmol/L) |
| 表 5 生酮饮食后各组裸鼠血酮 Tab.5 Blood ketone of three groups after ketogenic diet (Mean±SD, mmol/L) |
| 表 6 生酮饮食后各组裸鼠GKI值 Tab.6 GKI of three groups after ketogenic diet (Mean±SD) |
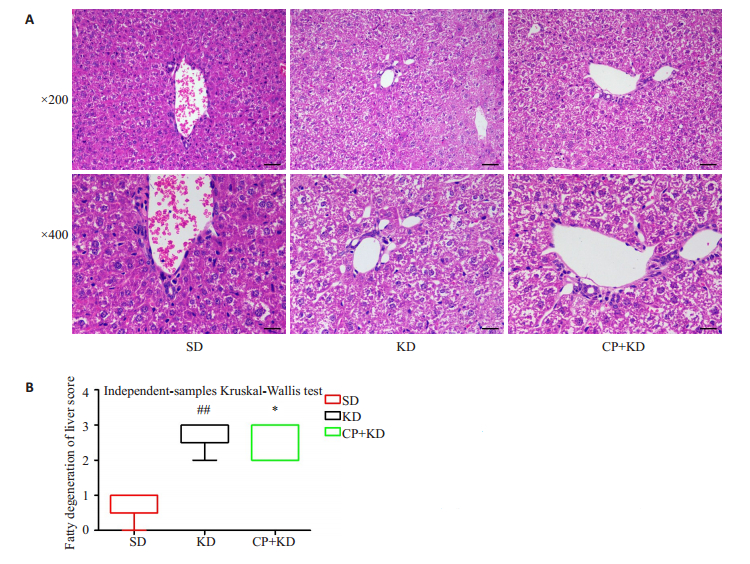
镜下各组裸鼠肝脏组织肝小叶结构完整,肝细胞中可见大小不等的脂滴,少见细胞核被挤于一侧,少见炎症反应,未见明显肝脏细胞气球样变,SD、KD和CP+KD组肝脏脂肪变性评分分别为0.8±0.5、2.8±0.5和2.6±0.6,分析后发现:与SD组比,KD及CP+KD组裸鼠肝脏脂肪变性明显(P=0.007,P=0.024,图 9)。
|
图 9 肝脏脂肪变性评分 Fig.9 Results of hepatic steatosis scores. A: HE staining for liver of tumor-bearing mice; B: Results of hepatic steatosis scores by Kruskal-Wallis test; ##P < 0.01 vs KD group; *P < 0.05 vs CP+KD group. |
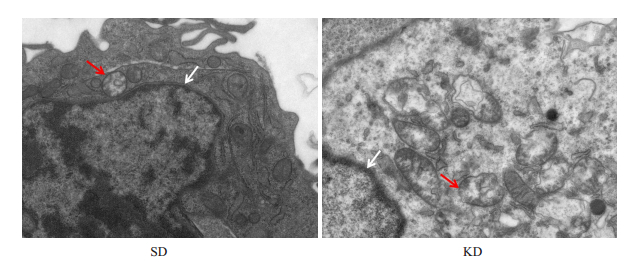
SD组和KD组肿瘤组织中均可见的双层膜或多层膜结构的“自噬体”,KD组中自噬体多于SD组(图 10)。
|
图 10 自噬体的透射电镜结果 Fig.10 Autophagy in cytoplasm of tumor cells observed by transmission electron microscopy (Magnification: ×8000) Red arrow, autophagosome; white arrow, nucleus. |
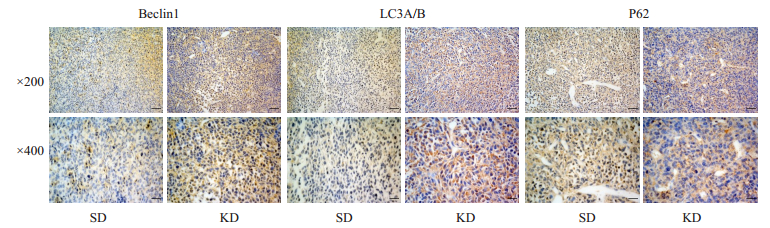
各蛋白的阳性染色呈淡黄、棕黄或棕褐色,Beclin1、LC3A/B定位于细胞浆和部分胞核,P62定位于细胞浆。SD组的Beclin1、LC3A/B、P62最终评分为2.7±1.2、1.7±0.6、8.0±1.7分,而KD组分别为6.0 ± 0.0、8.0 ± 1.7、3.3 ± 1.6分,即SD组Beclin1和LC3A/B表达呈弱阳性(+),P62表达呈强阳性(+++),KD组Beclin1、LC3A/B、P62表达分别为中度阳性(++)、强阳性(+++)、弱阳性(+)。秩和检验发现:KD组P62表达低于SD组(P=0.043),而Beclin1、LC3A/B表达增加(P=0.034,P=0.043,图 11)。
|
图 11 自噬蛋白的IHC(DAB显色)结果 Fig.11 Results for IHC (DAB staining; magnification is shown in the figure) for Beclin 1, LC3A/B, P62 proteins on NB xenografts. |
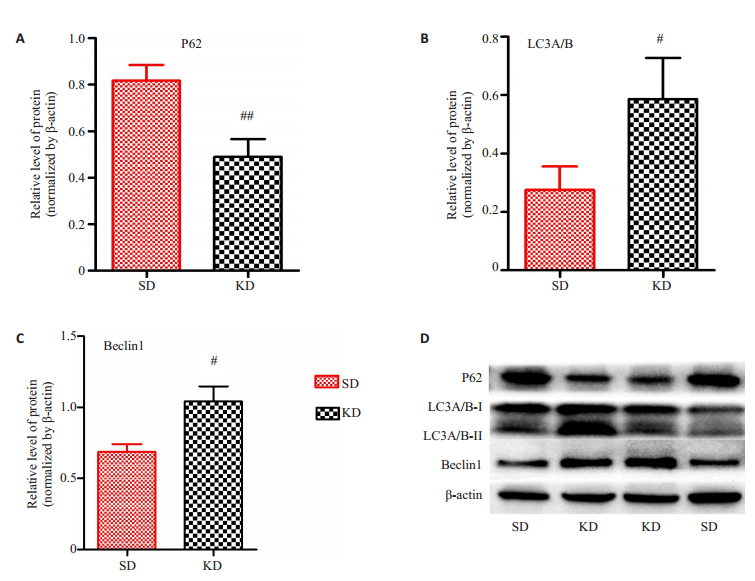
Western blot发现:与SD组比,KD组P62表达量明显较低(t=4.884,P<0.01),Beclin1(t=4.959,P<0.05)、LC3A/B表达增加(t=3.663,P<0.05,图 12)。
|
图 12 自噬蛋白的Western blot结果 Fig.12 Analysis of the autophagic proteins expression by Western blot. A: P62; B: LC3A/B; C: Beclin1; D: The protein strip pictures of Western blot; #P < 0.05, ##P < 0.01 vs KD group. |
“沃伯格效应”指无论有氧或无氧条件下肿瘤细胞的能量来源只有糖酵解途径[20-21],这为KD辅助治疗肿瘤提供了理论依据。本研究选用人神经母细胞瘤细胞株SH-SY5Y建立人神经母细胞瘤裸鼠模型,通过对肿瘤组织的生物学效应分析发现各组肿瘤组织中均有明显的病理性核分裂,且蛋白Ki67、caspase3和caspase8均表达,这表明肿瘤细胞恶性程度高、增殖活跃,说明了人神经母细胞瘤裸鼠模型的成功建立。KD组caspase3表达增加而caspase-8无明显变化,说明KD可能通过内源性而非外源性细胞凋亡途径来诱导NB凋亡。这与Skinner等[22]发现的酮体β-羟丁酸和乙酰乙酸促进NB细胞凋亡的研究结果类似。
本研究还发现:(1)实验组肿瘤体积较小、生长速度较缓,同时其裸鼠生存期明显延长;比较KD和CP+KD组,后者瘤积更小、生长速度更缓,这表明KD的抗肿瘤效应不及CP+KD,与Morscher等[8]和Newman等[23]的研究结果基本一致。(2)接种第19天,KD组体质量下降的原因可能有:①葡萄糖的供应量显著降低;②裸鼠短期的不适应,主要表现为进食量的减少;③低碳水化合物饮食或许有抑制食欲作用;④酮症状态的热效应增加了能量消耗;而其余时间点的KD组裸鼠体质量与SD组无明显差异,这说明KD对体质量影响较小,与其他研究结果吻合[9]。(3)接种第13天实验组血糖的下降可能也受上述因素影响。Aminzadeh-Gohari等[16]也发现:以长链脂肪为主的KD组血糖较对照组下降了20%。而后,实验组血糖复升并稳定于对照组相近水平,这提示KD对机体血浆血糖影响较小、不会导致严重的低血糖,与其他研究[8-9]结果相似,这可能是因为肿瘤细胞中糖异生活跃。Katherine等[25]发现非小细胞肺癌早期患者标本中丙酮酸羧化酶表达显著增加,干扰其表达后可明显抑制肿瘤细胞增殖。因此,在临床运用KD治疗肿瘤时,是否应该联合抑制糖异生药物来进一步阻断肿瘤细胞对葡萄糖的利用,尚需进一步探究。(4)GKI值反映了抗肿瘤效应的真实的酮体水平。KD组GKI值可达到3.0±2.6,与同类研究[16]相似。结合血酮可以明确KD组裸鼠已经达到“酮症”状态,但精神状态和活力保持良好,特别是实验末期,其明显优于对照组,未发现KD导致的严重不良反应(如意外死亡),说明裸鼠对这种酮症状态耐受性较好。诸多研究[23, 26-27]也表明:KD组裸鼠的行为学表现优于对照组。Schmidt等[28]发现:KD适用于晚期肿瘤病人,可以改善生活质量和血液检查指标,未发现严重不良反应。(5)实验组裸鼠的肝脏发生了轻微肝脂肪变性,说明肝脏可能对KD有脂肪代谢过载和/或应激反应,这与裸鼠体质量和血糖的下降均为KD的不良反应,与其他报道一致[29]。特别的是,KD的不良反应可在停用KD后逐渐消失[29-30]。我们的研究及以上文献均说明:KD处理后的裸鼠虽处于酮症状态,但生长良好,能较快适应饮食改变带来的血糖血酮变化,未发现严重不良反应,因此KD抗肿瘤治疗是相对安全的,具有可行性。
为探索KD抗肿瘤是否与细胞自噬相关,本研究检测了移植瘤中自噬体和自噬蛋白。细胞自噬水平与蛋白P62的表达负相关,而与Beclin1、LC3A/B正相关。结果显示:KD可能提高了细胞自噬水平,表明KD抗肿瘤可能与细胞自噬有关。Poillet等[31]发现细胞自噬对肿瘤生长有影响。Camberos等[32]发现:β-羟基丁酸能刺激大脑皮层神经元的自噬活动、防止因葡萄糖剥夺导致的神经元死亡。以上数据均提示:KD可能诱导细胞自噬,但后续还需扩建人神经母细胞瘤裸鼠模型、完善相关检测项目、联合体外实验分析细胞自噬变化,以进一步明确细胞自噬是否为KD抗肿瘤机制。
综上所述,我们得出如下结论:KD能抑制人神经母细胞瘤皮下移植瘤的生长,其可能的抗肿瘤机制与细胞自噬有关;KD治疗肿瘤是相对安全的,有望在临床上成为NB的一种新辅助饮食治疗方法。
| [1] |
Swift CC, Eklund MJ, Kraveka JM, et al. Updates in diagnosis, management, and treatment of neuroblastoma[J]. Radiographics, 2018, 38(2): 566-80. DOI:10.1148/rg.2018170132 |
| [2] |
Whittle SB, Smith V, Doherty E, et al. Overview and recent advances in the treatment of neuroblastoma[J]. Expert Rev Anticancer Ther, 2017, 17(4): 369-86. DOI:10.1080/14737140.2017.1285230 |
| [3] |
Bartmann C, Janaki Raman SR, Floter J, et al. Beta-hydroxybutyrate (3-OHB) can influence the energetic phenotype of breast cancer cells, but does not impact their proliferation and the response to chemotherapy or radiation[J]. Cancer Metab, 2018, 6(1): 8. |
| [4] |
Ok JH, Lee H, Chung HY, et al. The potential use of a ketogenic diet in pancreatobiliary cancer patients after pancreatectomy[J]. Anticancer Res, 2018, 38(11): 6519-27. DOI:10.21873/anticanres.13017 |
| [5] |
De Feyter HM, Behar KL, Rao JU, et al. A ketogenic diet increases transport and oxidation of ketone bodies in RG2 and 9L gliomas without affecting tumor growth[J]. Neuro-oncology, 2016, 18(8): 1079-87. DOI:10.1093/neuonc/now088 |
| [6] |
Martuscello RT, Vedam-Mai V, McCarthy DJ, et al. A supplemented high-fat low-carbohydrate diet for the treatment of glioblastoma[J]. Clin Cancer Res, 2016, 22(10): 2482-95. DOI:10.1158/1078-0432.CCR-15-0916 |
| [7] |
Martin-McGill KJ, Srikandarajah N, Marson AG, et al. The role of ketogenic diets in the therapeutic management of adult and paediatric gliomas: a systematic review[J]. CNS Oncol, 2018, 7(2): CNS17. |
| [8] |
Morscher RJ, Aminzadeh-Gohari S, Hauser-Kronberger C, et al. Combination of metronomic cyclophosphamide and dietary intervention inhibits neuroblastoma growth in a CD1-nu mouse model[J]. Oncotarget, 2016, 7(13): 17060-73. DOI:10.18632/oncotarget.7929 |
| [9] |
Morscher RJ, Aminzadeh GS, Feichtinger RG, et al. Inhibition of neuroblastoma tumor growth by ketogenic diet and/or calorie restriction in a CD1-Nu mouse model[J]. PLoS One, 2015, 10(6): e0129802. DOI:10.1371/journal.pone.0129802 |
| [10] |
Chung HY, Park YK. Rationale, Feasibility and acceptability of ketogenic diet for cancer treatment[J]. J Cancer Prev, 2017, 22(3): 127-34. |
| [11] |
Weber DD, Aminazdeh GS, Kofler B. Ketogenic diet in cancer therapy[J]. Aging (Albany NY), 2018, 10(2): 164-5. |
| [12] |
Allen BG, Bhatia SK, Anderson CM, et al. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism[J]. Redox Biol, 2014, 2: 963-70. DOI:10.1016/j.redox.2014.08.002 |
| [13] |
Vidali S, Aminzadeh S, Lambert B, et al. Mitochondria: The ketogenic diet-A metabolism-based therapy[J]. Int J Biochem Cell Biol, 2015, 63: 55-9. DOI:10.1016/j.biocel.2015.01.022 |
| [14] |
Cooper MA, McCoin C, Pei D, et al. Reduced mitochondrial reactive oxygen species production in peripheral nerves of mice fed a ketogenic diet[J]. Exp Physiol, 2018, 103(9): 1206-12. DOI:10.1113/EP087083 |
| [15] |
Lussier DM, Woolf EC, Johnson JL, et al. Enhanced immunity in a mouse model of malignant glioma is mediated by a therapeutic ketogenic diet[J]. BMC Cancer, 2016, 16: 310. DOI:10.1186/s12885-016-2337-7 |
| [16] |
Aminzadeh-Gohari S, Feichtinger RG, Vidali S, et al. A ketogenic diet supplemented with medium-chain triglycerides enhances the anti-tumor and anti-angiogenic efficacy of chemotherapy on neuroblastoma xenografts in a CD1-nu mouse model[J]. Oncotarget, 2017, 8(39): 64728-44. DOI:10.18632/oncotarget.20041 |
| [17] |
Li YJ, Lei YH, Yao N, et al. Autophagy and multidrug resistance in cancer[J]. Chin J Cancer, 2017, 36(1): 52. |
| [18] |
Izdebska M, Zielińska W, Hałas WM, et al. Involvement of actin in autophagy and autophagy-dependent multidrug resistance in cancer[J]. Cancers (Basel), 2019, 11(8): 1209. DOI:10.3390/cancers11081209 |
| [19] |
Anderson CM, Macleod KF. Autophagy and cancer cell metabolism[J]. Int Rev Cell Mol Biol, 2019, 347: 145-90. DOI:10.1016/bs.ircmb.2019.06.002 |
| [20] |
Pavlova NN, Thompson CB. The emerging hallmarks of cancer metabolism[J]. Cell Metab, 2016, 23(1): 27-47. |
| [21] |
Poff A, Koutnik AP, Egan KM, et al. Targeting the Warburg effect for cancer treatment: Ketogenic diets for management of glioma[J]. Semin Cancer Biol, 2019, 56: 135-48. DOI:10.1016/j.semcancer.2017.12.011 |
| [22] |
Skinner R, Trujillo A, Ma X, et al. Ketone bodies inhibit the viability of human neuroblastoma cells[J]. J Pediatr Surg, 2009, 44(1): 212-6. |
| [23] |
Newman JC, Covarrubias AJ, Zhao M, et al. Ketogenic diet reduces midlife mortality and improves memory in aging mice[J]. Cell Metab, 2017, 26(3): 547-57. |
| [24] |
Kasprowska LD, Liśkiewicz AD, Nowacka MM, et al. The ketogenic diet affects the social behavior of young male rats[J]. Physiol Behav, 2017, 179: 168-77. DOI:10.1016/j.physbeh.2017.06.007 |
| [25] |
Sellers K, Fox MP, Bousamra M 2nd, et al. Pyruvate carboxylase is critical for non-small-cell lung cancer proliferation[J]. J Clin Invest, 2015, 125(2): 687-98. DOI:10.1172/JCI72873 |
| [26] |
Ma S, Huang Q, Tominaga T, et al. An 8-week ketogenic diet alternated interleukin-6, ketolytic and lipolytic gene expression, and enhanced exercise capacity in mice[J]. Nutrients, 2018, 10(11): 1696. DOI:10.3390/nu10111696 |
| [27] |
Roberts MN, Wallace MA, Tomilov AA, et al. A Ketogenic Diet Extends Longevity and Healthspan in Adult Mice[J]. Cell Metab, 2017, 26(3): 539-46. |
| [28] |
Schmidt M, Pfetzer N, Schwab M, et al. Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: A pilot trial[J]. Nutr Metab (Lond), 2011, 8(1): 54. DOI:10.1186/1743-7075-8-54 |
| [29] |
相萍萍, 陈国芳, 刘超. 生酮饮食的益处和风险[J]. 江苏医药, 2017, 43(5): 352-5. |
| [30] |
Kim JT, Kang HC, Song JE, et al. Catch-up growth after long-term implementation and weaning from ketogenic diet in pediatric epileptic patients[J]. Clin Nutr, 2013, 32(1): 98-103. DOI:10.1016/j.clnu.2012.05.019 |
| [31] |
Poillet PL, White E. Role of tumor and host autophagy in cancer metabolism[J]. Genes Dev, 2019, 33(11-12): 610-9. DOI:10.1101/gad.325514.119 |
| [32] |
Camberos LL, Gerónimo OC, Montiel T, et al. The ketone body, β-Hydroxybutyrate stimulates the autophagic flux and prevents neuronal death induced by glucose deprivation in cortical cultured neurons[J]. Neurochem Res, 2016, 41(3): 600-9. DOI:10.1007/s11064-015-1700-4 |
 2020, Vol. 40
2020, Vol. 40

