高甘油三酯血症与冠心病的发生发展相关[1]。流行病学荟萃分析[2-3]、孟德尔随机化研究[4-5]及药物临床研究[6]均表明甘油三酯(TG)升高与心血管病风险增加有关,而且降低TG能带来心血管事件获益,因此,目前认为高TG是心血管病的独立危险因素。2019年ESC/ EAS血脂异常管理指南推荐他汀类药物作为高TG(TG≥2.3 mmol/L)合并高心血管病风险患者的首选药物,但是常规他汀类药物剂量对TG的降幅在10%~20%之间[7],而更大剂量的他汀类药物虽有更明显的TG降幅,但也可能带来他汀不耐受问题[8-9]。所以,在他汀类药物基础上,指南也指出可以考虑联合n-3类脂肪酸、非诺贝特来降低TG。
PCSK9抑制剂作为最强效的降胆固醇药物,已有明确的心血管保护作用,尤其是在他汀不耐受的心血管疾病人群中更是不二选择。国外研究[10]表明PCSK9抑制剂还有一定的降TG作用,但不同的临床研究[28-29]中PCSK9抑制剂对TG的有效性存在争议。在PCSK9抑制剂进入中国市场后,也出现了TG治疗前后无明显统计学差异的现象[11-12]。但是,无论国外还是国内的临床研究,均未明确纳入TG>4.52 mmol/L人群来比较PCSK9抑制剂在不同基线TG下对TG的影响。因此我们选择观察PCSK9抑制剂对国人TG的作用,尤其是高甘油三酯血症(HTG)人群中的治疗效果。
1 资料和方法 1.1 研究对象研究纳入2019年2月~2020年3月在南方医科大学南方医院(n=21)、中山大学附属第一医院(n=9)、佛山市南海区人民医院(n=14)、玉林市第一人民医院(n=8)、广东省人民医院(n=7)就诊并规律使用PCSK9抑制剂(瑞百安,Evolocumab)治疗的59名患者,为明确不同TG基线下PCSK9抑制剂对血脂谱的影响,根据2017年《高甘油三酯血症及其心血管风险管理专家共识》[13]将患者分为4组:TG正常组(Normal,TG≤1.7 mmol/L,n=24)、TG轻度升高组(Mild,1.7<TG≤2.3 mmol/L,n=11)、TG中度升高组(Moderate,2.3<TG≤5.6 mmol/L,n=13)、TG重度升高组(Severe,TG>5.6 mmol/L,n=11)。排除标准:已具备以下任一明确原因导致的高甘油三酯血症患者,包括:肾病综合征、甲状腺功能减退及已明确的引起甘油三酯升高的药物使用。
1.2 研究方法 1.2.1 病史采集收集所有研究对象包括性别、年龄、高血压史、糖尿病史、冠心病史、治疗时间(从第1次开具瑞百安到最近1次血脂复查时间为止),瑞百安治疗前/治疗后依折麦布、贝特类药物(仅非诺贝特)及他汀类药物(包括阿托伐他汀及瑞舒伐他汀)使用情况;收集患者入院或门诊抽血的血脂参数:治疗前后TG、低密度脂蛋白胆固醇(LDL-c)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-c)等资料。
1.2.2 数据处理TC改变度(TC change)定义为治疗后和治疗前TC的差值与治疗前TC的比,即TC改变度=(治疗后TC-治疗前TC)/治疗前TC。TG改变度(TG change)定义为治疗后和治疗前TG的差值与治疗前TG的比,即TG改变度=(治疗后TG-治疗前TG)/治疗前TG。LDL-c改变度(LDL-c change)定义为治疗后和治疗前LDL-c的差值与治疗前LDL-c的比,即LDL-c改变度=(治疗后LDL-c-治疗前LDL-c)/治疗前LDL-c。HDL改变度(HDL change)定义为治疗后和治疗前HDL的差值与治疗前HDL的比,即HDL改变度=(治疗后HDL-治疗前HDL)/治疗前HDL。
1.2.3 统计方法运用spss 26.0进行统计学分析。计量资料正态分布,用均数±标准差描述,两组间比较方差齐性采用t检验;计量资料非正态分布或方差不齐,以M(Q1,Q3)表示中位数及第25%百分位值及第75%百分位值,两组间比较用Mann-Whitney U检验。多组间方差齐性采用单因素方差分析,两组间比较采用Scheffé法;若方差不齐,则用Kruskal-Wallis H检验,两组间比较采用Bonferroni法校正。计数资料采用百分比表示,率和构成比采用χ2检验或Fisher's精确概率检验。比较治疗前后的配对资料若不满足正态分布则采用配对Wilcoxon符号秩检验,满足正态分布用配对t检验。如果是重要参数,则不论是否正态分布,均数±标准差、M(Q1,Q3)等形式表示。所有P值采用双侧检验,P<0.05为差异有统计学意义。
2 结果 2.1 PCSK9抑制剂对血脂的影响总体上,我们观察了中位时间32(19,48)d的59名心血管高危患者在PCSK9抑制剂治疗前后的血脂变化。在治疗前,所有患者的TG基线平均值为3.52± 4.46 mmol/L,中位值为1.86(1.27,3.17)mmol/L,PCSK9抑制剂治疗后TG平均降幅为19.80%,中位降幅为30.28%,治疗后TG平均值为1.83±1.20 mmol/L,中位值为1.47(0.98,2.19)mmol/L。治疗前的TC中位值为5.91(4.87,7.27)mmol/L,TC中位降幅51.39%,治疗后TC中位值为2.92(2.30,3.88)mmol/L。治疗前的LDL-c基线平均值为3.90±1.59 mmol/L,PCSK9抑制剂治疗后LDL-c平均降幅为56.34%,中位降幅为69.17%,治疗后LDL-c平均值为1.41±0.91 mmol/L。治疗前的HDL-c基线平均值为1.12±0.26 mmol/L,PCSK9抑制剂治疗后HDL-c平均升高3.42%,HDL-c中位升高为1.64%,治疗后HDL-c平均值为1.15 ± 0.39 mmol/L。TG、TC、LDL-c在治疗后对比基线水平差异均有统计学意义,P均<0.001。治疗后HDL-c对比基线差异无统计学,P=0.469。
2.2 甘油三酯基线分组的临床基线特征根据TG基线分为正常组、轻度升高组、中度升高组及重度升高组4组,各组的TG基线分别为:1.22、1.86、2.83、6.70 mmol/L。在治疗前各组TG基线存在差异并具有统计学意义(表 1,P=0.000),两两比较发现各组中位值存在差异并有统计学意义(P均=0.000),而正常组与轻度升高组、中度升高组、重度升高组还存在TG分布差异,轻度升高组与重度升高组之间也存在TG分布差异。
| 表 1 甘油三酯四分组临床基本资料 Tab.1 Demographic and clinical characteristics of the patients in the 4 groups with different baseline triglyceride levels |
各组HDL-c基线存在差异,两两比较发现重度升高组与正常组,重度升高组与轻度升高组之间存在差异并有统计学意义(P均<0.05),其余各组之间无显著差异。用药史方面,治疗前依折麦布使用史存在差异,轻度升高组使用率最高,达72.73%,而重度升高组使用率最低,仅9.09%,但在治疗后各组依折麦布使用率均有不同程度的升高,而重度升高组在PCSK9抑制剂后使用率也提高至45.45%。治疗前,54.55%的重度升高组患者使用贝特类药物,治疗后,该比例升至63.64%,其余3组患者则一直未服用贝特类药物。各组年龄、性别、高血压史、糖尿病病史、冠心病病史、LDL-c基线、TC基线、HDL-c基线、治疗前后他汀类使用史以及治疗时间上差异没有统计学意义。特别地,重度升高组有一个病人复查时未检测LDL-c,因此在进行LDL-c的降幅比较时人数为58人。
2.3 甘油三酯基线分组下PCSK9抑制剂对血脂的影响PCSK9抑制剂治疗后正常组的TG改变度中位值为-14.89%,轻度升高组为-11.96%,中度升高组为-46.37%,重度升高组为-68.31%。经Kruskal-Wallis H检验,正常组、轻度升高组、中度升高组及重度升高组TG改变度不全相同(表 2,P=0.000)。两两比较并用Bonferroni法校正后,TG改变度差异存在于正常组与中度升高组(调整后P=0.017)、正常组与重度升高组(调整后P=0.000)、轻度升高组与中度升高组(调整后P=0.025)、轻度升高组与重度升高组(调整后P=0.001)。其它组之间差异无统计学意义。
| 表 2 PCSK9抑制剂治疗后甘油三酯四分组的血脂变化 Tab.2 Changes of blood lipids after treatment in the 4 groups with different baseline triglyceride levels with PCSK9 inhibitors |
各组的LDL-c改变度不全相同(表 2,图 1,P=0.007)。两两比较发现正常组和重度升高组存在差异,(调整后P=0.009),其余各组LDL-c改变度差异无统计学意义。各组的TC改变度不全相同(P=0.033)。各组HDL-c改变度无明显差异(P=0.577)。
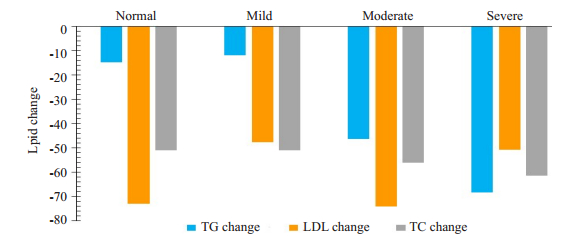
|
图 1 PCSK9抑制剂治疗后甘油三酯分组的血脂变化 Fig.1 Changes of blood lipids in different groups of triglycerides after treatment with PCSK9 inhibitors. |
正常组TG基线中位值为1.22 mmol/L,治疗后中位值0.97 mmol/L,PCSK9抑制剂对正常组TG影响无统计学意义(表 3,P=0.126)。轻度升高组TG基线中位值为1.86 mmol/L,治疗后中位值1.78 mmol/L,PCSK9抑制剂对轻度升高组TG影响无统计学意义(P=0.534)。中度升高组TG基线中位值为2.83 mmol/L,治疗后中位值1.47 mmol/L,PCSK9抑制剂能降低中度升高组TG水平(P=0.002)。重度升高组TG基线中位值为6.70 mmol/L,治疗后中位值3.01 mmol/L,PCSK9抑制剂能降低重度升高组TG水平(P=0.003)。
| 表 3 甘油三酯四分组治疗前后甘油三酯比较 Tab.3 Comparison of triglycerides in four groups before and after treatment with PCSK9 inhibitors |
以2.3 mmol/L作为TG分界值,正常组、轻度升高组及中度升高组经PCSK9抑制剂治疗后达到阈值的百分比较高,但重度升高组TG≤2.3 mmol/L的比例较低,仅27.27%。根据2019年ESC/ESA血脂异常管理指南建议,将LDL-c的阈值划分为1.4 mmol/L、1.8 mmol/L、2.6 mmol/L三个标准,各组LDL-c在PCSK9抑制剂治疗后达到1.4 mmol/L、1.8 mmol/L、2.6 mmol/L的百分比差异无统计学意义(表 4,P>0.05)。
| 表 4 PCSK9抑制剂治疗后甘油三酯四分组达到LDL-c、TG阈值的百分比 Tab.4 Achieving percentage in LDL-c and TG thresholds in four groups after treatment with PCSK9 inhibitors |
相关性分析:将TG基线水平与TG改变度做Spearman相关分析,发现甘油三酯基线水平与甘油三酯改变度相关(r=-0.407,P=0.001,图 1)。
3 讨论一项纳入10659名参与者为期22年的前瞻性研究发现,人群中TG最高的1/4的人群对比最低的1/4人群,冠心病(CHD)发生风险增加了60%(HR 1.60,95%CI 1.25-2.05,P<0.001)[14];同时,基因学研究也表明,导致TG升高的基因发生功能缺失突变将降低40% CHD风险(OR 0.60,95%CI 0.47-0.75,P=4×10-6)[15]。FILED[16]及ACCORD[17]研究证实,在高TG血症中,降低TG能降低心血管事件风险,且合并低HDL-c时心血管患病风险降低得更为明显。因此,高TG是心血管疾病的独立危险因素和治疗靶目标。
现在,降TG的常用药物为他汀类药物、贝特类药物及n-3类脂肪酸,指南指出他汀类药物是高TG合并心血管病高危人群的一线治疗药物。但是,他汀类药物常规剂量在降低TG上作用有限,而大剂量他汀类药物往往会增加他汀相关的副作用,同时,目前指南推荐的联合降TG的贝特类药物及n-3类脂肪酸心血管获益的临床证据相对有限。因此,我们急需一种既能降低大剂量他汀类药物副作用,又能带来确切心血管获益,且有降低TG潜力的药物,我们将目光投向新型的降脂药物―PCSK9抑制剂。
PCSK9抑制剂主要通过阻断循环中PCSK9与LDL受体(LDLR)的结合,从而阻止PCSK9-LDLR复合物通过内化作用降解,促进LDL-c的代谢来降低循环中LDL-c水平[18-19]。临床研究表明循环中PCSK9与TG水平存在正相关关系[20-22],而且PCSK9基因的功能缺失突变也将导致较低的TG水平[23-24],Wieneke等[25]提出血浆PCSK9参与TG代谢的可能机制:PCSK9通过消耗LDLR而阻止中间密度脂蛋白和乳糜微粒残余物的代谢从而升高TG,也可能通过对其他LDLR样受体,如CD36、VLDL受体的降解来升高TG。但是,在PCSK9抑制剂对TG的影响方面,不同的研究得出的结果大相径庭:TG降幅差异从3.3%[26]到33.7%[27],且相比对照组降幅不总是达到统计学意义。
FOURIER研究纳入了27564名有动脉粥样硬化性心血管疾病的患者,发现PCSK9抑制剂不仅能带来心血管事件获益,也能降低15.5%TG(与安慰剂组对比,P<0.001),与基线相比TG下降16.2%[10];Michel等[28对8个ODYSSEY Ⅲ期研究共4269名高胆固醇血症患者进行综合分析,发现PCSK9抑制剂不仅能显著降低LDL-c,也能降低17.3%TG(相比安慰剂组,P<0.0001),与基线相比TG下降16.4%]。但是,纳入50名家族性高胆固醇血症病人的TESLA Part B研究发现,PCSK9抑制剂治疗组与基线相比TG平均下降2.3%,与安慰剂相比TG只降低3.3%,P=0.62[26];Dirk等[29]则对DESCARTES研究中的905名高胆固醇血症患者进行分组研究,发现在糖尿病亚组中,PCSK9抑制剂治疗组相较安慰剂组TG下降8.8%(P>0.05)。
我们的研究表明PCSK9抑制剂能平均降低TG 19.80%,但不同TG基线降低幅度有所差异,在TG正常组和轻度升高组TG改变度不明显,但在中度升高组及重度升高组,TG中位降幅显著且与基线相比差异具有统计学意义。若以2.3 mmol/L作为TG分界值,TG>2.3 mmol/L组的TG改变度为-50.79%,PCSK9抑制剂对TG降幅明显并有统计学意义(P=0.001);但在TG<2.3 mmol/L组中则无明显影响(P=0.130)。相关性分析表明TG基线与TG改变度存在相关性。与其他临床研究结果相似,我们的研究表明PCSK9抑制剂也能显著降低LDL-c,平均降幅达56.34%,研究还表明,虽正常组与重度升高组相比LDL-c改变度存在差异,但重度升高组对LDL-c改变度降幅仍超过50%,且各分组在PCSK9抑制剂治疗后LDL-c≤1.8 mmol/L的百分比无统计学差异。PCSK9抑制剂也能显著降低TC,平均降幅为47.65%,中位降幅为51.39%,甘油三酯不同分组间TC改变度无明显差异。但是,PCSK9抑制剂治疗后HDL-c并无明显改变,各组间HDL-c改变度也无明显差异。
本研究中纳入的患者例数虽不多(59名),但TG却表现明显的降低,我们认为一个可能原因是PCSK9抑制剂对TG的影响与TG基线有关系,即当TG较高的时候,PCSK9抑制剂可能有较为明显的作用,但TG基线较低时,这种改变并不明显。因为既往绝大部分临床研究[10, 30-34],纳入的人群均排除TG>4.52 mmol/L的个体,导致TG的基线较低。但是,我们的研究并没有排除高TG的病人,其中TG升高病人(TG≥1.7 mmol/L)就占59.32%,而TG重度升高(TG≥5.6 mmol/L)的病人占18.64%。
值得说明的是,Evan等的研究也得到了相似的结论。他们进行了一个纳入4个Ⅲ期临床试验共1791名受试者的研究,分析PCSK9抑制剂的降TG幅度可能与甘油三酯基线有关。该研究将TG分为<1.70 mmo/L,1.70≤TG≤2.82 mmol/L以及TG≥2.82 mmol/L三个组,每组的TG基线平均数分别为1.12 mmol/L、2.11 mmol/L及3.17 mmol/L,结果发现随着TG基线的升高,PCSK9抑制剂降TG幅度更为明显[35]。但Evan等的研究并没有指出TG的降幅是否具有统计学意义,而我们的研究则表明,当TG较低时,TG改变度可能不明显或较低,只有TG基线达到某一水平,降TG的效果才较为显著。
本研究尚存在以下不足:首先,本研究纳入样本量偏少,且纳入的高TG血症比例较大,对真实人群的代表性不足,可能存在偏倚;其次,本研究并没有设置病例对照,而仅比较治疗前后的血脂谱,可能混淆其他因素对TG的影响;最后,本研究平均观察时间为41.32 d,中位观察时间32(19,48)d,观察时间较短且时间不一也可能对研究结果造成影响。
综上所述,本研究首次重点分析了PCSK9抑制剂对中国人群TG的影响,并可能在国际上首次明确纳入了严重高TG人群(TG>5.6 mmol/L),比较不同TG基线下PCSK9抑制剂对血脂的影响,发现PCSK9抑制剂能显著降低LDL-c、TC及TG,而对HDL-c影响不明显;同时,我们研究结果显示在TG≥2.3 mmol/L人群中TG有明显降幅。基于其心血管获益,我们有理由认为PCSK9抑制剂是心血管病高危人群合并高TG血症患者在他汀基础上的优选联合药物。
| [1] |
Nordestgaard BG, Varbo A. Triglycerides and cardiovascular disease[J]. Lancet, 2014, 384(9943): 626-35. DOI:10.1016/S0140-6736(14)61177-6 |
| [2] |
Sarwar N, Danesh J, Eiriksdottir G, et al. Triglycerides and the risk of coronary heart disease: 10, 158 incident cases among 262, 525 participants in 29 Western prospective studies[J]. Circulation, 2007, 115(4): 450-8. DOI:10.1161/CIRCULATIONAHA.106.637793 |
| [3] |
Patel A, Barzi F, Jamrozik K, et al. Serum triglycerides as a risk factor for cardiovascular diseases in the Asia-Pacific region[J]. Circulation, 2004, 110(17): 2678-86. DOI:10.1161/01.CIR.0000145615.33955.83 |
| [4] |
Jørgensen AB, Frikke-Schmidt R, West AS, et al. Genetically elevated non-fasting triglycerides and calculated remnant cholesterol as causal risk factors for myocardial infarction[J]. Eur Heart J, 2013, 34(24): 1826-33. DOI:10.1093/eurheartj/ehs431 |
| [5] |
Jørgensen AB, Frikke-Schmidt R, Nordestgaard BG, et al. Loss-offunction mutations in APOC3 and risk of ischemic vascular disease[J]. N Engl J Med, 2014, 371(1): 32-41. DOI:10.1056/NEJMoa1308027 |
| [6] |
Bhatt DL, Steg PG, Miller M, et al. Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia[J]. N Engl J Med, 2019, 380(1): 11-22. DOI:10.1056/NEJMoa1812792 |
| [7] |
Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk[J]. Eur Heart J, 2020, 41(1): 111-88. DOI:10.1093/eurheartj/ehz455 |
| [8] |
Newman CB, Preiss D, Tobert JA, et al. Statin safety and associated adverse events: a scientific statement from the American heart association[J]. Arterioscler Thromb Vasc Biol, 2019, 39(2): e38-e81. |
| [9] |
Taylor BA, Thompson PD. Statin-associated muscle disease: advances in diagnosis and management[J]. Neurotherapeutics, 2018, 15(4): 1006-17. DOI:10.1007/s13311-018-0670-z |
| [10] |
Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease[J]. N Engl J Med, 2017, 376(18): 1713-22. DOI:10.1056/NEJMoa1615664 |
| [11] |
马蕊, 张莉莉, 韩冰, 等. 前蛋白转化酶枯草溶菌素9抑制剂对他汀类药物不耐受急性冠状动脉综合征患者血脂影响[J]. 临床军医杂志, 2020, 48(5): 581-5. |
| [12] |
王晶, 邓松柏, 刘亚杰. PCSK9抑制剂对极高危动脉粥样硬化性心血管疾病患者血脂谱的影响[J]. 中华危重病急救医学, 2020, 32(3): 341-4. DOI:10.3760/cma.j.cn121430-20200129-00053 |
| [13] |
中国胆固醇教育计划协会, 叶平, 等. 高甘油三酯血症及其心血管风险管理专家共识[J]. 中华心血管病杂志, 2017, 45(2): 108-15. DOI:10.3760/cma.j.issn.0253-3758.2017.02.008 |
| [14] |
Iso H, Imano H, Yamagishi K, et al. Fasting and non-fasting triglycerides and risk of ischemic cardiovascular disease in Japanese men and women: the Circulatory Risk in Communities Study (CIRCS)[J]. Atherosclerosis, 2014, 237(1): 361-8. |
| [15] |
TG and HDL Working Group of the Exome Sequencing Project, National Heart, Lung, Blood Institute, Crosby J, Peloso GM, et al. Loss-of-function mutations in APOC3, triglycerides, and coronary disease[J]. N Engl J Med, 2014, 371(1): 22-31. DOI:10.1056/NEJMoa1307095 |
| [16] |
Scott R, O'Brien R, Fulcher G, et al. Effects of fenofibrate treatment on cardiovascular disease risk in 9, 795 individuals with type 2 diabetes and various components of the metabolic syndrome: the Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) study[J]. Diabetes Care, 2009, 32(3): 493-8. |
| [17] |
ACCORD Study Group, Ginsberg HN, Elam MB, et al. Effects of combination lipid therapy in type 2 diabetes mellitus[J]. N Engl J Med, 2010, 362: 1563-74. DOI:10.1056/NEJMoa1001282 |
| [18] |
Shapiro MD, Tavori H, Fazio S. PCSK9: From Basic Science Discoveries to Clinical Trials[J]. Circ Res, 2018, 122(10): 1420-38. DOI:10.1161/CIRCRESAHA.118.311227 |
| [19] |
Shimada YJ, Cannon CP. PCSK9 (Proprotein convertase subtilisin/ kexin type 9) inhibitors: past, present, and the future[J]. Eur Heart J, 2015, 36(36): 2415-24. DOI:10.1093/eurheartj/ehv174 |
| [20] |
Baass A, Dubuc G, Tremblay M, et al. Plasma PCSK9 is associated with age, sex, and multiple metabolic markers in a populationbased sample of children and adolescents[J]. Clin Chem, 2009, 55(9): 1637-45. DOI:10.1373/clinchem.2009.126987 |
| [21] |
Lakoski SG, Lagace TA, Cohen JC, et al. Genetic and metabolic determinants of plasma PCSK9 levels[J]. J Clin Endocrinol Metab, 2009, 94(7): 2537-43. DOI:10.1210/jc.2009-0141 |
| [22] |
Laugier-Robiolle S, Vergès B, Le Bras M, et al. Glycaemic control influences the relationship between plasma PCSK9 and LDL cholesterol in type 1 diabetes[J]. Diabetes Obes Metab, 2017, 19(3): 448-51. DOI:10.1111/dom.12819 |
| [23] |
Ooi TC, Krysa JA, Chaker S, et al. The Effect of PCSK9 Loss-ofFunction Variants on the Postprandial Lipid and ApoB-Lipoprotein Response[J]. J Clin Endocrinol Metab, 2017, 102(9): 3452-60. DOI:10.1210/jc.2017-00684 |
| [24] |
Cohen JC, Boerwinkle E, Mosley TH Jr, et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease[J]. N Engl J Med, 2006, 354(12): 1264-72. DOI:10.1056/NEJMoa054013 |
| [25] |
Wieneke D, Cédric LM., Bertrand C. eyond LDL: what role for PCSK9 in triglyceride-rich lipoprotein metabolism?[J]. Trends Endocrinol Metab, 2018, 29(6): 420-34. DOI:10.1016/j.tem.2018.03.013 |
| [26] |
Raal FJ, Honarpour N, Blom DJ, et al. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B): a randomised, double-blind, placebo-controlled trial[J]. Lancet, 2015, 385(9965): 341-50. DOI:10.1016/S0140-6736(14)61374-X |
| [27] |
Giugliano RP, Desai NR, Kohli P, et al. Efficacy, safety, and tolerability of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 in combination with a statin in patients with hypercholesterolaemia (LAPLACE-TIMI57): a randomised, placebo-controlled, dose-ranging, phase 2 study[J]. Lancet, 2012, 380(9858): 2007-17. DOI:10.1016/S0140-6736(12)61770-X |
| [28] |
Michel F, Daniel G, Velichka V, et al. Efficacy of alirocumab in high cardiovascular risk populations with or without heterozygous familial hypercholesterolemia: Pooled analysis of eight ODYSSEY Phase 3 clinical program trials[J]. Int J Cardiol, 2016, 223: 750-7. DOI:10.1016/j.ijcard.2016.08.273 |
| [29] |
Dirk JB, Michael JK, Eli R, et al. Evaluation of the efficacy, safety and glycaemic effects of evolocumab (AMG 145) in hypercholesterolaemic patients stratified by glycaemic status and metabolic syndrome[J]. Diabetes Obes Metab, 2017, 19(1): 98-107. DOI:10.1111/dom.12788 |
| [30] |
Robinson JG, Farnier M, Krempf M, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events[J]. N Engl J Med, 2015, 372(16): 1489-99. DOI:10.1056/NEJMoa1501031 |
| [31] |
Blom DJ, Hala T, Bolognese M, et al. A 52-week placebo-controlled trial of evolocumab in hyperlipidemia[J]. N Engl J Med, 2014, 370(19): 1809-19. DOI:10.1056/NEJMoa1316222 |
| [32] |
Schwartz GG, Steg PG, Szarek M, et al. Alirocumab and cardiovascular outcomes after acute coronary syndrome[J]. N Engl J Med, 2018, 379(22): 2097-107. DOI:10.1056/NEJMoa1801174 |
| [33] |
Robinson JG, Nedergaard BS, Rogers WJ, et al. Effect of evolocumab or ezetimibe added to moderate-or high-intensity statin therapy on LDL-C lowering in patients with hypercholesterolemia: the LAPLACE-2 randomized clinical trial[J]. JAMA, 2014, 311(18): 1870-82. DOI:10.1001/jama.2014.4030 |
| [34] |
Moriarty PM, Thompson PD, Cannon CP, et al. Efficacy and safety of alirocumab vs ezetimibe in statin-intolerant patients, with a statin rechallenge arm: The ODYSSEY ALTERNATIVE randomized trial[J]. J Clin Lipidol, 2015, 9(6): 758-69. DOI:10.1016/j.jacl.2015.08.006 |
| [35] |
Evan AS, Ransi S, Constantine D, et al. PCSK9 inhibition-mediated reduction in triglyceride with evolocumab is related to baseline triglyceride levels: an analysis from 1791 patients[J]. J Am Coll Cardiol, 2016, 67(13): 1866. DOI:10.1016/S0735-1097(16)31867-8 |
 2020, Vol. 40
2020, Vol. 40

