2. 南方医科大学中西医结合医院风湿免疫科,广东 广州 510315
2. Department of Rheumatology and Immunology, Integrated Hospital of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510315, China
类风湿关节炎(RA)是一种以关节及关节周围组织慢性炎症病变为主要表现的自身免疫性疾病,归属于中医“痹证”范畴,有“历节风”、“尩痹”、“顽痹”之称。金·张元素在《医学启源》中创制出当归拈痛汤这一著名方剂以治疗湿热痹痛。该方由茵陈、羌活、炙甘草、猪苓、泽泻、防风、知母、苍术、当归、葛根、苦参、人参、升麻、黄芩、白术组成,具有利湿清热、疏风止痛的功效,目前当归拈痛汤在临床广泛应用于RA以及少年类风湿性关节炎活动期的治疗,可以有效改善RA患者症状和主要理化指标[1],目前为了推广其临床应用及增加国际化应用的可能性,亟需对当归拈痛汤治疗RA作用的分子机制展开深入研究。
RA的病理表现为关节滑膜组织炎性增生、炎性细胞的浸润以及关节软骨进行性破坏[2]。而滑膜成纤维细胞(FLS)是RA病理变化过程中的主要效应细胞[3-5]。RA关节滑膜的过度增长主要是由于FLS凋亡的不足而导致的增殖与死亡的平衡失调而引起的[6]。细胞凋亡存在两大主要通路:首先为外在膜受体通路以Fas信号通路为代表,Fas被激活后再与具有“死亡区域”的Fas相关蛋白(FADD)结合,进一步激活caspase-8引起细胞凋亡;其次为内在线粒体通路:通过各种信号传导通路,进而引起的Bcl-2家族蛋白的变化,进而引起线粒体膜通透性的改变,细胞色素C的释放所引起的细胞凋亡[7]。近年来,国内外针对RA滑膜细胞凋亡分子机制的研究多集中在内在线粒体通路[8]。研究发现通过对内在凋亡通路的调控,可以明显改善实验性类风湿大鼠的炎症水平[9-10]。目前以Fas信号通路为切入点,研究RA中FLS凋亡的分子机制尚未完全清楚。本课题组结合国内外RA FLS凋亡通路研究现状,在前期工作基础中筛选出当归拈痛汤的作用靶点可能为Fas基因[11]。因此,本课题组推测当归拈痛汤治疗RA的作用机制可以与激活Fas通路,进而诱导滑膜细胞凋亡有关。本研究结果将丰富当归拈痛汤的疗效机理,为当归拈痛汤治疗RA提供新的实验依据,亦为RA现代药理学基础研究拓宽思路。
1 材料和方法 1.1 滑膜组织及动物本实验的滑膜标本均取自2018年5月~2019年10月南方医科大学中西医结合医院行膝关节滑膜清理术或膝关节置换术的患者。RA诊断符合美国ACR 1987年RA的诊断标准,并通过南方医科大学中西医结合医院医学伦理委员会审查。实验动物为SPF级SD雄性大鼠40只,体质量200±20 g,由南方医科大学动物中心实验室提供。动物许可证号为SYXK(粤)2016-0167。饲养于南方医科大学实验动物中心SPF级动物房。符合南方医科大学实验动物伦理委员会要求和原则(编号:L2017214)。
1.2 主要药品和试剂羌活15 g、茵陈15 g、炙甘草15 g、猪苓9 g、泽泻9 g、防风9 g、知母9 g、苍术9 g、当归9 g、葛根6 g、苦参6 g、人参6 g、升麻3 g、黄芩3 g。上述诸药均购自南方医院中药房,由南方医科大学中医药学院刘传明副教授按照2015年版《中国药典》进行鉴定,鉴定所购买中药无误。
胎牛血清、高糖型DMEM(批号分别为42Q7380K、8119284,Sigma);MTT粉末(MP Biomedicals,Hoechst33342染色液,批号:20180702,博士德公司);Annexin V- EGFP细胞凋亡检测试剂盒(批号:20180718,凯基公司);HiScript®Ⅲ RT SuperMix for qPCR(+gDNA wiper)(批号:20181017)、ChamQ SYBR® qPCR Master Mix(批号:20181015)(诺唯赞公司);全蛋白提取试剂盒(批号:20190103)、BCA定量试剂盒(批号20190203)(碧云天公司);Fas、FADD、caspase-8、caspase-3抗体(Cell Signaling Technology);羊抗兔IgG/HRP二抗(批号:BA1054)(武汉博士德生物公司);KR-33493抑制剂(MedChemExpress)。其他常规化学试剂均为进口或国产分析纯产品。
1.3 主要仪器BH-2型荧光显微镜(OLYMPUS),HERA cell 240i型二氧化碳培养箱(Thermo),cytoflex型流式细胞仪(Beckman Coulter),LightCycler96型实时定量PCR仪(Roche),Powerpac Universal型电泳通用电源及配套设备(BIO-RAD)。
1.4 方法 1.4.1 当归拈痛汤含药血清的制备当归拈痛汤由羌活15 g、茵陈15 g、炙甘草15 g、猪苓9 g、泽泻9 g、防风9 g、知母9 g、苍术9 g、当归9 g、葛根6 g、苦参6 g、人参6 g、升麻3 g、黄芩3 g、白术3 g共15味中药组成。将药材放置于煎煮容器中, 加10倍体积的蒸馏水没过药物后,充分浸泡1 h,煮沸0.5 h,纱布过滤。药渣加5倍体积的蒸馏水再次煎煮,煮沸0.5 h,纱布过滤。将两次滤液均匀混合,利用旋转蒸发仪浓缩到目的的生药量:1.312 g/mL,冷却装入灭菌药瓶,置4 ℃冰箱备用。成年人体质量按60 kg计算,则当归拈痛汤成人用量为2.1 g/kg,设置高、中、低剂量组,即含生药52.5 g/kg(高剂量),26.25 g/kg(中剂量),13.125 g/kg(低剂量)。将SPF级SD大鼠40只分为4组,分别为空白组、低剂量组、中剂量组、高剂量组,10只/组,每日灌胃1次,灌胃体积为10 mL/kg,空白组灌服等量的生理盐水。大鼠连续给药1周后,10%水合氯醛麻醉,腹主动脉采血,将采血管室温静置30 min,4000 r/min 4 ℃离心15 min,同组血清混合,56 ℃水浴灭活补体30 min,用0.22 pm微孔针头过滤器滤过,密封,-80 ℃冰箱保存备用
1.4.2 RA FLS的分离培养及鉴定无菌条件下,向提取的滑膜组织滴加1~2滴Ⅰ型胶原酶消化液,将其锐性剪碎至约1 mm×1 mm×1 mm大小,移至15 mL离心管中,加入2~3倍体积比I型胶原酶消化液,避光,于37 ℃摇动中消化2~4 h,经200目细胞滤网过滤组织块后,于1000 r/min离心5 min去上清,加入适量PBS(含双抗),吹打混匀后细胞计数,于1000 r/min离心5 min去上清,加入适量20% PBS培养液(含双抗),吹打混匀后,于5% CO2 37 ℃培养箱中培养。根据细胞培养情况,每1~ 3 d换液1次。细胞生长至约85%汇合时,用胰酶消化法传代,培养至3~6代用于以下实验。将RA FLS按每孔1×103个铺于96孔板上,培养24 h后,PBS清洗3次。经固定、通透、封闭、一抗4 ℃孵育过夜、漂洗、二抗37 ℃孵育2 h、DAPI染细胞核15 min,再漂洗后,荧光显微镜下观察。
1.4.3 MTT法检测细胞生长率收集对数期细胞,设置NC组:10%空白组血清,89%高糖型DMEM,1%双抗;DGNTD低剂量组:10%低剂量当归拈痛汤含药血清,89%高糖型DMEM,1%双抗;DGNTD中剂量组:10%中剂量当归拈痛汤含药血清,89%高糖型DMEM,1%双抗;DGNTD高剂量组:10%高剂量当归拈痛汤含药血清,89%高糖型DMEM,1%双抗。胰酶消化,调整细胞悬液浓度为1×105/mL,铺于96孔板,每孔加入100 μL,边缘孔用无菌PBS填充,37 ℃、5% CO2的培养箱中培养24 h。按照分组分别加入100 μL的培养液,每组设4个复孔,继续培养24、48、72 h,然后每孔加入20 μL MTT溶液(5 mg/mL),继续培养4 h。弃去培养液后,每孔加入二甲基亚砜100 μL,摇床上低速震荡10 min,酶标仪测各孔吸光度值A490 nm,记录结果。细胞生长率和抑制率公式分别为:
| $ \begin{array}{l} \;\;\;\;{\rm{细胞生长率}} = [({\rm{实验组}}{A_{{\rm{490 nm}}}} - {\rm{调零}}{A_{{\rm{490 nm}}}}){\rm{ }}/({\rm{空白}}{A_{{\rm{490 nm}}}} - \\ {\rm{调零}}{A_{{\rm{490 nm}}}})] \times 100\% \\ \;\;\;\;{\rm{细胞抑制率}}=1-{\rm{细胞生长率}} \end{array} $ |
实验分组:NC组;DGNTD中剂量组;DGNTD高剂量组。RA FLS细胞以1×105/(mL·孔)的数量接种于6孔板中,每孔予以3 mL培养液,37 ℃ 5% CO2条件下孵育24 h;分组给药干预48 h后,弃去培养液,每孔1 mL Hoechst33342染色液(2 μg/mL),室温避光孵育15 min,弃去染色液,用PBS漂洗3次,荧光显微镜下进行荧光激发和观察细胞凋亡情况。
1.4.5 AnnexinV-FITC/PI检测RA FLS凋亡率按照2.4实验分组给药干预48 h,弃去培养基,使用4 ℃ PBS漂洗2次,800 g离心5 min收集1×105个细胞,加入500 μL的Binding Buffer悬浮细胞;加入5 μL Annexin V-EGFP混匀后,加入5 μL PI混匀,室温避光孵育20 min,流式细胞仪器检测RA FLS凋亡率。
1.4.6 qPCR法检测Fas/caspase8凋亡通路相关基因Fas、FADD、caspase-8、caspase-3 mRNA表达水平按照2.4实验分组给药干预48 h,每孔加入1 mL Trizol,反复吹打数次移至EP管,室温静置5 min。往离心管中加入200 μL氯仿,震荡混匀15 s,室温静置3 min后,4 ℃ 12 000 g离心15 min。吸取含有总RNA的最上层无色水相至新的EP管,轻轻吸取约500 μL,加入500 μL的异丙醇,上下颠倒均匀,室温沉淀10 min后,4 ℃,12 000 g离心10 min。弃去上清液,管壁可见细小的白色沉淀。加入1 mL 75%乙醇,颠倒混匀,使沉淀悬浮。4 ℃,7500 g离心5 min,尽量吸除上清液后,打开盖子,室温晾干。待RNA略干后,加入10 μL DEPC水,充分溶解RNA。利用紫外分光光度仪上测定RNA样品的质量与浓度,A260/A280比值在1.8~2.1范围内表明总RNA纯度较好。在RT-PCR扩增仪上进行cDNA反转录,先42 ℃ 2 min去除基因组DNA;进行逆转录,反应条件37 ℃ 15 min,85 ℃ 5 s,反应结束后4 ℃,保温。在实时荧光PCR仪上进行PCR反应,反应条件为95 ℃预变性30 s,95 ℃ 10 s,60 ℃ 30 s,共扩增40个循环,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s进行溶解曲线分析。单峰溶解曲线表示扩增产物单一,无非特异性扩增产物。反应结束后由电脑软件自动分析并计算出结果。采用2-ΔΔCt法计算mRNA相对表达量。引物由擎科生物科技有限公司合成见表 1。
| 表 1 引物序列 Tab.1 Primer sequences |
分组给药干预48 h,弃细胞培养基,使用4 ℃ PBS漂洗3次,用细胞刮收集细胞,800 g 4 ℃离心10 min后,弃去PBS,加入适量配置好的细胞蛋白裂解液,4 ℃裂解30 min,12 000 g 4 ℃离心5 min,取上清,采用BCA蛋白浓度测定试剂盒检测蛋白浓度,将样品于95 ℃加热5 min,取20 μg进行12%的SDS-PAGE电泳,电泳完成后,将蛋白转移至PVDF膜。转膜后,用5%的脱脂奶粉封闭、抗目标蛋白一抗孵育、辣根过氧化物酶偶联的二抗孵育后,用超敏化学发光试剂显影。使用Image J软件分析各个条带的灰度值,最后进行统计分析。
1.4.8 Hoechst 33342染色检测抑制Fas/caspase8信号通路后细胞凋亡的变化按照实验分组:NC组:10%空白组血清,89%高糖型DMEM,1%双抗;DGNTD组:10%高剂量当归拈痛汤含药血清,89%高糖型DMEM,1%双抗;抑制剂组(KR-33493K组):20 μmol/mL KR-33493预处理1 h;抑制剂联合当归拈痛汤组(KR-33493+ DGNTD组):20 μmol/mL KR-33493预处理1 h+10%高剂量当归拈痛汤含药血清,89%高糖型DMEM,1%双抗。于37 ℃ 5% CO2条件下孵育48 h。余下步骤同2.4。
1.4.9 Western blot检测抑制Fas/caspase-8信号通路后Fas、FADD、caspase-8、caspase-3的表达量的变化分组参照1.4.8,余下步骤同1.4.7。
1.4.10 统计学方法所有数据用SPSS 20.0统计软件处理,定量资料用均数±标准差表示,两组样本比较用t检验,多个样本均数比较采用Oneway ANOVA分析。如果数据为非正态性分布,采用Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
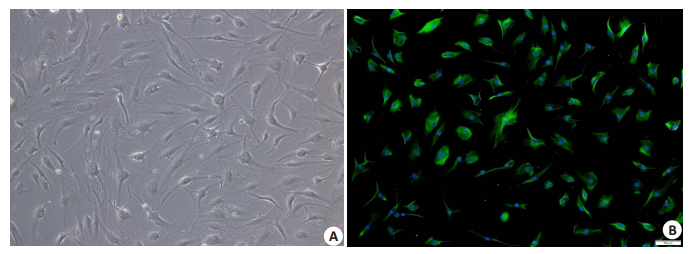
2 结果 2.1 RA FLS培养与鉴定光学显微镜观察下,滑膜细胞形态呈现长梭形,其细胞核为卵圆形位于细胞中央,贴壁生长,形态与FLS相符(图 1A)。Vimentin是FLS的特异表达的微丝蛋白[12],细胞免疫荧光检测表明培养的细胞为FLS(图 1B)。
|
图 1 RA FLS的细胞鉴定 Fig.1 Identification of FLS from RA patients (Original magnification:×100). A: RA FLS of the 4th generation under microscope; B: RA FLS of the 4th generation after immunofluorescence staining under fluorescence microscope. The cell nuclei were stained blue. Vimentin stained the cells green. |
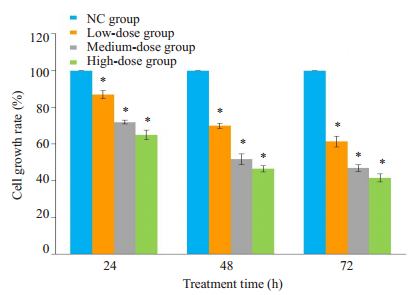
MTT法显示给药后随着药物剂量的增加和作用时间的增加,RA FLS的生长率明显减低(图 2)。与NC组相比,DGNTD中、高剂量组的生长率接近于50%(即半数抑制率),分别达51.73%、46.51%,可有效抑制RA FLS的增殖(P<0.05)。故选择DGNTD中、高剂量组的含药血清浓度以及48 h的作用时间作为后续细胞研究的干预条件。
|
图 2 当归拈痛汤含药血清对FLS细胞生长率的影响 Fig.2 Effect of DGNTD-containing sera on growth of the FLS. *P < 0.05 vs NC group. |
|
图 3 当归拈痛汤含药血清对RA FLS形态的影响 Fig.3 Effect of DGNTD-containing serum on the morphology of RA FLS (×200). A: NC group; B: DGNTD medium-dose group; C: DGNTD high-dose group. |
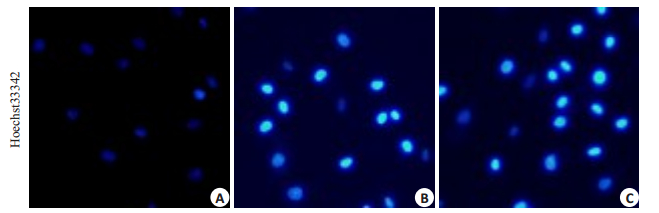
细胞经过Hoechst33342染色后,NC组可见细胞核轮廓清晰,大小一致,染色较浅;DGNTD中、高剂量组可见部分细胞核固缩呈均一的致密物,荧光强度明显加强。
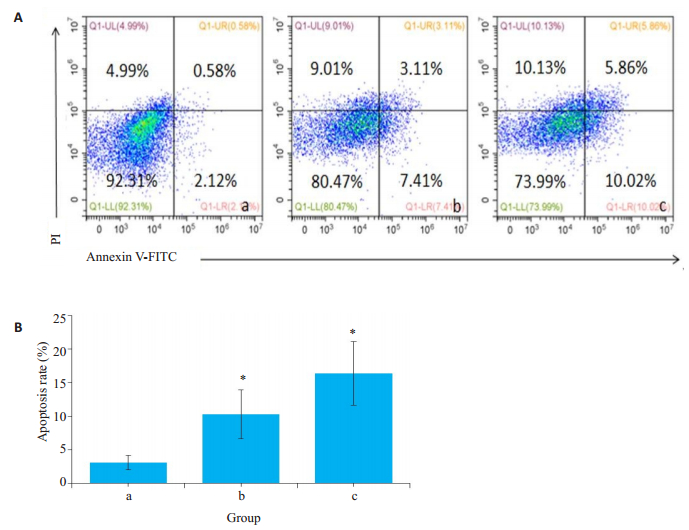
2.4 当归拈痛汤对RA FLS凋亡的影响随着当归拈痛汤的剂量增加,RA FLS的凋亡率有较为明显的增高(图 4)。相对于NC组(3.08±1.06)%的凋亡率,DGNTD中、高剂量组的当归拈痛汤含药血清干预48 h后,凋亡率分别为(10.31±3.64)%、(16.37± 4.75)%(P<0.05),分别是NC组的3.35倍和5.32倍。
|
图 4 当归拈痛汤含药血清对FLS细胞凋亡率的影响 Fig.4 Effect of DGNTD-containing serum on apoptosis rate of RA FLS. A: Flow cytometry to detect the apoptosis rate in the 3 groups; B: Bar chart of apoptosis rate of the 3 groups. *P < 0.05 vs NC group. a: NC group; b: DGNTD mediumdose group; c: DGNTD high-dose group. |
与NC组相比,DGNTD中、高剂量组Fas、FADD、caspase-8、caspase-3 mRNA的表达水平均有均有显著的升高(P<0.05,图 5)。其中以Fas mRNA的表达量变化最为显著,分别是NC组的4.77倍和5.61倍。
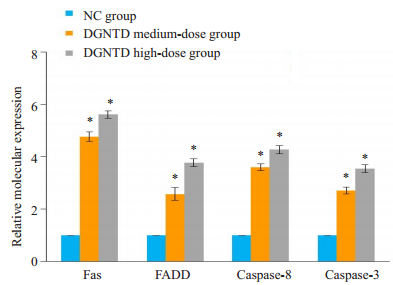
|
图 5 当归拈痛汤含药血清对Fas、FADD、caspase-8、caspase-3 mRNA的表达水平的影响 Fig.5 Effect of DGNTD-containing serum on the mRNA expressions of Fas, FADD, Caspase-8 and caspase-3. *P < 0.05 vs NC group. |
相比于NC组,随着DGNTD含药血清剂量的增加Fas、FADD、caspase-8、caspase-3蛋白表达量明显上升(P<0.05,图 6)。其中Fas的蛋白表达量变化最为明显,分别为NC组的1.74倍和2.41倍。
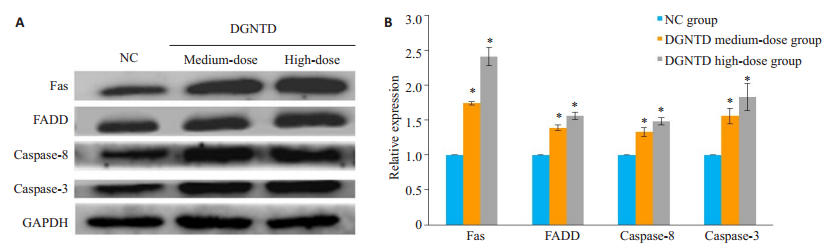
|
图 6 当归拈痛汤含药血清对Fas通路相关蛋白表达水平的影响 Fig.6 Effect of DGNTD-containing serum on expressions of Fas related proteins. A: Western blotting to detect the protein expression of Fas, FADD, caspase-8 and caspase-3 in the 3 groups; B: Bar chart of relative expression of Fas, FADD, caspase-8 and caspase-3 protein in the 3 groups. *P < 0.05 vs NC group. |
与NC组对比,DGNTD组,RA FLS细胞荧光强度增大,细胞凋亡明显增加;而KR-33493组的细胞荧光强度无明显改变。与DGNTD组对比,KR-33493+DGNTD组细胞荧光强度减少,细胞凋亡受抑制(图 7)。
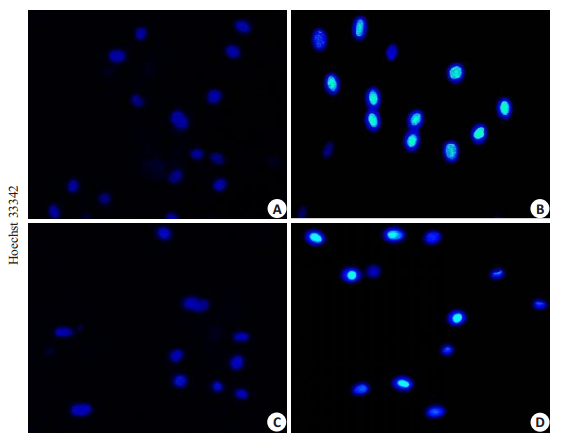
|
图 7 当归拈痛汤对抑制了Fas/caspase-8通路后细胞凋亡的影响 Fig.7 Effect of DGNTD on apoptosis of RA FLS after inhibition of Fas/caspase-8 pathway (×200). A: NC group; B: DGNTD group; C: KR-33493 group; D: KR-33493+DGNTD group. |
与NC组对比,DGNTD组中Fas、FADD、caspase-8、caspase-3表达量显著性上升;KR-33493组中Fas及其下游分子显著性下降(P<0.05)。与DGNTD组对比,在KR-33493 + DGNTD组中,Fas、FADD、caspase-8、caspase-3的蛋白表达量明显下降(P<0.05,图 8)。
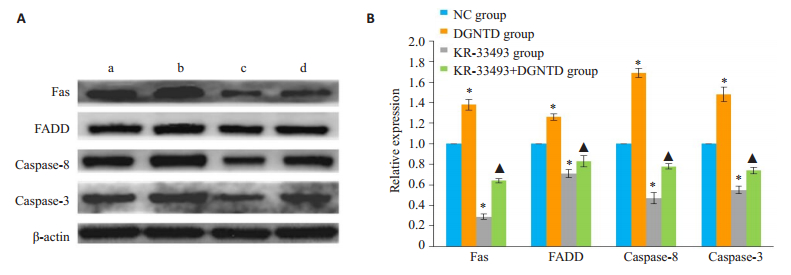
|
图 8 当归拈痛汤对抑制Fas/caspase-8通路后Fas、FADD、caspase-8、caspase-3表达量的影响 Fig.8 Effect of DGNTD on expressions of Fas, FADD, caspase-8 and caspase-3 after inhibition of Fas/caspase-8 pathway. A: Western blotting to detect the protein expression of Fas, FADD, caspase-8 and caspase-3 in four groups; B: Bar chart of relative expression of Fas, FADD, caspase-8 and caspase-3 protein in the 4 groups. *P < 0.05 vs NC group. ▲P < 0.05 vs DGNTD group. a: NC group; b: DGNTD group; c: KR-33493 group; d: KR-33493+DGNTD group. |
RA是临床常见的多发病。据统计,RA在我国的患病率为0.32%~0.36%[13]。该病具有反复发作,病情缠绵,致残率高的发病特点,严重危害人类健康[14]。临床中特别在广东岭南地区,其发病多以湿热痹证居多。《医学启源》中创制出当归拈痛汤这一著名方剂用于治疗湿热痹证。该方长于分消湿热,调理寒温,健脾祛邪,切中病机,被称为“湿热疼痛之圣方”。现代研究表明当归拈痛汤可以通过抑制炎症过程中滑膜增生、炎细胞的浸润、软骨和骨的破坏来改善佐剂性关节炎大鼠的滑膜炎症[15-19],但具体的作用机制尚不明确。本课题组前期研究发现当归拈痛汤能诱导促凋亡因子Fas/FasL mRNA表达,促进佐剂性关节炎大鼠滑膜细胞的凋亡。经蛋白质组学方法鉴定该方能有效改变Fas、c-fos、Hsp27、NFATc1磷酸化状态,经过生物信息学分析提示Fas通路可能是当归拈痛汤调控的重要信号通路[20]。
Fas/FasL信号通路广泛存在于滑膜组织中,是细胞凋亡的膜受体通路[21]。Fas在FasL的调节下被激活,募集胞浆中死亡域蛋白FADD[21]。FADD是凋亡信号传导中的重要连接蛋白,具有C端(DD结构域)和N端(DED结构域)。前者与Fas蛋白胞内段的DD结构域结合,后者与带有DED结构域的caspase-8发生同嗜性交联,三者形成死亡诱导信号复合物(DISC),激活caspase-8,进而通过级联反应使caspases-3等凋亡执行分子被活化,细胞发生凋亡[22-25]。研究发现在RA发病过程中Fas基因量表达改变,导致了滑膜细胞的增殖和凋亡失衡,促进RA的发展[26]。FLS的异常激活可导致促炎因子的释放,血管翳的形成,骨质破坏等,进一步加重RA的症状[27-28]。目前,以RA的凋亡特性为靶点的治疗方法已成为RA研究热点[29]。本研究发现,当归拈痛汤能有效抑制FLS的过度增殖,诱导细胞凋亡,可以上调Fas、FADD、caspase-8、caspase-3的转录水平,促进Fas、FADD、caspase-8、caspase-3蛋白量的表达。这提示当归拈痛汤促进FLS凋亡的机制很可能通过激活Fas/caspase-8信号通路实现。近年来研究表明通过激活FLS的Fas信号通路能有效改善RA的临床症状[30-32]。为了进一步验证当归拈痛汤的分子机制,本课题组利用Fas抑制剂KR-33493干扰抑制Fas信号通路后,检测当归拈痛汤促进RA FLS凋亡和Fas通路相关蛋白表达作用的改变。KR-33493是一个有效的Fas介导细胞死亡的抑制剂,能通过抑制Fas相关因子-1来影响Fas的表达[33]。结果显示与当归拈痛汤组相比,抑制剂+当归拈痛汤组中细胞凋亡减少,Fas/caspase-8信号通路相关蛋白表达量也显著降低,即当归拈痛汤的促凋亡效应被KR-33493抑制剂逆转。因此可以推测当归拈痛汤作用于FLS后,可以激活Fas基因促进了具有“死亡区域”的FADD的表达,并引发级联反应,活化起始凋亡蛋白酶caspase-8,最后激活效应凋亡蛋白caspase-3,有效地抑制细胞的炎性增生并诱导滑膜细胞凋亡。
综上所述,本研究深入探讨了当归拈痛汤促进RA滑膜成纤维细胞凋亡的分子机制。推测当归拈痛汤治疗RA的机制可能在于有效激活RA FLS的Fas通路,促进FADD的表达,进而激活caspase-8及其下游caspase- 3分子,引起FLS凋亡,有效减少滑膜的炎性增生。本研究有助于诠释当归拈痛汤多途径、多层次抗RA的科学内涵,为该药的临床应用提供充分的理论依据。
| [1] |
王福祖, 李琴, 宋维海, 等. 当归拈痛汤联合西药治疗早期类风湿性关节炎湿热痹阻证临床疗效观察[J]. 四川中医, 2018, 36(6): 145-8. |
| [2] |
Molendijk M, Hazes JM, Lubberts E. From patients with arthralgia, pre-RA and recently diagnosed RA: what is the current status of understanding RA pathogenesis?[J]. RMD Open, 2018, 4(1): e000256. DOI:10.1136/rmdopen-2016-000256 |
| [3] |
Alam J, Jantan I, Bukhari SNA. Rheumatoid arthritis: Recent advances on its etiology, role of cytokines and pharmacotherapy[J]. Biomed Pharmacother, 2017, 92: 615-33. DOI:10.1016/j.biopha.2017.05.055 |
| [4] |
McInnes IB, Schett G. Pathogenetic insights from the treatment of rheumatoid arthritis[J]. Lancet, 2017, 389(10086): 2328-37. DOI:10.1016/S0140-6736(17)31472-1 |
| [5] |
Wang SL, Zuo SG, Liu ZG, et al. Association of MTHFR and RFC1 gene polymorphisms with methotrexate efficacy and toxicity in Chinese Han patients with rheumatoid arthritis[J]. J Int Med Res, 2019, 300060519879588. |
| [6] |
Yang R, Zhang YZ, Wang L, et al. Increased autophagy in fibroblastlike synoviocytes leads to immune enhancement potential in rheumatoid arthritis[J]. Oncotarget, 2017, 8(9): 15420-30. DOI:10.18632/oncotarget.14331 |
| [7] |
Zhang Q, Liu J, Zhang MM, et al. Apoptosis induction of fibroblastlike synoviocytes is an important molecular-mechanism for herbal medicine along with its active components in treating rheumatoid arthritis[J]. Biomolecules, 2019, 9(12): E795. DOI:10.3390/biom9120795 |
| [8] |
Panga V, Kallor AA, Nair A, et al. Mitochondrial dysfunction in rheumatoid arthritis: a comprehensive analysis by integrating gene expression, protein-protein interactions and gene ontology data[J]. PLoS One, 2019, 14(11): e0224632. DOI:10.1371/journal.pone.0224632 |
| [9] |
Wang XJ, Gong S, Pu D, et al. Up-regulation of miR-365 promotes the apoptosis and restrains proliferation of synoviocytes through downregulation of IGF1 and the inactivation of the PI3K/AKT/ mTOR pathway in mice with rheumatoid arthritis[J]. Int Immunopharmacol, 2020, 79: 106067. DOI:10.1016/j.intimp.2019.106067 |
| [10] |
尚延春, 申晟, 柴巍巍, 等. 当归拈痛汤对类风湿关节炎大鼠滑膜细胞凋亡通路的影响[J]. 世界中医药, 2018, 13(7): 1718-22. DOI:10.3969/j.issn.1673-7202.2018.07.039 |
| [11] |
袁立霞, 刘亚伟. 当归拈痛汤及其拆方对类风湿性关节炎大鼠炎症因子谱的调控作用研究[J]. 时珍国医国药, 2015, 26(6): 1284-7. |
| [12] |
马莎, 林俊, 于亮, 等. 三种培养原代滑膜成纤维细胞方法的比较[J]. 昆明医科大学学报, 2016, 37(6): 52-6. DOI:10.3969/j.issn.1003-4706.2016.06.012 |
| [13] |
Smolen JS, Aletaha D, Me Innes IB. Rheumatoid arthritis[J]. Lancet, 2016, 388(10055): 2023-38. DOI:10.1016/S0140-6736(16)30173-8 |
| [14] |
McInnes IB, Schett G. Pathogenetic insights from the treatment of rheumatoid arthritis[J]. Lancet, 2017, 389(10086): 2328-37. DOI:10.1016/S0140-6736(17)31472-1 |
| [15] |
许伏龙, 袁立霞. 当归拈痛汤及拆方对类风湿关节炎大鼠血清IL-6的影响当归拈痛汤及拆方对类风湿关节炎大鼠血清IL-6的影响[J]. 辽宁中医杂志, 2015, 42(4): 871-72. |
| [16] |
易国仲, 袁立霞. 当归拈痛汤对类风湿性关节炎大鼠滑膜MMP-9的影响[J]. 时珍国医国药, 2014, 25(5): 1033-4. |
| [17] |
袁立霞. 当归拈痛汤及其拆方对类风湿性关节炎大鼠滑膜组织MMP- 3调节作用的实验研究[J]. 时珍国医国药, 2013, 24(6): 1313-4. DOI:10.3969/j.issn.1008-0805.2013.06.012 |
| [18] |
廖江铨, 田佳星, 陈俊绵, 等. 当归拈痛汤及其拆方对佐剂性关节炎大鼠滑膜组织VEGF表达的影响[J]. 中国中医基础医学杂志, 2010, 16(4): 298-9. |
| [19] |
袁立霞. 当归拈痛汤及拆方对类风湿性关节炎大鼠血清IL-1β和TNF- α的影响[J]. 中华中医药学刊, 2008, 26(6): 1213-4. |
| [20] |
袁立霞, 李青原, 易国仲, 等. 当归拈痛汤防治类风湿性关节炎大鼠滑膜病变的蛋白质组学研究[J]. 中药新药与临床药理, 2013, 24(6): 565-9. |
| [21] |
Janczi T, Böhm BB, Fehrl Y, et al. ADAM15 in apoptosis resistance of synovial fibroblasts: converting fas/CD95 death signals into the activation of prosurvival pathways by calmodulin recruitment[J]. Arthritis Rheumat, 2019, 71(1): 63-72. DOI:10.1002/art.40667 |
| [22] |
Hollomon MG, Patterson L, Santiago-O'farrill J, et al. Knock down of fas-associated protein with death domain (FADD) sensitizes osteosarcoma to TNFΑ-induced cell death[J]. J Cancer, 2020, 11(7): 1657-67. DOI:10.7150/jca.38721 |
| [23] |
Rodríguez-Frade JM, Guedán A, Lucas P, et al. Use of lentiviral particles as a cell membrane-based mFasL delivery system for in vivo treatment of inflammatory arthritis[J]. Front Immunol, 2017, 8: 460. DOI:10.3389/fimmu.2017.00460 |
| [24] |
Lee SH, Kwon JY, Kim SY, et al. Interferon-Gamma regulates inflammatory cell death by targeting necroptosis in experimental autoimmune arthritis[J]. Sci Rep, 2017, 7(1): 10133. |
| [25] |
Zhang K, Gao S, Guo JY, et al. Hypericin-photodynamic therapy inhibits proliferation and induces apoptosis in human rheumatoid arthritis fibroblast-like synoviocytes cell line MH7A[J]. Iran J Basic Med Sci, 2018, 21(2): 130-7. |
| [26] |
Zhu AP, Wang MJ, Zhou GX, et al. Fas/FasL, Bcl2 and Caspase-8 gene polymorphisms in Chinese patients with rheumatoid arthritis[J]. Rheumatol Int, 2016, 36(6): 807-18. DOI:10.1007/s00296-016-3443-1 |
| [27] |
Yoo SE, Yu CS, Jung S, et al. Design and synthesis of fluorescent and biotin tagged probes for the study of molecular actions of FAF1 inhibitor[J]. Bioorg Med Chem Lett, 2016, 26(4): 1169-72. DOI:10.1016/j.bmcl.2016.01.045 |
| [28] |
Cao YH, Liu J. Correlation analysis of apoptosis and clinical indicators in rheumatoid arthritis patients[J]. Chin J Integr Tradit West Med, 2016, 36(1): 35-9. |
| [29] |
Ueyama H, Okano T, Orita K, et al. Local transplantation of adiposederived stem cells has a significant therapeutic effect in a mouse model of rheumatoid arthritis[J]. Sci Rep, 2020, 10(1): 3076. |
| [30] |
Sun Y, Cao YH. Effects of Xinfeng capsule on the Fas/FasLmediated apoptotic pathway in patients with rheumatoid arthritis[J]. Chung I Tsa Chih Ying Wen Pan, 2018, 38(4): 601-9. |
| [31] |
Svrcina H, Greer A, Baker S, et al. Death effects of reveromycin A in normal and disease-associated cells of the joint[J]. J Cell Biochem, 2018, 119(6): 4382-96. DOI:10.1002/jcb.26463 |
| [32] |
Mouasni S, Gonzalez V, Schmitt A, et al. The classical NLRP3 inflammasome controls FADD unconventional secretion through microvesicle shedding[J]. Cell Death Dis, 2019, 10(3): 190. DOI:10.1038/s41419-019-1412-9 |
| [33] |
Jeong JW, Yu CS, Lee JH, et al. Subacute toxicity evaluation of KR- 33493, FAF1 inhibitor for a new anti-Parkinson's disease agent, after oral administration in rats and dogs[J]. Regul Toxicol Pharmacol, 2016, 81: 387-96. DOI:10.1016/j.yrtph.2016.09.022 |
 2020, Vol. 40
2020, Vol. 40

