放射治疗是脑肿瘤患者不可或缺的重要治疗手段。然而有文献表明,在脑肿瘤放射治疗6月后,50%~ 90%的患者会出现以认知功能障碍为主的放射性脑损伤[1],表现为学习能力、记忆力、反应速度、注意力及执行能力的下降。2%~5%的患者进展为痴呆,甚至出现记忆力丧失、共济失调和尿失禁等[2]。因此放射性神经损伤导致的认知功能障碍已经成为脑肿瘤患者临床上仅次于生存期的一个重要预后指标。但其发生机制仍未能完全阐明,临床上目前也没有切实有效的防治药物[3]。
既往相关研究表明,脑组织受到照射后,产生氧自由基导致氧化应激反应,被认为在脑组织的放射损伤中起关键作用[4]。本课题组既往研究也证实,通过激活Nrf2等能通过抑制氧化应激反应减轻放射性神经损伤[5-6]。近年来,以脂质过氧化反应导致的氧化应激被发现是一种新的细胞死亡模式—铁坏死的关键环节[7-8]。维生素E则发现能通过抑制脂质过氧化产物的生成而抑制铁坏死[9],从而调节动物模型的神经损伤[10]及认知功能[11],是铁坏死的天然抑制剂。
维生素E是否能减轻放射性神经损伤,以及在放射性神经损伤中的相关机制,目前尚无相关研究探讨。本研究拟通过体内外实验探索维生素E是否能减轻海马神经元放射性损伤,并初步探讨其机制,为诠释放射性神经损伤调控机制打开一个新的视角,也为进一步寻找新的放射性神经损伤治疗手段提供理论依据。
1 材料和方法 1.1 细胞照射采用本单位Varian 23EX直线加速器处理细胞,采用6 MV X射线分别给予单次照射8 Gy,源皮距100 cm。
1.2 MTT法检测细胞生存研究将HT-22细胞及U251细胞分别分为对照组、单纯药物干预组、单纯放疗组(RT)、放疗+药物联合干预组,药物分别为维生素E(200 μmol/L)、铁坏死抑制剂(Fer-1,5 μmol/L)、凋亡抑制剂(ZVAD-FMK,2 μmol/L)及坏死性凋亡抑制剂(Necro-1,100 μmol/L)进行处理。在96孔板中分别接种各组细胞,每组细胞设置3个复孔,细胞密度约5×103/孔,细胞贴壁24 h后按照1.1方法照射,继续培养48 h,每孔加入20 μL MTT溶液(5 mg/mL),4 h后小心吸去孔内培养液,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪A490 nm测量各孔吸光值,分析各组细胞生存。
1.3 铁坏死相关指标检测研究将海马神经元细胞HT-22分为实验组(control)、单纯放疗组(RT)、放疗联合维生素E处理组(RT+VE)、放疗联合铁坏死抑制剂处理组(RT+Fer-1)。通过流式细胞仪检测照射前后细胞脂质ROS的产量,采用C11-BODIPY荧光探针,按照BODIPYTM 581/591 C11 (Lipid Peroxidation Sensor)试剂盒(Invitrogen)说明书进行操作。细胞MDA以及GSH的检测分别根据Biyotime公司的MDA assay kit以及GSH assay kit试剂盒,按照说明书操作。细胞内铁离子检测按照Iron Assay Kit试剂盒(Abcam)说明书准备细胞样品,用铁离子探针25 ℃孵育1 h后在A593 nm处检测。GSH、Lipid ROS、Iron在检测后以control组结果为100%进行标准化处理。
1.4 小鼠行为学实验检测各组小鼠认识功能的改变实验小鼠选用C57BL/6J小鼠,随机分为对照组、单纯维生素E(VE)、单纯放疗组(RT)、放疗+维生素E联合干预组(RT+VE)(3只/组),各组小鼠照射前进行腹腔麻醉(3.5%水合氯醛,10 mL/kg),参考照射深度为皮下1 cm,采用6 MV高能X线(LINAC;2300EX;VARIAN Co., USA)给予单次16 Gy全脑照射剂量,铅挡块遮挡头部以下。维生素E(DL-αtocopheryl acetate,盖德化工)根据文献[9]加入小鼠饮食中进行喂食,含量为每天500 U/kg(此浓度为前期预实验作用浓度)。行为学实验采用Morris水迷宫测试仪(DMS 2型电脑全自动程控Morris水迷宫)进行定位航行实验检测小鼠学习能力,主要步骤:小鼠从4个入水点面向池壁放入水中,由Morris水迷宫自带的计算机视频跟踪记录仪追踪小鼠的游泳轨迹(每次≤90 s),并记录小鼠寻找固定平台的时间(即逃避潜伏期),如果小鼠90 s内未找到平台,须将其引致平台并停留10 s,此时逃避潜伏期记为90 s,3次成绩的平均值记为当日成绩,测试需持续7 d。
1.5 统计学分析使用SPSS 19.0统计软件,所有实验数据至少经过3次独立重复实验。计量资料数据以均数±标准差表示。多组间比较采用单因素方差分析,组间比较采用Bonferroni法(方差齐)及Dunnutt T3(方差不齐),P<0.05为差异有统计学意义。
2 结果 2.1 维生素E能提高放射后海马神经元细胞生存对海马神经元细胞HT-22及胶质瘤细胞U251按材料与方法1.2进行分组处理,细胞照射按照材料与方法1.1进行处理,药物予维生素E(200 μmol/L)干预。相对于对照组和VE组的海马神经元细胞HT-22及胶质瘤细胞株U251,给予放射线照射后RT组的两种细胞存活均出现明显下降(P<0.05);在放射线联合维生素E处理后(RT+VE),照射后的海马神经元HT-22细胞死亡被逆转(P<0.05),而胶质瘤细胞U251没有改变(P>0.05,图 1)。
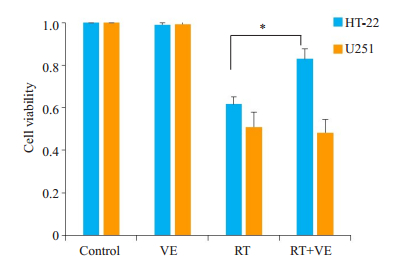
|
图 1 HT-22和U251细胞在放射线照射及维生素E处理后的生存 Fig.1 Vitamin E reverses radiation-induced cell death in HT-22 cells but not in U251 cells. *P < 0.05. |
进一步探索HT-22细胞的放射性死亡可能机制。按材料与方法1.1及1.2进行分组处理,RT+VE组放射线照射同时联合维生素E能逆转照射引起的细胞死亡。放射线照射并给予铁坏死抑制剂(RT+Fer-1组)同样能够逆转放射线诱导的细胞死亡(P<0.05),而凋亡抑制剂(RT+ZVAD组)及坏死性凋亡抑制剂(RT+Necro-1组)则不能逆转细胞死亡(图 2)。
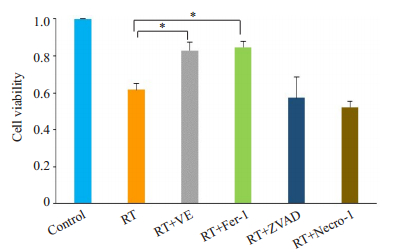
|
图 2 放射线照射及不同细胞死亡抑制剂处理后HT-22细胞的生存 Fig.2 Vitamin E and ferroptosis inhibitor (Ferrostatin-1, Liproxstatin-1) reverse radiation-induced cell death. The apoptosis inhibitor (ZVAD-FMK) or necrotic apoptosis inhibitor (Nerosulfonamide) do not show such an effect. *P < 0.05. |
对HT-22细胞按材料与方法1.3进行分组处理,相对于对照组的海马神经元细胞HT-22,RT组的放射线照射后HT-22细胞氧化应激水平明显升高,表现为还原型谷胱甘肽(GSH)水平明显下降,丙二醛及脂质活性氧簇(Lipid ROS)水平明显上升,同时细胞内铁离子浓度也明显上升(P<0.05)。给予维生素E及铁坏死抑制剂Fer-1后,放射后RT+VE及RT+Fer-1组HT-22细胞的氧化应激水平发生逆转,GSH水平上升,丙二醛、Lipid ROS下降,且细胞内铁离子水平下降(P<0.05,图 3)。
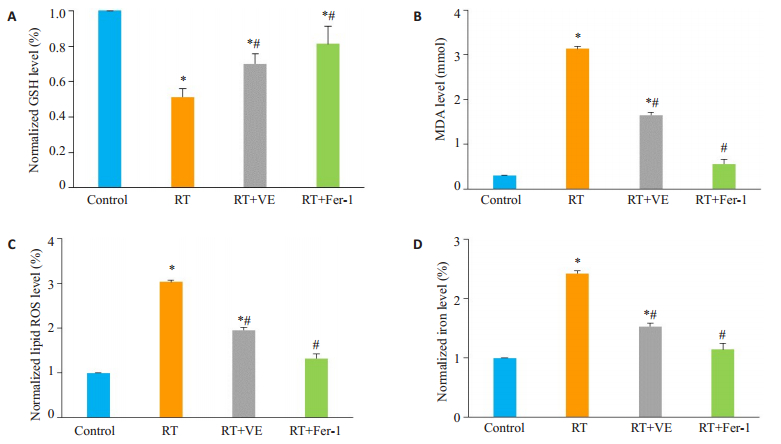
|
图 3 放射线照射联合维生素E或铁坏死抑制剂(Fer-1)处理后HT-22细胞的氧化应激水平和细胞内铁离子浓度改变情况 Fig.3 Changes of oxidative stress level and intracellular iron concentration in HT-22 cells after irradiation treated with vitamin E or ferroptosis inhibitor (Fer-1). A-D: Vitamin E and ferroptosis inhibitors (Ferrostatin-1) significantly reverse the changes of lipid peroxidation related indexes (MDA, GSH, Lipid ROS) and iron levels induced by radiation. Compared to control group, *P < 0.05; Compared to RT group, #P < 0.05 |
对研究小鼠按照材料与方法1.4进行分组处理。采用Morris水迷宫测试仪进行定位航行实验(学习能力),各组小鼠在开始实验后游行的距离和探索时间均减少,但相对于对照组及单纯维生素E处理组,RT组全脑照射后小鼠探索的距离及时间均有明显延长,而全脑照射前开始维生素E饮食的RT+VE组小鼠其游行的距离和探索时间较RT组有明显减少(P<0.05,图 4)。
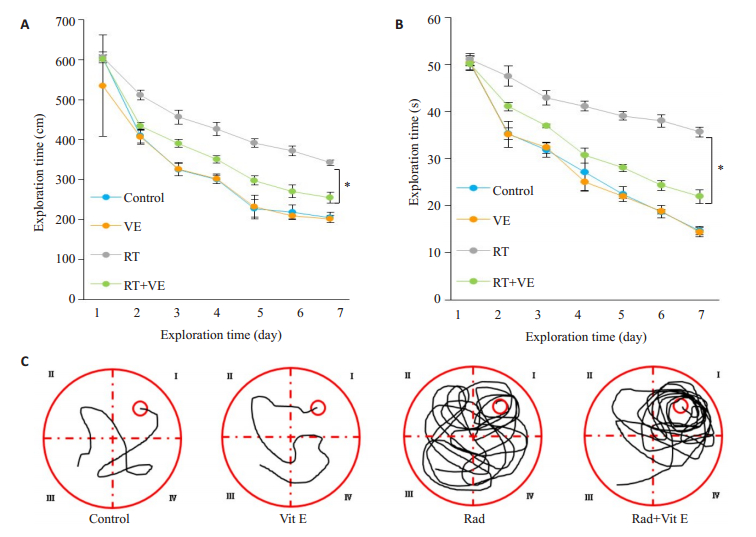
|
图 4 维生素E干预后小鼠在Morris水迷宫实验的游行距离和探索时间 Fig.4 Distance and exploration time of the mice in the Morris water maze test after vitamin E intervention. A: Vitamin E reduces exploration distance of the mice after radiotherapy; B: Vitamin E reduces the exploration time of the mice after radiotherapy. Compared to RT group, *P < 0.05; C: Swimming trajectories of the mice in Morris water maze test. |
本研究发现维生素E能减少海马神经元细胞HT-22照射后的细胞死亡,但对胶质瘤细胞没有影响,说明维生素E能有效减轻海马神经元的放射性损伤而不影响肿瘤治疗效果,是一种有临床潜在应用价值的放射性脑损伤保护药物。既往研究认为维生素E做为天然抗氧化剂可清除体内自由基而起到组织保护作用,但放疗导致细胞具体死亡方式及维生素E减少细胞死亡的具体机制并不明确。
本研究发现铁坏死抑制剂能有效减少HT-22细胞放射后细胞死亡。铁坏死是近年来被发现的一种新的细胞死亡模式,这一概念由Dixon[7]在2012年首次在Cell杂志上发表提出,目前研究表明铁坏死是一种铁离子依赖的、脂质过氧化大量累积引起氧化应激反应导致的细胞死亡,也称为铁死亡。它无论从形态学还是生理生化特征上均与其它形式的细胞程序性死亡如凋亡、坏死性凋亡等不同[8, 12]。本研究在探索放射线诱导细胞死亡的机制过程中,发现放射线诱导的细胞死亡仅能被铁坏死抑制剂及研究使用的维生素E减轻。符合既往研究中铁坏死不能被凋亡抑制剂及坏死性凋亡抑制剂逆转[13],而可以被铁螯合剂(如去铁胺)、亲脂性抗氧化剂(如维生素E、CoQ-10)、脂质过氧化反应抑制剂(如Ferrostatin-1)等所抑制[9, 14-15]。说明铁坏死而非凋亡或坏死是形成放射性神经损伤的主要原因之一[5, 16]。
铁坏死这种细胞死亡方式一经发现就被证明与多种神经系统疾病及神经损伤密切相关[17-19]。研究发现铁坏死在多种神经退行性病变如帕金森病[20]、阿兹海默综合症[11]以及神经损伤性疾病如血管性脑损伤[21]、创伤性脑损伤[22-23]的发生发展中起到重要作用。但放射性神经损伤过程中细胞死亡的具体机制存在争议,本研究首次发现铁坏死在海马神经元细胞放射性损伤过程中起到了重要作用。
许多天然抗氧化物被发现能够抑制铁坏死,比如硒可以通过调控谷胱甘肽过氧化物酶4(Gpx4)的表达抑制铁坏死,发挥抗氧化作用[24];表儿茶酚能够通过激活Nrf2通路减少氧化应激产物的堆积从而抑制铁坏死,减轻动物模型的出血性脑损伤[25];黄芩素可以减轻Erastin对System Xc-的作用从而抑制铁坏死[26]。在众多天然抗氧化物中,维生素E作为一种脂溶性维生素,是体内最重要的抗氧化剂之一。Carlson等[9]发现Gpx4-/-小鼠由于存在广泛肝细胞变性无法生存,但是给予维生素E喂食则可以使Gpx4-/-小鼠存活,维生素E可以逆转脂质过氧化导致的肝细胞铁坏死。研究显示补充维生素E可以推迟条件性敲除GPX4小鼠神经瘫痪症状的出现[10]。研究也显示在条件性敲除前脑及海马神经元GPX4的小鼠中给予不含维生素E的喂食将加速海马神经元退行性变及认知功能障碍的出现[11]。本研究观察到维生素E处理细胞后能减轻照射后海马神经元细胞的氧化应激反应,并降低组织细胞内铁离子浓度,说明维生素E能够有效抑制放射性神经损伤中铁坏死的发生。可能是通过抑制放射线照射后脂质过氧化产物的生成而抑制铁坏死,从而在放射性神经损伤的保护作用起到重要作用。
随后的小鼠Morris水迷宫定位航行实验也从体内实验的层面上发现:放射线照射联合维生素E干预组小鼠无论是探索的时间还是游行距离均优于单纯照射组,证实了维生素E干预对照射后小鼠出现的逃避潜伏期及游行距离的延长有改善作用,这也从动物试验层面佐证了维生素E能够减轻放射性神经损伤,从而改善照射后认知功能损害。
铁坏死作为一种新发现的细胞死亡方式,其研究的深入必将为一些疾病带来新的治疗靶点。体内外实验也发现抑制铁坏死在这类神经系统疾病及神经损伤动物模型中具有明显的神经保护作用[27]。一项以铁坏死抑制剂-铁螯合剂DFO治疗帕金森患者的Ⅱ期临床研究也得到了阳性结果[28],另一项大型Ⅲ期临床试验的结果也显示维生素E能够有效的缓解阿兹海默综合症患者的认知功能下降[29]。此外许多天然抗氧化物也被发现能够通过抑制铁坏死发挥抗氧化作用[9, 11]。本课题组后续拟根据目前研究结果,准备进一步开展维生素E对放射性神经损伤患者保护作用的临床研究,从而确定维生素E对放射性神经损伤的临床疗效。我们希望通过对维生素E与铁坏死在海马神经元放射性损伤过程中的探索,为诠释放射性神经损伤调控机制打开一个新的视角,也为寻找新的放射性神经损伤治疗靶点提供理论依据。
| [1] |
Makale MT, McDonald CR, Hattangadi-Gluth JA, et al. Mechanisms of radiotherapy-associated cognitive disability in patients with brain tumours[J]. Nat Rev Neurol, 2017, 13(1): 52-64. |
| [2] |
Dana Greene-Schloesser, Elizabeth Moore, Mike E Robbins. Molecular pathways: radiation-induced cognitive impairment[J]. Clin Cancer Res, 2013, 19(9): 2294-300. DOI:10.1158/1078-0432.CCR-11-2903 |
| [3] |
Peng XC, Huang JR, Wang SW, et al. Traditional Chinese medicine in neuroprotection after brain insults with special reference to radioprotection[J]. Evid Based Complement Alternat Med, 2018, 2018: 2767208. |
| [4] |
Yahyapour R, Motevaseli E, Rezaeyan A, et al. Reduction-oxidation (redox) system in radiation-induced normal tissue injury: molecular mechanisms and implications in radiation therapeutics[J]. Clinical & translational oncology: official publication of the Federation of Spanish Oncology Societies and of the National Cancer Institute of Mexico, 2018, 20(8): 975-88. |
| [5] |
Liao G, Li R, Chen X, et al. Sodium valproate prevents radiationinduced injury in hippocampal neurons via activation of the Nrf2/ HO-1 pathway[J]. Neuroscience, 2016, 331: 40-51. DOI:10.1016/j.neuroscience.2016.06.019 |
| [6] |
陈勇, 孙爱民, 陈智贤, 等. 人参皂甙Rg1对NOS的调控在海马神经元放射性损伤防护中的意义[J]. 南方医科大学学报, 2010, 30(7): 1522-5. |
| [7] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an irondependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-72. DOI:10.1016/j.cell.2012.03.042 |
| [8] |
Lei PX, Bai T, Sun YL. Mechanisms of ferroptosis and relations with regulated cell death: a review[J]. Front Physiol, 2019, 10: 139. DOI:10.3389/fphys.2019.00139 |
| [9] |
Carlson BA, Tobe R, Yefremova E, et al. Glutathione peroxidase 4 and vitamin E cooperatively prevent hepatocellular degeneration[J]. Redox Biol, 2016, 9: 22-31. DOI:10.1016/j.redox.2016.05.003 |
| [10] |
Chen LJ, Hambright WS, Na R, et al. Ablation of the ferroptosis inhibitor glutathione peroxidase 4 in neurons results in rapid motor neuron degeneration and paralysis[J]. J Biol Chem, 2015, 290(47): 28097-106. DOI:10.1074/jbc.M115.680090 |
| [11] |
Hambright WS, Fonseca RS, Chen LJ, et al. Ablation of ferroptosis regulator glutathione peroxidase 4 in forebrain neurons promotes cognitive impairment and neurodegeneration[J]. Redox Biol, 2017, 12: 8-17. DOI:10.1016/j.redox.2017.01.021 |
| [12] |
Miotto G, Rossetto M, di Paolo ML, et al. Insight into the mechanism of ferroptosis inhibition by ferrostatin-1[J]. Redox Biol, 2020, 28: 101328. DOI:10.1016/j.redox.2019.101328 |
| [13] |
Sun XF, Ou ZH, Chen RC, et al. Activation of the p62-Keap1-NRF2 pathway protects against ferroptosis in hepatocellular carcinoma cells[J]. Hepatology, 2016, 63(1): 173-84. |
| [14] |
Stockwell BR, Friedmann Angeli JP, Bayir H, et al. Ferroptosis: a regulated cell death Nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171(2): 273-85. |
| [15] |
Masaldan S, Bush AI, Devos D, et al. Striking while the iron is hot: Iron metabolism and ferroptosis in neurodegeneration[J]. Free Radic Biol Med, 2019, 133: 221-33. DOI:10.1016/j.freeradbiomed.2018.09.033 |
| [16] |
Li X, Zhuang XB, Qiao TK. Role of ferroptosis in the process of acute radiation-induced lung injury in mice[J]. Biochem Biophys Res Commun, 2019, 519(2): 240-5. |
| [17] |
Hou LY, Huang RX, Sun FQ, et al. NADPH oxidase regulates paraquat and maneb-induced dopaminergic neurodegeneration through ferroptosis[J]. Toxicology, 2019, 417: 64-73. DOI:10.1016/j.tox.2019.02.011 |
| [18] |
Mi YJ, Gao XC, Xu H, et al. The emerging roles of ferroptosis in Huntington's disease[J]. Neuromolecular Med, 2019, 21(2): 110-9. DOI:10.1007/s12017-018-8518-6 |
| [19] |
Mao XY, Zhou HH, Jin WL. Ferroptosis induction in pentylenetetrazole kindling and pilocarpine-induced epileptic seizures in mice[J]. Front Neurosci, 2019, 13: 721. DOI:10.3389/fnins.2019.00721 |
| [20] |
Do van B, Gouel F, Jonneaux A, et al. Ferroptosis, a newly characterized form of cell death in Parkinson's disease that is regulated by PKC[J]. Neurobiol Dis, 2016, 94: 169-78. DOI:10.1016/j.nbd.2016.05.011 |
| [21] |
Alim I, Caulfield JT, Chen YX, et al. Selenium drives a transcriptional adaptive program to block ferroptosis and treat stroke[J]. Cell, 2019, 177(5): 1262-79. DOI:10.1016/j.cell.2019.03.032 |
| [22] |
Kenny EM, Fidan E, Yang Q, et al. Ferroptosis contributes to neuronal death and functional outcome after traumatic brain injury[J]. Crit Care Med, 2019, 47(3): 410-8. |
| [23] |
Xie BS, Wang YQ, Lin Y, et al. Inhibition of ferroptosis attenuates tissue damage and improves long-term outcomes after traumatic brain injury in mice[J]. CNS Neurosci Ther, 2019, 25(4): 465-75. DOI:10.1111/cns.13069 |
| [24] |
Ingold I, Berndt C, Schmitt S, et al. Selenium utilization by GPX4 is required to prevent hydroperoxide-induced ferroptosis[J]. Cell, 2018, 172(3): 409-22.e21. |
| [25] |
Chang CF, Cho S, Wang J. (-)-Epicatechin protects hemorrhagic brain via synergistic Nrf2 pathways[J]. Ann Clin Transl Neurol, 2014, 1(4): 258-71. |
| [26] |
Xie YC, Song XX, Sun XF, et al. Identification of baicalein as a ferroptosis inhibitor by natural product library screening[J]. Biochem Biophys Res Commun, 2016, 473(4): 775-80. |
| [27] |
Zhang Y, Fan BY, Pang YL, et al. Neuroprotective effect of deferoxamine on erastininduced ferroptosis in primary cortical neurons[J]. Neural Regen Res, 2020, 15(8): 1539-45. DOI:10.4103/1673-5374.274344 |
| [28] |
Devos D, Moreau C, Devedjian JC, et al. Targeting chelatable iron as a therapeutic modality in Parkinson's disease[J]. Antioxid Redox Signal, 2014, 21(2): 195-210. DOI:10.1089/ars.2013.5593 |
| [29] |
Dysken MW, Sano M, Asthana S, et al. Effect of vitamin E and memantine on functional decline in Alzheimer disease: the TEAM-AD VA cooperative randomized trial[J]. JAMA, 2014, 311(1): 33-44. DOI:10.1001/jama.2013.282834 |
 2020, Vol. 40
2020, Vol. 40

