睾丸癌是年轻男性最常见的恶性实体肿瘤,其中生殖细胞肿瘤占所有睾丸肿瘤的大多数[1]。顺铂是治疗不同类型实体肿瘤的一线化疗药物[2],与其他药物联合使用对睾丸癌具有很高的治愈率。但治疗时产生的耐药性和肝肾毒性等不良反应,限制了顺铂等铂类药物在临床上的应用。因此,寻找特异性较高,对铂类化疗药物具有特殊敏感性的新靶点对临床上睾丸癌的治疗策略具有重要的指导意义。
泛连接蛋白(Panxs)是Panchin等在无脊椎动物体内找到的一类缝隙连接蛋白[3],包括3种Panx亚型,主要包括:Panx-1、Panx-2和Panx-3[4-5]。其结构由6个Panx蛋白形成一个六聚体半通道,但是Panx蛋白糖基化的表面形成的自抑制域,抑制了两个通道的对接,所以Panx通道不能形成细胞间的缝隙连接,其功能主要是参与细胞内与细胞外微环境的物质交换[6-7]。Panx可在细胞膜上形成离子通道,调节三磷酸腺苷(ATP)释放,参与多种生理病理过程[8-9]。
凋亡是依赖ATP的“程序性细胞死亡”或“细胞自杀”[10]。胞外的ATP是细胞膜上的嘌呤受体的激动剂[11-12]。近年来,有大量文献报道,Pannexin通道作为ATP的释放通道,参与了许多嘌呤信号转导的相关生理和病理过程,包括细胞凋亡、癌症进展和炎症等[13]。细胞外的ATP可以刺激肿瘤细胞表面的P2X7受体,引起细胞内三磷酸肌醇(IP3)通路的激活[14]。有报道发现IP3Rs和RyRs是两个主要的内质网Ca2+通道,可以影响线粒体Ca2+的摄取[15-16],而线粒体的Ca2+超载会导致细胞凋亡。近年来,有研究发现Panx-2通道位于内质网-线粒体接触位点[17]。而Panx-2通道对顺铂诱导睾丸癌细胞凋亡的影响尚未报道。本研究拟采用分子生物学方法干扰Panx-2基因表达,探究Panx-2通道对顺铂诱导睾丸癌I-10细胞凋亡的影响。
1 材料和方法 1.1 细胞株与细胞培养非精原睾丸癌细胞(Leydig细胞)株I- 10购于ATCC,精原睾丸癌细胞(Germ细胞)株Tcam-2购于北纳生物科技有限公司。课题组采用浓度递增法构建了耐顺铂小鼠睾丸癌细胞株I-10/DDP和耐顺铂人睾丸精原癌细胞株Tcam-2/DDP。I-10细胞培养在含2.5%(V/V)胎牛血清、15%(V/V)马血清、100 U/mL青霉素、100 U/mL链霉素的F12高糖培养基中,Tcam-2细胞培养在含10%(V/V)胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养基中。细胞于25 cm2透气培养瓶中贴壁生长,置于37 ℃、含体积分数5% CO2以及饱和湿度的细胞培养箱中。0.25%胰酶消化液(含0.02%EDTA)消化传代,每周传代2~3次。
1.2 主要试剂F12高糖培养基、DMEM培养液、胎牛血清、马血清(Gibco)、opti-MEM(Gibco);shRNA干扰质粒(吉玛基因),lipofectaminTM2000;顺铂(DDP)、四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、多聚甲醛、结晶紫;FITC-Annexin V/PI双染试剂盒(贝博BestBio);其他常用试剂均为国产分析级。羊抗兔二抗(Abbkine,A21020)、羊抗鼠二抗(Abbkine,A1010-1)、GAPDH一抗(Proteintech,60004-1-lg)、Panx-2一抗(Proteintech,26604-1-AP)、Bcl-2一抗(Abbkine,Abp50759),Bax一抗(Absin,abs130057-100 μg)。
1.3 I-10细胞稳转株的建立分别将由上海吉玛公司合成设计的阴性对照质粒(shNC)和干扰Panx-2基因质粒(Panx-2 shRNA1和Panx-2 shRNA2)片段转染入睾丸癌I-10细胞中。
shNC:
5'-GTTCTCCGAACGTGTCACGTTTCAAG
AGAACGTGACACGTTCGGAGAACTT-3'
shRNA1:
5'-GGAGCTCAACTTCCTTCTTCATTCAAG
AGATGAAGAAGGAAGTTGAGCTCCTT-3'
shRNA2:
5'-GCCCGGAGCAGAATCTGTTTGTTCAA
GAGACAAACAGATTCTGCTCCGGGCTT-3'
取对数期生长的I-10细胞,以2×105 cells/mL密度接种于6孔板中培养至60%~80%,避光,取5 μL shRNA干扰质粒(shRNA)和5 μL lipofectaminTM2000分别与250 μL opti-MEM混合(室温放置5 min),然后将上述两种混合液充分混合(总体积510 μL),室温放置20 min。弃去原培养液,510 μL/孔混合液加入细胞培养板中,最后用opti-MEM补足至2 mL。12 h后更换新鲜正常培养液,48 h后消化细胞,转移细胞至25 cm2细胞培养瓶中,此后使用含G418浓度为0.1 mg/mL的培养液,未转染或转染后丢失质粒的细胞会被G418杀死,转染成功的细胞带有抗G418基因质粒,可以存活。每天更换新鲜培养基,待细胞培养至80%,正常操作传代,如此反复筛选1月,提取蛋白,免疫印迹法检测,确认稳转株。稳转株可用于后续实验,也可-20 ℃保存备用。干扰实验分为4组:shRNA1组和shRNA2组分别为转染了shRNA1和shRNA2质粒组;NC组:转染对照质粒组;mork组:只加入lipofectaminTM2000转染组。
1.4 MTT法检测细胞存活率取对数生长期已稳定转染的细胞株,为mork组、NC组、shRNA1组和shRNA2组的细胞,每组细胞以5× 104/mL密度接种于96孔板,每组3个复孔。待细胞长至40%~50%时更换含16 μmol/L顺铂的新鲜培养基,分别培养24、48、72 h后,每孔加入15 μL(5 mg/mL)MTT溶液孵育4 h。然后弃去培养基,每孔加入150 μL DMSO置于37 ℃烘箱中孵育30 min,酶标仪检测吸光度值(A490 nm),实验重复3次。根据公式计算细胞存活率。
| $ {\rm{细胞存活率}} = \frac{{A{\rm{药物处理组}} - A{\rm{校正组}}}}{{A{\rm{对照组}} - A{\rm{校正组}}}} $ |
取对数生长期已稳定转染的细胞株,为mork组、NC组、shRNA1组和shRNA2组的细胞,每组细胞以200 cells/mL密度接种3 mL细胞于培养皿(直径60 mm)中,十字方向轻轻晃动使细胞分散均匀,置于37 ℃、含体积分数5% CO2以及饱和湿度的细胞培养箱中培养2~3周,期间细胞贴壁后换含16 μmol/L顺铂的新鲜培养基培养。当培养皿中出现明显的细胞集落时,终止培养,弃培养液后PBS洗2遍,空气干燥。多聚甲醛固定15 min后,弃多聚甲醛后再空气干燥。用结晶紫染色10 min,用PBS洗去染液,空气干燥,实验重复3次,拍照观察细胞集落形成情况。
1.6 FITC-Annexin V/PI双染法检测细胞早期凋亡率实验分为Control组和顺铂组,每组均使用已稳定转染对数生长期的NC组、shRNA1组和shRNA2组的细胞,每组细胞以2×105/mL密度接种于12孔板中。24 h后顺铂组更换含16 μmol/L顺铂的新鲜培养基,Control组更换新鲜正常培养基。8 h后用无EDTA的胰酶消化并收集细胞(2000 r/min离心5 min),细胞用冷PBS洗2次(2000 r/min离心5 min),收集细胞。先加100 μL的Binding Buffer将细胞吹匀,再按照说明分别加入5 μL Annexin-V和5 μL PI吹打均匀,避光孵育15 min,最后补足300 μL的Binding Buffer吹打均匀,放置冰上,流式细胞仪检测,实验重复3次,观察每组细胞的凋亡情况。
1.7 免疫印迹法检测Panx-2,caspase-3,Bcl-2,Bax蛋白表达取对数生长期已稳定转染的细胞株,为mork组、NC组、shRNA1组和shRNA2组的细胞,每组细胞以2×104/mL密度接种于6孔板,待细胞长至40%~50%时更换含16 μmol/L顺铂的新鲜培养基,培养24 h后,分别收集mork组、NC组、shRNA1组、shRNA2组的细胞,2500 r/min离心10 min,加入适当比例的PMSF与细胞裂解液,冰上裂解30 min,离心提取总蛋白(4 ℃、12 000 r/min离心30 min)。BCA试剂盒进行蛋白定量,准备蛋白样本。制备10%的SDS-PAGE凝胶,将蛋白样本进行上样,电泳(70 V 30 min;100 V 120 min),转膜(150 mA 150 min),牛奶封闭(120 min),TPBS洗涤3遍,孵一抗(4 ℃过夜),TPBS洗涤3遍,孵二抗(室温2 h),TPBS洗涤3遍。ECT发光试剂盒暗室发光显影,凝胶成像系统采集图像,用Bio Imaging system(Gene Genius)进行灰度值扫描分析进行定量分析,实验重复3次,以GAPDH为内参,计算相对表达量。
1.8 统计学分析实验数据均以均数±标准差表示。统计分析使用SPSS 16.0软件,两组数据之间的比较采用两独立样本的t检验,多组数据之间的比较采用单因素方差分析,P<0.05认为差异有统计学意义。
2 结果 2.1 Panx-2蛋白在I-10和I-10/DDP细胞中及Tcam-2和Tcam-2/DDP细胞中的表达采用免疫印迹法检测Panx-2蛋白。与I-10细胞比较,I-10/DDP细胞中Panx-2的表达增加(P<0.001,图 1A)。与Tcam-2细胞比较,Tcam-2/DDP细胞中Panx-2的表达增加(P<0.01,图 1B)。
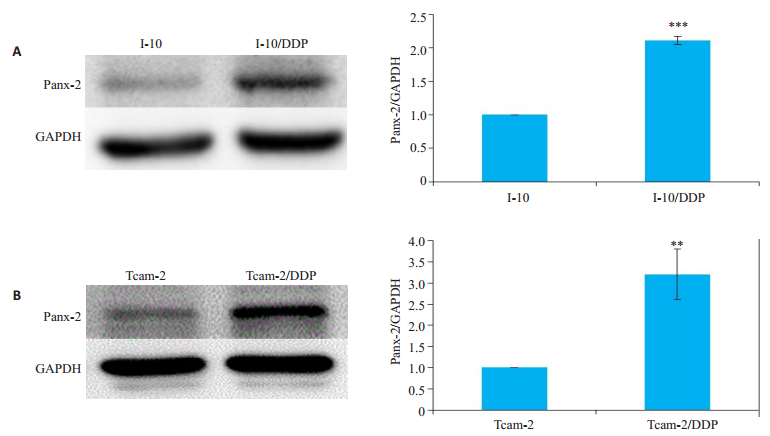
|
图 1 Panx-2蛋白在I-10和I-10/DDP细胞中及Tcam-2和Tcam-2/DDP细胞中的表达 Fig.1 Expressions of pannexin2 (Panx-2) protein in I-10, I-10/DDP, Tcam-2, and Tcam-2/DDP cells detected by Western blotting (n=3). A: I-10 and I-10/DDP; B: Tcam-2 and Tcam-2/DDP; ***P < 0.001 vs I-10, **P < 0.01 vs Tcam-2. |
采用免疫印迹法检测Panx-2蛋白,转染shRNA1和shRNA2后,Panx-2蛋白的表达量降低(P<0.01,图 2A)。
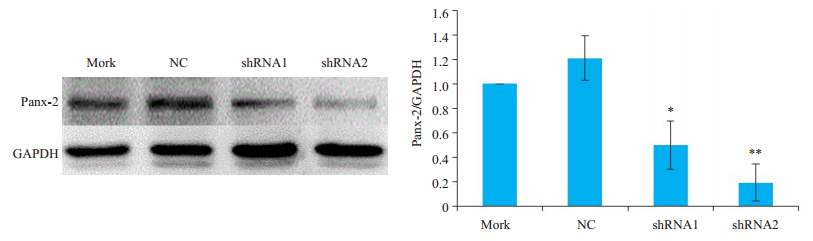
|
图 2 shRNA1和shRNA2对I-10细胞中Panx-2蛋白表达的影响 Fig.2 Effects of shRNA1 and shRNA2 on Panx-2 protein expression in I-10 Leydig tumor cells (n=3). NC: Negative control; *P < 0.05, **P < 0.01 vs NC group. |
采用MTT法检测细胞存活率。用16 μmol/L顺铂处理干扰Panx-2表达后的I-10细胞,在作用24、48、72 h后,转染shRNA1和shRNA2组的I-10细胞存活率均显著降低(P<0.01,P<0.001,图 3A)。
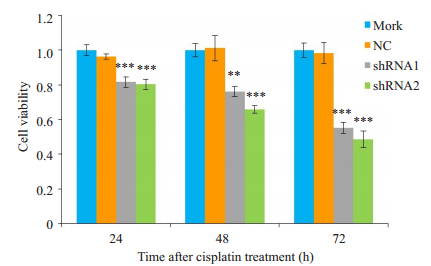
|
图 3 shRNA1和shRNA2对顺铂作用I-10细胞存活率的影响 Fig.3 Effect of shRNA1 and shRNA2 on viability of I-10 cells treated with cisplatin (n=3). **P < 0.01, ***P < 0.001 vs NC group. |
用16 μmol/L顺铂处理干扰Panx-2表达后的I-10细胞,转染shRNA1和shRNA2组的I-10细胞集落形成能力显著降低(P<0.001,P<0.001,图 4A)。
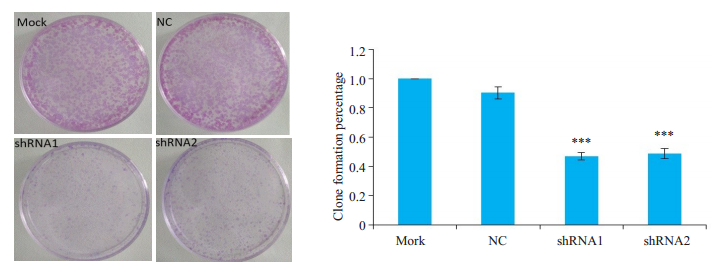
|
图 4 shRNA1和shRNA2对顺铂作用I-10细胞集落形成能力的影响 Fig.4 Effect of shRNA1 and shRNA2 on clonogeic capacity of I-10 cells treated with cisplatin (n=3). ***P < 0.001 vs NC group. |
采用Annexin V/PI双染法检测细胞早期凋亡。转染shRNA1和shRNA2组的I-10细胞早期凋亡率显著增加(P<0.01,图 5)。
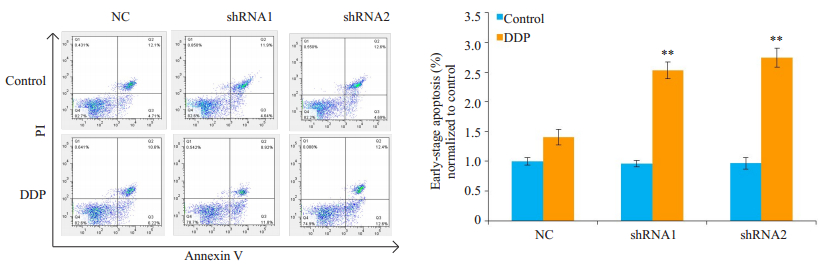
|
图 5 shRNA1和shRNA2对顺铂诱导I-10细胞早期凋亡的影响 Fig.5 Effect of shRNA1 and shRNA2 on early-apoptosis of I-10 cells treated with cisplatin (n=3). **P < 0.01 vs NC group. |
采用免疫印迹法检测caspase-3、Bcl-2、Bax蛋白的表达。转染shRNA1和shRNA2组的I-10细胞Cleavecaspase-3蛋白表达升高(P<0.05,图 6A);抑凋亡蛋白Bcl-2表达降低(P<0.01),而促凋亡蛋白Bax表达升高(P<0.05,图 6B)。
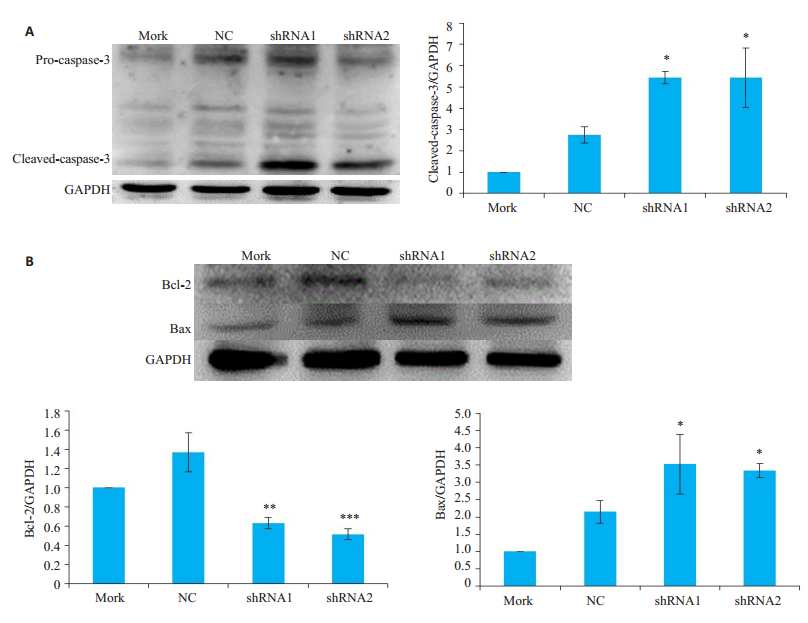
|
图 6 干扰Panx-2的表达水平对顺铂诱导的I-10细胞凋亡相关蛋白的影响 Fig.6 Effect of shRNA1 and shRNA2 on apoptosis-related proteins of I-10 cells treated with cisplatin (n=3). ***P < 0.001, **P < 0.01, *P < 0.05 vs NC group. |
顺铂是目前治疗各种实体肿瘤中最广泛的金属化疗药物之一,也是睾丸癌的一线化疗药物[18]。而顺铂的耐药性限制了它在临床上的应用。顺铂耐药性的产生依赖于多种因素,如药物积累、药物与不同蛋白之间结合失活、DNA修复增加、不同凋亡蛋白信号的改变等[19-22]。Panxs表现为肿瘤抑制作用,过表达Panx-1与Panx-2可抑制大鼠C6胶质瘤细胞在体内外的生长[23-24]。另外,抑制Panx-1通道可减轻顺铂治疗时所产生的急性肾损伤和肝脏炎性浸润[25]。有研究发现,Panx-2在多数肿瘤组织中表达含量减少[24, 26-27]。在本研究中我们使用免疫印迹法测定Panx-2的表达量,发现耐顺铂小鼠睾丸癌I-10/DDP细胞与小鼠睾丸癌I-10细胞相比,Panx-2表达量升高;以及耐顺铂人睾丸精原癌Tcam-2/DDP细胞与人睾丸精原癌Tcam-2细胞相比,Panx-2表达量升高。根据以上结果,我们推测睾丸癌细胞耐药性的产生可能与Panx-2表达量升高有关。
Panxs通道与大多数肿瘤的生长、增殖、侵袭、转移和凋亡有关[28]。近年来有研究显示,Panx-1蛋白主要分布于细胞膜以及细胞质内的高尔基体、内质网和溶酶体等细胞器中[5],Panx-3蛋白已被证实部分位于内质网,并在内质网上形成钙泄露通道[29]。与Panx-1和Panx-3不同的是,Panx-2蛋白的N-糖基化高糖残基并没有被高尔基体特异酶[30]加工成复杂的寡糖,Panx-2位于内质网-线粒体接触位点上[17]。在应激反应下,肿瘤抑制因子p53在内质网-线粒体接触点聚集,与肌内质网Ca2+- ATP酶泵(SERCA)相互作用,促进线粒体钙超载导致凋亡[31-32]。因此,我们猜测Panx-2可能参与细胞凋亡过程。本研究采用分子生物学方法干扰Panx-2的表达,结果发现睾丸癌I-10细胞出现增殖抑制和集落形成能力降低的现象;在干扰Panx-2的表达后,顺铂处理睾丸癌I-10细胞,发现顺铂对睾丸癌I-10细胞具有凋亡诱导作用。上述结果证实干扰Panx-2在细胞内的表达水平可显著增强顺铂诱导睾丸癌I-10细胞的凋亡作用。
细胞外ATP是细胞膜上嘌呤受体的激动剂。有研究表明,通过裂解caspase-3可以激活Panx-1通道,使Jurkat T急性淋巴细胞释放ATP,导致化疗药物诱导细胞凋亡[33-34]。参与凋亡过程的基因有很多种,其中胞质中的caspase-3是凋亡中的关键蛋白酶,凋亡信号的出现导致caspase-3在多种蛋白水解酶的作用下,发生裂解而活化;而Bcl-2蛋白主要分布在线粒体外膜、细胞膜内膜以及内质网膜等处,可抑制多种刺激下的多种细胞凋亡,Bax属于Bcl-2家族,也是极其重要的促凋亡基因之一。本研究干扰Panx-2的表达后联合顺铂作用睾丸癌I-10细胞,发现相比于NC组,干扰Panx-2组中的剪切体caspase-3和Bax表达水平明显升高,而Bcl-2表达水平显著降低。上述结果证实干扰Panx-2在细胞内的表达可显著增强顺铂诱导睾丸癌I-10细胞的凋亡作用。
综上所述,我们的研究证实了Panx-2参与顺铂诱导睾丸癌I-10细胞的凋亡过程,干扰Panx-2的表达能显著增强顺铂诱导睾丸癌I-10细胞发生凋亡,其机制可能与Panx-2参与抑制化疗药物诱导细胞凋亡的过程有关。这将为以Panx-2通道做为靶点提高顺铂对睾丸癌的化疗效果提供新策略。
| [1] |
Batool A, Karimi N, Wu XN, et al. Testicular germ cell tumor: a comprehensive review[J]. Cell Mol Life Sci, 2019, 76(9): 1713-27. DOI:10.1007/s00018-019-03022-7 |
| [2] |
Giacomini I, Ragazzi E, Pasut G, et al. The pentose phosphate pathway and its involvement in cisplatin resistance[J]. Int J Mol Sci, 2020, 21(3): E937. DOI:10.3390/ijms21030937 |
| [3] |
Panchin Y, Kelmanson I, Matz M, et al. A ubiquitous family of putative gap junction molecules[J]. Curr Biol, 2000, 10(13): R473-4. DOI:10.1016/S0960-9822(00)00576-5 |
| [4] |
Baranova A, Ivanov D, Petrash N, et al. The mammalian pannexin family is homologous to the invertebrate innexin gap junction proteins[J]. Genomics, 2004, 83(4): 706-16. DOI:10.1016/j.ygeno.2003.09.025 |
| [5] |
Bruzzone R, Hormuzdi SG, Barbe MT, et al. Pannexins, a family of gap junction proteins expressed in brain[J]. Proc Natl Acad Sci USA, 2003, 100(23): 13644-9. DOI:10.1073/pnas.2233464100 |
| [6] |
Begandt D, Good ME, Keller AS, et al. Pannexin channel and connexin hemichannel expression in vascular function and inflammation[J]. BMC Cell Biol, 2017, 18(Suppl 1): 2. |
| [7] |
Penuela S, Gehi R, Laird DW. The biochemistry and function of pannexin channels[J]. Biochim Biophys Acta, 2013, 1828(1): 15-22. |
| [8] |
Chen KW, Demarco B, Heilig R, et al. Extrinsic and intrinsic apoptosis activate pannexin-1 to drive NLRP3 inflammasome assembly[J]. EMBO J, 2019, 38(10): e101638. |
| [9] |
Mousseau M, Burma NE, Lee KY, et al. Microglial pannexin-1 channel activation is a spinal determinant of joint pain[J]. Sci Adv, 2018, 4(8): e9846. DOI:10.1126/sciadv.aas9846 |
| [10] |
Elmore SA. Apoptosis: a review of programmed cell death[J]. Toxicol Pathol, 2007, 35(4): 495-516. |
| [11] |
Yang DH, He Y, Muñoz-Planillo R, et al. Caspase-11 requires the pannexin-1 channel and the purinergic P2X7 pore to mediate pyroptosis and endotoxic shock[J]. Immunity, 2015, 43(5): 923-32. DOI:10.1016/j.immuni.2015.10.009 |
| [12] |
Bartlett R, Stokes L, Sluyter R. The P2X7 receptor channel: recent developments and the use of P2X7 antagonists in models of disease[J]. Pharmacol Rev, 2014, 66(3): 638-75. |
| [13] |
Deng ZQ, He ZH, Maksaev G, et al. Cryo-EM structures of the ATP release channel pannexin 1[J]. Nat Struct Mol Biol, 2020, 27(4): 373-81. |
| [14] |
Mohammad M, Habib HS. Pannexin channels: the emerging therapeutic targets[J]. Curr Drug Targets, 2014, 15(3): 272-80. DOI:10.2174/13894501113146660217 |
| [15] |
Kopach O, Kruglikov I, Pivneva T, et al. Functional coupling between ryanodine receptors, mitochondria and Ca(2+) ATPases in rat submandibular acinar cells[J]. Cell Calcium, 2008, 43(5): 469-81. DOI:10.1016/j.ceca.2007.08.001 |
| [16] |
Mendes CC, Gomes DA, Thompson M, et al. The type Ⅲ inositol 1, 4, 5-trisphosphate receptor preferentially transmits apoptotic Ca2+ signals into mitochondria[J]. J Biol Chem, 2005, 280(49): 40892-900. DOI:10.1074/jbc.M506623200 |
| [17] |
Le Vasseur M, Chen VC, Huang KT, et al. Pannexin 2 localizes at ER-mitochondria contact sites[J]. Cancers (Basel), 2019, 11(3): E343. DOI:10.3390/cancers11030343 |
| [18] |
Ghosh S. Cisplatin: The first metal based anticancer drug[J]. Bioorg Chem, 2019, 88(3): 102925. |
| [19] |
Siddik ZH. Cisplatin: mode of cytotoxic action and molecular basis of resistance[J]. Oncogene, 2003, 22(47): 7265-79. DOI:10.1038/sj.onc.1206933 |
| [20] |
Kelland LR. Preclinical perspectives on platinum resistance[J]. Drugs, 2000, 59(Suppl 4): 1-8; discussion 37-8. |
| [21] |
Skowron MA, Melnikova M, van Roermund JGH, et al. Multifaceted mechanisms of cisplatin resistance in long-term treated urothelial carcinoma cell lines[J]. Int J Mol Sci, 2018, 19(2): E590. DOI:10.3390/ijms19020590 |
| [22] |
Rocha CRR, Silva MM, Quinet A, et al. DNA repair pathways and cisplatin resistance: an intimate relationship[J]. Clinics (Sao Paulo), 2018, 73(suppl 1): e478s. |
| [23] |
Lai CP, Bechberger JF, Thompson RJ, et al. Tumor-suppressive effects of pannexin 1 in C6 glioma cells[J]. Cancer Res, 2007, 67(4): 1545-54. |
| [24] |
Lai CP, Bechberger JF, Naus CC. Pannexin2 as a novel growth regulator in C6 glioma cells[J]. Oncogene, 2009, 28(49): 4402-8. DOI:10.1038/onc.2009.283 |
| [25] |
Liu CB, Huang LW, Li CZ, et al. Blocking pannexin-1 alleviates cisplatin-induced acute kidney injury in mice by reducing renal inflammatory cell infiltration[J]. J South Med Univ, 2019, 39(5): 508-14. |
| [26] |
Litvin O, Tiunova A, Connell-Alberts Y, et al. What is hidden in the pannexin treasure trove: the sneak peek and the guesswork[J]. J Cell Mol Med, 2006, 10(3): 613-34. |
| [27] |
Xie CR, Sun HG, Wang FQ, et al. Integrated analysis of gene expression and DNA methylation changes induced by hepatocyte growth factor in human hepatocytes[J]. Mol Med Rep, 2015, 12(3): 4250-8. DOI:10.3892/mmr.2015.3974 |
| [28] |
Graham SV, Jiang JX, Mesnil M. Connexins and pannexins: important players in tumorigenesis, metastasis and potential therapeutics[J]. Int J Mol Sci, 2018, 19(6): E1645. DOI:10.3390/ijms19061645 |
| [29] |
Ishikawa M, Iwamoto T, Nakamura T, et al. Pannexin 3 functions as an ER Ca(2 +) channel, hemichannel, and gap junction to promote osteoblast differentiation[J]. J Cell Biol, 2011, 193(7): 1257-74. DOI:10.1083/jcb.201101050 |
| [30] |
Penuela S, Bhalla R, Nag K, et al. Glycosylation regulates pannexin intermixing and cellular localization[J]. Mol Biol Cell, 2009, 20(20): 4313-23. DOI:10.1091/mbc.e09-01-0067 |
| [31] |
Giorgi C, Bonora M, Sorrentino G, et al. P53 at the endoplasmic Reticulum regulates apoptosis in a Ca2+-dependent manner[J]. Proc Natl Acad Sci USA, 2015, 112(6): 1779-84. DOI:10.1073/pnas.1410723112 |
| [32] |
Giorgi C, Bonora M, Missiroli S, et al. Intravital imaging reveals p53-dependent cancer cell death induced by phototherapy via calcium signaling[J]. Oncotarget, 2015, 6(3): 1435-45. DOI:10.18632/oncotarget.2935 |
| [33] |
Boyd-Tressler A, Penuela S, Laird DW, et al. Chemotherapeutic drugs induce ATP release via caspase-gated pannexin-1 channels and a caspase/pannexin-1-independent mechanism[J]. J Biol Chem, 2014, 289(39): 27246-63. DOI:10.1074/jbc.M114.590240 |
| [34] |
Boyd-Tressler AM, Lane GS, Dubyak GR. Up-regulated ectonucleotidases in fas-associated death domain protein- and receptorinteracting protein kinase 1-deficient jurkat leukemia cells counteract extracellular ATP/AMP accumulation via pannexin-1 channels during chemotherapeutic drug-induced apoptosis[J]. Mol Pharmacol, 2017, 92(1): 30-47. DOI:10.1124/mol.116.104000 |
 2020, Vol. 40
2020, Vol. 40

