2. 中国医学科学院北京协和医学院生物医学工程所,天津 300192;
3. 南京中医药大学,江苏 南京 200019
2. Institute of Biomedical Engineering, Peking Union Medical College, Chinese Academy of Medical Sciences, Tianjin 300192, China;
3. Nanjing University of Chinese Medicine, Nanjing 200019, China
新近爆发的新型冠状病毒肺炎(COVID-19)是一种由新型冠状病毒感染引起的急性呼吸道传染病疫[1],以其传染性强、传播速度快、途径广(可通过飞沫、气溶胶等途径)[2]、潜伏期长、各类人群普遍易感等特点引起了全世界的恐慌和关注[3],对人类生命健康、经济发展和社会稳定带来巨大的负面影响[4]。目前尚无有效针对性的治疗药物,主要是患者临床症状进行对症支持治疗[5-6]。如何形成快速有效的针对COVID-19临床救治方案,以服务于全世界人类身体健康,是当前面临的重大问题和挑战[7]。
临床研究方面,COVID-19患者常伴有高血压等心血管疾病,其临床表现为发烧、咳嗽和呼吸困难等症状[8],其血液学特征出现白蛋白水平和淋巴细胞下降,C反应蛋白、乳酸脱氢酶LDH等水平升高[9],综合表明患者免疫功能和凝血功能受影响[10],与SARS、流感等呼吸系统病毒性感染有较大的关联,属于中医学瘟疫的范畴[11]。中医药以其“治未病”的早期干预、整体调节治疗作用对防控突发瘟疫类流行性传染病具有明显优势[12]。具体而言,中医在减轻瘟疫发热症状、控制病情发展恶化、减少激素用量、缓解临床并发症等方面起着关键作用[13]。COVID-19涉及到病毒感染和免疫系统,各地在系统总结古代抗瘟疫经验基础上,制订出多种中西医协同治疗方案,在轻症、普通型患者的症状改善效果显著,而对于重症或者危重症肺炎患者,中医药协同治疗亦可以提高疗效[14]。
在具体应用中,中药具有减少新型冠状病毒进入体内正常细胞、减少其炎症风暴,达到改善患者临床症状、增强机体的抵抗力、抑制肺部炎症感染和调节肠道菌群平衡等具有较好的作用。中医治则为“清热解毒、疏风透表、益气养阴”,在温病学说指导下,拟定了透解祛瘟颗粒(曾用名“肺炎1号方”,TJQW),该方由山慈菇、连翘、柴胡等16味中药材组成,经过临床观察效果显著,患者体温恢复正常,大部分患者的咳嗽症状、咽痛症状、乏力症状消失[15]。为深入研究TJQW组方治疗COVID-19药效物质基础,为后续先导物发现和优化提供参考,本文综合运用网络药理学和虚拟筛选等相关工具手段,在系统层面上研究TJQW组方-疾病核心靶点-信号通路间关系,为该方临床应用及相关药物开发提供启示。
1 材料和方法 1.1 TJQW活性成分筛选与优化分别选择中药系统药理学(TCMSP,http://tcmspw.com/TCMSP.php)、中药百科(http://www.nrc.ac.cn:9090/ETCM)、中医药整合数据库(TCMID,http://www.megabionet.org/TCMID/)、中药化学数据库(http://www.chemtcm.com)和台湾中药数据库(http://TCM.cmu.edu.tw/index.php)等5个在线数据库,从中搜集山慈菇、连翘、柴胡等16种中药材生物活性成分,以及上述中药材LC-MS相关数据资料,通过上述数据库检索,结合现有文献数据挖掘和收集,建立TJQW组方小分子数据库。
对构建的组方小分子数据库以口服生物利用度(OB)和类药性(DL)作为指标进行筛选,其阈值设定为OB≥30%,DL≥0.18,构建TJQW组方活性成分数据库。此外,通过现有文献数据,搜寻现有具有抗COVID-19阳性药物信息(表 1)。
| 表 1 治疗COVID-19的药物信息 Tab.1 Drugs against COVID-19 listed at DrugBank website |
接下来,选择Schrodinger平台canvas模块,对上述分别构建的组方小分子、筛选后的活性成分以及阳性药物的化学描述符进行计算,并对各组间分子的描述符进行主成分分析比较,以比较评价上述化合物数据库间在化学信息学方面的类药性特征。
1.2 TJQW筛选成分-靶标网络构建和分析分别利用PharmMapper(http://www.lilab-ecust.cn/pharmmapper)、DrugBank(https://www.drugbank.ca)和SwissTargetPrediction(http://www.swisstargetprediction.ch/)数据库,预测经OB和DL筛选后的TJQW活性成分-药物潜在靶点。接下来,选用Cytoscape 3.7.2构建化合物-蛋白宏观互作网络效应图,从整体水平上解析TJQW治疗疾病的分子机制,以考察中药组方与COVID-19疾病的关联度。其中化合物及相关的疾病靶标用作应答值,其中结点表示成分或者靶点蛋白,边表示成分与靶标的相互作用。选取网络度和介数两个关键的拓扑参数, 借助Network Analyzer插件互作网络图进行拓扑学分析, 综合反映TJQW筛选成分及对应疾病靶标的药理学价值,为系统了解该组方的药效物质基础奠定基础。
1.3 活性成分-阳性药物-疾病潜在靶点预测及蛋白相互作用网络采用上述活性成分靶点预测方法,以表 1所述7个阳性药物为训练集,预测TJQW组方活性成分-阳性药物潜在靶点。此外,还通过OMIM(https://omim.org/)、Genecards(https://www.genecards.org/)和DisGeNET数据库(https://www.disgenet.org/)对COVID-19疾病涉及到的基因和靶点进行了解析。将疾病网络的致病基因定位于活性成分-阳性药物潜在靶标网络中,最后即得针对COVID-19致病基因的活性成分-阳性药物-疾病三者交联的核心疾病靶标。
1.4 核心疾病靶标生物过程与通路富集分析为系统了解针对COVID-19致病基因的活性成分-阳性药物-疾病三者交联的核心疾病靶标基因的功能以及在疾病信号通路中的作用,选用Funrich(http://www.funrich.org/)和David(https://david.ncifcrf.gov/home.jsp)平台,对核心靶标进行GO和KEGG通路分析,物种限制为人源物种,以P作为筛选指标(P≤0.01),得到核心靶点参与的关键生物过程与通路信息,最终选用Cluego插件进行可视化呈现。
1.5 活性成分-核心疾病靶标虚拟筛选及网络分析为了筛选及验证TJQW筛选组分与COVID-19疾病网络核心靶点群之间相互作用的关系, 利用虚拟筛选平台Maestro,对每个活性分子与预测靶标进行受体-配体对接模拟。具体而言,首先对活性成分-核心疾病靶标分别进行前处理优化包括构象、能量及空间结构前处理优化,其次以蛋白自带配体或活性氨基酸残基生成活性结合位点,最后将优化好的活性成分分别与活性位点进行诱导-契合式柔性空间结构虚拟筛选。虚拟筛选筛选结束后,根据打分函数的评价, 对TJQW活性分子与COVID-19疾病核心靶标互作的强弱依次进行排序。若打分函数低于阈值, 即判定为活性成分-核心疾病靶标之间可形成较强的相互作用。并选用Cytoscape对活性成分-核心疾病靶标虚拟筛选结果-核心靶标信号通路三者之间进行网络可视化表征。
2 结果与分析 2.1 小分子成分数据库构建经过数据库搜寻和相关文献挖掘,分别从TJQW组方中山慈菇、连翘、柴胡、青蒿、蝉蜕、前胡、金银花、黄芩、苍术、乌梅、黄芪、太子参、茯苓、川贝母、玄参、土鳖虫等16种中药材分别检索到18、150、350、120、8、101、236、143、26、40、69、25、34、63、47、20个化合物,经ADME特性OB和DL指标筛选后,分别从上述16种中药材筛选得到3、23、11、16、0、24、23、36、2、8、8、10、13、9、0个化合物。经过去重后,组方小分子、筛选后的活性成分以及阳性药物数据库中分别有1400、159和7个化合物。
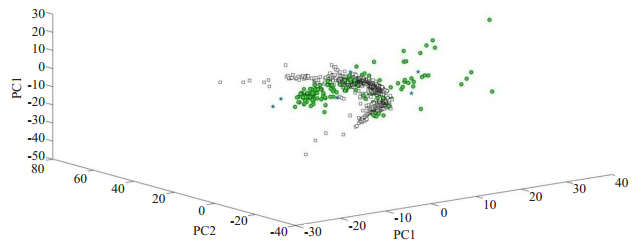
化学信息学方面共计算了270个涉及到物理化学、拓扑信息学和药代学特征方面的描述符,所得到的多维分子描述符的数值映射到三维主成分分析图上。分别构建的组方小分子、筛选后的活性成分以及阳性药物数据库化学描述符主成分分析结果详见图 1和表 2,结果显示各组间呈多样性化学空间分布,表明筛选后的TJQW组方成分无论是描述符化学空间分布还是统计值计算均与阳性药物间存在较大的差距,具有较好的结构多样性。在化学空间位置方面,筛选后的活性组分重叠性较高,提示与成分相关联疾病靶标均有相应的药效分子与其产生多种药理活性的药效作用。综上所述,筛选后TJQW活性组分具有较好类药性和结构多样性特征,为后续筛选COVID-19活性先导物提供了较好的支撑。
|
图 1 组方小分子、筛选后的活性成分以及阳性药物化学信息学比较 Fig.1 Chemical informatics comparison of all compounds, filtered compounds and positive drugs. The positive drugs, filtered compounds and all compounds were characterized by dots, pentagrams and squares. |
| 表 2 TJQW组方小分子、筛选后的活性成分以及阳性药物部分描述符比较 Tab.2 Partial molecular descriptors' Comparison of TJQW molecules, screened bioactive ingredients and positive drugs |
表格中各分子描述符统计值数据按TJQW组方小分子/筛选后的活性成分/阳性药物顺序进行展示。
2.2 TJQW筛选成分-靶标网络效应经Network Analyzer插件分析网络拓扑学发现,TJQW筛选成分-靶标网络包含416个节点,由257个靶标蛋白和159个筛选成分构成,其中平均节点度为17.30。成分-靶标网络中,枢纽节点具有较高的调控分值,调控分值越高,说明与这些节点在疾病网络中发挥了关键作用。疾病网络的416个节点中,有39个节点degree≥20,其中包括14个蛋白靶标和25个成分,在成分-疾病网络中起着关键作用。排列靠前的10个靶标蛋白分别为PTGS2、HSP90AA1、PTGS1、NCOA2、SCN5A、DPP4、AR、SERPIND1、PCP4、PRSS1,相关蛋白靶标涉及到AA网络中IL、TNF和IFN等炎症因子和抗病毒等相关信号通路,相关信号网络与COVID-19临床症状密切相关。相对应的前10个活性成分中,分别有Phillyrin(连翘)、MOL003315(连翘)、MOL007658(玄参)、173183(乌梅)、isoimperatorin(前胡)、sinpemine A(川贝母)、isoverticine(川贝母)、Korseveriline(川贝母)、5283628(茯苓)、Cerevisterol(茯苓),通过对TJQW组方分析,连翘清解疫毒、化痰散结,为君药,乌梅生津润肺,川贝母、玄参消化痰热,茯苓健脾助运,共为佐药,以上结果综合表明TJQW筛选成分与COVID-19疾病涉及的临床症状密切相关,与其临床效果相对应。
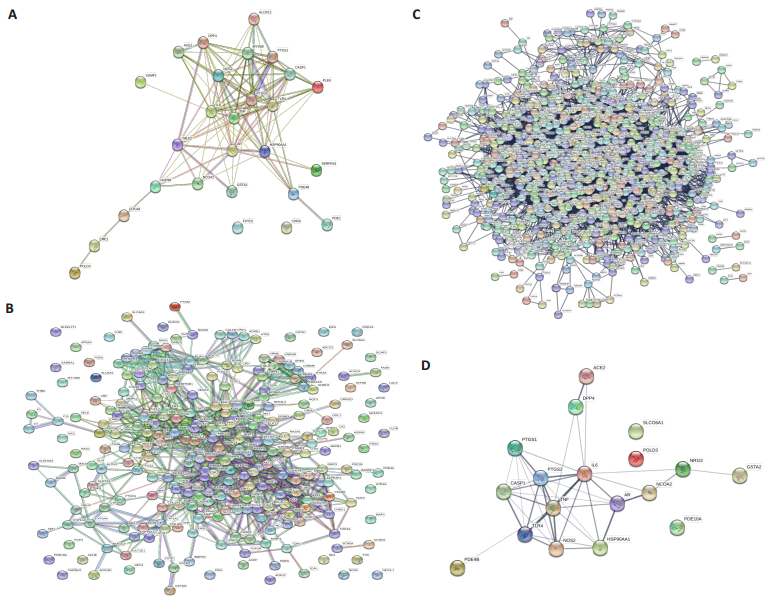
2.3 活性成分-阳性药物-疾病潜在靶点为全面考察TJQW治疗COVID-19疾病物质基础,接下来对活性成分-阳性药物-疾病三者交互的疾病核心靶标,以服务于后续的疾病核心靶标通路和虚拟筛选。通过数据库搜寻与文献数据挖掘,相关结果详见图 2。如图 2A所示,通过PharmMapper、DrugBank和Swiss TargetPrediction确定了7个阳性药物的27个蛋白靶点,如GSTA2、TNF和PDE4B等,涉及到军团菌、利什曼原虫、甲流、沙门氏菌等相关的病毒和细菌等感染以及肺结核等相关蛋白靶点,与COVID-19的临床症状有密切联系;此外,与TJQW活性组分有关的靶点有257个,涉及到MAPK、P53和NF-kappa B等相关信号通路的细胞因子通路网络炎症风暴有关联(图 2B);通过OMIM、Genecards和DisGeNET,基于COVID-19疾病网络获得了2217个疾病基因网络(图 2C)。
|
图 2 TJQW活性成分-阳性药物-疾病潜在靶点蛋白效应图 Fig.2 Potential target protein diagram predicted by the bioactive component-positive drugs-disease network. A, B, C and D stand for each targets of positive drugs, filtered compounds, disease gene and cross linking of the A-B-C, respectively. |
通过对活性成分-阳性药物-疾病三者进行相似性检索,得到了TJQW组方抗COVID-19疾病靶点网络(图 2D),共有GSTA2、TNF、NR1I2等18个靶点蛋白。通过STRING数据库,创建了靶蛋白的蛋白质-蛋白质相互作用(PPI),网络分析的边(edge)和每个靶点平均值分别为109、4900、9680、41和8.07、38.1、20.9、4.82。
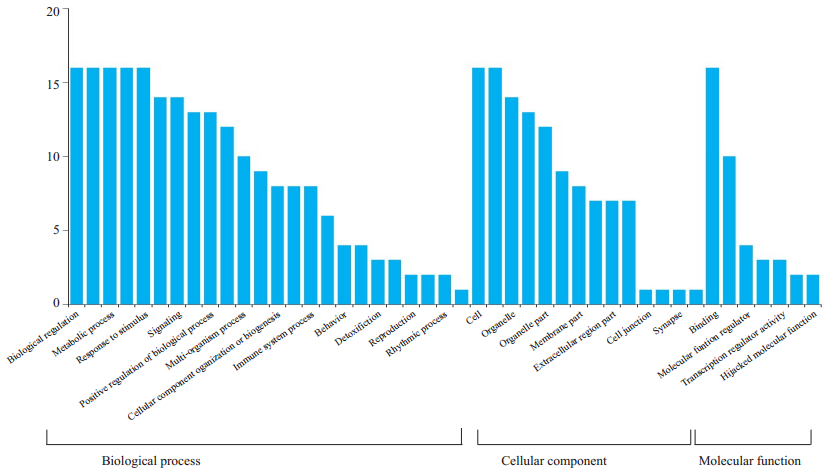
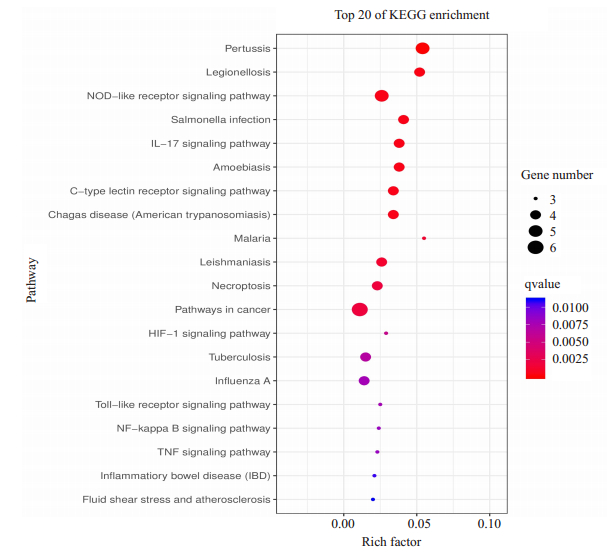
2.4 GO与KEGG通路分析利用Funrich、David数据库和Cluego插件的可视化分析,对GSTA2、TNF、NR1I2等18个抗COVID-19疾病核心靶点进行富集,筛选了靠前的GO注释结果和KEGG通路(图 3~4)。其中生物过程、细胞成分和分子功能分别获得1560、970和945条富集结果,分别占比44.89%、27.91%和27.19%,具体结果方面生物过程主要涉及生物调控、细胞过程、代谢过程、生物过程调控等,细胞成分涉及到细胞、细胞器和细胞膜等,分子功能涉及到结合、催化、分子功能调节等方面。核心靶标的KEGG通路富集得到49条,其中排名靠前的20条详见图 4,主要涉及到百日咳、军团菌病、NOD样受体信号通路、沙门氏菌感染、IL-17信号通路、阿米巴病、C型凝集素受体信号通路、恰加斯病(美国锥虫病)等信号通路,感染、免疫系统和炎症因子通路密切相关,与COVID- 19的病理机制和临床症状涉及到的病毒感染、免疫失衡和炎症因子瀑布式效应有一定的关联。
|
图 3 18个抗COVID-19疾病核心靶点富集分析结果 Fig.3 GO enrichment analysis of the 18 putative targets for COVID-19. Biological processed, cellular components and molecular functions were presented from left to right. |
|
图 4 18个抗COVID-19疾病核心靶点KEGG富集分析结果 Fig.4 KEGG enrichment analysis of the 18 putative targets for COVID-19. |
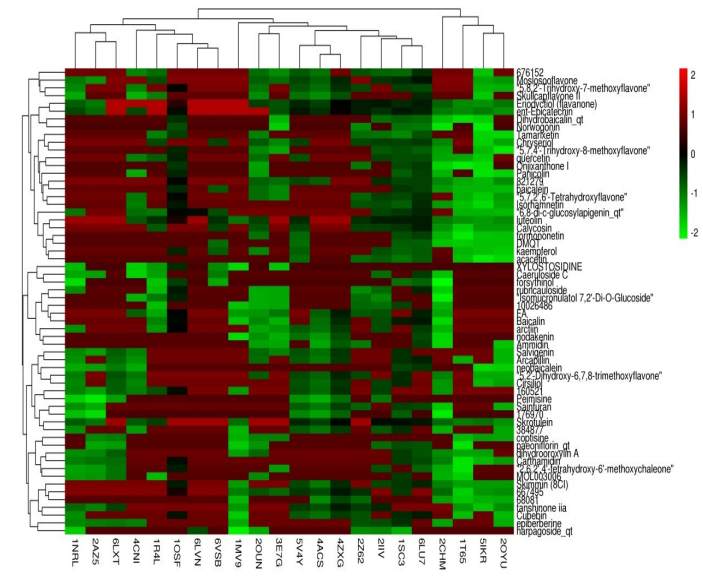
在上述筛选出的18个靶点基础上,结合新近报道的COVID-19相关蛋白结构,包括冠状病毒3CL水解酶(MPRO)、S糖蛋白等4个蛋白,作为筛选的靶点蛋白,相关蛋白的名称、Uniprot、PDB-id号、筛选阈值(蛋白自带配体-阳性药物筛选分值)等信息详见表 3。结果显示,TJQW活性成分中,每个核心疾病靶标蛋白有14个及以上化合物与其应答,与NR1I2蛋白由潜在结合效应的分子多达64个。159个组分化合物中,142(142/159, 89.3%)个化合物与1个及以上蛋白有结合效应。按照与虚拟筛选靶标蛋白有响应数进行排序,限于篇幅选择了靠前的60个活性成分以及对应的靶标蛋白绘制聚类分析热图(图 5),绝大多数的TJQW活性分子均集中作用于某些靶标蛋白, 提示这些响应应答可能是治疗COVID-19疾病的关键靶标和关键分子。
| 表 3 22种针对COVID-19疾病靶标信息和对接结果 Tab.3 Detailed information and docking results of the 22 disease target for COVID-19 |
|
图 5 前60个成分-靶点虚拟筛选结果聚类分析热图 Fig.5 Heat map of cluster analysis for the virtual screening results by the first 60 components and related targets. |
将TJQW活性成分、核心作用靶点以及前20个KEGG通路分析结果信息分别导入Cytoscape 3.6.0软件中构建“TJQW活性成分-核心靶点-疾病通路”网络,结果显示同一活性成分对应多个作用靶点,多个靶点对应同一通路的关系,体现了TJQW的多成分、多靶点的作用特点。
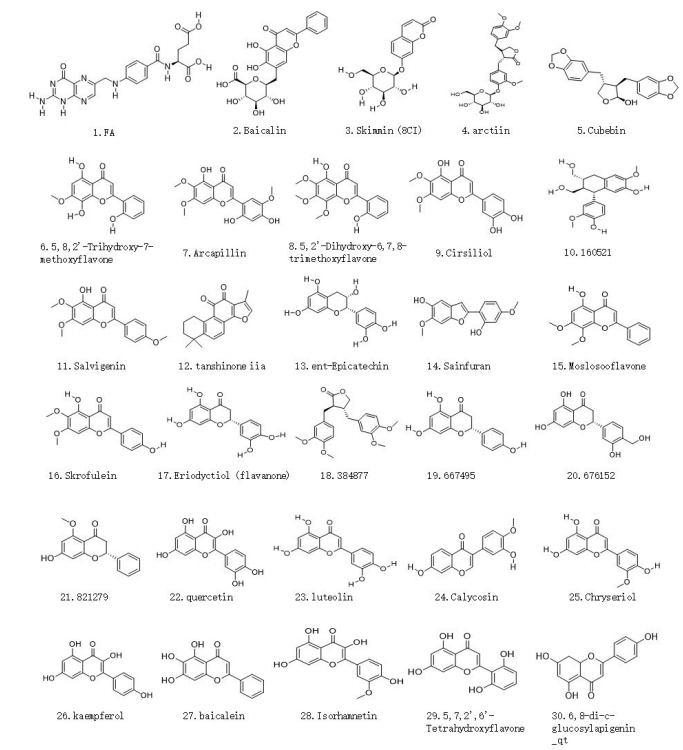
2.6 TJQW活性组分分子结构特征为了深入阐释TJQW活性组分质量COVID-19的分子机制,为后续的先导物发现和优化提供参考,选择了与筛选靶标响应排名靠前的30个化合物,并对其分子结构进行阐释(图 6,为了简述,以下描述化合物均用序号)。在来源上2、5、7、14、28来源于柴胡,1、24来源于黄芪,6、8、11、13、15、17、21、29来源于黄芩,25来源于金银花,4、10、18、22、23、26来源于连翘,3、12、20来源于前胡,16、30来源于青蒿,19来源于乌梅。在结构分类方面大部分化合物属于黄酮(如2)、醌类(如12)、生物碱(如1)、苷类(如4)和香豆素类(如)等,其中黄酮如2、6-9等最多,该类化合物具有1个(及以上)的酚羟基,羰基。所列举的前30个化合物中,均有1个及以上的苯环、羰基和高活性氧自由基(包括烷氧基、羟基或过氧化物自由基),分别为药效活性集团提供芳环中心和氢键供体(受体)以保证其与疾病靶标蛋白在三维空间构象上高度契合。高活性氧自由基及其对脂质过氧化的有效抑制,使得黄酮类化合物具有较好的类药性, 与COVID-19临床症状相关联的抗炎症因子、抗氧化、抗感染[16]等活性密切相关,以上筛选的前30个化合物可为先导物筛选和发现提供参考。
|
图 6 与疾病靶标蛋白由潜在结合作用的前30个化合物分子结构 Fig.6 Chemical structure of the top 30 compounds with potential biological interactions with COVID-19 target protein. |
相关研究显示TJQW组方内中药材在抗病毒感染、改善炎症因子瀑布效应和提升机体免疫力等方面具有较好的作用,如连翘具抗疱疹、流感等病毒[17],金银花抗病毒、抗炎、解热、促进炎症因子自噬等作用,用于治疗咽喉炎症、肺结核并呼吸道感染、肺炎等[18]。
本项目通过系统药理学,筛选出了一系列疾病靶标和活性组分,组方协同抗COVID-19疾病作用效应,多成分、多靶点、多通路协同作用于疾病核心靶标网络。基于TJQW成分作用靶点-抗COVID-19阳性药物和疾病网络交联,遴选了22个靶标作为作为COVID-19疾病的核心靶点蛋白,以及与COVID-19疾病核心靶标蛋白有潜在结合作用的前30个化合物分子,每个化合物分子均与10及以上靶点有协同抑制效应,TJQW组方中分别有5、2、8、1、6、3、2、1个化合物来源于组方中柴胡、黄芪、黄芩、金银花、连翘、前胡、青蒿和乌梅等,其中来源于青蒿的黄酮类化合物16和30分别与PDE4B等15个和CASP1等11核心靶点显示了较好的生物学作用,研究结果进一步证实了青蒿的抗病毒感染作用[19-20],除疟疾外,青蒿还可用于对炎症及免疫系统疾病治疗[21],相关研究显示青蒿素类衍生物各类红斑狼疮等炎症有效[22-23]。在结构分类方面,筛选出的前30个化合物多为黄酮类,因其结构中含芳环中心,羰基和烷氧基等氢键供体(受体),以及糖基,使得黄酮类化合物具有较好的ADME类药性,与COVID-19疾病网络核心靶点的亲和力相对较强,在炎症细胞因子通路等疾病网络中发挥重要作用[24],也是抗感染类瘟疫先导物发现的重要来源[25]。由图 5~6可得,TJQW组方主要通过黄芩苷(2)、蓟黄素(16)、槲皮素(22)、木犀草素(23)、毛蕊异黄酮(24)等30种活性成分发挥节点作用,以其相同或相似的基本骨架结构,在整体上层面上呈现出对COVID-19疾病核心靶标结合位点叠加效应,在筛选过程中显示了良好的应用前景,而相关研究证实黄酮类化合物具有广谱抗病毒抗感染效应,如槲皮素-3-半乳糖苷对抑制SARS冠状病毒3CLpro蛋白(SARS-CoV)而起到抗感染作用[26],木犀草素通过抑制NOS2、PTGS2等蛋白酶活性,而起到抗病毒、抗炎、抗氧化、抗纤维化等活性,这在一定程度上验证了本项目系统药理学筛选结果的可靠性[27]。
TJQW活性成分-核心靶点网络系统药理学筛选得到NR1I2(金圣草(黄)素等)、3CL hydrolase(MPRO,山奈酚等)、CASP1(黄芩黄酮Ⅰ等)、PDE4B(柽柳黄素等)、PDE10A(去甲汉黄芩素等)等核心靶点,表明该组方主要通过与癌症并发症、感染、免疫等有关的信号通路发挥作用。具体而言,组方活性组分山奈酚等通过作用于NOS2、PTGS2、HSP90AA1、IL6、AR、GSTA2等6个靶点组成的网络通路发挥抗癌症并发症作用[28],该通路中NOS2、PTGS2靶点与炎症有关,GSTA2蛋白与药物代谢有关,山奈酚、木犀草素、槲皮素通过协同抑制该通路的6个蛋白靶点而起到抗疾病癌症并发症效应;抗感染方面主要有木犀草素等化合物作用于百日咳、军团菌病、沙门氏菌感染等10条网络通路,上述10条抗感染通路分别由(NOS2、IL6、TLR4、CASP1、TNF)、(IL6、TLR4、CASP1、TNF)、(NOS2、IL6、TLR4、CASP1)蛋白靶点网络构成;免疫方面主要由槲皮素等组分作用于NOD样受体(HSP90AA1、IL6、TLR4[29]、CASP1、TNF)、IL-17(PTGS2、HSP90AA1、IL6、TNF)、C型凝集素受体信号通路(PTGS2、IL6、CASP1、TNF)等。上述信号通路中,IL6、TNF和CASP1等细胞炎症因子其关键作用[30],后者经合成分泌、受体表达、生物效应等作用,综合构成炎症因子效应网络[31],在炎症相关介质激活以及COVID-19引发的肺损伤中发挥着核心作用。本研究结果证实,TJQW组方中黄芩素等可抑制多种炎症细胞因子的生成,降低促炎/抗炎细胞因子水平,降低IL6、TNF等细胞因子水平,也就是说,组方活性成分通过分别激活NF-kappa B(由PTGS2、TLR4、TNF共3个靶点蛋白)和TNF(PTGS2、IL6、TNF共3个靶点蛋白)信号转导通路作用,抑制多种炎症细胞因子的生成,改善COVID-19引发肺泡壁受损、肺泡水肿等炎性渗出。
综上所述,综合运用ADME药代动力学类药性参数筛选、化学空间主成分分析、虚拟筛选模拟、网络互作模型构建等多种手段,明确了TJQW抗COVID-19疾病关键30个药效分子,以其近似的基本骨架,在整体上可以呈现出对COVID-19靶点结合位点显示了叠加效应,探索其作用的核心疾病靶标,以及相关关键生物学通路, 最终从“关键活性药效分子-疾病关键节点靶标-相关生物学通路”角度来揭示TJQW多个成分、多个靶点和多条通路机制治疗COVID-19的作用机制药效物质基础,并筛选出一系列活性先导物,黄酮类化合物起主导作用。由于中药组方防治复杂瘟疫类疾病的研究机制仍存在许多尚待解决的问题,后续需要开展相应的生物学验证实验来对实验结果进行证实,以全方面多维阐释病理机制效应。
| [1] |
卜军, 陈茂, 程晓曙, 等. 新型冠状病毒肺炎防控形势下急性心肌梗死诊治流程和路径的中国专家共识(第1版)[J]. 南方医科大学学报, 2020, 40(2): 147-51. |
| [2] |
方磊, 朱清广, 程伟, 等. 308例新型冠状病毒肺炎病例回顾性分析及抗疫强身功运动处方的临床应用方案[J]. 上海中医药杂志, 2020, 54(5): 40-5. |
| [3] |
赵序茅, 李欣海, 聂常虹. 基于大数据回溯新冠肺炎的扩散趋势及中国对疫情的控制研究[J]. 中国科学院院刊, 2020, 35(3): 248-55. |
| [4] |
傅晓彬, 李杰生, 黄洲, 等. 蒲公英果实征: 9例新型冠状病毒肺炎的CT征象[J]. 南方医科大学学报, 2020, 40(2): 159-63. |
| [5] |
周烨真, 张世豪, 陈嘉仪, 等. 新型冠状病毒SARS-CoV-2的变异和进化分析[J]. 南方医科大学学报, 2020, 40(2): 152-8. |
| [6] |
袁蓉, 信琪琪, 唐仕欢, 等. 中医整体观指导下的COVID-19治疗——同时着眼于病毒和宿主的疗法[J]. 中国中药杂志, 2020, 45(7): 1521-5. |
| [7] |
杨明炜, 陈锋, 朱定俊, 等. 苦参碱氯化钠注射液治疗40例新型冠状病毒肺炎的临床疗效分析[J]. 中国中药杂志, 2020, 45(10): 2221-31. |
| [8] |
Li JO, Lam DSC, Chen YX, et al. Novel Coronavirus disease 2019 (COVID-19): The importance of recognising possible early ocular manifestation and using protective eyewear[J]. Br J Ophthalmol, 2020, 104(3): 297-8. |
| [9] |
山东大学齐鲁医院新型冠状病毒肺炎防控工作组. 山东大学齐鲁医院新型冠状病毒肺炎防控策略与实践[J]. 山东大学学报:医学版, 2020, 58(3): 8-18. |
| [10] |
范永升, 谢冠群. 从中医疫病探讨新型冠状病毒肺炎的防治[J]. 浙江中医药大学学报, 2020, 44(4): 313-5, 323. |
| [11] |
柴光军, 索继江, 刘运喜, 等. 新型冠状病毒肺炎暴发疫情流行病学调查经验初探[J]. 中华医院感染学杂志, 2020(8): 1147-51. |
| [12] |
魏士雄, 王平. 从新型冠状病毒肺炎疫情中探讨中医药的一定优势和价值[J]. 陕西中医, 2020, 41(3): 287-9. |
| [13] |
古敏, 刘娇, 史楠楠, 等. 中医药分期防治新型冠状病毒肺炎的药性功效分析中医药分期防治新型冠状病毒肺炎的药性功效分析[J]. 中国中药杂志, 2020, 45(6): 1253-8. |
| [14] |
王辉, 金鑫瑶, 庞博, 等. 中医药干预新型冠状病毒肺炎临床研究方案分析[J]. 中国中药杂志, 2020, 45(6): 1232-41. |
| [15] |
傅晓霞, 林路平, 谭行华. 透解祛瘟颗粒治疗新型冠状病毒肺炎2例病例报告[J]. 暨南大学学报:自然科学与医学版, 2020, 41(2): 151-6. |
| [16] |
吴秀文, 任建安. 中国实用外科杂志, 2020, 40, 等.连翘酯苷A对IBV感染细胞内受体和抗病毒基因表达的影响[J]. 北京农学院学报, 2017, 31(1): 37-42. |
| [17] |
张彤, 刘蓓桦, 杨晓炼, 等. 连翘酯苷A对IBV感染细胞内受体和抗病毒基因表达的影响[J]. 北京农学院学报, 2017, 32(1): 37-42. |
| [18] |
米慧娟, 王永香, 孟瑾, 等. 基于偏最小二乘法对金银花抗流感病毒谱-效相关性模型的探讨[J]. 中国中药杂志, 2015, 40(23): 4650-4. |
| [19] |
陈剑涛, 熊思艺, 林子峰, 等. 青蒿琥酯对猴免疫缺陷病毒感染中国恒河猴模型T淋巴细胞活化的调节作用[J]. 中医学报, 2017, 32(11): 2029-34. |
| [20] |
张军峰, 谭健, 蒲蔷, 等. 青蒿提取物抗单纯疱疹病毒活性研究[J]. 天然产物研究与开发, 2003, 15(2): 104-8. |
| [21] |
桂建雄, 曹蕾, 王斌, 等. 青蒿素衍生物SM934抑制TLR7/9信号通路对系统性红斑狼疮小鼠B细胞的影响研究[J]. 中国临床药理学杂志, 2019, 35(19): 2343-6. |
| [22] |
常杰, 李忱, 张文. 青蒿、青蒿素及其衍生物治疗系统性红斑狼疮研究现状[J]. 中国中西医结合杂志, 2019, 39(3): 377-80. |
| [23] |
蒋炳丽.白杨素衍生物的设计合成及其在血浆中促凝/抗凝活性研究[D].南宁: 广西大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10593-1017230734.htm
|
| [24] |
黄海. GM-CSF抗流感病毒机制及恩替卡韦黄芩苷组合物抗乙肝病毒药效研究[D].上海: 复旦大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10246-1015422896.htm
|
| [25] |
邱家章.黄芩苷抗金黄色葡萄球菌α-溶血素作用靶位的确证[D].长春: 吉林大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10183-1012365826.htm
|
| [26] |
Chen LL, Li J, Luo C, et al. Binding interaction of quercetin-3-betagalactoside and its synthetic derivatives with SARS-CoV3 CL(pro): structure-activity relationship studies reveal salient pharmacophore features[J]. Bioorg Med Chem, 2006, 14(24): 8295-306. |
| [27] |
Hu C, Kitts DD. Luteolin and luteolin-7-O-glucoside from dandelion flower suppress iNOS and COX-2 in RAW264.7 cells[J]. Mol Cell Biochem, 2004, 265(1/2): 107-13. |
| [28] |
Landi S, Gemignani F, Bottari F, et al. Polymorphisms within inflammatory genes and colorectal cancer[J]. J Negat Results Biomed, 2006, 5: 15. |
| [29] |
谭继翔, 何进, 秦文熠, 等. 槲皮素通过抑制TLR4/NF-κB通路缓解脂多糖诱导的急性肾损伤[J]. 南方医科大学学报, 2019, 39(5): 598-602. |
| [30] |
李霜.脓毒症的细胞生物治疗新机制—间充质干细胞抑制巨噬细胞炎症复合体3的激活[D].西安: 第四军医大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-90032-1015961536.htm
|
| [31] |
张莹.活血解毒中药配伍抗血小板及炎症反应的研究[D].北京: 北京中医药大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10026-1016069893.htm
|
 2020, Vol. 40
2020, Vol. 40

