瓜蒌为葫芦科植物栝楼或双边栝楼的成熟果实[1],含3, 29-二苯甲酰基栝楼仁三醇(3, 29-DK)等专属化学成分,且《中国药典》(2015版)以3, 29-DK为瓜蒌的含量评价指标成分[2]。汉代名医张仲景所著的《金匮要略》中以瓜蒌作为治疗胸痹症[3-5]的君药。现代研究表明,瓜蒌在改善心血管系统疾病方面疗效确切,刘颁等[6]研究瓜蒌皮注射液联合阿司匹林能显著降低高龄不稳定型心绞痛患者的血小板最大聚集率,疗效及预后都优于单一药物,且不良反应少;王洪白等[7]发现瓜蒌薤白白酒汤治疗胸痹心痛具有良好的疗效,可以理气宽胸、通阳散结,解除患者胸痛、心悸、气短等症状;郭玉洪等[8]研究发现瓜蒌皮在治疗缺血性脑卒中、改善经皮冠状动脉介入治疗术后患者生活质量和治疗心绞痛、心肌梗死及心力衰竭等方面疗效显著。但目前瓜蒌用于临床的剂型有汤剂与注射剂,存在用药不便,患者依从性[9]差等问题,为此课题组前期研制了瓜蒌缓释微丸[10],以达到减少用药频次,便于患者使用的目的。为此,为进一步研究瓜蒌缓释微丸的体内释放特性,本研究采用LC-MS/MS法对自制的瓜蒌缓释微丸在大鼠体内的药代动力学[11-17]进行研究,测定大鼠给药后不同时间点血浆中3, 29-DK的含量,考察瓜蒌缓释微丸的药动学特征,为瓜蒌缓释微丸的新剂型奠定基础,保证其有效性与安全性[18]。
1 实验材料和方法 1.1 试剂3, 29-DK(成都普菲德生物技术有限公司,纯度≥98%,批号:20150303);路路通酸(成都普菲德生物技术有限公司,纯度≥98%,批号:20160119);瓜蒌缓释微丸(0.8 g/g,每0.8 g瓜蒌缓释微丸相当于瓜蒌原材料1 g,皖南医学院药学院药物制剂及其质量控制课题组;批号:20190620~20190630);瓜蒌提取物(2 g/g,每1 g瓜蒌提取物相当于原药材2 g,皖南医学院药学院药物制剂及其质量控制课题组;批号:20190610);乙醚(无锡市亚盛化工有限公司,批号:20180323);甲酸(天津市化学试剂三厂,批号:20160820);乙酸乙酯(天津市福晨化学试剂厂,批号:20140107);氨水(天津市福晨化学试剂厂,批号:20130422);甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。
1.2 仪器液质联用仪(Agilent Technologies 1260 Infinity液相色谱仪,6460 Triple Quad LC/MS,MassHunter工作站,日本岛津公司);岛津AUW 220 D分析天平(日本岛津公司);JW-3021 HR高速冷冻离心机(安徽省嘉文仪器装备有限公司);DW-86 L 626型海尔立式超低温保存箱(青岛海尔特种仪器有限公司);数显恒温水浴锅(HH系列)(江苏金坛医疗仪器厂);FS-1型可调高速匀浆机(江苏金坛国胜实验仪器厂)。
1.3 实验动物SPF级雄性SD大鼠,无特定病原体,体质量200~ 250 g,常州卡文斯实验动物有限公司,生产许可证号:SCXK(苏)2016-0010。大鼠生存环境温度为25±2 ℃,湿度为(50±10)%,12 h/d光照12 h,正常进食与饮水,适应性饲养1周。
1.4 色谱质谱条件 1.4.1 色谱条件色谱柱:Phenomenex液相色谱柱Kinetex 2.6 uXB-C 18 100A(50×4.60 mm,2.6 μm);流动相:甲醇(93%)-0.1%甲酸水溶液(7%);流速:0.5 mL/min;柱温:35 ℃,进样量:5 μL。
1.4.2 质谱条件[19]离子源为安捷伦喷射流技术的电喷雾(AJS ESI离子源);正离子检测模式;干燥气为氮气;干燥温度为350 ℃;干燥气流量为10 L/min;雾化器压力为40 psi;毛细管电压为4000 V;多重反应检测模式(MRM),其中3, 29-DK:m/z为689.3→567.2,碰撞电压为90 V,碰撞能量为45 eV;内标物质路路通酸:m/z为477.2→209.0,碰撞电压为120 V,碰撞能量为35 eV,采集时间均为6 min。相关质谱图见图 1。
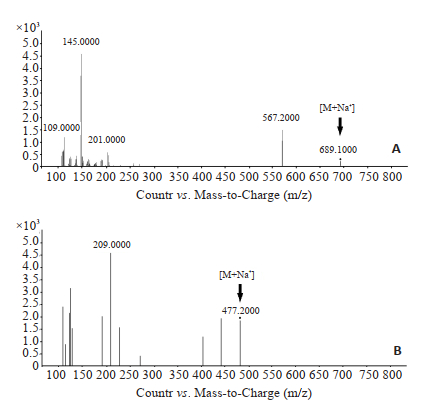
|
图 1 检测物质的色谱图 Fig.1 Chromatogram of the test substances of 3, 29-DK (A) and liquid ambronic acid (B). |
取3, 29-DK对照品适量,精密称定,至棕色量瓶中,用甲醇溶解并定容至刻度,制备浓度为1 μg/mL的储备液。用甲醇将上述储备液分别稀释至浓度为0.5、1、2、4、8、16、32 ng/mL的3, 29-DK对照品溶液,备用。
1.5.2 内标路路通酸溶液的制备取路路通酸对照品适量,精密称定,用甲醇溶解并定容至刻度,制备浓度为100 ng/mL的内标溶液,备用。
1.6 标准血浆样品与质控样品的制备取“1.5.1”项下浓度为0.5、1、2、4、8、16、32 ng/mL的3, 29-DK对照品溶液200 μL,挥干,再分别精密吸取大鼠空白血浆200 μL,按“1.7”项下方法制备成浓度为0.5、1、2、4、8、16、32 ng/mL的标准血浆样品,备用。
另取“1.5.1”项下浓度为1、8、32 ng/mL的3, 29-DK对照品溶液200 μL,挥干,再分别精密吸取大鼠空白血浆200 μL,按“1.7”项下方法制备成浓度为1、8、32 ng/mL各6份的质控样品,备用。
1.7 血浆样品处理精密吸取血浆样品200 μL,加入内标物质路路通酸溶液200 μL,加入乙酸乙酯2 mL,涡旋3 min,离心。吸取上清液,37 ℃挥干。加入甲醇100 μL复溶,涡旋30 s,离心。吸取上清液,置于进样瓶中,备用。
1.8 方法学验证 1.8.1 专属性试验取空白血浆、3, 29-DK标准血浆样品、瓜蒌缓释微丸给药1 h的血浆样品及瓜蒌提取物给药1 h的血浆样品,按“1.7”与“1.4”项下方法处理血浆样品并进行测定,得到对应的HPLC图,确定血浆中内源性物质及瓜蒌缓释微丸、瓜蒌提取物中其他组分对3, 29-DK的干扰情况。
1.8.2 标准曲线的制备、定量限的确定取“1.6”项下系列标准血浆样品,按“1.7”与“1.4”项下方法处理血浆样品并进行测定,以3, 29-DK浓度(X,ng/mL)为横坐标,以3, 29-DK与路路通酸的峰面积比值为纵坐标(Y),用加权法运算,进行线性回归分析。
1.8.3 精密度与准确度取“1.6”项下制备的的血浆质控样品各6份,按“1.7”与“1.4”项下方法处理血浆样品并进行测定,1次/d,连续平行测定3 d。记录日内、日间精密度RSD值及准确度RE值[20]。
1.8.4 回收率与基质效应取“1.6”项下血浆质控样品各6份,按“1.7”与“1.4”项下方法处理血浆样品并进行测定,计算3, 29-DK的峰面积为A;取大鼠空白血浆18份,按“1.7”项下方法处理血浆,取上清液,加入浓度为1、8、32 ng/mL对照品溶液复溶,进样分析测定,得峰面积B;计算提取回收率/%=A/B×100%。另取溶剂200 μL代替空白血浆,按“1.7”项下方法处理,挥干后,加入浓度为1、8、32 ng/mL对照品溶液复溶,进样分析测定,记录峰面积C。计算内标归一化的基质因子/%=B/C×100%[21-23]。
1.8.5 稳定性取“1.6”项下浓度为2、8、32 ng/mL标准血浆样品各18份,分为3批,分别考察血浆样品在室温放置24 h、-20 ℃反复冻融3次、-80 ℃冷冻保存30 d的稳定性,按“1.7”与“1.4”项下方法处理血浆样品并进行测定,记录3, 29-DK的峰面积,计算RSD值。
1.9 药代动力学研究12只SD雄性大鼠随机分为2组,分为瓜蒌缓释微丸组、瓜蒌提取物组。大鼠给药前禁食12 h,自由饮水,给药后4 h统一进食。瓜蒌缓释微丸组的剂量为1.26 g/kg;瓜蒌提取物组的剂量为0.79 g/kg(ChP2015,成人1 d服用瓜蒌药材剂量为15 g,按成人60 kg计,大鼠的等效剂量为(15 g/60 kg)*6.3=1.58 g/kg。另:瓜蒌片(批准文号:国药准字Z31020173)口服,4片/次,3次/d,每片含干浸膏0.26 g,每克干浸膏相当于10 g瓜蒌,故该片剂1 d服用剂量相当于瓜蒌药材31.2 g。综合瓜蒌药材及瓜蒌片的人给药剂量,瓜蒌缓释微丸组、瓜蒌提取物组的给药剂量相当人的等效剂量)。瓜蒌缓释微丸组在给药后第1、2、4、6、8、10、12、18、24、36、48 h眼眶取血500 μL;瓜蒌提取物组在给药后第15、30、45、60、90、120、180、240、300 min眼眶取血500 μL。每次取血后,大鼠灌以相同体积的生理盐水补充体液。按“1.7”与“1.4”项下方法测定各时间点的瓜蒌缓释微丸组与瓜蒌提取物组组血浆样品中3, 29-DK的浓度,绘制药-时曲线图。采用DAS 2.0软件对瓜蒌缓释微丸组、瓜蒌提取物组数据进行拟合分析,通过非房室方法计算平均血药浓度数据得出药代动力学主要参考统计距参数。
1.10 统计学分析本实验数据均以均数±标准差表示,SPSS 26.0软件处理分析,采用单因素方差分析组间数据,独立样本t检验分析两组数据,P < 0.05表示差异有统计学意义。
2 结果 2.1 方法学评价 2.1.1 专属性大鼠血浆中内源性物质及瓜蒌缓释微丸中其他组分不干扰测定[24],基线噪音小,说明该方法专属性良好(图 2)。
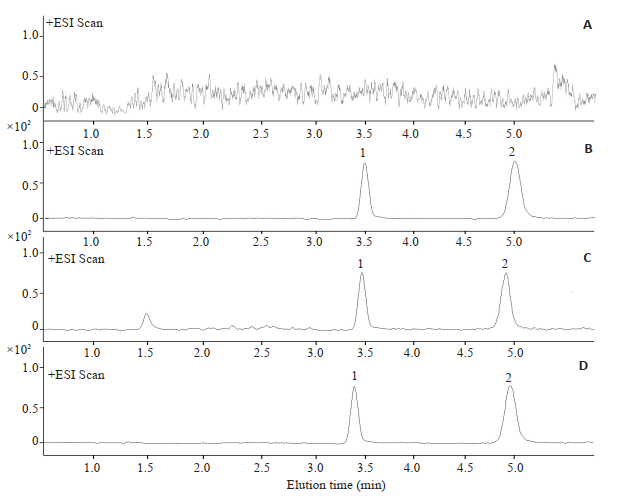
|
图 2 瓜蒌中3, 29-DK的LC-MS/MS分析图 Fig.2 LC-MS/MS analysis of 3, 29-DK in trichosanthes (A: Blank plasma; B: 3, 29-DK standard plasma sample; C: Plasma samples of Trichosanthes sustained-release pellets for 1 h; D: Plasma samples of Trichosanthes extract for 1 h) 1 is betulonicacid; 2 is 3, 29-DK. |
线性回归方程为Y=0.020X+ 0.041(权重系数为W=1/C),r=0.9990,3, 29-DK浓度在0.5 ng/mL~32 ng/mL范围内线性关系良好,定量限为0.5 ng/mL(S/N > 10)。
2.1.3 精密度与准确度低、中、高浓度生物质控样品精密度与准确度良好,符合生物样品分析要求(表 1)。
| 表 1 3, 29-DK的精密度与准确度 Tab.1 recision and accuracy of 3, 29-DK (Mean±SD, n=6) |
低、中、高浓度生物质控样品回收率良好,未见内源性物质干扰3, 29-DK的检测,符合生物样品分析要求(表 2)。
| 表 2 3, 29-DK的回收率与基质效应 Tab.2 Recovery and matrix effect of 3, 29-DK (Mean±SD, n=6) |
低、中、高浓度生物质控样品在各条件下稳定性良好,符合生物样品分析要求(表 3)。
| 表 3 3, 29-DK的稳定性 Tab.3 Stability of 3, 29-DK (n=6) |
与瓜蒌提取物组相比,瓜蒌缓释微丸组在大鼠体内滞留时间MRT(0-t)为(15.51±0.40)h,明显延长,且差异具有统计学意义(P < 0.05);药时曲线下面积AUC(0-t)为(172.12±8.12)μg/L·h,提高约11倍,差异具有统计学意义(P < 0.01);半衰期t1/2及达峰时间Tmax显著延长(P < 0.01),最大浓度Cmax明显降低(P < 0.05,图 3、表 4)。
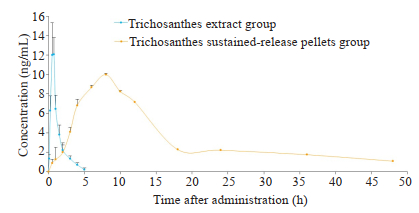
|
图 3 瓜蒌缓释微丸组和瓜蒌提取物组3, 29-DK的平均血药浓度-时间曲线 Fig.3 The mean blood concentration time curve of 3, 29-DK in Trichosanthes sustained-release pellets group and Trichosanthes extract group (n=6). |
| 表 4 3, 29-DK在大鼠体内的药代动力学参数比较 Tab.4 Comparison of pharmacokinetic parameters of 3, 29-DK in rats (Mean±SD, n=6) |
3, 29-DK为瓜蒌中的专属性成分,在瓜蒌药材及制剂中性质稳定,《中国药典》(2015年版)及有关文献[25-27]均以3, 29-DK为药材质量评价或相关研究的定量测定指标。实验依靠LC-MS/MS法高灵敏性、操作方法简单、检测迅速等特点[28-30],线性范围良好,方法学验证符合要求,结合结果说明了该方法适用于瓜蒌缓释微丸中3, 29-DK在大鼠体内的药代动力学研究。
流动相中加入甲酸,营造一个微弱的酸性条件,有助于离子化,利于分离目标峰[31-32],最后流动相比例调整为甲醇(93%)-0.1%甲酸水溶液(7%);路路通酸的保留时间为3.34 min,3, 29-DK保留时间为4.97 min。
实验考察了乙腈与乙酸乙酯提取溶剂,通过综合比较杂质的干扰与提取回收率[33],发现乙酸乙酯沉淀蛋白的效果最好。且在碱性条件下,血浆中的内源性物质不干扰3, 29-DK的含量测定。
研究结果表明大鼠在单次灌胃给药后,瓜蒌缓释微丸中3, 29-DK在7.67±0.82 h出现达峰浓度,最大浓度Cmax为9.96±0.69 ng/mL,消除半衰期t1/2为12.21±2.37 h,瓜蒌提取物中3, 29-DK在0.63±0.14 h出现达峰浓度,最大浓度Cmax为13.31 ± 0.89 ng/mL,消除半衰期t1/2为0.91±0.30 h,说明瓜蒌缓释微丸在健康SD大鼠体内的血药浓度较为稳定,吸收缓慢,从而达到缓释效果。本研究为瓜蒌缓释微丸临床前药代动力学研究提供理论依据。
瓜蒌缓释微丸组与瓜蒌提取物组的3, 29-DK终末半衰期理论上是相同或相似的,但图 3结果显示有明显差异。分析得出瓜蒌缓释微丸组消除相回归直线Y1= -0.1798X1+9.7005,r=0.9992;瓜蒌提取物组消除相回归直线Y2=-0.6457X2+2.2717,r=0.9997。瓜蒌提取物组消除快,间接体现了瓜蒌缓释微丸组增加了3, 29-DK在体内的滞留时间长,取样时间相同,两组达到的吸收程度与消除程度不同,释放慢的缓释微丸组末端直线斜率会有较大误差;取样结束时间相同,直线斜率的差异影响半衰期值的大小,从而导致终末半衰期不相同。
本实验中瓜蒌缓释微丸的生物利用度明显提高,可能有以下几个原因(主要由药时曲线下面积AUC、最大峰浓度Cmax、达峰浓度时间Tmax三个数据体现):(1)由瓜蒌缓释微丸组与瓜蒌提取物组的最大峰浓度相比,说明瓜蒌缓释微丸释药较为完全;(2)瓜蒌缓释微丸组达峰时间明显延迟,说明通过缓释制剂手段控制药物释放,使吸收代替分布;(3)胃肠道生理因素(胃排空):瓜蒌提取物溶液在胃部迅速吸收;瓜蒌缓释微丸在胃部、十二指肠吸收,且瓜蒌缓释微丸体积小,质量大,说明微丸较轻,比表面积大,在胃内容物上方,在吸收部位停留时间长,胃排空时间长,即滞留时间长,丰富的肠道绒毛毛细血管可充分缓慢吸收3, 29-DK;(4)制剂因素:瓜蒌缓释微丸中的辅料可使3, 29-DK的血浆蛋白结合率提高,使3, 29-DK在大鼠体内消除慢,作用维持时间长,药效平稳。而单一的瓜蒌提取物溶液与血浆蛋白结合率低,体内消除快,同时作用时间短。
由实验结果可知,与瓜蒌提取物相比较,初步确定了瓜蒌缓释微丸在体内具有缓释效果,延长生物半衰期。由于本实验只考察了生物等效剂量下的瓜蒌缓释微丸在大鼠体内的药代动力学研究,该剂量是否使疗效-剂量最佳化,提高患者依从性,需进行多剂量组药代动力学及药效学考察来确定[34-35]。
| [1] |
万丽娟, 卢金清, 许俊洁, 等. 瓜蒌子化学成分和药理作用的研究进展[J]. 中国药房, 2015, 26(31): 4440-3. |
| [2] |
国家药典委员会.中华人民共和国药典第一部[S].北京: 中国医药科技出版社, 2015: 112.
|
| [3] |
许伟明, 胡镜清, 江丽杰. 《金匮要略》瓜蒌薤白三方治胸痹原意探析[J]. 中华中医药杂志, 2017, 32(5): 2288-90. |
| [4] |
张悦晨, 谭舒, 朱文艳, 等. 瓜蒌在心血管疾病应用的研究进展[J]. 世界最新医学信息文摘, 2019, 19(52): 47-8. |
| [5] |
梁伟, 何家振, 韩林涛, 等. 瓜蒌-薤白"药对治疗胸痹作用机制的研究[J]. 时珍国医国药, 2015, 26(2): 414-6. |
| [6] |
刘颁, 石振东. 瓜蒌皮注射液联合阿司匹林治疗高龄不稳定型心绞痛的临床效果及对血小板聚集率的影响[J]. 中国疗养医学, 2016, 25(2): 188-90. |
| [7] |
王洪白, 杨霞, 李华菊. 瓜蒌薤白白酒汤加减治疗胸痹心痛56例[J]. 实用中医药杂志, 2018, 34(12): 1441. |
| [8] |
郭玉洪, 赵洋洋, 刘原, 等. 瓜蒌皮治疗心血管疾病的作用机制及临床应用概况[J]. 中国药房, 2019, 30(21): 3013-8. |
| [9] |
鄢海燕, 邹纯才. 瓜蒌的药理学作用与机制研究进展及网络药理学研究展望[J]. 国际药学研究杂志, 2019, 46(2): 89-96, 115. |
| [10] |
卞莹莹, 鄢海燕, 邹纯才. 瓜蒌缓释微丸的制备及体外释放度研究[J]. 国际药学研究杂志, 2019, 46(6): 461-6. |
| [11] |
李川. 中药多成分药代动力学研究:思路与方法[J]. 中国中药杂志, 2017, 42(4): 607-17. |
| [12] |
吕斌, 寻添荣, 吴树龙, 等. HPLC-MS/MS同时检测大鼠血浆中阿托伐他汀和伏立康唑的浓度[J]. 南方医科大学学报, 2019, 39(3): 337-43. |
| [13] |
刘玉婷, 蒋且英, 黄国勇, 等. LC-MS法研究黄芪对附子6种乌头生物碱大鼠药代动力学的影响[J]. 药学学报, 2019, 54(12): 2289-95. |
| [14] |
张瑞卿, 杨文倩, 余裕炳, 等. 硝苯地平骨架型缓释微丸在大鼠体内药代动力学及其与CYP3A4代谢酶活性的关系[J]. 中国药科大学学报, 2018, 49(4): 427-32. |
| [15] |
刘红菊, 闫冲, 李宝红. 液相色谱-串联质谱测定大鼠血浆中紫云英苷的浓度及其药代动力学研究[J]. 南方医科大学学报, 2013, 33(7): 1049-52, 1056. |
| [16] |
管咏梅, 朱卫丰, 管雪静, 等. LC-MS研究白芷中香豆素成分对多烯紫杉醇药代动力学的影响[J]. 中国中药杂志, 2017, 42(24): 4870-4. |
| [17] |
查琳, 赵岩, 祝洪艳, 等. 人参茎叶总皂苷脂质体与水溶液在大鼠体内的血药浓度及药代动力学参数对比分析[J]. 中国中药杂志, 2017, 42(10): 1957-63. |
| [18] |
李睿, 曹唯仪, 唐旭东, 等. 中药新药早期临床安全性评价思路初探[J]. 中国新药杂志, 2016, 25(24): 2799-803. |
| [19] |
Zhao CL, Zhang N, Chen B, et al. A rapid and sensitive LC-MS/MS method for quantification of 3, 29-dibenzoyl rarounitriol in rat plasma: application to a pharmacokinetic study[J]. Biomed Chromatogr, 2015, 29(8): 1229-34. |
| [20] |
白俊其, 黄娟, 徐文, 等. LC-MS/MS法测定石斛碱在大鼠体内药代动力学研究[J]. 世界中医药, 2019, 14(9): 2272-5. |
| [21] |
梁枫, 李多, 汪荣斌, 等. 基于LC-MS/MS研究异夏佛塔苷在大鼠体内药代动力学及其绝对生物利用度[J]. 中国药科大学学报, 2019, 50(1): 75-80. |
| [22] |
李嘉华, 苏晓纯, 刘奕明, 等. LC-MS/MS法同时测定大鼠组织中士的宁、马钱子碱及其代谢物[J]. 中国药理学通报, 2019, 35(6): 884-9. |
| [23] |
刘玥昕, 吴骁, 关蓉, 等. 大黄及牛黄解毒片大鼠给药后血浆中大黄活性成分的药代动力学比较研究[J]. 中国药科大学学报, 2018, 49(4): 449-55. |
| [24] |
吴双双, 罗晓健, 何明珍, 等. 穿心莲内酯喷干粉药代动力学研究[J]. 江西中医药, 2018, 49(5): 62-5. |
| [25] |
邹纯才, 李玉龙, 鄢海燕, 等. 米酒对瓜蒌薤白中3, 29-二苯甲酰基栝楼仁三醇在人肠道菌群降解影响的研究[J]. 中国药学杂志, 2017, 52(1): 53-6. |
| [26] |
谭翔, 邹顺, 薛琰, 等. 黔产瓜蒌中3, 29-二苯甲酰基栝楼仁三醇的含量测定[J]. 贵阳中医学院学报, 2014, 36(3): 14-5. |
| [27] |
魏国栋, 马思缇, 王苏丽. 瓜蒌皮药材质量标准研究[J]. 亚太传统医药, 2015, 11(13): 29-31. |
| [28] |
廖琼峰, 姚媛, 张蕾, 等. LC/MS/MS法测定大鼠血浆中穿心莲内酯和脱水穿心莲内酯及药动学研究[J]. 世界科学技术:中医药现代化, 2009, 11(6): 847-51. |
| [29] |
纪顺利, 宋帆帆, 郑阳, 等. LC-MS/MS同时测定人血浆中阿莫西林和克拉维酸及其生物等效性研究[J]. 中国药科大学学报, 2019, 50(6): 699-706. |
| [30] |
温慧敏, 尹小娟, 杨沙, 等. 不同剂型琥珀酸美托洛尔在大鼠体内的药代动力学对比研究[J]. 西部医学, 2019, 31(1): 30-5. |
| [31] |
李汇涓, 孙鲁宁, 张宏文, 等. LC-MS/MS法测定人血浆中安妥沙星的浓度及盐酸安妥沙星片在健康人体的药代动力学研究[J]. 中国临床药理学杂志, 2018, 34(7): 866-9. |
| [32] |
崔艳丽, 武峰. LC-MS/MS法同时测定比格犬血浆中甘精胰岛素及其代谢物浓度[J]. 中国临床药理学杂志, 2018, 34(17): 2117-20. |
| [33] |
王文静, 龚子东, 韩宝来. 丹参提取物及益心舒片中丹酚酸B的大鼠体内药代动力学研究[J]. 国际药学研究杂志, 2019, 46(5): 382-6. |
| [34] |
张纯刚, 于琛琛, 康宁, 等. 大鼠体内白藜芦醇胶束的药代动力学研究[J]. 中国药业, 2019, 28(19): 21-3. |
| [35] |
孙瑜, 田树成. 乌头汤和改良乌头汤药代动力学-药效学动物实验比较[J]. 中国药业, 2020, 29(1): 15-9. |
 2020, Vol. 40
2020, Vol. 40

