乳腺癌是全世界女性癌症相关死亡的主要原因,在2018年全球癌症统计中其发病率和死亡率位居第2位[1]。分子靶向治疗是近年来乳腺癌研究的热点之一,与化疗药物相比,它是一种具有多种作用机制的新型抗肿瘤药物。然而,三阴乳腺癌(TNBC)作为乳腺癌的一种类型,占所有乳腺癌的10%~20%,与其他类型的乳腺癌相比具有强侵袭力、缺乏有效药物靶点和临床治疗手段单一等特点[2-3]。因此,寻找新型有效的药物及治疗靶点较为迫切。有研究通过靶向不同的信号途径,发现潜在的TNBC治疗靶点,如表皮生长因子受体(EGFR)[4-6]。研究表明,EGFR在多种人类肿瘤中表现出异常,包括基因扩增和突变且在接近80%的肿瘤细胞中呈高表达[7]。
研究表明,EGFR-TKI可对多种癌症发挥抗肿瘤作用,如肺癌[8-9]、乳腺癌[10]等。EGFR-TKI通过阻断EGFR分子内酪氨酸的自身磷酸化及酪氨酸激酶的活化,抑制EGFR二聚体的形成,从而抑制EGFR激活,阻止下游信号转导,抑制细胞周期进程、诱导细胞自噬和加速细胞凋亡[11]。HS-10296是具有自主知识产权的一种小分子抗肿瘤化合物,可靶向EGFR发挥抗肿瘤活性,属于EGFR-TKI,临床前研究显示其对于肺癌有着较好的治疗效果,我们期待拓展其在其他肿瘤中的应用。然而,HS-10296对TNBC细胞体外生长的影响以及是否诱导细胞发生自噬相关性死亡或者其他死亡形式,和具体的抗肿瘤机制尚无文献报道。本研究以新型EGFR-TKI HS-10296为研究对象,观察其对TNBC MDA-MB-231细胞的增殖抑制作用以及对细胞凋亡和自噬的影响,并探讨相关可能机制,为开辟TNBC的临床治疗途径提供新的理论和实验依据。
1 材料和方法 1.1 材料人乳腺上皮癌细胞株MDA-MB-231购于北纳生物细胞库,于蚌埠医学院生化药理实验室冻存。HS-10296(江苏豪森药业有限公司),DMEM高糖培养基(Hyclone),胎牛血清(四季青),CCK-8(Biosharp),Annexin V-FITC/PI试剂盒(贝博生物),JC-1检测试剂盒、胰酶细胞消化液、青霉素-链霉素、RIPA裂解液、PMSF、BCA蛋白浓度测定试剂盒(碧云天),氯喹(CQ)(Sigma),β-actin、EGFR/p-EGFR、Akt/p-Akt、Caspase-3、PARP、LC3B抗体(CST)。
1.2 方法 1.2.1 细胞培养MDA-MB-231细胞培养于含有10%胎牛血清和青霉素1×105 U/L、链霉素100 mg/L的DMEM高糖培养基中,置于37 ℃、5% CO2恒温培养箱中。
1.2.2 CCK-8检测细胞存活率将MDA-MB-231细胞接种于96孔板中,7×103/孔,置于恒温37 ℃、5% CO2培养箱中,待细胞贴壁后,更换孔中培养液为单用HS-10296(0、1、2、4、6、8、10、12 μmol/L)、单用CQ(40 μmol/L)以及HS-10296(4、6 μmol/L)与CQ联合的DMEM培养液,每组5个复孔,并设置溶剂对照组。在培养箱中继续培养24、48、72 h后,每孔加入CCK-8溶液10 μL,放置于培养箱中孵育2 h,酶标仪设置450 nm,检测此波长下各个孔的吸光度值A450 nm,重复实验3次。计算公式:细胞存活率(%)=(实验组A/对照组A)×100%。
1.2.3 集落克隆法检测细胞增殖抑制将MDA-MB-231细胞接种于6孔板中,5×103/孔,细胞贴壁后,将细胞培养液更换为含有HS-10296(0、0.4、0.6、0.8 μmol/L)的新鲜培养液,再将细胞置于培养箱。5 d后移除培养液并使用预冷PBS清洗2次,然后加入多聚甲醛,放置在-20 ℃,10 min后加入结晶紫,室温放置10 min,然后使用双蒸水清洗,室温放置干燥后拍照。实验重复3次。
1.2.4 形态学观察将MDA-MB-231细胞接种于6孔板中,2×105/孔,待细胞于培养箱中贴壁良好,弃去孔中培养液,将细胞分为4组:HS-10296(0、4、6、8 μmol/L)组,继续培养24 h后使用倒置显微镜拍照。
1.2.5 线粒体膜电位变化将MDA-MB-231细胞接种于6孔板中,2×105/孔,待细胞贴壁后,加入不同浓度的HS-10296,继续培养24 h,弃去孔中培养液并使用预冷PBS洗涤两次,根据线粒体膜电位检测说明书加入JC-1工作液并继续操作,使用倒置荧光显微镜观察线粒体膜电位变化,实验重复3次。线粒体膜电位的降低可由红光向绿光的转变提示。
1.2.6 流式细胞术检测细胞凋亡将MDA-MB-231细胞接种于6孔板中,2×105/孔,置于培养箱中,细胞贴壁后更换培养液为含有HS-10296(0、4、6、8 μmol/L)的培养液,继续培养24 h,使用离心机600 g收集细胞,加入Annexin-V-FITC/PI双染试剂染色,上流式细胞仪检测,实验重复3次。
1.2.7 电镜观察细胞自噬MDA-MB-231细胞种于60 mm皿中,待细胞密度合适,贴壁良好,加入HS-10296(8 μmol/L)作用24 h,使用4 ℃离心机600 g收集细胞,PBS洗3次,用3%戊二醛和2%多聚甲醛在0.1 mol/L PBS缓冲液(pH 7.4)中固定,4 ℃状态下保存。最后使用透射电子显微镜采集图片。
1.2.8 Western blot检测相关蛋白表达MDA-MB-231细胞种于60 mm皿中,分组情况:HS-10296(0、4、6、8 μmol/L)、CQ(40 μmol/L)及HS-10296(4 μmol/L)和CQ联合,药物作用24 h,收集细胞并加入RIPA裂解液,冰上裂解30 min,4 ℃低温离心机12 000 r/mim离心30 min,提取蛋白上清,使用BCA法进行蛋白定量,使各组蛋白至等浓度。各组取30 μg蛋白,SDS-PAGE电泳,然后转膜至PVDF膜,使用5%脱脂牛奶封闭4 h;TPBS洗膜3次,5 min/次;4 ℃一抗孵育过夜,TPBS洗膜3次;室温二抗孵育2 h,TPBS洗膜3次;ECL试剂盒发光显影,使用凝胶成像系统获取图像。Image J测定各显色条带的灰度值,以目的条带与β-actin灰度值的比值作为目的蛋白的相对表达量。
1.3 统计分析方法采用SPSS21.0软件对实验结果进行分析,数据以均数±标准差表示,采用单因素方差分析评价实验组间的差异,P < 0.05为差异具有统计学意义。
2 结果 2.1 HS-10296对MDA-MB-231细胞的增殖抑制作用CCK-8结果显示,随着药物浓度增加和时间延长,HS-10296对MDA-MB-231细胞的抑制作用逐渐增强(图 1A),24、48、72 h的IC50值分别为8.393、2.777、2.016 μmol/L。集落克隆实验结果显示,HS-10296呈剂量依赖性的抑制集落的形成(图 1B)。同时,通过倒置显微镜观察到给予HS-10296药物组细胞的形态与密度与对照组相比均出现不同程度的变化,8 μmol/L HS-10296处理后,可明显看出细胞萎缩加剧,折光性增加,悬浮细胞明显增多(图 1C)。
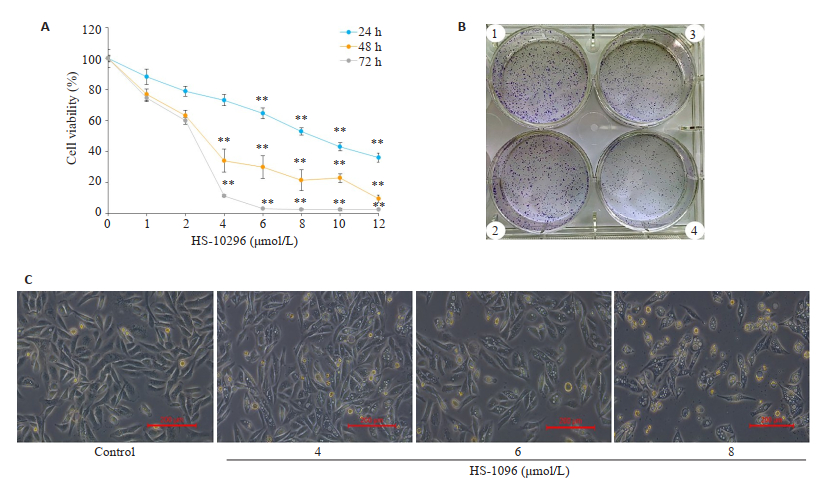
|
图 1 HS-10296对MDA-MB-231细胞的增殖抑制作用 Fig.1 Inhibitory effects of HS-10296 on MDA-MB-231 cells. A: CCK-8 assay; B: Clonogenic assay; 1: Control; 2: HS-1096 (0.4 μmol/L); 3: HS-1096 (0.6 μmol/L); 4: HS-1096 (0.8 μmol/L); C: Morphological changes of MDA-MB-231 cells. **P < 0.01 vs control. |
JC-1结果显示,给予6、8 μmol/L HS-10296处理细胞后,与对照组相比,细胞内红光比例减少,绿光比例增加,红光向绿光转变的过程提示线粒体膜电位下降(图 2A),此为细胞发生早期凋亡的重要特征之一。流式细胞术检测结果显示,8 μmol/L HS-10296能显著诱导细胞凋亡(P < 0.01,图 2B)。随着药物浓度增加,与对照组相比,剪切的Caspase-3表达逐渐升高(图 2D),8 μmol/L HS-10296处理组PARP剪切带增加较为显著,差异具有统计学意义(P < 0.01)。
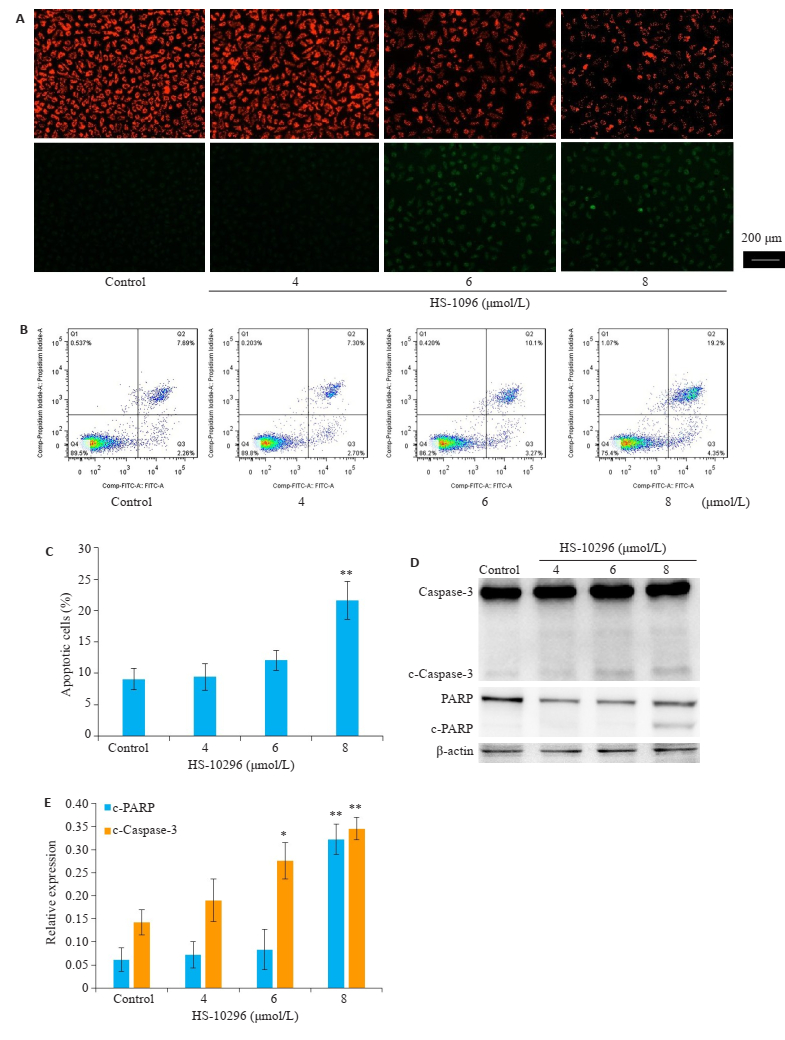
|
图 2 HS-10296诱导MDA-MB-231细胞发生凋亡 Fig.2 HS-10296 induces apoptosis in MDA-MB-231 cells. A: Effect of HS-10296 on mitochondrial membrane potential of the cells; B: Flow cytometry of the cells with different treatments; C: Bar graphs showing the percentages of the apoptotic cells; D, E: Expression of apoptosis-associated proteins in the cells. *P < 0.05, **P < 0.01 vs control. |
倒置显微镜观察到给予HS-10296(8 μmol/L)药物组细胞内出现大量空泡(图 3A),电镜观察到药物组细胞内存在自噬囊泡(图 3B)。Western blot结果显示,自噬标志蛋白LC3B出现大量切割,LC3B/Ⅱ呈剂量依赖性增加(图 3C)。
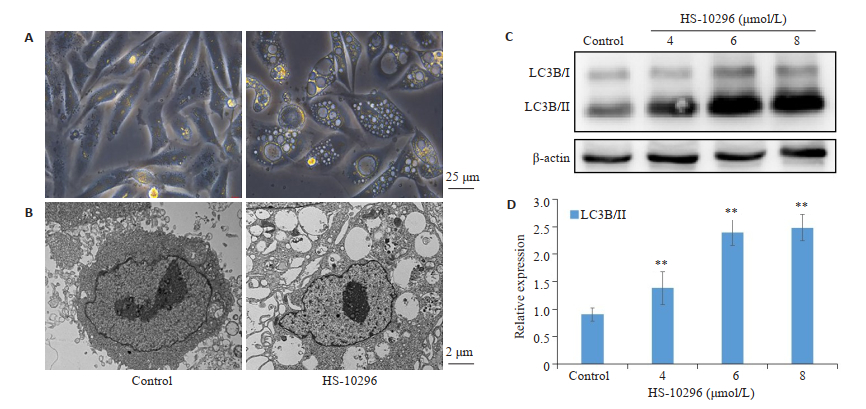
|
图 3 HS-10296诱导MDA-MB-231细胞发生自噬 Fig.3 HS-10296 induces autophagy in MDA-MB-231 cells. A: Cells under inverted microscope; B: Observation of the cells under electron microscope; C,D: Expression of LC3B/II protein in the cells. **P < 0.01 vs control. |
CQ预处理细胞1 h后,CCK-8检测显示,与对照组和单用HS-10296(4、6 μmol/L)相比,HS-10296联合CQ组细胞存活率降低(P < 0.01)。同时观察到HS-10296(4 μmol/L)联合CQ组中LC3B/Ⅱ表达高于单用CQ组与单用HS-10296(4 μmol/L)组(图 4)。
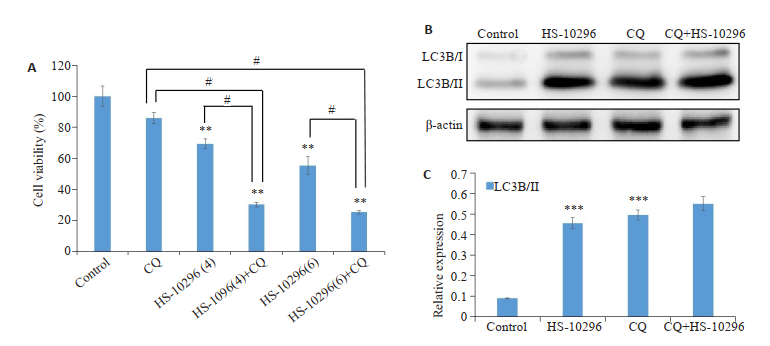
|
图 4 抑制自噬增强MDA-MB-231细胞对HS-10296的敏感性 Fig.4 Inhibition of autophagy enhances the sensitivity of MDA-MB-231 cells to HS-10296. A: CCK-8 assay of the cells incubated with HS-10296 (4 and 6 μmol/L) for 24 h with or without 1 h pretreatment with CQ; B: Western blot analysis. #P < 0.05; **P < 0.01 vs control; ***P < 0.001 vs CQ+HS-10296. |
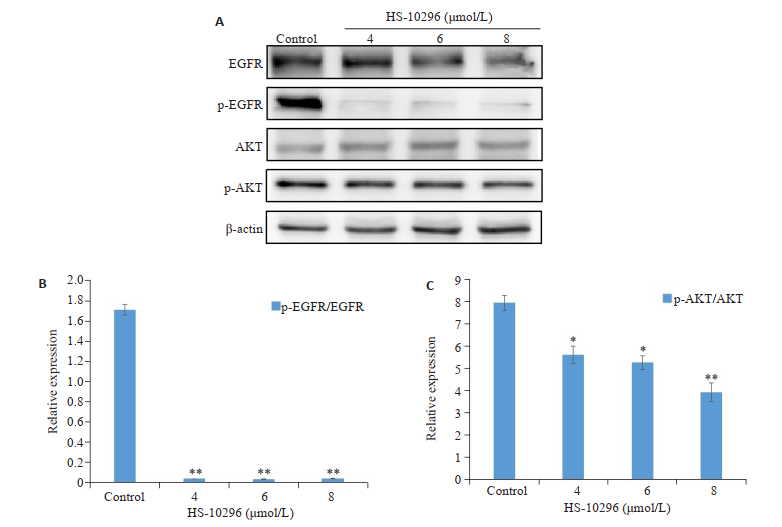
Western blot检测结果显示,随着HS-10296浓度的增加,细胞内磷酸化的EGFR和AKT蛋白表达逐渐减少,与对照组比较差异具有统计学意义(P < 0.05,图 5)。
|
图 5 HS-10296降低MDA-MB-231细胞内EGFR和AKT蛋白的磷酸化水平 Fig.5 HS-10296 reduces the phosphorylation of EGFR andAKT proteins in MDA-MB-231 cells. *P < 0.05, **P < 0.01 vs control. |
多年来,化疗一直是TNBC主要的系统治疗选择,以提高患者的总体生存率[12],但是化疗耐药性及不良反应等是TNBC患者治疗面临的诸多挑战[13]。因此,多项研究检测了化疗前后的分子变化,以确定TNBC可能的靶向治疗[14],为疾病治疗提供新的方案。本研究发现,EGFR-TKI HS-10296在体外对TNBC有着较好的抗肿瘤效果。EGFR属于跨膜受体酪氨酸蛋白激酶,由细胞外配体结合区,疏水跨膜结构域和细胞内激酶区3部分组成,其下游包括MAPK/ERK,PI3K/AKT等信号途径。EGFR在细胞增殖、肿瘤发生、抗癌耐药等方面起着重要作用,异常的EGFR信号在许多人类恶性肿瘤中被发现,包括结肠直肠癌、肺癌、乳腺癌和头颈癌[15-16]。因此,EGFR可能成为抗癌治疗发展的一个靶点。TNBC MDA-MB-231细胞虽然不表达ER、PR、HER2等受体,但是存在EGFR的表达[17]。本研究结果显示HS-10926作为一种EGFR-TKI可有效抑制MDA-MB-231细胞的生长增殖及诱导细胞发生自噬和凋亡。
细胞凋亡是程序性死亡的主要形式,也是研究最多的一种形式。Caspases是广泛表达的半胱氨酸蛋白酶,在细胞凋亡中发挥核心的作用。在生理情况下,Caspases表现为非活性形式,蛋白酶活性低[18-19],死亡诱导刺激导致Caspases的天冬氨酸残基切割和N-末端抑制结构域的去除,激活凋亡破坏阶段[19]。细胞程序性死亡的异常是恶性转化过程中重要的遗传变化之一,因此,抑制细胞增殖和诱导细胞凋亡是恶性肿瘤的主要治疗策略[20]。本实验CCK-8结果表明,HS-10296可呈时间和剂量依赖性的抑制MDA-MB-231细胞的增殖。经流式和免疫印迹分析,HS-10296处理后可引起细胞发生凋亡,引起Caspase-3的剪切活化。细胞自噬,也被称为Ⅱ型程序性细胞死亡,自噬通量通常在细胞应激和营养缺乏时被激活,一般通过自噬小体的积累表现出来[21-22]。但是在生理情况下,自噬总是发生在基础水平,起着细胞内质量控制系统的作用,以维持内稳态,去除任何多余的或受损的蛋白质等[23]。自噬与凋亡之间关系复杂,有研究表明,自噬在细胞凋亡中起着积极和消极的作用,例如,咪唑仑被报道可诱导肺癌A549细胞的自噬细胞死亡[24],自噬抑制改善受体酪氨酸激酶抑制剂的细胞毒性作用[25],这表明自噬在多种组织细胞中有着不同的功能。有文献研究诱导自噬是吉非替尼作用于乳腺癌的早期反应,提出EGFR可以作为乳腺癌治疗的潜在靶点[10],然而目前对于TNBC的相关研究报道较少,本研究首次使用HS-10296作用于TNBC,观察其抗肿瘤作用及潜在分子机制,同时探讨自噬在药物作用过程中所发挥的作用,以期为后续可能耐药提供实验依据用于增强细胞对药物的敏感性。本研究使用HS-10296处理细胞后,通过电镜观察到细胞内出现自噬小体,同时在免疫印迹分析中发现HS-10296可上调细胞内自噬标记蛋白LC3B的表达,这表明HS-10296可诱导细胞发生自噬,本研究使用自噬抑制剂CQ预处理细胞后,发现抑制自噬增加了细胞对HS-10296的敏感性,说明自噬的产生在其中可能发挥了促进肿瘤细胞生存的作用。为进一步了解HS-10296诱导MDA-MB-231细胞自噬和凋亡的分子机制,我们研究了不同浓度HS-10296对EGFR、p-EGFR、AKT、p-AKT的表达影响,发现细胞内p-EGFR和p-AKT均有不同程度的降低。有研究表明,PI3K/AKT通路影响着蛋白质合成、代谢、细胞周期调节和增殖等多种生理活动,在调节自噬和凋亡中起重要作用[26-27],EGFR/PI3K/AKT/等信号通路可以抑制自噬以及抵抗凋亡[28],所以我们推测在HS-12096作用的可能机制中EGFR/PI3K/AKT信号通路发挥着作用。
综上所述,本研究结果表明HS-10296可以通过抑制EGFR/PI3K/AKT信号通路,抑制TNBC MDA-MB-231细胞的增殖,诱导细胞自噬和凋亡,具有抗肿瘤作用,为靶向EGFR可能成为TNBC的一种有效的治疗策略提供实验依据,同时联合自噬抑制剂增强细胞对药物的敏感性或许是可行的附加方式。然而,HS-10296诱导的MDA-MB-231细胞自噬与凋亡之间的确切关系及相关机制仍需进一步研究。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
O'Reilly EA, Gubbins L, Sharma S, et al. The fate of chemoresistance in triple negative breast cancer (TNBC)[J]. BBA Clin, 2015, 3: 257-75. DOI:10.1016/j.bbacli.2015.03.003 |
| [3] |
Diana A, Franzese E, Centonze S, et al. Triple-negative breast cancers: systematic review of the literature on molecular and clinical features with a focus on treatment with innovative drugs[J]. Curr Oncol Rep, 2018, 20(10): 76-83. DOI:10.1007/s11912-018-0726-6 |
| [4] |
Shao FY, Sun H, Deng CX. Potential therapeutic targets of triplenegative breast cancer based on its intrinsic subtype[J]. Oncotarget, 2017, 8(42): 73329-44. DOI:10.18632/oncotarget.20274 |
| [5] |
Schuler M, Awada A, Harter P, et al. A phase Ⅱ trial to assess efficacy and safety of afatinib in extensively pretreated patients with HER2-negative metastatic breast cancer[J]. Breast Cancer Res Treat, 2012, 134(3): 1149-59. |
| [6] |
Trédan O, Campone M, Jassem J, et al. Ixabepilone alone or with cetuximab as first-line treatment for advanced/metastatic triplenegative breast cancer[J]. Clin Breast Cancer, 2015, 15(1): 8-15. |
| [7] |
Harari PM, Allen GW, Bonner JA. Biology of interactions: antiepidermal growth factor receptor agents[J]. J Clin Oncol, 2007, 25(26): 4057-65. DOI:10.1200/JCO.2007.11.8984 |
| [8] |
Li YY, Lam SK, Mak JC, et al. Erlotinib-induced autophagy in epidermal growth factor receptor mutated non-small cell lung cancer[J]. Lung Cancer, 2013, 81(3): 354-61. DOI:10.1016/j.lungcan.2013.05.012 |
| [9] |
Zhang ZR, Zhang MX, Liu H, et al. AZD9291 promotes autophagy and inhibits PI3K/Akt pathway in NSCLC cancer cells[J]. J Cell Biochem, 2019, 120(1): 756-67. |
| [10] |
Dragowska WH, Weppler SA, Wang JC, et al. Induction of autophagy is an early response to gefitinib and a potential therapeutic target in breast cancer[J]. PLoS One, 2013, 8(10): e76503-9. DOI:10.1371/journal.pone.0076503 |
| [11] |
刘慧慧, 王孟昭, 胡克, 等. EGFR-TKI在非小细胞肺癌中耐药机制的研究进展[J]. 中国肺癌杂志, 2013, 16(10): 535-40. DOI:10.3779/j.issn.1009-3419.2013.10.07 |
| [12] |
Khosravi-Shahi P, Cabezón-Gutiérrez L, Custodio-Cabello S. Metastatic triple negative breast cancer: Optimizing treatment options, new and emerging targeted therapies[J]. Asia Pac J Clin Oncol, 2018, 14(1): 32-9. DOI:10.1111/ajco.12748 |
| [13] |
Lee A, Djamgoz MBA. Triple negative breast cancer: Emerging therapeutic modalities and novel combination therapies[J]. Cancer Treat Rev, 2018, 62: 110-22. DOI:10.1016/j.ctrv.2017.11.003 |
| [14] |
Balko JM, Giltnane JM, Wang K, et al. Molecular profiling of the residual disease of triple-negative breast cancers after neoadjuvant chemotherapy identifies actionable therapeutic targets[J]. Cancer Discov, 2014, 4(2): 232-45. DOI:10.1158/2159-8290.CD-13-0286 |
| [15] |
Dong QJ, Yu PF, Ye L, et al. PCC0208027, a novel tyrosine kinase inhibitor, inhibits tumor growth of NSCLC by targeting EGFR and HER2 aberrations[J]. Sci Rep, 2019, 9(1): 5692-701. |
| [16] |
Wang H, Yao F, Luo SY, et al. A mutual activation loop between the Ca2+-activated chloride channel TMEM16A and EGFR/STAT3 signaling promotes breast cancer tumorigenesis[J]. Cancer Lett, 2019, 455: 48-59. DOI:10.1016/j.canlet.2019.04.027 |
| [17] |
Subik K, Lee JF, Baxter L, et al. The expression patterns of ER, PR, HER2, CK5/6, EGFR, ki-67 and AR by immunohistochemical analysis in breast cancer cell lines[J]. Breast Cancer (Auckl), 2010, 4: 35-41. |
| [18] |
Thornberry NA, Lazebnik Y. Caspases: enemies within[J]. Science, 1998, 281(5381): 1312-6. DOI:10.1126/science.281.5381.1312 |
| [19] |
Martinon F, Tschopp J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases[J]. Cell, 2004, 117(5): 561-74. DOI:10.1016/j.cell.2004.05.004 |
| [20] |
郝艳梅, 殷红梅, 朱超莽, 等. 苦参碱通过抑制PI3K/AKT/mTOR通路促进非小细胞肺癌A549细胞的自噬和凋亡[J]. 南方医科大学学报, 2019, 39(7): 760-5. |
| [21] |
Russell RC, Yuan HX, Guan KL. Autophagy regulation by nutrient signaling[J]. Cell Res, 2014, 24(1): 42-57. |
| [22] |
Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4): 728-41. DOI:10.1016/j.cell.2011.10.026 |
| [23] |
Mariño G, Niso-Santano M, Baehrecke EH, et al. Self-consumption: the interplay of autophagy and apoptosis[J]. Nat Rev Mol Cell Biol, 2014, 15(2): 81-94. |
| [24] |
An HK, Kim KS, Lee JW, et al. Mimulone-induced autophagy through p53-mediated AMPK/mTOR pathway increases caspasemediated apoptotic cell death in A549 human lung cancer cells[J]. PLoS One, 2014, 9(12): e114607-15. DOI:10.1371/journal.pone.0114607 |
| [25] |
Aveic S, Pantile M, Polo P, et al. Autophagy inhibition improves the cytotoxic effects of receptor tyrosine kinase inhibitors[J]. Cancer Cell Int, 2018, 18: 63-71. DOI:10.1186/s12935-018-0557-4 |
| [26] |
Heras-Sandoval D, Pérez-Rojas JM, Hernández-Damián J, et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J]. Cell Signal, 2014, 26(12): 2694-701. DOI:10.1016/j.cellsig.2014.08.019 |
| [27] |
Kumar D, Shankar S, Srivastava RK. Rottlerin induces autophagy and apoptosis in prostate cancer stem cells via PI3K/Akt/mTOR signaling pathway[J]. Cancer Lett, 2014, 343(2): 179-89. DOI:10.1016/j.canlet.2013.10.003 |
| [28] |
Kwon Y, Kim M, Jung HS, et al. Targeting autophagy for overcoming resistance to anti-EGFR treatments[J]. Cancers (Basel), 2019, 11(9): E1374-83. DOI:10.3390/cancers11091374 |
 2020, Vol. 40
2020, Vol. 40

