神经元微环境稳态平衡是大脑行使功能正常的关键因素[1]。在生理条件下,细胞外pH值维持在7.4附近范围[2]。但是在一些疾病病理变化过程中会打破神经元微环境稳态平衡,并影响疾病的发生和进展[3-4]。在癫痫发作过程中,神经元的超同步化过兴奋引起细胞外H+的累积,从而使神经元外部微环境呈酸性状态,进而降低神经元的兴奋性,抑制癫痫发作[5-6]。
1997年人们首次克隆并发现的酸敏感离子通道家族(ASICs)提升了人们对于神经系统疾病中细胞外酸化对神经元的影响的理解[7]。ASICs作为神经系统中广泛表达的一类对Na+和Ca2+具有渗透性的阳离子通道,可被细胞外酸化和神经元调节活动所激活[8-9]。有研究提示ASICs在细胞外酸化环境下可能参与调节电生理性癫痫放电,并抑制行为性癫痫[10-11]。脑内癫痫性放电在电生理(如脑电图、细胞外记录)上可分为发作前期、发作期、发作后期和发作间期放电。这些放电模式相应地在病理上表现为发作前癫痫起源区异常不断增强的电活动、发作时脑电同步化全面性扩散、发作后脑电短暂抑制状态和发作间遏期癫痫起源区局部的异常脑电活动[12]。然而,目前尚不清楚ASICs如何在细胞外酸化条件下精确调节电生理癫痫样活动模式,以及其潜在的电生理机制。在本研究中,我们在小鼠海马脑片上使用提高细胞外K+浓度的高钾模型或在人工脑脊液中使用GABAA受体拮抗剂的去抑制模型记录细胞外酸化对癫痫样活动的影响,探究其潜在的调控作用和机制。
1 材料和方法 1.1 动物、试剂和仪器本实验所使用3~4周SPF级C57 BL/6J雄性小鼠均由广东省实验动物中心提供(广东广州;实验动物使用许可编号:SYXK(粤)2016-0167)。小鼠饲养在恒温、恒湿、12 h光暗循环的环境中,光照时间为8:00 am~8:00 pm。小鼠自由且无限制地饮食和饮水。所有小鼠实验均通过南方医科大学实验福利和伦理委员会的批准。
试剂:Diminazene Aceturate(Sigma);SR 95531(Sigma)。
仪器:Axon 700B膜片钳放大器(Axon),DIGIDATA 1440A模-数/数-模转换器(Axon)。
1.2 脑片制作小鼠使用0.75%戊巴比妥钠腹腔注射麻醉,使用剂量为75 mg/kg。小鼠麻醉后使用预先通95% O2/5% CO2的混合气20~30 min的高糖切片液(mmol/L:26 NaHCO3,10 D-Glucose,12 MgSO4,2 KCl,1.3 NaH2PO4,0.2 CaCl2,220 Sucrose)经心灌注,充分冲去血液之后使用剪刀取头,放置于冷冻的冰盒上取脑。后使用震动切片机切300 μm厚度的脑片,将脑片放于预先使用95% O2/5% CO2混合气充分通氧、放置于恒温水浴锅34 ℃预先升温的人工脑脊液脑槽中。在恒温水浴箱中恢复30 min后将脑槽取出置于室温中,室温恢复1 h后才可用于实验使用。
1.3 场电位记录为了将人工脑脊液(mmol/L:126 NaCl,2.5 KCl,1 MgCl2,26 NaHCO3,1.25 NaH2PO4,2 CaCl2,10 D-Glucose,充分通氧后pH值为7.4,渗透压为290~310 mOsm)的pH值从7.4降低到6.8,我们将NaHCO3的浓度从26 mmol/L降低至6.5 mmol/L,并将NaCl的浓度从126 mmol/L提升至145.5 mmol/L,以维持渗透压的正常范围。场电位记录槽温度设置为38.5±0.2 ℃,流速调整为3~4 mL/min,使脑片得到充分供氧。将玻璃电极放置到海马CA3锥体细胞带上合适位置后记录场电位。过滤频率为1 kHz,采样频率为5 kHz。场电位记录每个灌流时长为20 min,每个灌流时长的后10 min用于数据分析。为了分析场电位的放电,在Clampfit软件上使用阈值检测,将阈值设置在噪音之上后进行检测并排除噪音造成的干扰,然后再进行发作性癫痫样放电和非发作性癫痫样放电分析。
1.4 全细胞记录电极内液成分[mmol/L:135 K-gluconate,5 KCl,2 MgCl2,10 HEPES,2 Mg-ATP,0.2 Na2-ATP(使用Tris base调整pH到7.2,渗透压调整到290~310 mOsm)]。观察神经元的状态,并选取状态良好的神经元。缓慢移动到神经元上方后撤出正压,并给与适当的负压以利于更好的高阻封接。待封接电阻达到1 GΩ以上以后,进行快电容补偿,后进行负压和电击共同作用的破膜,接入电阻的范围小于30 MΩ则该细胞可采用,否则舍弃。破膜后进行慢电容补偿,并记录神经元静息膜电位,静息膜电位为-55 mV~-75 mV的神经元可进行记录,否则则视为神经元状态不好,舍弃。在全细胞电压钳模式下,神经元钳制在-70 mV,电流钳模式下,使用钳制电流将神经元膜电位钳制在-70±2 mV。数据采集和记录使用Axon MultiClamp 700B膜片钳放大器和DIGIDATA 1440A模-数/数-模转换器,过滤频率为1 kHz,记录采样频率为5 kHz。数据分析使用Clampfit。
1.5 数据统计本研究中的实验所得数据均使用SPSS13.0软件进行统计分析。两独立样本均数比较使用独立样本t检验方法,配对样本均数比较使用配对样本t检验方法,多组均数之间的比较使用独立样本单因素方差分析,多组数据重复测量采用独立样本双因素方差分析方法。所有数据使用均数±标准误表示。P < 0.05认为差异有统计学意义。
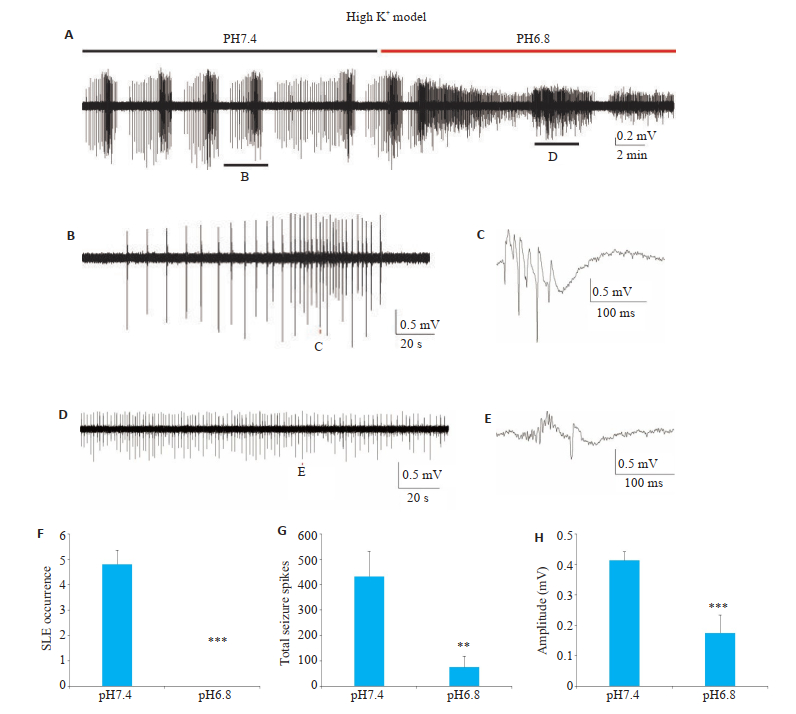
2 结果 2.1 高钾癫痫样放电模型中细胞外酸化减弱癫痫样放电活动,发作性癫痫放电转换为非发作性癫痫放电在诱导出癫痫样放电活动之后,记录20 min,然后转换成高钾低pH值人工脑脊液,记录20 min(图 1A)。在转换成高钾低pH值人工脑脊液后,癫痫样放电的模式发生了改变,癫痫样放电模式从发作性癫痫样放电转换为非发作性癫痫样放电(图 1A~F)。细胞外酸化时癫痫样放电的单次峰电位的总数量显著减少(图 1G,P < 0.01)。同时癫痫样放电的单次峰电位的幅度也显著降低(图 1H,P < 0.001)。
|
图 1 细胞外酸化对细胞外高钾诱导的癫痫样活动的影响 Fig.1 Effects of extracellular acidosis on epileptic activities induced by elevating extracellular K + (Mean±SE, n=10, ***P < 0.001, **P < 0.01 vs pH 7.4). A-E: Epileptic activities in high [K +] o model at pH 7.4 (black bar) and pH 6.8 (red bar); F: Statistical analysis of the occurrence of SLE in 10 min in high [K +]o model; G: Total seizure spikes in 10 min in high [K +]o model; H:Amplitude of seizure spikes in 10 min in high [K+]o mode. |
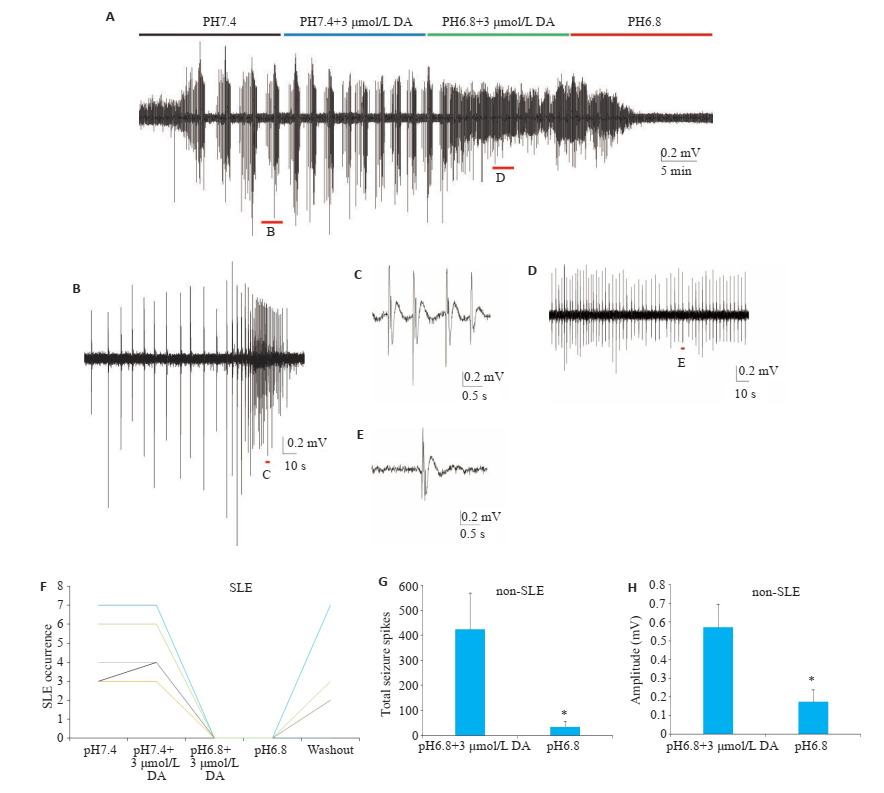
采用3 μmol/L的ASICs拮抗剂DA特异性阻断ASICs,在pH值为7.4的高钾人工脑脊液中,使用酸敏感离子通道拮抗剂DA对癫痫样放电几乎没有影响,然而当转换为pH=6.8的高钾人工脑脊液之后,癫痫样放电的模式依旧从发作性癫痫样放电转换为非发作性癫痫样放电(图 2A~E),发作性癫痫样放电事件的数量也降低至0(图 2F)。并且在酸性高钾人工脑脊液中洗脱DA之后,非发作性癫痫样放电的单次峰电位数量显著减少(图 2G,P < 0.05);幅度也显著降低(图 2H,P < 0.05)。
|
图 2 在高钾模型中ASICs拮抗剂对发作性癫痫样放电和非发作性癫痫样放电的不同作用 Fig.2 Different effects of ASICs blockage on ILEs and non-ILEs in high [K+]o model (Mean±SE, n=7, *P < 0.05 vs pH 6.8/3 μmol/L DA). A-E: Epileptic activities in high [K +]o model at pH 7.4 (black bar), pH 7.4/3 μmol/L DA (blue bar), pH 6.8/3 μmol/L DA (green bar), and pH 6.8 (red bar); F: Serial changes of the SLE occurrence (in 10 min) of separate experiments (n=6) in high [K+]o model at pH 7.4, pH 7.4/3 μmol/L DA, pH 6.8/3 μmol/L DA, and pH 6.8; G: Statistical analysis of spike number of non-ILEs in 10 min in high [K +]o model at pH 6.8/3 μmol/L DA and pH 6.8; H: Statistical analysis of spike amplitude of non-ILEs in 10 min in high [K+]o model at pH 6.8/3 μmol/LDA and pH 6.8. |
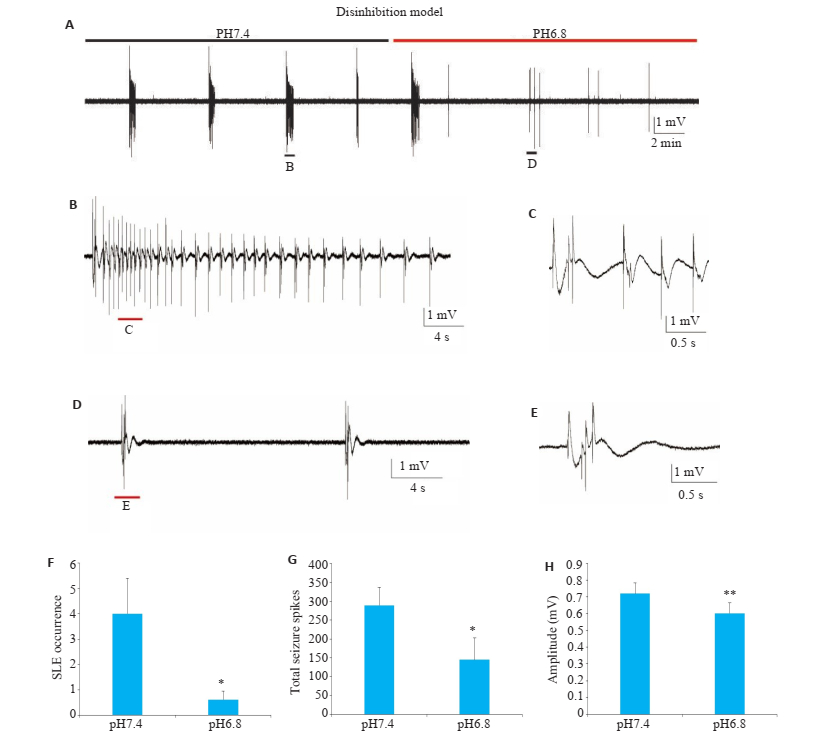
将人工脑脊液中的钾离子浓度提升至5 mmol/L,同时人工脑脊液中使用10 μmol/L的GABAA受体拮抗剂SR 95531诱发去抑制癫痫样放电,与高钾模型的流程一样,在诱发出癫痫样放电20 min后转化为低pH值去抑制癫痫样模型人工脑脊液,然后记录20 min(图 3A)。结果与高钾癫痫样模型结果类似,细胞外酸化可明显减少发作性癫痫样放电的数量(图 3A~F,P < 0.05)。同时也检测了癫痫样放电的单次峰电位的数量和幅度,总癫痫样放电的单次峰电位的数量显著减少(图 3G,P < 0.05)。同时癫痫样放电中的单次峰电位的幅度也显著降低(图 3H,P < 0.01)。
|
图 3 细胞外酸化对去抑制模型中SR 95531诱导的癫痫样活动的影响 Fig.3 Effects of extracellular acidosis on epileptic activities induced by 10 μmol/L SR 95531 in disinhibition model (Mean± SE, n=13, *P < 0.05, **P < 0.01, vs pH 7.4). A-E: Epileptic activities in disinhibition model at pH 7.4 (black bar) and pH 6.8 (red bar); F: Statistical analysis of the occurrence of SILEs in 10 min in disinhibition model; G: Total seizure spikes in 10 min in disinhibition model; H:Amplitude of seizure spikes in 10 min in disinhibition model. |
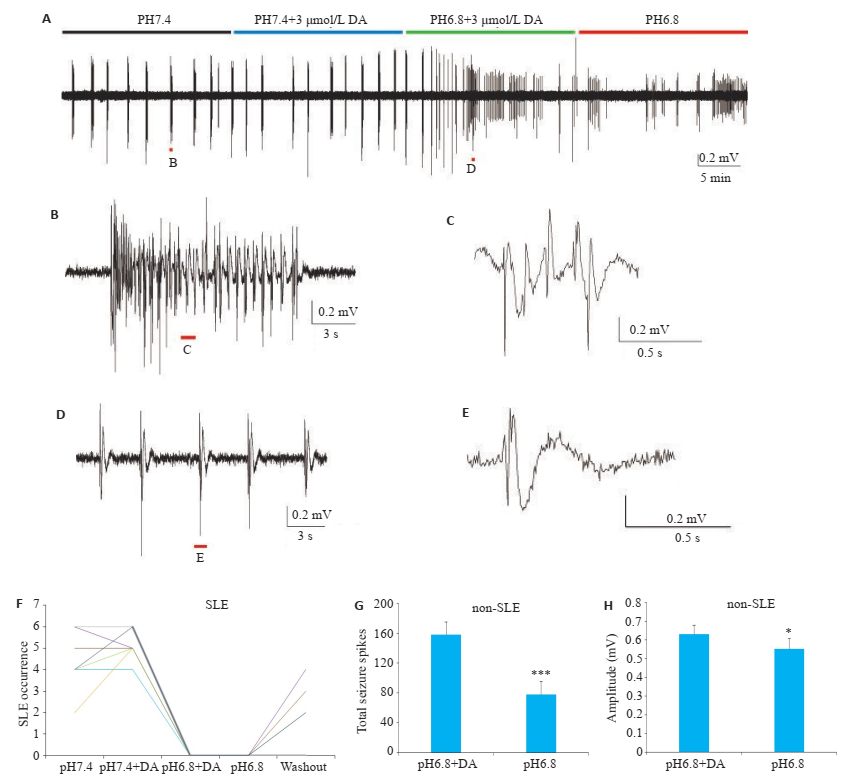
在pH值为7.4的去抑制人工脑脊液中,使用DA对癫痫样放电几乎没有影响(图 4A),然而当转换为pH= 6.8的去抑制人工脑脊液之后,癫痫样放电的模式依旧从发作性癫痫样放电转换为非发作性癫痫样放电(图 4A~F),发作性癫痫样放电事件的数量也降低至0(图 4F)。并且在洗脱DA之后,非发作性癫痫样放电的单次峰电位数量显著减少(图 4G,P < 0.001);幅度也显著降低(图 4H,P < 0.05)。
|
图 4 在去抑制模型中ASICs拮抗剂对发作性癫痫样放电和非发作性癫痫样放电的不同作用 Fig.4 Different effects of ASICs blockage on ILEs and non-ILEs in disinhibition model. A-E: Epileptic activities in disinhibition model at pH 7.4 (black bar), pH 7.4/3 μmol/L DA(blue bar), pH 6.8/3 μmol/L DA(green bar), and pH 6.8 (red bar); F: Serial changes of the SLE occurrence (in 10 min) of separate experiments (n=7) in disinhibition model; G: Statistical analysis of spike number of nonILEs in 10 min in disinhibition model; H: Spike amplitude of non-ILEs in 10 minutes in disinhibition model (Mean±SE, n=12, *P < 0.05, ***P < 0.001 vs pH 6.8/3 μmol/LDA). |
在电流钳模式下使用1 ms,1000 pA的注入电流诱发动作电位的产生(图 5A),这种高强度但超短时程的脉冲电流既可诱发动作电位的产生,又不影响动作电位的基本特性及细胞的状态。每隔20 s诱发一次动作电位,记录3 min的基线后转换为pH=6.8的人工脑脊液,并继续记录15 min。对最后的3 min进行统计。细胞外酸化对锥体神经元的动作电位的幅度并无明显影响(图 5B,P > 0.05),但是可明显升高动作电位的阈电位(图 5C,P < 0.01);同时细胞外酸化显著升高动作电位的半波宽(图 5D,P < 0.05);动作电位到达尖峰的时间显著增加(图 5E,P < 0.01)。
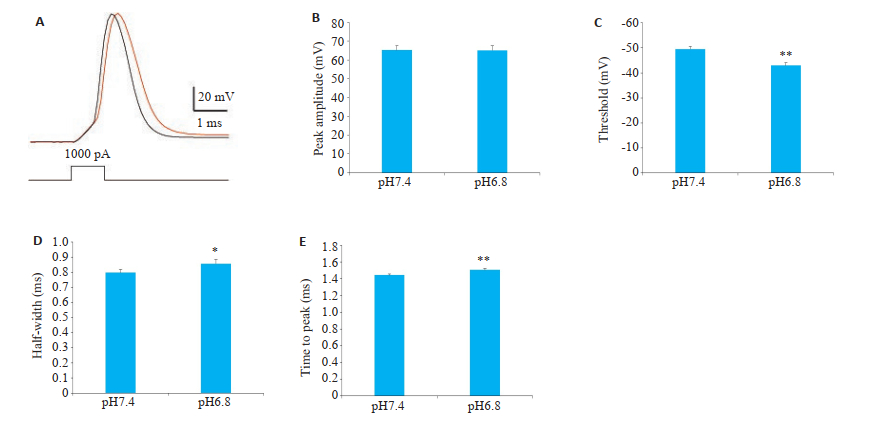
|
图 5 细胞外酸化改变动作电位的特性 Fig.5 Extracellular acidosis changes properties of APs (Mean ± SEM, n=9, *P < 0.05, **P < 0.01 vs pH 7.4). A: Representative recordings of APs induced via a brief current injection (1 ms, 1000 pA) at pH 7.4 (black bar) or pH 6.8 (red bar); B:Statistical analysis of AP peak amplitude; C: AP threshold; D:AP half-width; E: Time to peak ofAPs. |
在电流钳模式下,使用20 pA的步阶注入电流诱发动作电位的产生(图 6A)。在细胞外酸化环境下,步阶注入电流诱发的动作电位的数量在120 pA开始明显降低(图 6B)。而在两种不同pH值的人工脑脊液中均使用ASICs拮抗剂之后,在细胞外酸化环境下步阶注入电流诱发的动作电位的数量依旧明显降低(图 6C)。同样,在两种不同pH值的人工脑脊液中均使用GABAA受体拮抗剂之后,在细胞外酸化环境下步阶注入电流诱发的动作电位的数量依旧明显降低(图 6D)。
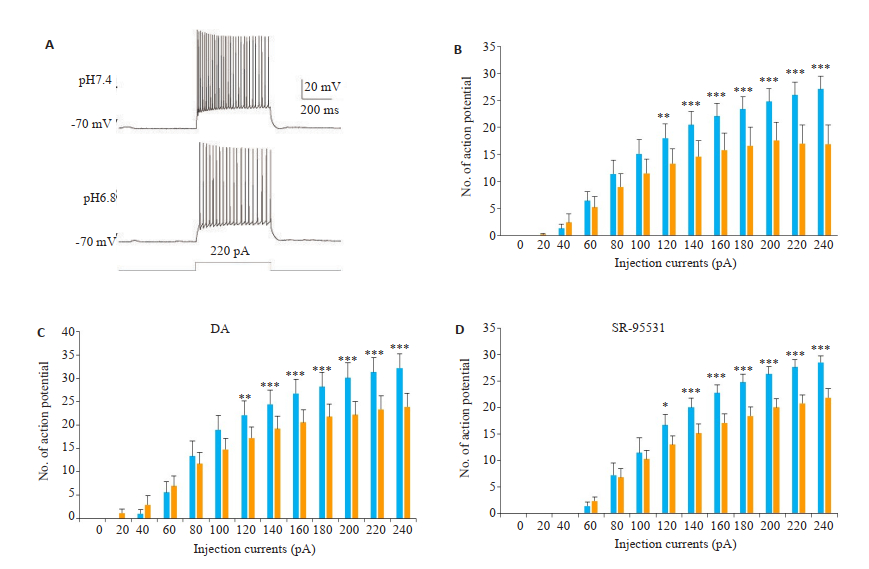
|
图 6 阻断ASICs或GABAA受体对于细胞外酸化降低动作电位的发放率并无影响 Fig.6 ASIC's blockage fails to abolish the suppression of APs by extracellular acidosis[Mean±SEM, n=9, *P < 0.05, **P < 0.01, ***P < 0.001 vs pH 6.8 (yellow bar)]. A: Representative recordings of APs induced by step current injection (500 ms, 220 pA); B: Statistical analysis of the number of APs in response to increasing step current injections; C: APs in response to increasing step current injections in the presence of 3 μmol/L DA; D: APs in response to increasing step current injections in the presence of 10 μmol/L SR-95531. |
在本研究中我们使用了场电位记录方式和全细胞膜片钳记录方式在海马脑片上探究细胞外酸化以及酸敏感离子通道拮抗剂对于癫痫样放电模式改变的作用,和对神经元内在兴奋性的影响。我们主要发现了:(1)细胞外酸化弱化癫痫样放电,并且发作性癫痫样放电模式会转换成非发作性癫痫样放电模式;(2)细胞外酸化可减弱神经元的内在兴奋性;(3)细胞外酸化减弱发作性癫痫样放电和神经元兴奋性的作用均不依赖于ASICs的作用;(4)在胞外酸化环境下,ASICs可通过直接作用于兴奋性神经元减弱非发作性癫痫样放电的频率。
细胞内外的稳态平衡是维持神经系统正常运转的重要条件。而在神经系统中,大量的酸碱缓冲因子例如CO32-/HCO3-、HPO42-/H2PO4-等使得细胞外基质的pH值保持在7.4左右[13]。然而多种神经系统疾病如脑缺血[14-15]、中风[16-17]、阿尔兹海默症[18]、帕金森疾病[19]、癫痫[11, 20]等,均可导致细胞外酸碱平衡紊乱,过多的酸性物质如H+、HCO3-等堆积,导致酸中毒的病理状态[21]。而这种酸中毒在大多数情况下存在着不良的后果,多是通过包括ASICs、Na+-H+交换器等引起继发性的神经系统损伤和神经元的死亡[16, 22]。一般来说,细胞外碱中毒促进神经元的兴奋和突触传递[23],而细胞外的酸化降低神经元的兴奋性和突触传递[24]。恢复酸碱平衡和阻断酸中毒下游通路是消除酸中毒中神经元死亡等不良后果的两种有希望的途径。然而,考虑到神经系统酸碱平衡机制的复杂性,阻断酸中毒下游通路更为容易操控,因此ASICs成为酸中毒相关疾病的首选治疗靶点。
ASICs是酸敏感、Na+和Ca2+通透的离子通道家族,在癫痫发作时导致的细胞外酸化中发挥中关键的作用[25]。一般来说,细胞外酸化可激活ASICs,并产生去极化电流[26-27]。由于ASICs在神经系统中广泛表达[28],因此细胞外酸化可能激活抑制性中间神经元,从而提升神经系统整体的抑制性,介导癫痫的自发终止过程。同时由于ASICs也在锥体神经元中表达,细胞外酸化也有可能提升神经元的兴奋性,进而促进癫痫的发作[29-30]。有研究证明,细胞外酸化可使神经元膜电位去极化,并有ASICs依赖的诱导自发动作电位的生成[31]。然而除去对神经元的去极化作用,ASICs还可以直接抑制单个神经元的动作电位的爆发,即当神经元产生爆发放电时,ASICs的激活可抑制这种动作电位的爆发[28, 32]。
因此在本实验中首先使用场电位记录的方式,使用高钾模型研究细胞外酸化对癫痫样放电的影响。我们观察到细胞外酸化可明显降低癫痫样放电的程度。同时癫痫样放电的模式也有所改变,从发作性癫痫样放电转换为非发作性癫痫样放电。同时为了排除细胞外酸化通过ASICs对抑制性中间神经元的激活作用,我们同样使用了GABAA受体拮抗剂的去抑制癫痫样模型。结果与高钾模型基本一致。同时我们还使用了ASICs拮抗剂DA抑制ASICs在细胞外酸化中的作用。我们发现,使用DA的确可阻断细胞外酸化中对于非发作性癫痫样放电活动的抑制作用,但是并不能改变癫痫样放电模式的转换。同时也表明细胞外酸化对癫痫样放电的弱化作用可能是通过直接作用于锥体神经元,从而改变癫痫样放电的模式转换。我们使用全细胞膜片钳记录的方式检测了细胞外酸化对神经元的影响,发现细胞外酸化可明显降低神经元的兴奋性。同时细胞外酸化在对神经元的低频放电并无太大影响,但是在神经元高频放电时,细胞外酸化可明显降低神经元的放电频率。我们推测这种细胞外酸化对于神经元高频放电的抑制性可能与癫痫样放电的模式转换有关。
综上所述,我们研究结果显示细胞外酸化对癫痫样放电有抑制作用,将发作性癫痫样放电转为非发作性癫痫样放电,在病理上意义可能是将同步化全面性扩散性癫痫样放电转为较局限的癫痫样放电,但细胞外酸化对癫痫样放电的抑制作用不依赖于ASICs。而在酸性环境下,ASICs对非发作性癫痫样放电具有抑制作用,且该作用依赖于ASICs。因此,以ASICs为靶点的癫痫治疗需要考虑癫痫样放电模式的选择性。
| [1] |
Zilberter Y, Zilberter T, Bregestovski P. Neuronal activity in vitro and the in vivo reality: the role of energy homeostasis[J]. Trend Pharmacol Sci, 2010, 31(9): 394-401. DOI:10.1016/j.tips.2010.06.005 |
| [2] |
Li S, Zhu AW, Zhu T, et al. Single biosensor for simultaneous quantification of glucose and pH in a rat brain of diabetic model using both current and potential outputs[J]. Anal Chem, 2017, 89(12): 6656-62. DOI:10.1021/acs.analchem.7b00881 |
| [3] |
Wang YC, Li WZ, Wu Y, et al. Acid-sensing Ion channel 1a contributes to the effect of extracellular acidosis on NLRP1 inflammasome activation in cortical neurons[J]. J Neuroinflammation, 2015, 12: 246. DOI:10.1186/s12974-015-0465-7 |
| [4] |
Huang L, Zhao SD, Lu W, et al. Acidosis-induced dysfunction of cortical GABAergic neurons through astrocyte-related excitotoxicity[J]. PLoS One, 2015, 10(10): e0140324. DOI:10.1371/journal.pone.0140324 |
| [5] |
Lee HN, Eom S, Kim SH, et al. Epilepsy characteristics and clinical outcome in patients with mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes (MELAS)[J]. Pediatr Neurol, 2016, 64: 59-65. DOI:10.1016/j.pediatrneurol.2016.08.016 |
| [6] |
Yang Y, Zhu BL, Zheng FS, et al. Chronic metformin treatment facilitates seizure termination[J]. Biochem Biophys Res Commun, 2017, 484(2): 450-5. DOI:10.1016/j.bbrc.2017.01.157 |
| [7] |
Bassilana F, Champigny G, Waldmann R, et al. The acid-sensitive ionic channel subunit ASIC and the mammalian degenerin MDEG form a heteromultimeric H+-gated Na+ channel with novel properties[J]. J Biol Chem, 1997, 272(46): 28819-22. DOI:10.1074/jbc.272.46.28819 |
| [8] |
Quagliato LA, Freire RC, Nardi AE. The role of acid-sensitive Ion channels in panic disorder: a systematic review of animal studies and meta-analysis of human studies[J]. Transl Psychiatry, 2018, 8(1): 185. DOI:10.1038/s41398-018-0238-z |
| [9] |
Deval E, Gasull X, Noël J, et al. Acid-sensing Ion channels (ASICs): pharmacology and implication in pain[J]. Pharmacol Ther, 2010, 128(3): 549-58. DOI:10.1016/j.pharmthera.2010.08.006 |
| [10] |
Ievglevskyi O, Isaev D, Netsyk O, et al. Acid-sensing Ion channels regulate spontaneous inhibitory activity in the hippocampus: possible implications for epilepsy[J]. Philos Trans R Soc Lond, B, Biol Sci, 2016, 371(1700): 20150431. DOI:10.1098/rstb.2015.0431 |
| [11] |
Cao QQ, Wang W, Gu J, et al. Erratum to: elevated expression of acidsensing Ion channel 3 inhibits epilepsy via activation of interneurons[J]. Mol Neurobiol, 2016, 53(1): 499. |
| [12] |
Badawy R, MacDonell R, Jackson G, et al. The peri-ictal state: cortical excitability changes within 24 h of a seizure[J]. Brain, 2009, 132(Pt 4): 1013-21. |
| [13] |
Feng Li, Chao Chen, Xixi Yang, et al. Acetal-linked hyperbranched polyphosphoester nanocarriers loaded with chlorin e6 for pHactivatable photodynamic therapy[J]. ACS Appl Mater Interfaces, 2018, 10(25): 21198. DOI:10.1021/acsami.8b06758 |
| [14] |
Li MH, Leng TD, Feng XC, et al. Modulation of Acid-sensing Ion channel 1a by intracellular pH and Its role in ischemic stroke[J]. J Biol Chem, 2016, 291(35): 18370-83. DOI:10.1074/jbc.M115.713636 |
| [15] |
Redd M, Scheuer S, Saez N, et al. Acid sensing ion channel 1a is a key mediator of cardiac ischemia-reperfusion injury[J]. BioRxiv, 2019, 2019: 869826. |
| [16] |
Chassagnon IR, McCarthy CA, Chin YK, et al. Potent neuroprotection after stroke afforded by a double-knot spider-venom peptide that inhibits acid-sensing Ion channel 1a[J]. Proc Natl Acad Sci USA, 2017, 114(14): 3750-5. DOI:10.1073/pnas.1614728114 |
| [17] |
Ren YD, Li CC, Chang JL, et al. Hi1a as a novel neuroprotective agent for ischemic stroke by inhibition of acid-sensing Ion channel 1a[J]. Transl Stroke Res, 2018, 9(2): 96-8. DOI:10.1007/s12975-017-0575-x |
| [18] |
Gonzales EB, Sumien N. Acidity and acid-sensing Ion channels in the normal and Alzheimer's disease brain[J]. J Alzheimers Dis, 2017, 57(4): 1137-44. DOI:10.3233/JAD-161131 |
| [19] |
Zhao JJ, Yu SQ, Zheng Y, et al. Oxidative modification and its implications for the neurodegeneration of Parkinson's disease[J]. Mol Neurobiol, 2017, 54(2): 1404-18. DOI:10.1007/s12035-016-9743-3 |
| [20] |
Cao Q, Xiao ZM, Wang X, et al. Inhibition of acid sensing Ion channel 3 aggravates seizures by regulating NMDAR function[J]. Neurochem Res, 2018, 43(6): 1227-41. DOI:10.1007/s11064-018-2540-9 |
| [21] |
Jalalvand E, Robertson B, Tostivint H, et al. The spinal cord has an intrinsic system for the control of pH[J]. Curr Biol, 2016, 26(10): 1346-51. DOI:10.1016/j.cub.2016.03.048 |
| [22] |
Osei OJ, Yang JH, Del Carmen Vitery M, et al. PAC proton-activated chloride channel contributes to acid-induced cell death in primary rat cortical neurons[J]. Channels (Austin), 2020, 14(1): 53-8. DOI:10.1080/19336950.2020.1730019 |
| [23] |
Jang IS, Nakamura M, Kubota H, et al. Extracellular pH modulation of excitatory synaptic transmission in hippocampal CA3 neurons[J]. J Neurophysiol, 2020. DOI:10.1152/jn.00013.2020 |
| [24] |
Chiacchiaretta M, Latifi S, Bramini M, et al. Neuronal hyperactivity causes Na +/H + exchanger-induced extracellular acidification at active synapses[J]. J Cell Sci, 2017, 130(8): 1435-49. DOI:10.1242/jcs.198564 |
| [25] |
Lasoń W, Chlebicka M, Rejdak K. Research advances in basic mechanisms of seizures and antiepileptic drug action[J]. Pharmacol Rep, 2013, 65(4): 787-801. DOI:10.1016/S1734-1140(13)71060-0 |
| [26] |
Bolshakov KV, Essin KV, Buldakova SL, et al. Characterization of acid-sensitive Ion channels in freshly isolated rat brain neurons[J]. Neuroscience, 2002, 110(4): 723-30. DOI:10.1016/S0306-4522(01)00582-6 |
| [27] |
Shafaat OS, Winkler JR, Gray HB, et al. Photoactivation of an acidsensitive Ion channel associated with vision and pain[J]. Chem Bio Chem, 2016, 17(14): 1323-7. DOI:10.1002/cbic.201600230 |
| [28] |
Cakir Z, Yildirim C, Buran I, et al. Acid-sensing Ion channels (ASICs) influence excitability of stellate neurons in the mouse cochlear nucleus[J]. J Comp Physiol A Neuroethol Sens Neural Behav Physiol, 2019, 205(5): 769-81. DOI:10.1007/s00359-019-01365-x |
| [29] |
Quansah H, N'Gouemo P. Amiloride and SN-6 suppress audiogenic seizure susceptibility in genetically epilepsy-prone rats[J]. CNS Neurosci Ther, 2014, 20(9): 860-6. DOI:10.1111/cns.12296 |
| [30] |
Yang F, Sun XL, Ding YX, et al. Astrocytic acid-sensing Ion channel 1a contributes to the development of chronic epileptogenesis[J]. Sci Rep, 2016, 6: 31581. DOI:10.1038/srep31581 |
| [31] |
Roberta DC, Chaabane L, Biffi E, et al. Down-sizing of neuronal network activity and density of presynaptic terminals by pathological acidosis are efficiently prevented by diminazene aceturate[J]. Brain Behav Immun, 2015, 45: 263-76. DOI:10.1016/j.bbi.2014.12.003 |
| [32] |
Alijevic O, Bignucolo O, Hichri E, et al. Slowing of the time course of acidification decreases the acid-sensing ion channel 1a current amplitude and modulates action potential firing in neurons[J]. Frontn Cell Neurosci, 2020, 14: 41. |
 2020, Vol. 40
2020, Vol. 40

