2. 西安医学院基础与转化医学研究所,陕西 西安 710061
2. Institute of Basic and Translational Medicine, Xi'an Medical College, Xi'an 710061, China
缺血性心脏病是冠状动脉缺血引发的慢性心肌受损性疾病,是全世界范围内导致死亡的主要原因,在我国是仅次于脑血管疾病的第二大死因[1]。采用溶栓或经皮冠状动脉血管成形术尽早恢复缺血心肌血流供应,是目前最有效的临床治疗手段[2-3]。然而,血流恢复的同时会进一步加重损伤,表现为心脏收缩舒张功能障碍,心肌收缩力下降,心肌细胞死亡增多,出现缺血再灌注(IR)损伤,这大大限制了临床治疗效果[4-6]。以往研究证实,挛缩是缺血再灌注过程中不可避免的一种重要病理现象[7-9],是形成缺血再灌注损伤的重要原因。目前除了2, 3-丁二酮单肟(BDM)外,还未见其它有关抑制挛缩的药物报道,寻找能有效减轻挛缩改善缺血再灌注损伤的药物,成为临床和基础研究中亟待解决的难题。
褪黑素(Mel)是一种松果体分泌的吲哚类神经内分泌激素,在调节神经、内分泌和免疫功能等方面发挥重要作用[10]。大量研究报道了褪黑素在减轻氧化应激、减少细胞凋亡、改善胞内钙稳态和内质网应激从而减小心肌损伤的作用[11-14]。尽管褪黑素在心血管疾病中具有明确的保护作用[15-17],但其是否能通过抑制挛缩改善缺血再灌注损伤并不清楚,本研究采用离体心脏缺血再灌注模型,探讨褪黑素抑制挛缩改善心肌缺血再灌注损伤的作用及其可能的机制。
1 材料和方法 1.1 实验动物与试剂40只健康成年雄性SD大鼠,购于西安交通大学实验动物中心,体质量220~250 g;Mel、2, 3-丁二酮单肟(BDM)和2、3、5-氯化三苯基四氮唑(TTC)购自Sigma公司;LDH活性检测试剂盒购自R & D公司;cTnI、ATP和caspase-3活性检测试剂盒购自南京建成生物公司;cytochrome c、cleaved caspase-3抗体购自Cell Siginal Technology公司,GAPDH、辣根过氧化物酶标记的山羊抗兔和山羊抗鼠二抗购自北京中杉金桥生物技术有限公司。正常灌流液Krebs-Henseleit(KH)组分和含量:NaCl 118 mmol/L,MgSO4 1.2 mmol/L,NaHCO3 25 mmol/L,KH2PO4 1.2 mmol/L,KCl 4.7 mmol/L,CaCl21.25 mmol/L,Glucose 11 mmol/L,pH维持7.4,温度维持在37 ℃。用体积分数为95% O2和5% CO2混合气体向KH液中通气至实验结束。
1.2 制备大鼠离体心脏灌流模型大鼠腹腔注射500 U/kg肝素和40 mg/kg戊巴比妥钠(30 g/L),麻醉好后开胸快速取出心脏放置于预冷的KH液中。将主动脉根部固定于Langendorff灌流管口,37 ℃恒温KH液经主动脉口逆行恒压灌注,灌注压为80 mmHg。待心脏复跳后,在左心耳处剪一小口,将前端带有乳胶球囊的导管经二尖瓣插入左心室,导管与压力换能器相连并通过记录仪将数据保存在计算机中。调节球囊内的液体量使稳定期左心室舒张末压维持在0~5 mmHg,对心脏平衡灌注15 min,待其跳动稳定后标记为灌注开始,并按照实验分组进行处理。
1.3 实验分组40只大鼠按随机数字表法分成4组(10只/组):正常对照组(Control):KH液正常灌注175 min;缺血再灌注组(IR):KH液正常灌注10 min,全心缺血45 min,恢复KH液灌注120 min;Mel处理缺血再灌注组(Mel+IR):KH液正常灌注9 min,用含Mel的KH液灌注1 min,全心缺血45 min,用含Mel的KH液灌注5 min,KH液正常灌注115 min;BDM处理缺血再灌注组(BDM+IR):KH液正常灌注9 min,用含BDM的KH液灌注1 min,全心缺血45 min,用含BDM的KH液灌注5 min,KH液正常灌注115 min。根据文献报道确定Mel(5 μmol/L)和BDM(20 mmol/L)浓度[7, 18]。
1.4 心脏功能的测定实验全程记录左室内压(LVP)、左室舒张末压(LVEDP)和左室收缩峰压(LVPSP)的变化。左室发展压(LVDP)数值采用LVPSP和LVEDP的差值计算,其大小反映左室收缩功能。LVEDP的数值可直接反映左室舒张功能,是检测挛缩发生的一个重要直观的指标。
1.5 心肌损伤面积测定实验结束后,立即取下心脏冻存于-80 ℃冰箱约1 h;沿心尖向心底部将心脏连续切成6片厚度约2 mm左右的切片,放入1% TTC溶液并在37 ℃水浴中避光孵育15 min;然后用4%多聚甲醛室温过夜固定;心脏切片用数码相机拍照,使用OPTIMASv5.2软件测量心肌死亡面积。红色区代表正常心肌组织,白色区代表死亡心肌组织,计算心肌死亡面积百分比(%)=(白色区面积/总面积)×100%。
1.6 HE染色再灌注结束后,取各组左室相同部位心肌组织,用4%多聚甲醛固定过夜,行常规脱水、石蜡包埋和切片,严格按照HE染色方法的步骤行常规染色,采用普通光学显微镜拍照并保存。
1.7 LDH活性、cTnI含量和ATP含量检测收集各组再灌注开始后前5 min内的冠脉流出液,根据R & D公司和南京建成生物公司提供的ELISA试剂盒说明书采用酶标仪检测各组冠脉流出液中LDH活性和cTnI含量,并按照说明书将对照组测量的LDH或cTnI吸光值设定为1,其他组测量的LDH活性或cTnI含量以各组吸光值/对照组吸光值来表示。取各组大鼠左室相同部位心肌组织,提取蛋白,采用BCA比色法进行蛋白定量,根据南京建成生物公司提供的ELISA试剂盒说明书采用酶标仪检测各组心肌组织ATP含量。
1.8 透射电镜观察收缩带的形成取左室心肌在含有100 mmol/L磷酸盐缓冲液的4%戊二醛中浸泡固定过夜,然后用1%四氧化锇室温下固定2 h。将心肌组织依次在梯度浓度的乙醇中脱水并嵌入环氧树脂中固定,切成0.5 μm厚的薄片,用1%亚甲基蓝染色1 h,光镜下选定代表性区域后,用超微切片机将薄片切成50~70 nm厚,并用1 %醋酸铀酰和2%柠檬酸铅染色30 min,透射电子显微镜(FEI, Thermo Fisher Scientific)下观察收缩带的形成。
1.9 Western blot法检测cleaved caspase-3和cytochrome c蛋白的表达取各组大鼠左室相同部位心肌组织,提取蛋白,采用BCA比色法进行蛋白定量;配制12% SDS-PAGE分离胶和5%浓缩胶,蛋白样品用金属浴98 ℃煮10 min,每孔蛋白样品上样均为35 μg,置于电泳缓冲液中电泳,将目的蛋白分离后,恒压90 V转膜70 min,将目的蛋白转移至PVDF膜上。用5%脱脂奶粉室温封闭2 h,然后将目的条带切下并用cleaved caspase-3、cytochrome c(稀释度为1:1000)和GAPDH一抗(稀释度为1:5000)4 ℃孵育过夜;第2天,TBST洗膜后,用HRP标记的山羊抗兔和山羊抗鼠二抗(稀释度为1:5000)室温摇床孵育90 min,TBST洗膜,ECL显色,用Image J图像分析软件进行灰度值分析。以GAPDH作为内参。
1.10 统计学分析数据采用均数±标准差表示,应用GraphPad Prism 5.0统计软件进行分析,各组间差异比较采用单因素方差分析,两组间比较采用Tukey检验,以P < 0.05表示差异有统计学意义。
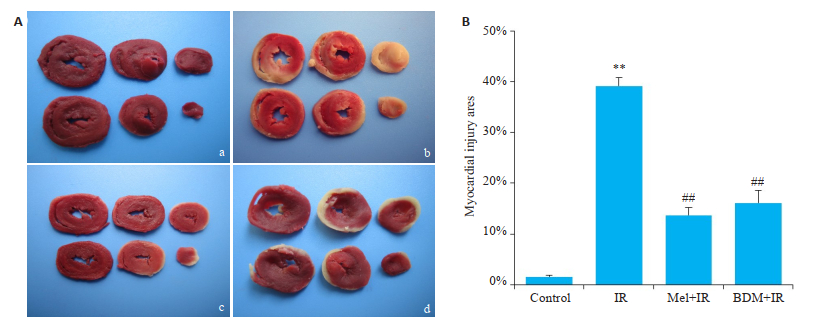
2 结果 2.1 Mel和BDM减小缺血再灌注心肌损伤面积心脏缺血再灌注后会出现明显的心肌细胞死亡。TTC染色结果显示,与Control组相比,IR组心肌死亡面积明显增加(P < 0.01);而与IR组相比,分别给予5 μmol/L Mel或20 mmol/L BDM处理后,可显著减小IR引起的心肌细胞死亡(P < 0.01,图 1)。
|
图 1 各组心肌死亡面积的比较 Fig.1 Myocardial injury area in each group. A: TTC staining (a: Control; b: IR; c: Mel + IR; d: BDM + IR); B: Comparison of myocardial injury area. **P < 0.01 vs control, ##P < 0.01 vs IR. |
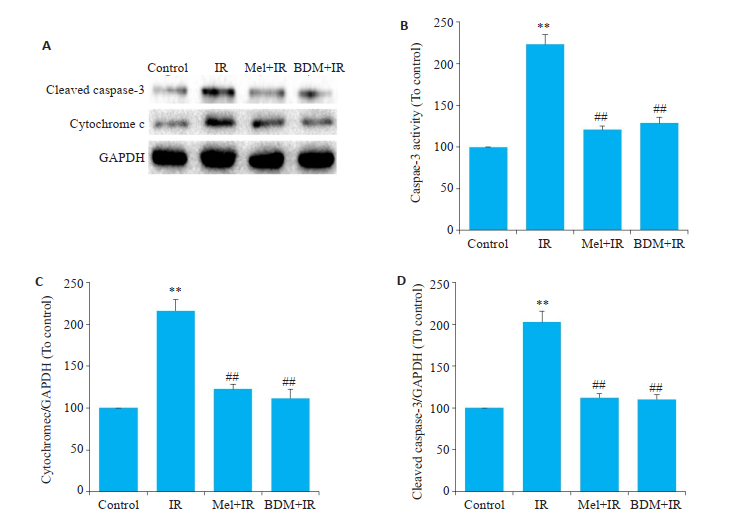
细胞凋亡是心脏缺血再灌注过程中一种重要的细胞死亡方式。Western blot结果显示,与Control组相比,IR组cytochrome c和cleaved caspase-3蛋白表达量显著升高(P < 0.01);而分别给予5 μmol/LMel或20 mmol/L BDM处理后,可显著降低cytochrome c和cleaved caspase-3的表达(P < 0.01);同时,ELISA检测发现:与Control组相比,IR组caspase-3活性显著升高(P < 0.01);而与IR组相比,给予5 μmol/L Mel或20 mmol/L BDM处理后,可显著抑制caspase-3活性(P < 0.01,图 2)。
|
图 2 各组心肌细胞凋亡的变化 Fig.2 Apoptosis of the cardiac myocytes in each group. A: Expressions of cleaved caspase-3 and cytochrome c; B: Caspase-3 activity; C: Comparison of cytochrome c; D: Comparison of cleaved caspase-3. **P < 0.01 vs control, ##P < 0.01 vs IR. |
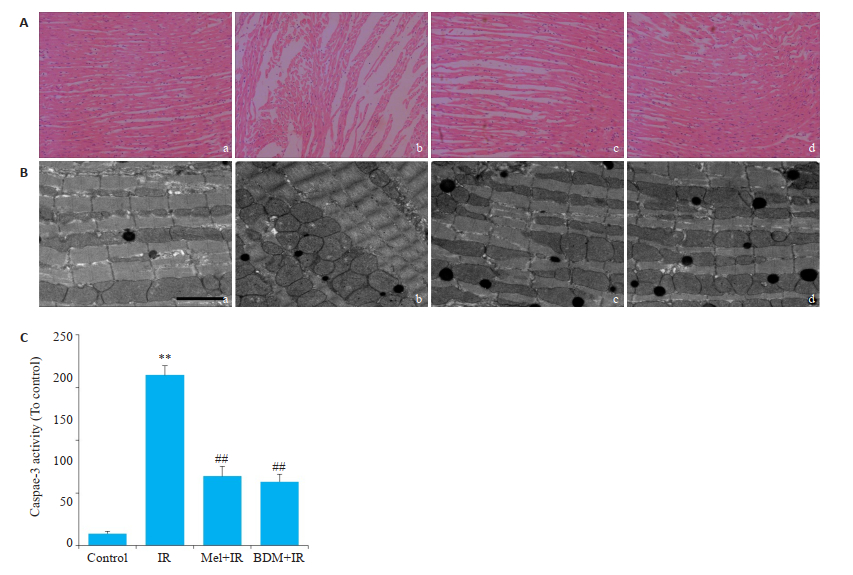
心肌肌节过度收缩形成的肌原纤维收缩带,使机械张力增大导致部分心肌纤维断裂并引起心脏舒张功能障碍,表现为左室舒张末压抬升。如图 3所示,HE染色结果显示,Control组心肌纤维排列整齐,结构清晰,无断裂现象;IR组心肌纤维明显断裂,纤维排列紊乱,细胞核逸出;而分别给予5 μmol/L Mel或20 mmol/L BDM处理后,心肌纤维断裂显著减少,排列明显改善(图 3A)。心脏功能结果显示,与Control组相比,IR组心脏功能显著降低,表现为LVEDP显著抬升(P < 0.01);而与IR组相比,给予5 μmol/L Mel或20 mmol/L BDM处理后,可显著降低LVEDP(P < 0.01,图 3C)。另外,电镜结果显示,Control组细胞膜完整,肌节间距正常;IR组肌节显著缩短,形成明显收缩带;5 μmol/L Mel或20 mmol/L BDM处理后,可明显增加肌节间距,抑制收缩带的形成(图 3B)。
|
图 3 各组HE染色、LVEDP和收缩带的比较 Fig.3 HE staining, LVEDP and contraction band in each group (Original magnification: ×200). A: HE staining of myocardial tissue (a: Control; b: IR; c: Mel + IR; d: BDM + IR); B: Comparison of LVEDP. C: Representative electron microscopy images (a: Control; b: IR; c: Mel + IR; d: BDM + IR). **P < 0.01 vs control, ##P < 0.01 vs IR. Bar: 1 μm. |
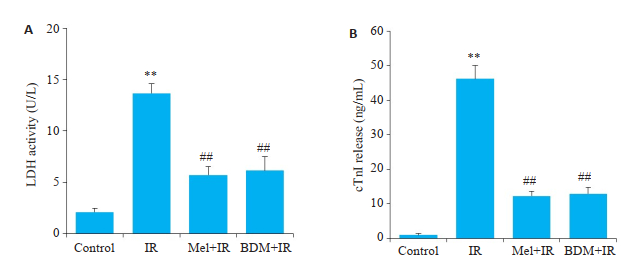
缺血再灌注时肌原纤维收缩带的形成,会引起机械应力显著增加从而导致心肌细胞膜撕裂,使细胞内容物如LDH和cTnI随灌注液流出。如图 4所示,ELISA检测发现,与Control组相比,IR组冠脉流出液中LDH活性和cTnI含量显著增加(P < 0.01);而与IR组相比,分别给予5 μmol/L Mel或20 mmol/L BDM处理后,可显著降低冠脉流出液中LDH活性和cTnI含量(P < 0.01)。
|
图 4 各组冠脉流出液中LDH活性和cTnI的含量 Fig.4 LDH activity and cTnI content in the coronary outflow. A: LDH activity; B: cTnI content; **P < 0.01 vs control, ##P < 0.01 vs IR. |
缺血再灌注时心肌组织内ATP含量的减少是导致挛缩形成的一个重要原因。如图 5所示,ELISA检测发现,与Control组相比,IR组心肌组织中ATP含量显著降低(P < 0.01);而与IR组相比,分别给予5 μmol/L Mel或20 mmol/L BDM处理后,心肌组织内ATP含量明显增加(P < 0.01)。
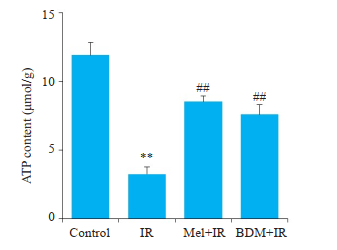
|
图 5 各组心肌细胞内ATP含量比较 Fig.5 Content of ATP in each group. **P < 0.01 vs control, ##P < 0.01 vs IR. |
心肌缺血再灌注损伤是临床上采用溶栓或冠状动脉成形术治疗急性心肌梗死以及心脏停跳手术等治疗方法不可避免的伴随事件,可触发心肌顿抑、心律失常,甚至进展为心力衰竭[19-24]。以往的研究表明,缺血再灌注时肌原纤维过度收缩形成挛缩,引起机械应力显著增加诱发舒张功能障碍是导致缺血再灌注损伤的重要因素,也是临床上形成“石头心”的主要原因[25]。然而,到目前为止临床上仍没有很好的防治办法,因此,寻找能够抑制或改善挛缩的药物成为防治“石头心”的关键。
而BDM作为肌球蛋白和肌动蛋白的解偶联剂,是一种可产生负性肌力作用的药物,可显著抑制心肌挛缩,是停搏液的重要成分之一,具有减少心肌能量消耗,提高心脏对缺血和停搏的耐受力,改善心肌耗氧的供需平衡等作用[26]。作为基础研究中抑制挛缩的工具药被广泛使用,因此,本研究中我们选择BDM作为阳性对照药物。挛缩可通过损伤细胞膜骨架蛋白,引起细胞死亡,最终导致梗死面积增大[27-28];此外,挛缩还会引起线粒体损伤,触发线粒体通透性转换孔(MPTP)的开放[28],而MPTP开放会导致细胞色素c释放到胞质,触发细胞凋亡过程。Mel作为一种内源性吲哚类激素,由于其具有抗氧化应激、抗炎症、减轻细胞凋亡和坏死、改善线粒体损伤等功能,因而在临床和基础研究中得到了广泛的关注,并被证实在心血管系统中发挥重要保护作用[29]。与以往的报道一致[7, 18],本实验结果发现,Mel和BDM都可明显减小IR引起的心肌损伤面积,降低凋亡蛋白cleaved caspase-3和cytochrome c的表达,抑制caspase-3的活性,这些结果进一步证实了Mel和BDM都可以明显减少IR引起的细胞死亡,减轻心肌缺血再灌注损伤,发挥心肌保护作用。
挛缩是导致心肌缺血再灌注损伤的一个重要原因,肌原纤维过度收缩形成的机械应力会引起心脏舒张功能障碍。同时,机械应力的增加还会导致心肌细胞膜不同程度的撕裂,使部分心肌纤维发生断裂,并导致细胞膜通透性增大。这一方面可以引起细胞外染料如伊文思蓝穿透细胞膜进入细胞内,另外还能引起细胞内容物LDH和cTnI的外漏[30]。因此,LDH和cTnI的量在一定程度上反映了挛缩的强度。本实验观察到,IR组冠脉流出液中LDH活性和cTnI含量显著增加,心肌纤维断裂明显,这表明IR组心肌细胞膜出现严重撕裂,纤维断裂,LDH和cTnI等细胞内容物大量漏出。而Mel和BDM可减轻心肌纤维断裂,减少LDH和cTnI的漏出;另外,挛缩发生时会出现肌节过度收缩,形成明显的收缩带,并导致左室舒张功能障碍,表现为再灌注期LVEDP显著抬升。本实验发现,IR组肌节过度收缩并形成明显收缩带,同时LVEDP显著抬升,而Mel和BDM处理后可显著抑制肌节过度收缩和收缩带形成,并降低LVEDP。结合以上这些实验结果,本研究提示,与BDM作用一样,Mel可减轻挛缩的发生。
以往的研究报道,细胞内Ca2+超载和ATP含量降低是导致挛缩产生的重要机制[8, 31]。我们之前的研究发现[32],Mel可以改善离体大鼠心脏钙超载损伤,这与Mel抑制Ca2+超载损伤有关。然而Mel是否可以通过提高细胞内ATP含量,减轻挛缩从而改善心肌缺血再灌注损伤,还未见报道。本实验结果显示,IR组心肌细胞内ATP的含量显著降低,同时伴有心肌损伤和挛缩程度的加重,而Mel和BDM干预后能增加胞内ATP含量,并减轻心肌损伤和挛缩的发生。这些结果提示,Mel减轻挛缩的作用与增加心肌细胞内ATP含量有关。
综上所述,挛缩是导致心肌缺血再灌注损伤的一个重要原因,本实验进一步明确了Mel改善心肌缺血再灌注损伤的作用,并证实其改善缺血再灌注损伤的作用机制是通过增加胞内ATP含量,降低挛缩程度,减轻细胞膜撕裂减少细胞内容物的漏出。本研究结果为临床上应用Mel防治缺血再灌注损伤提供了新的实验依据和理论支持。
| [1] |
张干深, 宇传华, 罗丽莎, 等. 1990—2015年中国缺血性心脏病疾病负担趋势分析[J]. 中华预防医学杂志, 2017, 51(10): 915-21. DOI:10.3760/cma.j.issn.0253-9624.2017.10.009 |
| [2] |
Ibáñez B, Heusch G, Ovize M, et al. Evolving therapies for myocardial ischemia/reperfusion injury[J]. J Am Coll Cardiol, 2015, 65(14): 1454-71. DOI:10.1016/j.jacc.2015.02.032 |
| [3] |
Bagai A, Dangas GD, Stone GW, et al. Reperfusion strategies in acute coronary syndromes[J]. Circ Res, 2014, 114(12): 1918-28. DOI:10.1161/CIRCRESAHA.114.302744 |
| [4] |
Cadenas S. ROS and redox signaling in myocardial ischemiareperfusion injury and cardioprotection[J]. Free Radic Biol Med, 2018, 117: 76-89. DOI:10.1016/j.freeradbiomed.2018.01.024 |
| [5] |
Hausenloy DJ, Yellon DM. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. J Clin Invest, 2013, 123(1): 92-100. DOI:10.1172/JCI62874 |
| [6] |
Heusch G. Molecular basis of cardioprotection: signal transduction in ischemic pre-, post-, and remote conditioning[J]. Circ Res, 2015, 116(4): 674-99. DOI:10.1161/CIRCRESAHA.116.305348 |
| [7] |
孔令恒, 顾晓明, 苏兴利, 等. 2, 3-丁二酮单肟改善大鼠离体心脏钙反常损伤的作用及机制[J]. 南方医科大学学报, 2016, 36(5): 633-8. DOI:10.3969/j.issn.1673-4254.2016.05.007 |
| [8] |
Garcia-Dorado D, Ruiz-Meana M, Inserte J, et al. Calcium-mediated cell death during myocardial reperfusion[J]. Cardiovasc Res, 2012, 94(2): 168-80. |
| [9] |
Ragone MI, Bonazzola P, Colareda GA, et al. Cardioprotective effect of hyperthyroidism on the stunned rat heart during ischaemiareperfusion: Energetics and role of mitochondria[J]. Exp Physiol, 2015, 100(6): 680-97. DOI:10.1113/EP085063 |
| [10] |
Tordjman S, Chokron S, Delorme R, et al. Melatonin: pharmacology, functions and therapeutic benefits[J]. Curr Neuropharmacol, 2017, 15(3): 434-43. DOI:10.2174/1570159X14666161228122115 |
| [11] |
Favero G, Franceschetti L, Buffoli B, et al. Melatonin: Protection against age-related cardiac pathology[J]. Ageing Res Rev, 2017, 35: 336-49. DOI:10.1016/j.arr.2016.11.007 |
| [12] |
Lochner A, Marais E, Huisamen B. Melatonin and cardioprotection against ischaemia/reperfusion injury: What's new? A review[J]. J Pineal Res, 2018, 65(1): e12490. DOI:10.1111/jpi.12490 |
| [13] |
Zhai MG, Liu ZH, Zhang B, et al. Melatonin protects against the pathological cardiac hypertrophy induced by transverse aortic constriction through activating PGC-1β: In vivo and in vitro studies[J]. J Pineal Res, 2017, 63(3): e12433. DOI:10.1111/jpi.12433 |
| [14] |
Pei HF, Hou JN, Wei FP, et al. Melatonin attenuates postmyocardial infarction injury via increasing Tom70 expression[J]. J Pineal Res, 2017, 62(1): e12371. DOI:10.1111/jpi.12371 |
| [15] |
Ma ZQ, Xin ZL, Di WC, et al. Melatonin and mitochondrial function during ischemia/reperfusion injury[J]. Cell Mol Life Sci, 2017, 74(21): 3989-98. DOI:10.1007/s00018-017-2618-6 |
| [16] |
Han D, Huang W, Li X, et al. Melatonin facilitates adipose-derived mesenchymal stem cells to repair the murine infarcted heart via the SIRT1 signaling pathway[J]. J Pineal Res, 2016, 60(2): 178-92. DOI:10.1111/jpi.12299 |
| [17] |
Liu Y, Li LN, Guo S, et al. Melatonin improves cardiac function in a mouse model of heart failure with preserved ejection fraction[J]. Redox Biol, 2018, 18: 211-21. DOI:10.1016/j.redox.2018.07.007 |
| [18] |
Yang Y, Duan WX, Jin ZX, et al. JAK2/STAT3 activation by melatonin attenuates the mitochondrial oxidative damage induced by myocardial ischemia/reperfusion injury[J]. J Pineal Res, 2013, 55(3): 275-86. DOI:10.1111/jpi.12070 |
| [19] |
孔令恒, 刘哲, 张建英, 等. 心肌缺血-再灌注-钙超载损伤的基础与临床研究[J]. 中国体外循环杂志, 2015, 13(4): 253-6. |
| [20] |
Jiang XB, Kong B, Shuai W, et al. Loss of MD1 exacerbates myocardial ischemia/reperfusion injury and susceptibility to ventricular arrhythmia[J]. Eur J Pharmacol, 2019, 844: 79-86. DOI:10.1016/j.ejphar.2018.11.025 |
| [21] |
Wang GX, Zhang Q, Yuan W, et al. Enalapril protects against myocardial ischemia/reperfusion injury in a swine model of cardiac arrest and resuscitation[J]. Int J Mol Med, 2016, 38(5): 1463-73. DOI:10.3892/ijmm.2016.2737 |
| [22] |
Heusch G, Gersh BJ. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge[J]. Eur Heart J, 2017, 38(11): 774-84. |
| [23] |
Woodall MC, Woodall BP, Gao EH, et al. Cardiac fibroblast GRK2 deletion enhances contractility and remodeling following ischemia/reperfusion injury[J]. Circ Res, 2016, 119(10): 1116-27. DOI:10.1161/CIRCRESAHA.116.309538 |
| [24] |
Patil KD, Halperin HR, Becker LB. Cardiac arrest: resuscitation and reperfusion[J]. Circ Res, 2015, 116(12): 2041-9. DOI:10.1161/CIRCRESAHA.116.304495 |
| [25] |
Lee BK, Jeung KW, Choi SS, et al. Effects of the administration of 2, 3-butanedione monoxime during conventional cardiopulmonary resuscitation on ischaemic contracture and resuscitability in a pig model of out-of-hospital cardiac arrest[J]. Resuscitation, 2015, 87: 26-32. DOI:10.1016/j.resuscitation.2014.11.011 |
| [26] |
Hall AR, Hausenloy DJ. Mitochondrial respiratory inhibition by 2, 3-butanedione monoxime (BDM): implications for culturing isolated mouse ventricular cardiomyocytes[J]. Physiol Rep, 2016, 4(1): e12606. DOI:10.14814/phy2.12606 |
| [27] |
Garcia-Dorado D, Théroux P, Duran JM, et al. Selective inhibition of the contractile apparatus. A new approach to modification of infarct size, infarct composition, and infarct geometry during coronary artery occlusion and reperfusion[J]. Circulation, 1992, 85(3): 1160-74. DOI:10.1161/01.CIR.85.3.1160 |
| [28] |
Piper HM, García-Dorado D. Prime causes of rapid cardiomyocyte death during reperfusion[J]. Ann Thorac Surg, 1999, 68(5): 1913-9. DOI:10.1016/S0003-4975(99)01025-5 |
| [29] |
Reiter RJ, Mayo JC, Tan DX, et al. Melatonin as an antioxidant: under promises but over delivers[J]. J Pineal Res, 2017, 61(3): 253-78. |
| [30] |
Kong LH, Gu XM, Wu F, et al. CaMKⅡ inhibition mitigates ischemia/reperfusion-elicited calpain activation and the damage to membrane skeleton proteins in isolated rat hearts[J]. Biochem Biophys Res Commun, 2017, 491(3): 687-92. DOI:10.1016/j.bbrc.2017.07.128 |
| [31] |
Consolini AE, Ragone MI, Bonazzola P, et al. Mitochondrial bioenergetics during Ischemia and reperfusion[J]. Adv Exp Med Biol, 2017, 982: 141-67. |
| [32] |
孔令恒, 魏明, 孙娜, 等. 褪黑素在大鼠离体心脏急性钙超载损伤中的作用[J]. 中南大学学报:医学版, 2017, 42(6): 611-6. |
 2020, Vol. 40
2020, Vol. 40

