2. 郑州大学口腔医学院,河南 郑州 450007
2. School of Stomatology, Zhengzhou University, Zhengzhou 450007, China
牙周炎是临床常见炎症性疾病,具有较高的发病率,已严重危害人类口腔健康,研究表明缺氧环境可促进致病菌生长从而加重牙周炎发生过程,并可促进人牙周膜成纤维细胞等牙周组织细胞凋亡[1]。牙周炎发生时可促进机体免疫细胞释放炎症因子从而加重牙周组织炎症及氧化应激损伤[2-4]。因而如何抑制人牙周膜成纤维细胞凋亡、炎症因子分泌及氧化应激反应成为牙周炎防治亟待解决的问题。骨膜素属于间质特异性分泌蛋白,并可促进成骨细胞分化,还可促进平滑肌细胞增殖及迁移[5]。研究表明骨膜素通过p38 MAPK途径减轻缺氧或缺血性损伤引起的急性肾脏损伤[6]。骨膜素可以通过抑制人类成骨细胞中的eIF2α-ATF4途径从而在褪黑素诱导的细胞凋亡发挥保护作用[7]。研究表明炎症因子可激活P38丝裂原活化蛋白激酶(P38MAPK)信号通路从而参与炎症、氧化应激及细胞凋亡等病理过程[8]。我们之前的研究表明骨膜素可以通过激活Akt/PKB信号通路来抑制缺氧诱导的人牙周膜成纤维细胞的凋亡[9],而骨膜素在人牙周膜成纤维细胞中对p38 MAPK信号通路的影响尚未见相关研究报道。本研究观察骨膜素干预人牙周膜成纤维细胞后对细胞氧化应激、炎症因子及细胞凋亡的影响,及其对P38MAPK信号通路的调控作用,为牙周炎的临床治疗及其基础研究提供新方向。
1 材料和方法 1.1 材料和试剂重组人骨膜素(Minneapolis);p38MAPK激活剂茴香霉素Anisomycin(MedChemExpress);人牙周膜成纤维细胞(BioWhittaker);杜氏改良培养基(DMEM)、0.25%胰蛋白酶、胎牛血清(FBS)(Gibco);厌氧产气袋(拜尔迪生物);膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡试剂盒(BD Biosciences Pharmingen);甲基噻唑基四唑(MTT)与二甲基亚砜(DMSO)(艾美捷);兔抗人缺氧诱导因子1α(HIF-1α)、β-actin抗体与辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗、兔抗人p38 MAPK、磷酸化P38丝裂原活化蛋白激酶(p-p38 MAPK)抗体(Cell Signaling Technology);兔抗人P21、细胞周期蛋白1(CyclinD1)抗体(Santa Cruz);兔抗人B淋巴细胞瘤-2相关蛋白(Bax)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved caspase-3)、B淋巴细胞瘤-2(Bcl-2)抗体(Abcam);白细胞介素-1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子-α(TNF-α)检测试剂盒(Raybiotech);活性氧(ROS)检测试剂盒(碧云天);超氧化物歧化酶(SOD)酶联免疫吸附试验(ELISA)检测试剂盒(建成生物);蛋白提取与蛋白免疫印迹(Western blot)检测实验所需试剂均(生工生物)。
1.2 方法 1.2.1 缺氧处理和实验分组人牙周膜成纤维细胞复苏后置于含有10%FBS的DMEM培养基内培养,培养环境37 ℃、5%CO2培养箱,每隔24 h更换1次培养液。取人牙周膜成纤维细胞置于厌氧产气袋内,条件:O2含量处于1%左右,密封处理48 h。将未经过缺氧处理的细胞作为空白组,缺氧处理的细胞作为缺氧组。取生长状态良好的细胞制备单细胞悬液,调整细胞密度至1×105/mL,将细胞悬液按照每孔100 μL的密度接种于24孔板,按照随机数字表法随机分为骨膜素低、中、高浓度组(细胞缺氧处理后置于含有终浓度为25、50和100 ng/mL骨膜素的培养液中培养24 h)[10]。
1.2.2 MTT检测细胞增殖于培养72 h时收集“1.2.1”实验分组细胞接种于96孔板(3×104个细胞/孔),每组设置3个复孔,加入质量浓度为5 mg/mL的MTT溶液(20 μL/孔),室温孵育4 h,弃孔内培养液,加入DMSO(150 μL/孔),放入振荡仪匀速振荡15 min,应用酶标仪检测波长为490 nm处各孔A490 nm,计算细胞存活率。
1.2.3 流式细胞术检测细胞凋亡收集各组细胞,0.25%胰蛋白酶消化,PBS洗涤,调整细胞密度至2×106/mL,细胞悬液转移至离心管,4 ℃经1000 r/min转速离心10 min,弃上清,加入预冷PBS重悬细胞,相同条件下离心10 min,PBS洗涤,加入200 μL Binding Buffer,分别加入5 μL Annexin V-FITC与PI,充分混匀,室温避光孵育15 min,加入300 μLBinding Buffer,置于FACS Calibur流式细胞仪及应用Cellauest软件检测各组细胞凋亡率。
1.2.4 检测炎症因子IL-1β、IL-6、TNF-α的水平收集各组细胞培养上清液,采用夹心ELISA法测定炎症因子IL-1β、IL-6、TNF-α的含量,严格按照试剂盒说明书进行操作。
1.2.5 检测ROS荧光强度与SOD活性采用不含血清的培养液稀释DCFH-DA(稀释比1:1000),DCFH-DA终浓度为10 μmol/L,将DCFH-DA分别加入“1.2.1”实验分组的细胞中,室温避光孵育20 min,使用不含血清的培养液洗涤,应用荧光酶标仪检测各组细胞内ROS荧光强度。采用0.25%胰蛋白酶消化各组细胞,预冷PBS洗涤细胞,加入500 μLPBS重悬细胞,使用超声波裂解细胞,4 ℃条件下经4000 r/min转速离心15 min,吸取上清液,按照SOD ELISA试剂盒检测SOD活性。
1.2.6 Western blot检测HIF-1α、P21、CyclinD1、Bax、Cleaved caspase-3、Bcl-2与p38 MAPK信号通路相关蛋白表达收集各组细胞,预冷PBS洗涤,加入150 μL细胞裂解液,冰浴30 min,提取各组细胞总蛋白,采用二喹啉甲酸(BCA)法测定各组蛋白含量。取蛋白样品30 μg加入5×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液,充分混合,沸水煮15 min,蛋白变性后进行SDS-PAGE反应,将分离的蛋白凝胶转移至PVDF膜,5%脱脂牛奶封闭2 h,加入1:1000稀释的HIF-1α、P21、CyclinD1、Bax、Cleaved caspase-3、Bcl-2与1:2000稀释的p38 MAPK、p-p38 MAPK、β-actin抗体,4 ℃孵育24 h,TBST洗涤,加入二抗稀释液(1: 5000),室温孵育2 h,TBST洗涤,暗室内曝光,显影,采用Image-Proplus软件对蛋白条带进行灰度值分析,目的蛋白条带灰度值与β-actin条带灰度值的比值即为目的蛋白相对表达量。
1.3 统计学处理采用SPSS21.0统计学软件分析数据,计量资料以均数±标准差表示,数据进行正态分布检验及组间方差齐性检验,符合正态分布及方差齐性,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;不符合正态分布、方差齐性分析的数据,采用Kruska-Wallis H进行统计处理,以P < 0.05为差异具有统计学意义。
2 结果 2.1 骨膜素促进缺氧诱导的人牙周膜成纤维细胞存活实验结果显示,与空白组相比,缺氧组人牙周膜成纤维细胞存活率显著降低(P < 0.05),P21蛋白相对表达量显著升高(P < 0.05),CyclinD1蛋白相对表达量显著降低(P < 0.05);与缺氧组相比,骨膜素低浓度组、骨膜素中浓度组、骨膜素高浓度组人牙周膜成纤维细胞存活率显著升高(P < 0.05),P21蛋白相对表达量显著降低(P < 0.05),CyclinD1蛋白相对表达量显著升高(P < 0.05,图 1、表 1)。
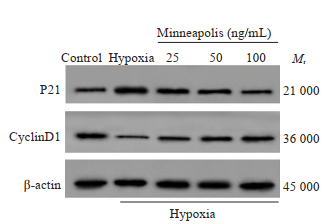
|
图 1 P21和CyclinD1蛋白免疫印迹图 Fig.1 Protein levels of P21 and cyclin D1 in the cells detected by Western blotting. |
| 表 1 骨膜素对缺氧诱导的人牙周膜成纤维细胞存活的影响 Tab.1 Effect of periostin on viability of hypoxia-induced human periodontal ligament fibroblasts(Mean±SD, n=9) |
相较于空白组,缺氧组人牙周膜成纤维细胞凋亡率显著升高(P < 0.05),Bax、Cleaved caspase-3蛋白相对表达量显著升高(P < 0.05),Bcl-2蛋白相对表达量显著降低(P < 0.05);与缺氧组相比,骨膜素低浓度组、骨膜素中浓度组、骨膜素高浓度组人牙周膜成纤维细胞凋亡率显著降低(P < 0.05),Bax、Cleaved caspase-3蛋白相对表达量显著降低(P < 0.05),Bcl-2蛋白相对表达量显著升高(P < 0.05,图 2、表 2)。
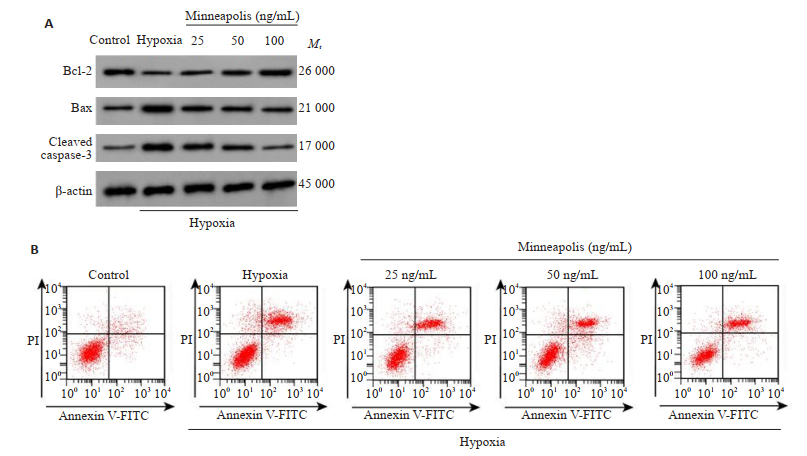
|
图 2 Cleaved caspase-3、Bax、Bcl-2蛋白免疫印迹(A)和细胞凋亡(B) Fig.2 Protein levels of cleaved caspase-3, Bax and Bcl-2 (A) and apoptosis (B) of the cells with different treatments. |
| 表 2 骨膜素对缺氧诱导的人牙周膜成纤维细胞凋亡的影响 Tab.2 Effect of periostin on apoptosis of hypoxia-induced human periodontal ligament fibroblasts (Mean±SD, n=9) |
Western blot检测结果显示,与空白组相比,缺氧组人牙周膜成纤维细胞HIF-1α蛋白相对表达量显著升高(P < 0.05);与缺氧组相比,骨膜素低浓度组、骨膜素中浓度组、骨膜素高浓度组HIF-1α蛋白相对表达量显著降低(P < 0.05,图 3、表 3)。
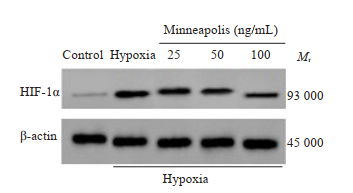
|
图 3 HIF-1α蛋白免疫印迹图 Fig.3 Protein level of HIF-1α. |
| 表 3 骨膜素对缺氧诱导的人牙周膜成纤维细胞HIF-1α蛋白表达的影响 Tab.3 Effect of periostin on HIF-1α expression of hypoxiainduced human periodontal ligament fibroblasts (Mean±SD, n=9) |
实验结果显示,与空白组相比,缺氧组人牙周膜成纤维细胞炎症因子IL-1β、IL-6、TNF-α水平显著升高(P < 0.05);与缺氧组相比,骨膜素低浓度组、骨膜素中浓度组、骨膜素高浓度组人牙周膜成纤维细胞炎症因子IL-1β、IL-6、TNF-α水平显著降低(P < 0.05,表 4)。
| 表 4 骨膜素对缺氧诱导的人牙周膜成纤维细胞IL-1β、IL-6和TNF-α分泌的影响 Tab.4 Effect of periostin on IL-1β, IL-6 and TNF-α expression of hypoxia-induced human periodontal ligament fibroblasts (Mean±SD, n=9) |
相比于空白组,缺氧组人牙周膜成纤维细胞ROS荧光强度显著升高(P < 0.05),SOD活性显著降低(P < 0.05);与缺氧组相比,骨膜素低浓度组、骨膜素中浓度组、骨膜素高浓度组ROS荧光强度显著降低(P < 0.05),SOD活性显著升高(P < 0.05,表 5)。
| 表 5 骨膜素对缺氧诱导的人牙周膜成纤维细胞ROS和SOD产生的影响 Tab.5 Effect of periostin on ROS and SOD production in hypoxia-induced human periodontal ligament fibroblasts (Mean±SD, n=9) |
Western blot检测结果显示,与空白组相比,缺氧组人牙周膜成纤维细胞中p-p38 MAPK蛋白相对表达量显著升高(P < 0.05);与缺氧组相比,骨膜素低浓度组、骨膜素中浓度组、骨膜素高浓度组人牙周膜成纤维细胞中p-p38 MAPK蛋白相对表达量显著降低(P < 0.05),各组间p38 MAPK蛋白相对表达量相比差异无统计学意义(P > 0.05,图 4、表 6)。
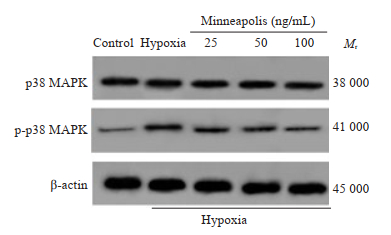
|
图 4 p38 MAPK和p-p38 MAPK蛋白免疫印迹图 Fig.4 The protein level of p38 MAPK and p-p38 MAPK. |
| 表 6 骨膜素对缺氧诱导的人牙周膜成纤维细胞p38 MAPK和p-p38 MAPK蛋白表达的影响 Tab.6 Effect of periostin on p38 MAPK and p-p38 MAPK exprssion of hypoxia-induced human periodontal ligament fibroblasts (Mean±SD, n=9) |
结果如表 7所示,用p38MAPK激活剂Anisomycin(300 ng/mL)处理骨膜素(100 ng/mL)处理后的缺氧诱导人牙周膜成纤维细胞,结果显示ROS荧光强度显著升高,SOD活性显著降低,说明细胞的抗氧化能力降低,证实了p38MAPK激活剂能够逆转骨膜素对缺氧诱导的人牙周膜成纤维细胞氧化应激的保护作用。
| 表 7 p38 MAPK激活剂对缺氧诱导的人牙周膜成纤维细胞氧化应激的影响 Tab.7 Effect of p38MAPK activator on oxidative stress in hypoxia-induced human periodontal ligament fibroblasts (Mean±SD, n=9) |
缺氧诱导的人牙周膜成纤维细胞凋亡可能促进牙周炎的发生及发展,减轻牙周炎引发的氧化应激反应可明显抑制牙周炎症发生及发展[11-15]。因而本研究积极探寻牙周炎相关理论依据。
本研究结果显示缺氧处理后细胞存活率显著降低,而骨膜素处理后细胞存活率显著升高。研究表明CyclinD1属于细胞周期的正调控因子并可促使细胞周期由G1期进入S期,促进细胞增殖,而P21属于细胞周期蛋白激酶抑制剂并可抑制细胞周期进程,抑制细胞增殖[16-18]。本研究结果显示缺氧诱导后细胞中P21蛋白表达水平明显升高,CyclinD1蛋白表达水平明显降低,而骨膜素处理后能够明显逆转这一反应,提示骨膜素可能通过上调CyclinD1表达及下调P21表达从而促进缺氧诱导的人牙周膜成纤维细胞存活。研究表明线粒体凋亡途径是细胞凋亡的主要信号通路之一,Bcl-2是抗凋亡蛋白,Bax是促凋亡蛋白,Bax由细胞浆转移至线粒体内而促进细胞色素C释放进而激活Caspase-9,进一步激活下游caspase-3级联反应从而诱导细胞凋亡[19-21]。本研究结果显示缺氧处理后细胞凋亡率显著升高,Bax、Cleaved caspase-3蛋白表达水平明显升高,Bcl-2蛋白表达水平明显降低,而骨膜素处理后细胞凋亡率显著降低,并可抑制Bax、Cleaved caspase-3蛋白表达,促进Bcl-2蛋白表达,提示骨膜素可能通过抑制线粒体凋亡途径而抑制缺氧诱导的人牙周膜成纤维细胞凋亡。
HIF-1α属于机体缺氧反应的转录因子并可参与机体炎症免疫反应,同时还可促进炎症因子表达及诱导血管新生[22]。本研究结果显示缺氧处理后细胞中HIF-1α蛋白表达水平明显升高,而骨膜素处理后能够明显降低HIF-1α的表达,提示骨膜素可能通过下调HIF-1α表达而减轻缺氧诱导的人牙周膜成纤维细胞炎症损伤。本研究检测各组细胞炎症因子表达水平,结果显示缺氧处理后IL-1β、IL-6、TNF-α水平显著升高,而骨膜素处理后IL-1β、IL-6、TNF-α水平显著降低,与相关文献报道相似[23-25]。研究表明氧化应激与牙周炎发生及发展过程密切相关,正常生理条件下,细胞内ROS生成与清除处于平衡状态,ROS生成量增多促使细胞氧化应激反应的发生从而引发细胞功能障碍,SOD属于抗氧化酶类并可清除机体内氧自由基[26]。本研究结果显示缺氧处理后细胞ROS荧光强度明显增强,SOD活性明显降低,而骨膜素处理后ROS荧光强度明显降低,SOD活性显著升高,说明骨膜素可清除氧自由基从而保护人牙周膜成纤维细胞免受氧化应激损伤。相关报道指出低氧环境可激活p38 MAPK信号通路进而损伤成纤维细胞[27-28]。在各种细胞因子刺激作用下可促进p38 MAPK活化,p38 MAPK从细胞表面转移至细胞核内部从而参与细胞增殖、凋亡等生物学过程,研究表明抑制p38 MAPK信号通路激活可有效抑制心肌成纤维细胞增殖[29]。相关研究报道指出阻断p38 MAPK信号通路可有效降低炎症因子表达从而减轻滑膜成纤维细胞炎症损伤[30]。本研究结果显示缺氧处理后细胞中p-p38 MAPK蛋白表达水平显著升高,而骨膜素处理后可明显降低p-p38 MAPK蛋白表达水平,提示骨膜素可能通过抑制p38 MAPK信号通路的活化从而减轻缺氧诱导的人牙周膜成纤维细胞损伤。
综上所述,骨膜素可明显抑制缺氧诱导的人牙周膜成纤维细胞凋亡,促进细胞增殖,还可抑制氧化应激反应,增强细胞抗氧化应激能力,抑制炎症因子分泌,其作用机制可能与抑制p38 MAPK信号通路的激活有关,可为进一步揭示牙周炎发病机制奠定理论基础。
| [1] |
He Y, Jian CX, Zhang HY, et al. Hypoxia enhances periodontal ligament stem cell proliferation via the MAPK signaling pathway[J]. Genet Mol Res, 2016, 15(4): 1-12. |
| [2] |
刘惠莉. 抑制Akt/PKB信号通路促进缺氧诱导的人牙周膜成纤维细胞凋亡[J]. 实用口腔医学杂志, 2018, 34(2): 164-7. DOI:10.3969/j.issn.1001-3733.2018.02.004 |
| [3] |
周敏, 王佐林. 氢气对脂多糖致人牙周膜细胞氧化应激损伤的保护作用[J]. 华西口腔医学杂志, 2018, 36(2): 123-7. |
| [4] |
郑睿, 谭裕洁, 古萌琴, 等. N-乙酰半胱氨酸对脂多糖诱导的人牙周膜成纤维细胞表达相关蛋白和基因的影响[J]. 安徽医科大学学报, 2019, 54(6): 925-9. |
| [5] |
李静乐, 严文广, 王建刚, 等. 骨膜素在平滑肌细胞迁移和增殖中的作用及阿托伐他汀对其的影响[J]. 中南大学学报:医学版, 2012, 37(7): 689-94. |
| [6] |
An JN, Yang SH, Kim YC, et al. Periostin induces kidney fibrosis after acute kidney injury via the p38 MAPK pathway[J]. Am J Physiol Renal Physiol, 2019, 316(3): F426-37. DOI:10.1152/ajprenal.00203.2018 |
| [7] |
Meng XT, Zhu Y, Tao L, et al. Periostin has a protective role in melatonin-induced cell apoptosis by inhibiting the eIF2α-ATF4 pathway in human osteoblasts[J]. Int J Mol Med, 2018, 41(2): 1003-12. |
| [8] |
晏燕, 陈先卓, 周云, 等. 白细胞介素-1β通过P38MAPK信号通路调节人牙周膜成纤维细胞MMP-1表达的研究[J]. 牙体牙髓牙周病学杂志, 2013, 23(12): 748-52. |
| [9] |
Liu HL, Chen Z. Periostin inhibits hypoxia-induced apoptosisin human periodontal ligament fibroblasts via the Akt/PKB signaling pathway[J]. Int J Clin Exp Med, 2017, 10(6): 9171-9. |
| [10] |
Yu KW, Yao CC, Jeng JH, et al. Periostin inhibits mechanical stretchinduced apoptosis in osteoblast-like MG-63 cells[J]. Taiwan Yi Zhi, 2018, 117(4): 292-300. |
| [11] |
Ullrich N, Schröder A, Jantsch J, et al. The role of mechanotransduction versus hypoxia during simulated orthodontic compressive strain-an in vitro study of human periodontal ligament fibroblasts[J]. Int J Oral Sci, 2019, 11(4): 33. DOI:10.1038/s41368-019-0066-x |
| [12] |
Tóthová L, Celec P. Oxidative stress and antioxidants in the diagnosis and therapy of periodontitis[J]. Front Physiol, 2017, 8: 1055. DOI:10.3389/fphys.2017.01055 |
| [13] |
Hernández-Ríos P, Pussinen PJ, Vernal R, et al. Oxidative stress in the local and systemic events of apical periodontitis[J]. Front Physiol, 2017, 8: 869. DOI:10.3389/fphys.2017.00869 |
| [14] |
Li XC, Hu L, Ma LS, et al. Severe periodontitis may influence cementum and dental pulp through inflammation, oxidative stress, and apoptosis[J]. J Periodontol, 2019, 90(11): 1297-306. DOI:10.1002/JPER.18-0604 |
| [15] |
Chen MM, Cai WJ, Zhao SF, et al. Oxidative stress-related biomarkers in saliva and gingival crevicular fluid associated with chronic periodontitis: a systematic review and meta-analysis[J]. J Clin Periodontol, 2019, 46(6): 608-22. DOI:10.1111/jcpe.13112 |
| [16] |
Wu WJ, Liu QQ, Liu YX, et al. Dixdc1 targets CyclinD1 and p21 via PI3K pathway activation to promote Schwann cell proliferation after sciatic nerve crush[J]. Biochem Biophys Res Commun, 2016, 478(2): 956-63. DOI:10.1016/j.bbrc.2016.08.058 |
| [17] |
Liao S, Xiao SS, Chen HX, et al. CD38 enhances the proliferation and inhibits the apoptosis of cervical cancer cells by affecting the mitochondria functions[J]. Mol Carcinog, 2017, 56(10): 2245-57. DOI:10.1002/mc.22677 |
| [18] |
Yang H, Ma PC, Cao YP, et al. ECPIRM, a potential therapeutic agent for cutaneous T-cell lymphoma, inhibits cell proliferation and promotes apoptosis via a JAK/STAT pathway[J]. Anticancer Agents Med Chem, 2018, 18(3): 401-11. DOI:10.2174/1871520617666170327115657 |
| [19] |
Peng X, Chen KJ, Chen J, et al. Aflatoxin B1 affects apoptosis and expression of Bax, Bcl-2, and Caspase-3 in Thymus and Bursa of Fabricius in broiler chickens[J]. Environ Toxicol, 2016, 31(9): 1113-20. DOI:10.1002/tox.22120 |
| [20] |
Wnęk A, Andrzejewska E, Kobos J, et al. Molecular and immunohistochemical expression of apoptotic proteins Bax, Bcl-2 and Caspase 3 in infantile hemangioma tissues as an effect of propranolol treatment[J]. Immunol Lett, 2017, 185: 27-31. DOI:10.1016/j.imlet.2017.03.005 |
| [21] |
Ran LW, Chen F, Zhang J, et al. Antitumor effects of pollen polysaccharides from Chinese wolfberry on DU145 cells via the PI3K/AKT pathway in vitro and in vivo[J]. Int J Biol Macromol, 2020, 152: 1164-73. DOI:10.1016/j.ijbiomac.2019.10.206 |
| [22] |
Braverman J, Stanley SA. Nitric oxide modulates macrophage responses to Mycobacterium tuberculosis infection through activation of HIF-1α and repression of NF-κB[J]. J Immunol, 2017, 199(5): 1805-16. DOI:10.4049/jimmunol.1700515 |
| [23] |
He CY, Jiang LP, Wang CY, et al. Inhibition of NF-κB by pyrrolidine dithiocarbamate prevents the inflammatory response in a ligatureinduced peri-implantitis model: a canine study[J]. Cell Physiol Biochem, 2018, 49(2): 610-25. DOI:10.1159/000492997 |
| [24] |
França MCM, da Silva TM, Silva GO, et al. Effect of ethylenediaminetetraacetic acid and hyaluronic acid on the viability and cytokine expression of periodontal ligament fibroblasts[J]. Dent Traumatol, 2018, 34(4): 271-7. DOI:10.1111/edt.12404 |
| [25] |
Abidi AH, Presley CS, Dabbous M, et al. Anti-inflammatory activity of cannabinoid receptor 2 ligands in primary HPDL fibroblasts[J]. Arch Oral Biol, 2018, 87: 79-85. DOI:10.1016/j.archoralbio.2017.12.005 |
| [26] |
Naresh CK, Rao SM, Shetty PR, et al. Salivary antioxidant enzymes and lipid peroxidation product malondialdehyde and sialic acid levels among smokers and non-smokers with chronic periodontitisA clinico-biochemical study[J]. J Family Med Prim Care, 2019, 8(9): 2960-4. DOI:10.4103/jfmpc.jfmpc_438_19 |
| [27] |
Nie YJ, Yang YY, Zhang J, et al. Shikonin suppresses pulmonary fibroblasts proliferation and activation by regulating Akt and p38 MAPK signaling pathways[J]. Biomedecine Pharmacother, 2017, 95: 1119-28. DOI:10.1016/j.biopha.2017.09.023 |
| [28] |
Weng J, Tu MY, Wang P, et al. Amiodarone induces cell proliferation and myofibroblast differentiation via ERK1/2 and p38 MAPK signaling in fibroblasts[J]. Biomedecine Pharmacother, 2019, 115: 108889. DOI:10.1016/j.biopha.2019.108889 |
| [29] |
Kojonazarov B, Novoyatleva T, Boehm M, et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy[J]. Am J Respir Cell Mol Biol, 2017, 57(5): 603-14. DOI:10.1165/rcmb.2016-0374OC |
| [30] |
Hanabayashi M, Takahashi N, Sobue Y, et al. Hyaluronan oligosaccharides induce MMP-1 and-3 via transcriptional activation of NF-κB and p38 MAPK in rheumatoid synovial fibroblasts[J]. PLoS One, 2016, 11(8): e0161875. DOI:10.1371/journal.pone.0161875 |
 2020, Vol. 40
2020, Vol. 40

