2. 中南大学湘雅医院妇产科,湖南 长沙 410008
2. Department of Gynecology and Obstetrics, Xiangya Hospital, Central South University, Changsha 410008, China
子宫内膜间质肉瘤(ESS)是起源于子宫内膜间质细胞的妇科恶性肿瘤[1-2],其发病率相对较低[3-4]。目前临床上根据肿瘤的病理特征将ESS分为低度恶性子宫内膜间质肉瘤(LGESS)和高度恶性子宫内膜间质肉瘤(HGESS)[5-6]。但ESS的确切发病机制不详,可能与一些特征性染色体易位等遗传学改变有关。
研究表明HELQ是通过直接与RAD51C蛋白的异四聚复合蛋白体(BCDX2)结合,促进RAD51C介导的DNA同源重组修复[7]。RAD51C是DNA同源重组修复的核心蛋白分子,在DNA损伤后细胞的修复过程中具有关键作用[8],是介导重组交换的重要蛋白[9-10]。此外,RAD51C异常表达与多种恶性肿瘤的发生发展相关,如在乳腺癌中,miR-155可靶向抑制RAD51C蛋白,降低放疗后肿瘤细胞DNA同源重组修复,进而增强乳腺癌放疗敏感性[11]。然而,ESS组织中HELQ和RAD51C的表达情况尚未见相关报道。
本研究拟检测正常子宫内膜及ESS子宫内膜中HELQ和RAD51C蛋白表达,并分析与ESS肿瘤临床特征的相关性,为明确ESS发病机制及开发新型诊断标志物提供科学证据。
1 资料和方法 1.1 研究对象及纳入排除标准收集2013年1月~2016年12月在湖南省肿瘤医院接受手术治疗且术后进行常规病理检查确诊为ESS(37例,分布年龄为19~71岁,中位年龄52岁)。纳入标准:所有患者在手术切除前均未进行放疗、化疗和激素等干预,未合并其他恶性肿瘤、妊娠或急性感染。排除标准:本研究为回顾性研究,未满足以上纳入标准的ESS病例均未纳入。此外,收集同期因其他原因(如子宫肌瘤、宫颈上皮内瘤变和子宫腺肌瘤)行子宫切除术患者的子宫内膜标本(14例)作为对照。所有患者的临床及病理检查结果资料完整。本研究对照和ESS两组年龄分布情况为:对照组:14例,年龄为20~48岁,中位年龄38岁;ESS组:37例,年龄为19~71岁,中位年龄47岁。
1.2 临床资料收集以FIGO2009年子宫肉瘤分期为标准。37例ESS患者的基本临床病理信息如表 1所示。ESS患者的首发症状以月经异常、阴道异常流血和腹痛为主,同时也有阴道排液和腹胀等少见首发症状。
| 表 1 37例ESS患者的基本临床病理信息 Tab.1 Clinical data of the ESS patients (n=37) |
所有样本石蜡块由湖南省肿瘤医院病理科提供,制备组织芯片,切片后进行常规HE染色。HE染色步骤如下:4 μm厚度的切片置于60 ℃烤箱1 h后,进过二甲苯脱蜡,100%,95%和80%梯度乙醇浸泡各5 min后,冲洗,苏木素染液浸泡3 min,取出流水冲洗后,1%盐酸酒精进行分化,并通过碳酸锂溶液返蓝,之后伊红溶液浸泡1 min,脱水、透化,中性树脂封片。以上HE相关试剂均购于北京鼎国生物技术有限公司。
1.3.2 免疫组织化学染色检测HELQ和RAD51C蛋白表达采用免疫组织化学染色(SP法)检测各样本中HELQ和RAD51C的蛋白表达。连续切片获得4 μm切片并贴片于防脱落的玻璃片上。置于60 ℃烤箱30 min后脱蜡至水。采用微波热修复法进行抗原修复,滴加3%双氧水至切片上,室温下静置10 min清除内源性过氧化氢酶活性。PBS清洗3次后进行封闭,室温放置30 min,随后小心甩去多余液体;在切片的样本中滴加一抗(HELQ308:1:100;RAD51C:1:100),置于湿盒中4 ℃过夜;次日PBS后滴加大鼠抗兔二抗(1:200),37 ℃湿盒内放置45 min;PBS清洗3次后滴加DAB显色液于样本上,在显微镜下观察染色程度判断染色时间;苏木精复染后采用中性树胶封片,显微镜拍片。
1.3.3 结果判定IHC免疫结果由两位病理科医师双盲法阅片,采用半定量法判定结果。每张切片结果随机取5个视野,按下表(表 2)进行判定。
| 表 2 IHC免疫结果判定标准 Tab.2 Criteria of the expression detected by immunochemistry |
计量资料以均数±标准差表示,采用SPSS22.0分析软件进行统计学分析。计数资料采用卡方检验,相关分析采用Spearman等级相关分析。P < 0.05认为差异具有统计学意义。
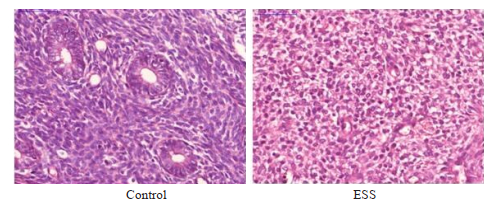
2 结果 2.1 各组组织病理形态学改变HE染色结果显示对照组子宫内膜结构完整、管腔形态规整、上皮细胞排列整齐,未见异常细胞核;ESS组织失去正常的组织形态、管腔消失、组织细胞排列紊乱,可见大量核固缩核异形(图 1)。
|
图 1 各组样本组织病理形态学染色结果 Fig.1 Pathological changes of each group (HE staining, original magnification: ×400). ESS: Endometrial stromal sarcoma. |
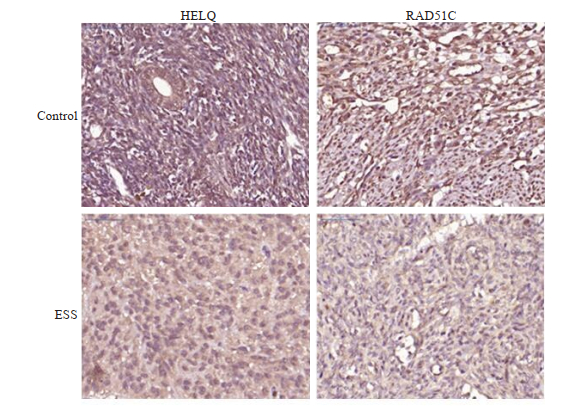
IHC染色结果可知对照组子宫内膜组织中HELQ和RAD51C均呈现中度阳性表达,可见大量染为棕色的颗粒,其中RAD51C集中表达于细胞核内;而ESS患者中HELQ和RAD51C表达降低,呈弱阳性表达(图 2)。分析发现ESS患者子宫内膜HELQ和RAD51C表达阳性率均下降,其中HELQ表达阳性率下降具有统计学意义(P < 0.05,表 3)。
|
图 2 各组织HELQ和RAD51C免疫组织化学染色结果 Fig.2 The expression of HELQ and RAD51C detected by immunochemistry (×400). |
| 表 3 ESS患者HELQ和RAD51C表达 Tab.3 The expression of HELQ and RAD51C in ESS patient |
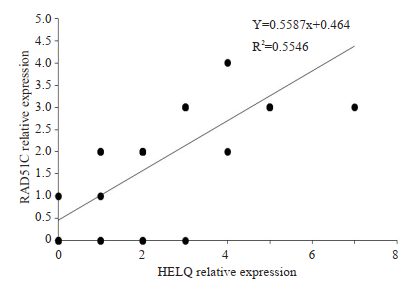
相关性分析发现RAD51C相对表达量与HELQ相对表达量呈正相关(R2=0.5546,F值=61.0,P < 0.001),表明HELQ和RAD51C表达呈正相关(图 3)。
|
图 3 ESS中HELQ和RAD51C表达相关性分析 Fig.3 Correlation analysis of HELQ and RAD51C of ESS patients. |
HELQ和RAD51C与ESS患者的临床特征相关性(表 4)。其中HELQ表达与ESS肿瘤大小相关(P < 0.05,表 4),与ESS患者年龄、FIGO分期和淋巴结转移的相关性无统计学意义(P > 0.05,表 4)。而RAD51C与ESS临床特征均无相关性(P > 0.05,表 4)。
| 表 4 HELQ和RAD51C蛋白表达与ESS患者的临床特征的关系 Tab.4 Relationship between the HELQ, RAD51C expression and the clinical characteristics of ESS patients Variables |
ESS是女性生殖系统较为少见的恶性肿瘤之一,发病率相对较低,仅占子宫恶性肿瘤的0.2%[12-13]。ESS缺乏特异性的临床症状,常见的临床症状有月经不规律、腹痛、腹部或盆腔检查出包块,导致术前诊断存在一定难度,早期易误诊为腺肌症或子宫平滑肌瘤;而晚期常与子宫内膜癌和宫颈癌等妇科恶性肿瘤混淆[14-15]。目前对于子宫内膜间质肉瘤的发病机制不详,可能与一些特征性的染色体易位等遗传学改变有关。此外,糖尿病、肥胖以及月经初潮早可增高子宫内膜间质肉瘤的发病风险[16-18]。而子宫内膜间质细胞过度增殖是子宫内膜间质肉瘤的病理特征[19],研究表明正常细胞凋亡减少和肿瘤细胞损伤修复能力增强,将导致细胞出现过度增殖表型,是肿瘤生长的重要机制之一[20-21]。
HELQ是一种ATP依赖性多功能解旋酶,DNA解旋酶可以修复核苷酸的错配,双链断裂及同源重组交叉反应等DNA损伤,对于维持机体基因及染色体稳定至关重要。目前发现HELQ基因可以修复细胞增殖时DNA复制过程中发生的DNA损伤,如果HELQ发生缺陷或缺失,DNA错误复制的可能性增加,从而增加恶性肿瘤发生几率[22]。研究表明HELQ可以激活DNA损伤应答酶ATR的底物CHK1以及RAD51旁系同源物,包括RAD51C在内,从而有效促进已损坏的复制交叉中同源重组过程,参与维持基因组稳定性[7]。本研究首次观察到ESS组织中HELQ表达水平显著下降,这与骨肉瘤[23]中HELQ变化趋势一致,提示HELQ表达下降可能是ESS肿瘤发生机制之一。RAD51C是HELQ下游的DNA修复执行蛋白,它在ESS组织中较正常对照组织呈现表达下降的现象,而且RAD51C和HELQ表达水平在ESS中呈显著正相关,但ESS中RAD51C表达降低的具体机制尚未明确。有研究报道结直肠癌[24]中RAD51C表达增高,与本研究结果不一致,我们推测RAD51C表达可能具有肿瘤异质性,即不同肿瘤细胞中因其组织特性差异、发生机制不同,导致RAD51C表达水平变化亦呈现不同的态势,其具体调控机制还有待进一步研究。
我们研究发现ESS患者肿瘤组织 > 5 cm组的HELQ阳性率高于肿瘤组织≤5 cm患者组,提示HELQ介导的DNA损伤修复可能参与ESS肿瘤细胞增殖过程。对HELQ生理功能机制研究证实:HELQ可能作用于停滞的DNA复制叉,使其上的结合蛋白与DNA解离,以保证后续DNA修复合成的进行[25-27],维持细胞正常染色体复制及增殖。当小鼠HELQ发生缺陷或缺失时,即表现出生育能力低下,生殖细胞受损以及肿瘤易感的特征[7]。但我们的研究尚无法解答HELQ影响ESS肿瘤细胞增殖能力的具体机制,HELQ影响ESS肿瘤细胞增殖能力的科学问题还需深入研究。
淋巴结转移在ESS患者中并不多见,本研究观察到27.8%的ESS患者存在淋巴结转移的现象。有研究报道RAD51C在出现淋巴结转移的乳腺癌组织中较未出现淋巴结转移的组织表达水平显著增高[28],而且RAD51C高表达与乳腺肿瘤发生腋下淋巴结转移正相关[29]。因此,基于本研究结果:具有淋巴结转移的ESS患者RAD51C表达阳性率高达80.0%,略高于无淋巴结转移患者(69.2%),加之具有淋巴结转移的ESS患者预后较差的依据[30],我们推测ESS患者RAD51C表达水平可能与疾病预后存在相关性,今后我们将通过长期随访来证实这一推测。
综上所述,本研究证实ESS中HELQ和RAD51C表达较正常子宫内膜,表达显著降低,并且HELQ和RAD51C表达呈正相关(P < 0.05)。ESS中HELQ表达强度与肿瘤大小相关(P < 0.05)。HELQ和RAD51C表达强度与患者年龄、FIGO分期和淋巴结转移无关(P > 0.05)。通过我们的研究结果,提示HELQ与RAD51C参与的DNA同源重组修复途径与ESS的发生相关,ESS患者中DNA损伤修复能力下降,可能是ESS的发病机制或/和疾病进展的重要因素之一。
| [1] |
Stewart LE, Beck TL, Giannakopoulos NV, et al. Impact of oophorectomy and hormone suppression in low grade endometrial stromal sarcoma: a multicenter review[J]. Gynecol Oncol, 2018, 149(2): 297-300. DOI:10.1016/j.ygyno.2018.03.008 |
| [2] |
Przybyl J, Kidzinski L, Hastie T, et al. Gene expression profiling of low-grade endometrial stromal sarcoma indicates fusion proteinmediated activation of the Wnt signaling pathway[J]. Gynecol Oncol, 2018, 149(2): 388-93. DOI:10.1016/j.ygyno.2018.03.007 |
| [3] |
Baniak N, Adams S, Lee CH, et al. Extrapelvic metastases in endometrial stromal sarcomas: a clinicopathological review with immunohistochemical and molecular characterization[J]. Int J Surg Pathol, 2019, 27(2): 208-15. DOI:10.1177/1066896918794278 |
| [4] |
Hoang L, Chiang S, Lee CH. Endometrial stromal sarcomas and related neoplasms: new developments and diagnostic considerations[J]. Pathology, 2018, 50(2): 162-77. |
| [5] |
中国抗癌协会妇科肿瘤专业委员会. 子宫肉瘤诊断与治疗指南(第四版)[J]. 中国实用妇科与产科杂志, 2018, 34(10): 1106-10. |
| [6] |
Bebia V., Acosta-Sanchez U., Monreal-Clua S., et al. High-grade and low-grade endometrial stromal sarcoma: Descriptive and survival analysis[J]. IntJ Gyneco Cancer, 2019, 29 A118-A9. |
| [7] |
Adelman CA, Lolo RL, Birkbak NJ, et al. HELQ promotes RAD51 paralogue-dependent repair to avert germ cell loss and tumorigenesis[J]. Nature, 2013, 502(7471): 381-4. DOI:10.1038/nature12565 |
| [8] |
Mohan M, Akula D, Dhillon A, et al. Human RAD51 paralogue RAD51C fosters repair of alkylated DNA by interacting with the ALKBH3 demethylase[J]. Nucleic Acids Res, 2019, 47(22): 11729-45. |
| [9] |
Ceccaldi R, Liu JC, Amunugama R, et al. Homologous-recombination-deficient tumours are dependent on Polθ-mediated repair[J]. Nature, 2015, 518(7538): 258-62. DOI:10.1038/nature14184 |
| [10] |
Chu WK, Payne MJ, Beli P, et al. FBH1 influences DNA replication fork stability and homologous recombination through ubiquitylation of RAD51[J]. Nat Commun, 2015, 6: 5931. DOI:10.1038/ncomms6931 |
| [11] |
Gasparini P, Lovat F, Fassan M, et al. Protective role of miR-155 in breast cancer through RAD51 targeting impairs homologous recombination after irradiation[J]. Proc Natl Acad Sci USA, 2014, 111(12): 4536-41. DOI:10.1073/pnas.1402604111 |
| [12] |
Wu HW, Luo Y, Yin NL, et al. Vaginal endometrial stromal sarcoma: a literature review[J]. Eur J Obstet Gynecol Reprod Biol X, 2019, 4: 100094. DOI:10.1016/j.eurox.2019.100094 |
| [13] |
Stout I., Ghatak S., Wipf H., et al. Uterine adenosarcoma and low grade endometrial stromal sarcoma: A comparative study using novel immunohistochemical markers[J]. Mod Pathol, 2019, 32. |
| [14] |
Meurer M, Floquet A, Ray-Coquard I, et al. Localized high grade endometrial stromal sarcoma and localized undifferentiated uterine sarcoma: a retrospective series of the french sarcoma group[J]. Int J Gynecol Cancer, 2019, 29(4): 691-8. DOI:10.1136/ijgc-2018-000064 |
| [15] |
Thangappah RBP. Uterine sarcoma: a clinico-pathological study[J]. J Obstet Gynaecol India, 2019, 69(Suppl 2): 147-52. |
| [16] |
Sciallis AP, Bedroske PP, Schoolmeester JK, et al. High-grade endometrial stromal sarcomas: a clinicopathologic study of a group of tumors with heterogenous morphologic and genetic features[J]. Am J Surg Pathol, 2014, 38(9): 1161-72. DOI:10.1097/PAS.0000000000000256 |
| [17] |
Dvorská D, Braný D, Danková Z, et al. Factors affecting the uterine sarcomas developement and possibilities of their clinical diagnosis [J]. Ceska Gynekol, 83(5): 364-70.
|
| [18] |
Kyriazoglou A, Liontos M, Ziogas DC, et al. Management of uterine sarcomas and prognostic indicators: real world data from a singleinstitution[J]. BMC Cancer, 2018, 18(1): 1247. DOI:10.1186/s12885-018-5156-1 |
| [19] |
Lee CH, Nucci MR. Endometrial stromal sarcoma: the new genetic paradigm[J]. Histopathology, 2015, 67(1): 1-19. DOI:10.1111/his.12594 |
| [20] |
Kalimutho M, Bain AL, Mukherjee B, et al. Enhanced dependency of KRAS-mutant colorectal cancer cells on RAD51-dependent homologous recombination repair identified from genetic interactions in Saccharomyces cerevisiae[J]. Mol Oncol, 2017, 11(5): 470-90. DOI:10.1002/1878-0261.12040 |
| [21] |
Kobayashi H, Uekuri C, Akasaka J, et al. The biology of uterine sarcomas: a review and update[J]. Mol Clin Oncol, 2013, 1(4): 599-609. DOI:10.3892/mco.2013.124 |
| [22] |
Dolgova EV, Alyamkina EA, Efremov YR, et al. Identification of cancer stem cells and a strategy for their elimination[J]. Cancer Biol Ther, 2014, 15(10): 1378-94. DOI:10.4161/cbt.29854 |
| [23] |
Liu DN, Zhou YF, Peng AF, et al. HELQ reverses the malignant phenotype of osteosarcoma cells via CHK1-RAD51 signaling pathway[J]. Oncol Rep, 2017, 37(2): 1107-13. DOI:10.3892/or.2016.5329 |
| [24] |
Sriramulu S, Ramachandran M, Subramanian S, et al. A review on role of ATM gene in hereditary transfer of colorectal cancer[J]. Acta Biomed, 2019, 89(4): 463-9. |
| [25] |
Muzzini DM, Plevani P, Boulton SJ, et al. Caenorhabditis elegans POLQ-1 and HEL-308 function in two distinct DNA interstrand cross-link repair pathways[J]. DNA Repair (Amst), 2008, 7(6): 941-50. DOI:10.1016/j.dnarep.2008.03.021 |
| [26] |
Woodman IL, Brammer K, Bolt EL. Physical interaction between archaeal DNA repair helicase Hel308 and Replication Protein A (RPA)[J]. DNARepair (Amst), 2011, 10(3): 306-13. DOI:10.1016/j.dnarep.2010.12.001 |
| [27] |
Boyd JB, Golino MD, Shaw KE, et al. Third-chromosome mutagensensitive mutants of Drosophila melanogaster[J]. Genetics, 1981, 97(3/4): 607-23. |
| [28] |
Klopfleisch R, Gruber AD. Increased expression of BRCA2 and RAD51 in lymph node metastases of canine mammary adenocarcinomas[J]. Vet Pathol, 2009, 46(3): 416-22. DOI:10.1354/vp.08-VP-0212-K-FL |
| [29] |
Dawson LM, Smith KN, Werdyani S, et al. A dominant RAD51C pathogenic splicing variant predisposes to breast and ovarian cancer in the Newfoundland population due to founder effect[J]. Mol Genet Genomic Med, 2020, 8(2): e1070. DOI:10.1002/mgg3.1070 |
| [30] |
Wang M, Meng SH, Li B, et al. Survival outcomes of different treatment modalities in patients with low-grade endometrial stromal sarcoma[J]. Chin Med J, 2019, 132(9): 1128-32. DOI:10.1097/CM9.0000000000000259 |
 2020, Vol. 40
2020, Vol. 40

