2. 蚌埠医学院科研中心组织移植安徽省重点实验室,安徽 蚌埠 233030;
3. 蚌埠医学院第一附属医院中心实验室,安徽 蚌埠 233004
2. Anhui Provincial Key Laboratory of Tissue Transplantation, Bengbu Medical College, Bengbu 233030, China;
3. Central Laboratory, First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
衣原体是一种严格细胞内寄生的原核细胞型微生物,可引起多种人类疾病,抗菌药物可有效控制活动性感染,但无法彻底清除细胞内衣原体,持续性胞内感染状态是导致肺炎复发、过敏性哮喘及心血管系统疾病的危险因素[1-2]。机体抗衣原体适应性免疫以分泌IFN-γ为特征的CD4+T(Th1)细胞免疫应答为主[3-4]。研究显示NK细胞可通过分泌IFN-γ等细胞因子驱动宿主抗衣原体的固有和适应性免疫应答[5-6]。新近观点认为,免疫细胞间的交互作用在宿主抵御衣原体感染中发挥关键作用,该方向的研究有望为深入探索抗感染免疫调控机制提供新的视角[7-8]。
NK细胞是固有免疫细胞的重要成员,在抗衣原体感染中起保护作用[5]。通过调控NK细胞的功能可增强机体抵御衣原体感染的能力。CD96是免疫球蛋白超家族成员,研究发现CD96是NK细胞表面的抑制性受体,可竞争性抑制CD226与CD155的结合,负向调节NK细胞分泌IFN-γ的能力[9-10]。目前有关CD96调控NK细胞功能在衣原体感染疾病中的作用尚未见报道,通过体内靶向CD96分子表达调控NK细胞在机体抵御衣原体肺部感染中的能力,目前尚不清楚。因此,本研究通过体内中和CD96水平,观察衣原体肺部感染鼠的肺炎症状及机体固有和适应性免疫应答的水平,探讨CD96调控NK细胞功能在衣原体肺部感染中的作用及可能机制。
1 材料和方法 1.1 细胞NK92MI细胞系为本实验室保存,悬浮培养于含12.5%马血清,12.5%胎牛血清,2 mmol/L L-谷氨酰胺,0.2 mmol/L肌醇,0.1 mmol/L β-疏基乙醇,0.02 mmol/L叶酸的MEM α培养基中。Hep-2细胞系为本实验室保存,培养于含10%胎牛血清的RPIM1640培养基中。
1.2 实验动物6~8周龄SPF级BALB/c小鼠45只(北京维通利华实验动物技术有限公司),体质量22±2 g,实验动物使用许可证号为SYXK(皖)2017-001。本实验通过蚌埠医学院实验动物伦理审批(伦动科批字[2019]第53号)。
1.3 衣原体鼠衣原体(Chlamydia muridarum,C. muridarum)购自ATCC细胞库(ATCC® VR-123TM),培养于Hep-2细胞中。
1.4 主要试剂苏木素伊红染液(北京索莱宝公司);辣根过氧化物酶(HRP)标记的山羊抗兔IgG、山羊抗小鼠IgG、兔抗β-actin抗体(abcam);化学发光底物增强检测试剂盒(ECL Kit)(millipore);CD96引物由上海生工生物工程有限公司合成;TRIzol(thermo scientific);逆转录试剂盒、SYBRGreen Ⅱ荧光定量PCR试剂盒(TaKaRa);MEM α、RPIM 1640培养基、胎牛血清、马血清(Gibco BRL);Anti-CD96(3.3, rat IgG1)(Bio X Cell);F4/80+免疫磁珠(美天旎);谷氨酰胺、肌醇、β-疏基乙醇、叶酸、DEAE-葡聚糖、4氯-1萘酚和放线菌酮(CY)(Sigma);流式抗体(小鼠anti-DX5-FITC、CD3e-APC、CD4-PEcy7、IFN-γ-PE、F4/80-PE)、Brefeldin A、刺激剂、IC Fixation Buffer、Permeabilization buffer及IFN-γELISA试剂盒(eBioscience)。
1.5 分组与动物模型建立选取雄性BALB/c小鼠,应用随机数字表法将实验小鼠为感染组(Cm组)、实验组(anti-CD96组)及对照组(sham组),5只/组,进行3次独立重复实验。采用滴鼻吸入C. muridarum建立肺部感染模型,anti-CD96组小鼠在感染基础上给予腹腔注射anti-CD96抗体(250 μg/只,每3 d给药1次),Cm组腹腔注射生理盐水,对照组(sham组)小鼠鼻吸入缓冲液[11]。于建模和第5天颈椎脱臼法处死小鼠,取检并检测。
1.6 肺组织病理学评估取小鼠右肺中叶于4%多聚甲醛中固定,石蜡包埋切片,HE染色。组织炎症评分主要评估呼吸道,血管周围及肺间质炎症累及范围[12]。
1.7 实时定量PCR采用TRIzol提取总RNA,反转录后使用SYBRGreen Ⅱ进行实时定量荧光定量PCR检测,CD96引物序列如下:上游引物序列5'-TGGGAAGAGCTA TTCAATGTTGG-3',下游引物序列5'-AGAGGCCAT ATTGGGGATGATAA-3',GAPDH做内参基因,引物序列如下:上游引物序列5'-AGGTCGGTGTGAACGG ATTTG-3',下游引物序列5'-TGTAGACCATGTAGT TGAGGTCA-3'。
1.8 衣原体负荷检测无菌取小鼠左肺,于SPG蔗糖缓冲液中研磨破碎组织。离心后取上清液,感染Hep-2细胞,在含CY的完全培养基中培养20 h左右,经甲醇固定,抗衣原体LPS抗体孵育(1:50,37 ℃,2 h),二抗为HRP标记的山羊抗小鼠抗体(1:500,37 ℃,1 h),4氯-1萘酚显色,室温避光显色反应2 min。PBS洗去显色液,于显微镜下IFUs计数[5]。
1.9 流式细胞术分离肺单个核细胞,取1×106细胞进行巨噬细胞染色,采用F4/80-PE荧光抗体进行表面染色(4 ℃,30 min);另取2×106细胞铺板刺激培养6 h,进行NK细胞和Th1细胞染色,培养后细胞先进行表面染色(CD3e-APC、CD4-PE-cy7、DX5-FITC,4 ℃,30 min),破膜后再进行细胞内因子染色(IFN-γ-PE);流式细胞仪检测并分析巨噬细胞(F4/80+)、分泌IFN-γ的NK细胞(CD3-DX5+IFN-γ+),Th1细胞(CD3+CD4+IFN-γ+)的比例[5]。
1.10 ELISA小鼠肺组织中IFN-γ的水平按照ELISA试剂盒说明书操作,于450 nm波长下检测吸光度A450 nm,计算IFN-γ的浓度。
1.11 Western blot使用SDS裂解液裂解细胞,提取总蛋白,用Western blot法检测CD96蛋白表达,以β-actin为内参。样品经SDS-聚丙烯酰胺凝胶电泳,转移到PVDF膜上,用10%脱脂奶粉室温封闭30 min,Anti-CD96或β-actin抗体孵育(1:1000,4 ℃,过夜),洗膜后,山羊抗兔IgG孵育(1:5000,室温,2 h),洗膜后,采用ECL化学发光,曝光,图片扫描后用Image J软件分析每个目的条带灰度值,用目的蛋白灰度值与内参灰度值的比值代表目的蛋白的相对表达含量[13]。
1.12 统计学分析所有实验均由3次独立实验验证,选择具有代表性的一次实验数据进行统计分析。采用Graphpad Prism 7.0(San Diego,CA)软件分析。计量资料以均数±标准差表示。两组之间差异分析采用独立样本t检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 C. muridarum感染抑制NK细胞中CD96的表达C. muridarum感染后第1、3、5天,采用磁珠分离各时间点以及Sham组小鼠肺NK细胞,检测结果显示NK细胞中CD96 mRNA表达显著降低(P < 0.05,图 1A)。NK92细胞系经C. muridarum感染后6、12、24 h,CD96表达均明显下降(P < 0.05,图 1B)。
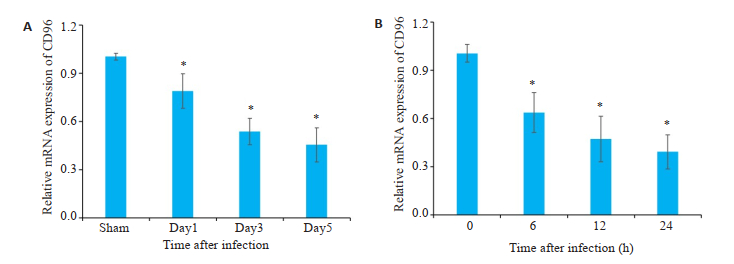
|
图 1 C. muridarum感染抑制NK细胞中CD96的表达 Fig.1 C. muridarum infection inhibits CD96 expression in NK cells. A: CD96 mRNA expression in lung NK cells; B: CD96 mRNA expression in NK92MI cells, n=5. *P < 0.05 vs Sham, 0 h. |
经Western blot验证anti-CD96抗体可有效中和小鼠肺组织中CD96表达(P < 0.05,图 2A~B)。通过每日记录各组小鼠疾病状态发现,自感染后第3天开始anti-CD96组小鼠体质量下降程度较Cm组减轻(P < 0.05,图 2C);于感染后第5天处死小鼠,肺组织病理切片结果证实,anti-CD96组小鼠肺炎减轻,病理评分显示差异有统计学意义(P < 0.05,图 2D~E)。
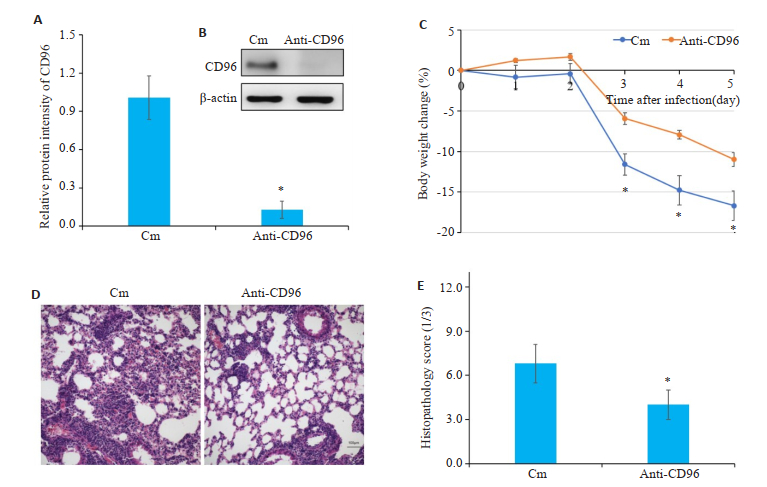
|
图 2 体内中和CD96减轻C. muridarum肺部感染小鼠的症状 Fig.2 Neutralizing CD96 in vivo reduces the lung pathologies in C. muridarum-infected mice. A: Relative protein intensity of CD96; B: CD96 protein expression in lung NK cells; C: Body weight change; D: Pathological changes of the lung tissues; E: Histopathology score, n=5. *P < 0.05 vs Cm. |
与Cm组相比,anti-CD96组小鼠肺部衣原体负荷降低,差异有统计学意义(P < 0.05,图 3)。
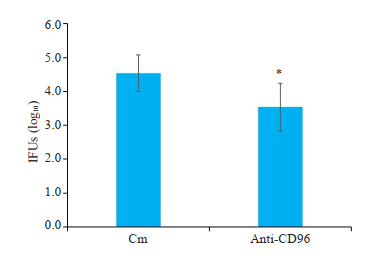
|
图 3 体内中和CD96抑制C. muridarum肺部感染小鼠肺组织中衣原体负荷 Fig.3 Neutralizing CD96 in vivo lowers chlamydia load in the lung tissue of C. muridarum-infected mice (n=5). *P < 0.05 vs Cm group. |
Anti-CD96组小鼠肺组织中分泌IFN-γ的NK细胞(CD3-DX5+IFN-γ+)比例高于Cm组(P < 0.05,图 4A~B);另外,与Cm组相比,anti-CD96组小鼠肺单个核细胞中IFN-γ的蛋白表达水平也显著升高(P < 0.05,图 4C)。
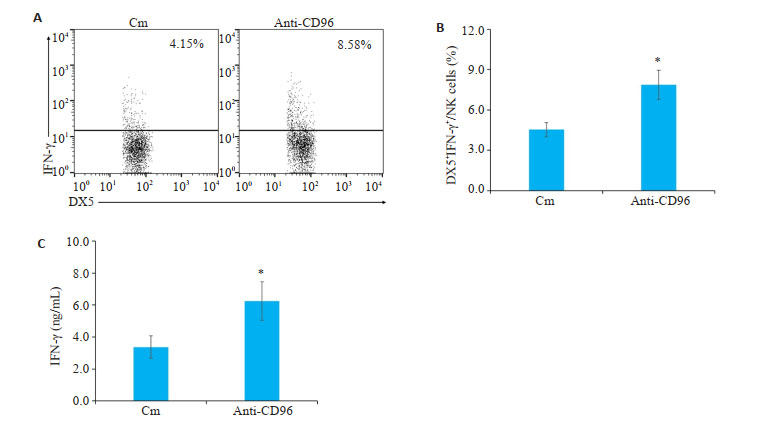
|
图 4 体内中和CD96增强NK细胞产生IFN-γ能力 Fig.4 Neutralizing CD96 enhances the ability of NK cells to produce IFN-γ. A: Flow cytometry of IFN-γ+NK cells in the lung; B: Proportion of IFN-γ + NK cells; C: Expression of IFN-γ (n=5). *P < 0.05 vs Cm group. |
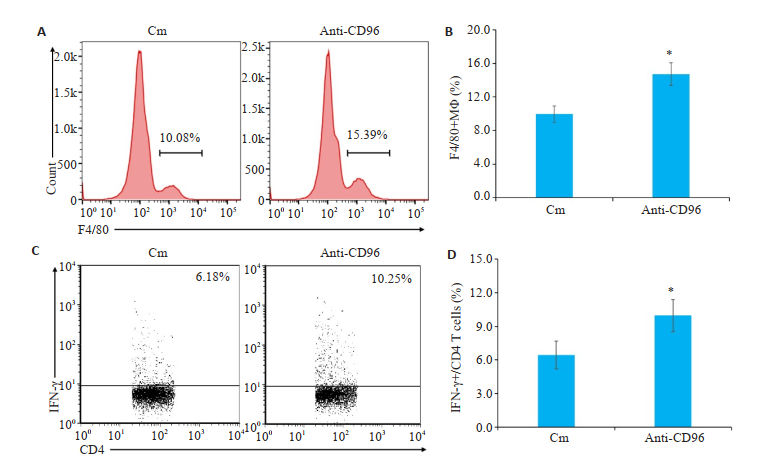
anti-CD96组与Cm组相比,NK细胞免疫调节作用也显著增强,小鼠肺脏中巨噬细胞比例增加(F4/80+,P < 0.05,图 5A~B),Th1应答增强(CD3+CD4+IFN-γ+,P < 0.05,图 5C~D)。
|
图 5 体内中和CD96可增强NK细胞的免疫调节作用 Fig.5 Neutralizing CD96 enhances immune regulation by NK cells. A: Flow cytometry of F4/80 + macrophages in the lung; B: Proportion of F4/80 + macrophages; C: Flow cytometry of CD3 +CD4 +IFN-γ+ cells; D: Proportion of CD3 +CD4 + IFN-γ+ cells (n=5). *P < 0.05 vs Cm. |
本研究表明,在BALB/c小鼠肺部衣原体感染模型中调控CD96对NK细胞免疫功能发挥重要作用。靶向抑制CD96可减轻C. muridarum感染小鼠肺组织病理损伤,降低肺部细菌载量,这可能与NK细胞分泌IFN-γ能力及其对固有和适应性免疫的调节功能增强有关。本研究结果显示,在BALB/c小鼠肺部衣原体感染模型中通过靶向CD96分子表达可减轻C. muridarum感染小鼠肺炎,其可能机制是增强NK细胞分泌IFN-γ能力及其免疫调节功能。
NK细胞是先天性淋巴细胞重要成员,在宿主抗衣原体肺部感染中具有保护作用。有研究发现,野生型鼠感染C. muridarum后,与同型对照组相比,NK细胞去除鼠表现为载菌量增加,肺损伤加重和体质量下降明显[14]。另外,在衣原体生殖道感染模型中得到了相似的结果,即NK细胞去除引起Th2应答增强,感染加重[15]。研究发现,小鼠C. pneumoniae和C. muridarum感染后,肺中NK细胞快速聚集并活化,NK细胞表面CD69表达增加,杀伤YAC-1细胞和分泌IFN-γ的能力显著增强。C. pneumoniae感染中,NK细胞去除后,宿主抵抗感染的能力下降。这证明在小鼠肺部衣原体模型中,NK细胞发挥了保护作用[16]。本研究也证实了,体内去除NK细胞,机体对衣原体的易感性更敏感,与文献报道一致[5]。所以,通过调控NK细胞功能可增强机体抵御衣原体肺部感染的能力。本研究通过靶向调控NK细胞内CD96表达水平,调控NK细胞的功能,将有助于进一步认识NK细胞在衣原体感染中的作用。
CD96和CD226(DNAM-1)是受体家族新发现的成员,可与Nectin和Nectin样蛋白相互作用[17-19]。CD226可激活NK细胞介导的细胞毒作用[20-21]。相反,CD96和CD226共享配体CD155,CD96通过与CD226竞争结合CD155可抑制NK细胞的功能[22-23]。通过使用CD96缺陷(Cd96-/-)小鼠,发现CD96与配体CD155结合直接抑制NK细胞在体外和体内产生IFN-γ的能力。本研究也证实了,通过阻断CD96,小鼠肺组织中NK细胞分泌IFN-γ的能力增强,肺单个核细胞分泌的IFN-γ水平也显著增高。在细菌感染性疾病中,高水平的IFN-γ可加重机体炎症损伤,而在体内可有效抑制衣原体增殖[24]。既往研究发现,Cd96-/-小鼠对细菌脂多糖(LPS)诱导的炎症反应更敏感[9]。而衣原体表面的LPS与细菌不同,在感染机体后,对于炎症诱导能力较弱[25]。因此,阻断CD96在衣原体感染疾病中的作用可能与细菌LPS有所差别,更重要的是,目前尚未见CD96在衣原体感染性疾病中作用的报道。我们猜测阻断CD96可能对NK细胞在衣原体感染中的免疫功能起重要作用[9]。本研究结果发现,腹腔注射给予CD96中和抗体,C. muridarum感染小鼠的体质量下降减缓,肺组织病理损伤减轻,肺部细菌载量也显著下降。以上结果证实,在衣原体肺部感染中,阻断CD96可增强机体抵御衣原体的能力,减轻组织损伤,具有保护机体的作用,这与CD96在细菌LPS刺激的过度炎症反应不同,本研究首先在胞内菌感染性疾病中探讨CD96的作用。
NK细胞的免疫调节作用越来越受到重视。近年来的研究发现,NK细胞对固有免疫和适应性免疫都存在广泛的调控作用[26-27]。NK细胞在启动T细胞应答时可通过分泌细胞因子,如IFN-γ,直接促进naïve CD4+T细胞向Th1方向极化。小鼠体内实验阐明,活化的NK细胞以CXCR3依赖的方式进入淋巴结,在淋巴结中NK细胞是naïve CD4+T细胞向Th1方向极化所必须的IFN-γ的早期来源[28]。在利什曼原虫的动物感染模型中,封闭NK细胞的TGF-β信号导致IFN-γ分泌增加,促进naïve CD4+T细胞向Th1方向极化,导致抗病原体能力的增强[29]。我们的前期研究发现,在衣原体肺部感染模型中,NK细胞可通过调节Th1、Th17、Treg应答平衡,发挥抗感染免疫保护作用[5, 30-31]。本研究通过体内中和CD96,发现NK细胞分泌IFN-γ的能力增强,anti-CD96组与Cm组相比,NK细胞免疫调节作用也显著增强,表现为小鼠肺脏中巨噬细胞比例增加,Th1应答增强。以上结果提示,在衣原体肺部感染中,CD96可能通过增强NK细胞分泌IFN-γ能力及其对固有和适应性免疫的调节功能发挥抗感染免疫保护作用。既往研究证实了CD96对NK细胞分泌细胞因子及细胞毒作用具有重要调节作用,而对NK细胞的免疫调节作用报道较少[32]。本研究在此基础上,进一步证实了,靶向NK细胞表面抑制性受体CD96可增强其对固有和适用性免疫细胞的调节能力,丰富了CD96在NK细胞功能调节中的作用。
综上所述,通过靶向CD96可增强NK细胞分泌细胞因子及免疫调节能力。阻断CD96可促进NK细胞分泌细胞因子,进而增强其多固有和适应性免疫的调节能力,有助于机体清除肺部衣原体感染和减轻病理损伤。本研究在胞内菌感染的动物模型中发现了CD96调控NK细胞的作用,进一步证明了NK细胞在抵御病原体感染中的重要性,也扩展了我们对感染性疾病中NK细胞免疫调节作用的认识。我们的发现为调节CD96功能在感染性疾病中的治疗作用提供依据。
| [1] |
Leung A, Wong A, Hon KL. Community-acquired pneumonia in children[J]. Recent Pat Inflamm Allergy Drug Discov, 2018, 12(2): 136-44. DOI:10.2174/1872213X12666180621163821 |
| [2] |
Elwell C, Mirrashidi K, Engel J. Chlamydia cell biology and pathogenesis[J]. Nat Rev Microbiol, 2016, 14(6): 385-400. DOI:10.1038/nrmicro.2016.30 |
| [3] |
Stary G, Olive A, Radovic-Moreno AF, et al. A mucosal vaccine against Chlamydia trachomatis generates two waves of protective memory T cells[J]. Science, 2015, 348(6241): aaa8205-13. DOI:10.1126/science.aaa8205 |
| [4] |
Rothfuchs AG, Kreuger MR, Wigzell H, et al. Macrophages, CD4+or CD8+ cells are each sufficient for protection against Chlamydia pneumoniae infection through their ability to secrete IFN-Γ[J]. J Immunol, 2004, 172(4): 2407-15. |
| [5] |
Li J, Dong XJ, Zhao L, et al. Natural killer cells regulate Th1/Treg and Th17/Treg balance in chlamydial lung infection[J]. J Cell Mol Med, 2016, 20(7): 1339-51. DOI:10.1111/jcmm.12821 |
| [6] |
Shekhar S, Peng Y, Gao XL, et al. NK cells modulate the lung dendritic cell-mediated Th1/Th17 immunity during intracellular bacterial infection[J]. Eur J Immunol, 2015, 45(10): 2810-20. DOI:10.1002/eji.201445390 |
| [7] |
Zhao L, Gao XL, Bai H, et al. The important role of dendritic cell (DC) in iNKT-mediated modulation of NK cell function in Chlamydia pneumoniae lung infection[J]. Mediators Inflamm, 2019, 329: 4742634-42. |
| [8] |
Radomski N, Karger A, Franzke K, et al. Chlamydia psittaci-infected dendritic cells communicate with NK cells via exosomes to activate antibacterial immunity[J]. Infect Immun, 2019, 88(1): e00541-19. |
| [9] |
Chan CJ, Martinet L, Gilfillan S, et al. The receptors CD96 and CD226 oppose each other in the regulation of natural killer cell functions[J]. Nat Immunol, 2014, 15(5): 431-8. DOI:10.1038/ni.2850 |
| [10] |
Kim N, Kim HS. Targeting checkpoint receptors and molecules for therapeutic modulation of natural killer cells[J]. Front Immunol, 2018, 9: 2041-50. DOI:10.3389/fimmu.2018.02041 |
| [11] |
Mittal D, Lepletier A, Madore J, et al. CD96 is an immune checkpoint that regulates CD8+ T-cell antitumor function[J]. Cancer Immunol Res, 2019, 7(4): 559-71. DOI:10.1158/2326-6066.CIR-18-0637 |
| [12] |
Horvat JC, Beagley KW, Wade MA, et al. Neonatal chlamydial infection induces mixed T-cell responses that drive allergic airway disease[J]. Am J Respir Crit Care Med, 2007, 176(6): 556-64. DOI:10.1164/rccm.200607-1005OC |
| [13] |
Li J, Zuo LG, Tian Y, et al. Spontaneous colitis in IL-10-deficient mice was ameliorated via inhibiting glutaminase1[J]. J Cell Mol Med, 2019, 23(8): 5632-41. DOI:10.1111/jcmm.14471 |
| [14] |
Jiao L, Gao XL, Joyee AG, et al. NK cells promote type 1 T cell immunity through modulating the function of dendritic cells during intracellular bacterial infection[J]. J Immunol, 2011, 187(1): 401-11. |
| [15] |
Tseng CT, Rank RG. Role of NK cells in early host response to chlamydial genital infection[J]. Infect Immun, 1998, 66(12): 5867-75. DOI:10.1128/IAI.66.12.5867-5875.1998 |
| [16] |
Zhao L, Gao XL, Peng Y, et al. Differential modulating effect of natural killer (NK) T cells on interferon-γ production and cytotoxic function of NK cells and its relationship with NK subsets in Chlamydia muridarum infection[J]. Immunology, 2011, 134(2): 172-84. |
| [17] |
Bi JC, Tian ZG. NK cell dysfunction and checkpoint immunotherapy[J]. Front Immunol, 2019, 10: 1999-2011. DOI:10.3389/fimmu.2019.01999 |
| [18] |
Deuss FA, Watson GM, Goodall KJ, et al. Structural basis for the recognition of nectin-like protein-5 by the human-activating immune receptor, DNAM-1[J]. J Biol Chem, 2019, 294(33): 12534-46. DOI:10.1074/jbc.RA119.009261 |
| [19] |
Georgiev H, Ravens I, Papadogianni G, et al. Coming of age: CD96 emerges as modulator of immune responses[J]. Front Immunol, 2018, 9: 1072-80. DOI:10.3389/fimmu.2018.01072 |
| [20] |
Khan M, Arooj S, Wang H. NK cell-based immune checkpoint inhibition[J]. Front Immunol, 2020, 11: 167-75. DOI:10.3389/fimmu.2020.00167 |
| [21] |
毕嘉成, 田志刚. NK细胞耗竭与卡控点免疫治疗[J]. 中国免疫学杂志, 2019, 35(2): 129-34. |
| [22] |
Minton K. Natural killer cells: a TACTILE restraint[J]. Nat Rev Immunol, 2014, 14(5): 285-93. |
| [23] |
Martinet L, Smyth MJ. Balancing natural killer cell activation through paired receptors[J]. Nat Rev Immunol, 2015, 15(4): 243-54. DOI:10.1038/nri3799 |
| [24] |
Helble JD, Gonzalez RJ, von Andrian UH, et al. Gamma interferon is required for Chlamydia clearance but is dispensable for T cell homing to the genital tract[J]. mBio, 2020, 11(2): e00191-20. |
| [25] |
Brunham RC, Rey-Ladino J. Immunology of Chlamydia infection: implications for a Chlamydia trachomatis vaccine[J]. Nat Rev Immunol, 2005, 5(2): 149-61. DOI:10.1038/nri1551 |
| [26] |
Feng CG, Kaviratne M, Rothfuchs AG, et al. NK cell-derived IFNGamma differentially regulates innate resistance and neutrophil response in T cell-deficient hosts infected with Mycobacterium tuberculosis[J]. J Immunol, 2006, 177(10): 7086-93. DOI:10.4049/jimmunol.177.10.7086 |
| [27] |
O'Brien KL, Finlay DK. Immunometabolism and natural killer cell responses[J]. Nat Rev Immunol, 2019, 19(5): 282-90. DOI:10.1038/s41577-019-0139-2 |
| [28] |
Martín-Fontecha A, Thomsen LL, Brett S, et al. Induced recruitment of NK cells to lymph nodes provides IFN-Gamma for T(H)1 priming[J]. Nat Immunol, 2004, 5(12): 1260-5. DOI:10.1038/ni1138 |
| [29] |
Laouar Y, Sutterwala FS, Gorelik L, et al. Transforming growth factor-beta controls T helper type 1 cell development through regulation of natural killer cell interferon-Gamma[J]. Nat Immunol, 2005, 6(6): 600-7. DOI:10.1038/ni1197 |
| [30] |
周小青, 李静, 赵蕾, 等. 自然杀伤细胞通过树突状细胞调控衣原体肺部感染中Th17/Treg免疫应答平衡[J]. 山东大学学报:医学版, 2019, 57(4): 15-9. |
| [31] |
董晓婧, 李静, 赵蕾, 等. 鼠衣原体肺部感染中自然杀伤细胞对白细胞介素-22产生及疾病进程的影响[J]. 山东大学学报:医学版, 2016, 54(11): 19-23. |
| [32] |
Barrow AD, Edeling MA, Trifonov V, et al. Natural killer cells control tumor growth by sensing a growth factor[J]. Cell, 2018, 172(3): 534-48. DOI:10.1016/j.cell.2017.11.037 |
 2020, Vol. 40
2020, Vol. 40

