卒中后抑郁(PSD)是一种与卒中事件相关的情感障碍,是缺血性脑卒中最常见的并发症之一。由于研究对象、评估标准和评估时间的不同,PSD的患病率从25%到70%不等[1]。既往研究认为,PSD患者存在神经功能恢复延迟、严重影响日常生活活动和生活质量,并且PSD的发生与脑卒中复发和死亡风险呈正相关,是卒中康复的重要障碍[2]。但目前卒中后抑郁的发病机制尚不清楚。既往研究表明,PSD可能与单胺神经递质假说、神经营养蛋白及受体的信号传导、炎症免疫的激活、HPA轴及皮质醇的活化、海马神经发生、缺血损伤细胞的可塑性、继发性退行性改变有关[3]。因此,阐明PSD的发病机制,探索新的稳定的生物标志物对PSD的诊断和治疗以及卒中患者的预后具有重要意义。
近年来,PSD病因相关临床因素的研究较多,但其结果并不一致[4],包括性别、年龄、收入水平、受教育程度、既往卒中史、病变部位等,这可能是由于研究计划、纳入及评判标准或区域政策的差异造成,故单纯依靠临床指标在早期诊断PSD中具有局限性。MicroRNAs(miRNAs)是一种小的,长度约为19~25核苷酸的非编码RNA,它可以调节多种下游靶点,并参与多种功能通路的分化。此外,microrna可以在血浆中稳定检测到。目前miRNAs已经作为一种新的潜在的血液生物标志物,在包括重度抑郁症等精神疾病的预测和治疗中得到应用[5]。miR-30a-5p属于miR-30a家族,基因序列高度保守,在循环血液中稳定存在。先前的研究已经表明,miR-30a-5p在某些神经系统疾病中起着重要而复杂的作用,包括卒中[6]、帕金森病[7]、阿尔茨海默病[8]、癫痫[9]、亨廷顿病[10]等。Long等[11]发现急性期缺血性脑卒中(AIS)患者血浆中miR-30a-5p的水平变化明显,提示miR-30a可能通过调控与脑梗死相关RhoB和beclin-1基因靶点调节细胞凋亡和神经再生。Mellios等[12]认为miR-30a-5p很可能是BDNF合成的转录后抑制剂,调控脑源性神经营养因子(BDNF)在前额叶皮层(PFC)的表达,参与抑郁的形成。虽然既往研究表明miR-30a-5p可能通过调节细胞凋亡和神经再生,参与脑梗死和抑郁的发病过程,但miR-30a-5p与PSD的相关性尚未被报道。卒中后抑郁患者外周血清miR-30a-5p表达水平的差异性以及其作用机制仍缺乏系统性研究。
综上所述,本研究通过生物信息学方法阐述脑卒中患者外周血miR-30-5p表达水平与PSD的相关性,并通过临床样本验证其差异性表达,并对其可能作用的机制进行了生物信息学预测,为进一步了解PSD的发病机制,提供潜在的血液生物标志物和可能的治疗靶点提供理论依据。
1 材料和方法 1.1 MicroRNA数据分析检索公共基因表达GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库,未发现与PSD相关的MicroRNAs基因信息,进一步检索PUBMED、MEDLINE数据库,获取卒中相关的血浆microRNA、抑郁症相关血浆microRNA的相关综述、meta分析,结果提示3篇文献符合要求,分别为PMID30563269\PMID28673667\PMID31125682。使用VENNY 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)免费在线软件,将上述3个文献中的差异性表达血浆microRNA取交集,得出在卒中和抑郁症中都有差异性表达的血浆microRNA。
1.2 临床样本的收集和初步验证 1.2.1 一般临床资料和外周血液样本的收集收集自2018年10月~2019年3月就诊于皖南医学院弋矶山医院神经内科卒中病房并首次诊断为急性脑梗死的患者。纳入标准:(1)缺血性脑卒中的诊断符合2010年《中国急性缺血性脑卒中诊疗指南》,并经头颅MRI扫描证实;(2)病程少于1周;(3)年满十八周岁。排除标准:(1)患者卒中前已诊断痴呆或病程中存在认知功能下降或意识障碍不能配合完成检查和随访者;(2)患者病前诊断为抑郁症或抑郁状态,正在服用抗抑郁药物者;(3)患有其他精神疾病,如焦虑、自杀行为等;(4)存在严重器质性疾病,如急慢性炎症或感染、心肺功能衰竭、肝肾功能不全或严重代谢性疾病等全身性疾病患者;(5)严重失语、构音障碍、视觉和听觉障碍者;(6)患者因其他各种原因无法完成随访或随访中丢失、退出研究或死亡的患者。所有参与者或其亲属均签署书面知情同意书。收集包括人口统计学(年龄、性别、受教育程度等)、卒中危险因素(高血压、高脂血症、糖尿病、缺血性心脏病)、既往卒中病史、卒中部位,卒中严重程度[美国国立卫生研究院卒中量表(NIHSS)评分]于患者入院后24 h有神经内科专业医师进行评价)。对入组患者由经认证的神经科医生以发病3个月为时间点进行门诊或电话随访。根据Hamilton抑郁量表(HAMD-17)行抑郁程度的评价,对于评分值≥7者按照《美国精神病学会叶精神疾病诊断与统计手册》第4版(DSM-IV)诊断标准诊断抑郁,分为PSD组和non-PSD组。
入院当天留取研究对象外周静脉血5 mL,血液标本使用枸橼酸钠抗凝剂抗凝,离机离心(5 min,3000 r/min),将上清液转移至1.5 mL冻存管内-80 ℃保存。
1.2.2 外周血RNA提取和qRT-PCR按照Qiagen公司的miRNeasy RNA isolation试剂盒说明书提取血浆总RNA,提取的RNA使用NanoDrop 2000C instrument(Thermo Fisher Scientific, Waltham, MA)检测RNA浓度和A260/280比值,然后立即进行逆转录,使用Vazyme公司的miRNA 1st Strand cDNA Synthesis Kit(by stemloop)进行逆转录。miR-30a-5p茎环引物序列为5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGC ACTGGATACGACCTTCCA-3',采用U6作为内参,其茎环引物序列为5'-CGAGCACAGAATCGCTTCA CGAATTTGCGTGTCAT-3'。采用ROCHE公司的实时定量PCR仪进行SYBR法检测,按照Vazyme公司AceQ Universal SYBR qPCR Master Mix(Q511-02)试剂盒操作说明书来配置定量PCR反应体系,使用ROCHE PCR仪自带“两步法”进行定量检测。miR-30a-5p上游引物5'-CGCGTGTAAACATCCTCGAC-3',下游引物5'-AGTGCAGGGTCCGAGGTATT-3'。U6上游引物5'-CGAGCACAGAATCGCTTCA-3',下游5'-CTCGCTTCGGCAGCACATAT-3'。结果分析采用2-ΔΔCt法。
1.3 miR-30a-5p靶基因预测及筛选使用ENCORI在线网站(http://starbase.sysu.edu.cn/),基于网站内的miRNA-mRNA模块预测miR-30a-5p可能作用的靶基因,为了提高预测的准确性及缩小靶基因的范围,PREDICTED PROGRAM栏目设定Targetscan、PicTar和miRanda。检索CTD(Comparative Toxicogenomics Database)数据库(http://ctdbase.org/),获取抑郁症相关的蛋白,并将检索到的蛋白与ENCORI预测到的靶蛋白取交集得到miR-30a-5p调控的抑郁相关靶蛋白。
1.4 靶基因GO分析和KEGG富集分析使用FUNRICH软件(http://www.funrich.org/)进行靶基因的GO(Gene Ontology)分析,包括cellular component、molecular function和biology process三个方面,采用R语言进行KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析并绘制图形。
1.5 靶基因PPI及HUB基因筛选使用STRING数据库(https://string-db.org/)进行靶基因的PPI(Protein-Protein Interaction)网络分析,将靶基因导入STRING数据库,生成PPI网络图。为了进一步筛选HUB基因,我们下载TSV格式结果并导入至Cytoscape软件内,使用软件内的cytoHubba插件来进行可视化分析并筛选出前20个基因,运算方法选择MCC。
1.6 统计学处理数值变量数据使用均数±标准差表示,两组间数值变量的比较采用t检验,计数资料采用例数(百分比)[n(%)]表示,组间比较采用χ2检验。P < 0.05认为有统计学差异存在,数据分析及作图采用Graphpad Prism 7(Version 7.01)和SPSS 18.0。
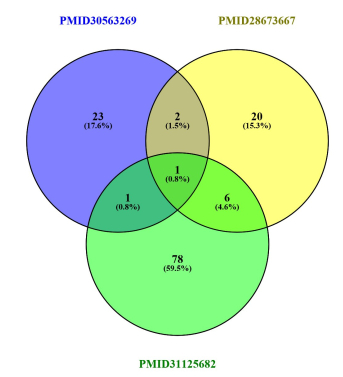
2 结果 2.1 miR-30a-5p与卒中后抑郁的相关性通过PUBMED、MEDLINE数据库文献检索发现,与卒中相关的血浆microRNA 86种(PMID31125682),与抑郁相关的血浆microRNA分别为27种(PMID30563269)和29种(PMID28673667),VENN图如下(图 1),交集microRNA为miR-30a-5p。
|
图 1 抑郁相关的mircroRNA和卒中相关的血浆microRNA交集VENN图 Fig.1 VENN diagram of the intersection of depressionrelated and stroke-related plasma mircroRNA. |
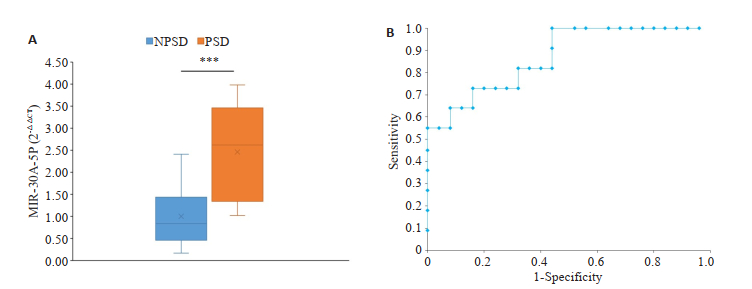
研究最终入组并完成3个月随访患者36例,其中男性17例,女性19例,年龄60.33±7.41岁,其中PSD组11例,非PSD组25例,两组在性别、年龄、脑血管危险因素、既往卒中史、卒中部位、NHISS评分上无统计学差异,P均 > 0.05(表 1)。非PSD患者(n=25)外周血miR-30a-5p表达量为1±0.126,PSD患者(n=11)表达量为2.462±0.326,差异具有统计学意义(P < 0.0001,图 2A),ROC曲线提示miR-30a-5p预测PSD的AUC=0.869(95%CI,0.745~0.993,P=0.0005,图 2B),cut-off值为1.597,对应的敏感性和特异性分别为0.727、0.840。
| 表 1 PSD组与非PSD组microRNA谱表达的临床资料比较 Tab.1 Comparison of the clinical data of microRNAprofile expression between PSD group and non-PSD group |
|
图 2 miR-30a-5p和卒中后抑郁的相关性 Fig.2 Correlation between miR-30a-5p and post stroke depression. A: Boxplots comparison of the miR-30a-5p value in patients with non-PSD group and PSD group; B: ROC analysis of miR-30a-5p in diagnosis of post stroke depression. ***P < 0.0001. |
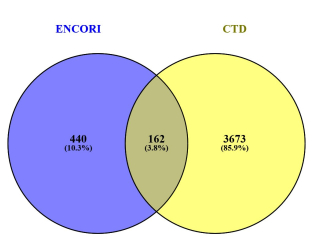
通过ENCORI在线网站,预测到miR-30a-5p的靶基因共有602种,CTD数据库检索到抑郁症相关的基因3835种,二者取交集得到162种蛋白(图 3)。
|
图 3 miR-30a-5p卒中后抑郁相关的靶蛋白VENN图 Fig.3 VENN diagram of miR-30a-5p target protein associated with post-stroke depression. |
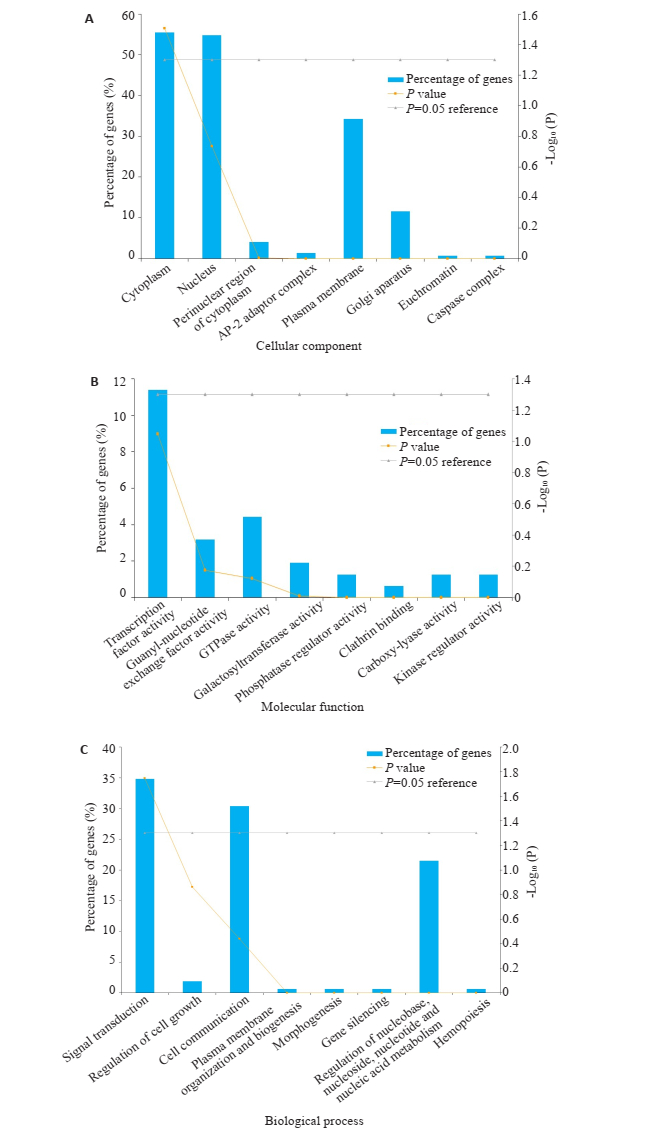
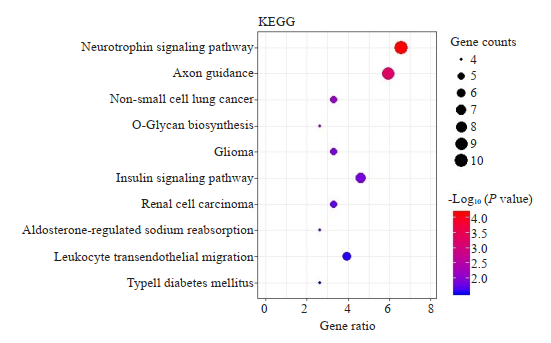
为了进一步了解靶基因的生物学作用,我们使用FUNRICH软件进行162种靶基因的GO分析,Cellular component分析提示靶基因主要位于细胞浆和细胞核中,分别占总蛋白数量的55.479%和54.795%(图 4A);Molecular function分析提示靶基因主要具有转录因子功能(11.392%)、GTP酶活性(4.430%),鸟苷酸交换因子活性(3.165%),半乳糖基转移酶活性(1.899%),调节磷酸化酶作用(1.266%),羧基裂解酶活性(1.266%),激酶调节作用(1.266%)(图 4B);Biology process分析提示靶基因主要参与信号转导(34.810%),细胞间通讯(30.380%),核碱基、核苷、核苷酸和核酸代谢的调节(21.519%)(图 4C)。经KEGG通路富集分析发现,靶基因主要作用于神经营养素信号通路、轴突导向信号通路、胰岛素信号传导系统(图 5)。
|
图 4 miR-30a-5p生物信息学GO分析 Fig.4 Bioinformation analysis of the differently expressed miR-30a-5p and predicted targets. A: GO cellular component; B: GO molecular function; C: GO biological process. |
|
图 5 miR-30a-5p相关PSD靶基因KEGG富集图 Fig.5 KEGG enrichment pathway of miR-30a-5p-related PSD target genes. |
|
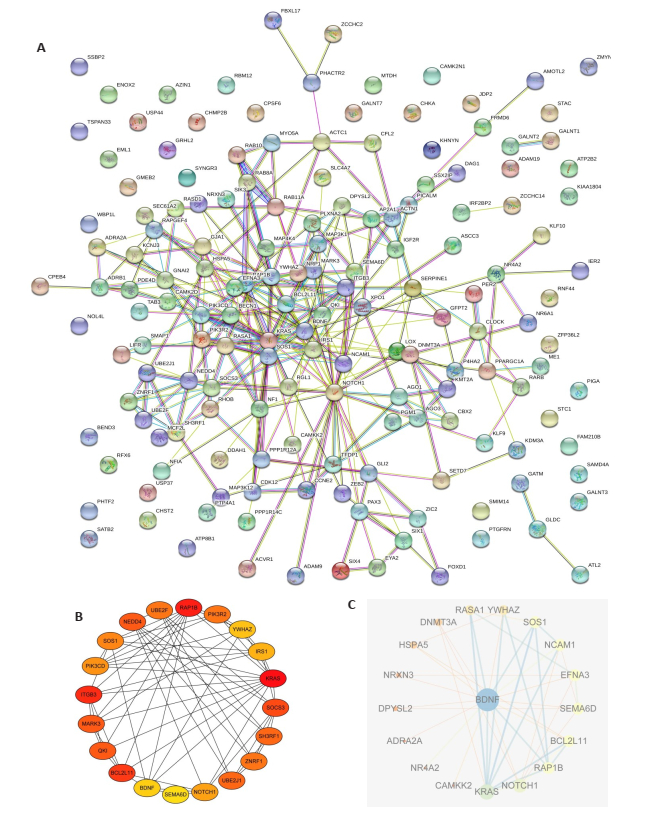
图 6 miR-30a-5pPSD相关靶基因PPI网络图和HUB基因 Fig.6 Protein-protein interaction network and HUB genes associated with miR-30a-5p. A: PPI network for psd related genes; B: HUB target genes(top 20) related to miR-30a-5p; C: BDNF-related genes. |
PSD是脑卒中后常见的并发症之一,以长期持续的情绪低落为特征,是一种与卒中相关的情感性精神障碍,影响1/3一卒中患者近5年的生存质量。但目前临床上尚缺乏稳定、便捷的早期预测PSD的指标。
MicroRNA是一类小分子非编码单链RNA,通过部分性或完全性与靶mRNA的3'非翻译区(3'UTR)互补配对,阻止其翻译或使其降解,从而对靶基因起到转录后调节作用。既往文献报道,MicroRNAs参与并调控中枢神经系统的许多生物学过程,与内皮功能障碍、细胞凋亡、细胞增殖、炎症反应、氧化应激、血管生成和神经生成相关[13-14]。此外,外周血miRNA的理化性质和表达相对稳定,获得途径、检测手段相对简单、微创和廉价,且在疾病早期就可被检出,一部分miRNA已经成为某些肿瘤和缺血性卒中的生物标记物[15-16]。但有关MicroRNA和卒中后抑郁的研究很少,我们检索了公共基因表达GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库,未发现与PSD相关的MicroRNA芯片信息。
本研究中我们通过文献检索与卒中以及抑郁相关的血浆miRNA,应用VENNY在线软件对检索大数据取交集,得到同时与卒中和抑郁都存在相关性的血浆microRNA: miR-30a-5p,而目前为止miR-30a-5p与PSD的关系尚未被报道。据我们所知,我们首先报道了miR-30a-5p与PSD的相关性。并通过临床样本的QRT-PCR初步验证了其与PSD的相关性。此外,ROC曲线分析发现miR-30a-5p预测PSD的AUC=0.869(95%CI,0.745-0.993,P=0.0005),cut-off值为1.597,对应的敏感性和特异性分别为0.727、0.840。既往文献关于卒中后3个月PSD血液标志物的研究报道较少。Li等[17]认为入院时较低的血清BDNF水平可以预测3个月内PSD的发生,敏感性为73.2%,特异性为70.7%。而与BDNF相比,循环miR-30a-5p对卒中后3个月PSD的预测准确性更高,敏感性为72.7%,特异性为84.0%。因此,我们认为患者入院时血浆miR-30a-5p很可能是预测PSD的一种新的生物标志物。
为进一步了解外周血差异性表达的miR-30a-5p对卒中后3个月PSD的可能作用机制,我们对miR-30a-5p的进行了生物信息血分析。为降低靶基因预测依赖于“种子区”碱基的互补所造成的的假阳性率,我们采用ENCORI在线数据库和CTD数据库的交叉预测,并同时预测到与抑郁相关的miR-30a-5p的靶基因162种。KEGG通路富集分析发现,这些靶蛋白主要作用于神经营养素信号通路、轴突导向信号通路、胰岛素信号传导系统。由于上述生物学功能涉及到PSD发生、发展的各个阶段,我们推测miR-30a-5p可能通过调控其下游一系列靶基因的表达进而引起多种生物学特性改变,参与PSD的发生发展。其中神经营养素信号转导和轴突发育是最为突出的生物学过程。这可能为我们了解卒中后3个月PSD的发病机制提供了新的线索。轴突发育与神经细胞再生和神经的可塑性相关,轴突生长被认为是一种自发形式的神经可塑性,在神经系统发育和中枢神经系统损伤后功能恢复中起关键作用[18]。而神经营养素信号通路(如Ras-Raf-MAP激酶信号通路)在神经营养受体下游的级联反应是控制轴突生长的关键细胞信号通路[19]。既往研究中神经可塑性假说被用来解释重度抑郁的病因[20]以及脑卒中患者康复阶段认知功能的改变[21]。而我们的研究中预测到与抑郁相关的miR-30a-5p的靶蛋白主要作用于神经营养素信号转导和轴突发育等生物学过程,参与神经可塑性,从而参与PSD可能病因机制,这与既往研究相符。
同时我们对PSD相关的162种基因建立PPI网络分析图,并筛选出前20种关键基因,并建立与BDNF相关的PPI网络分析图。在本研究中我们首次发现并提出miR-30a-5p可以调控BDNF基因。脑源性神经营养因子(BDNF)是一种重要的神经营养因子,影响神经元增殖、突触功能和突触可塑性[22]。而神经元可塑性的破坏已被证明在PSD的发病过程中起重要作用。BDNF与脑单胺类神经递质关系密切,是5-羟色胺能神经元的强效营养剂[23],其在抗抑郁药物作用机制中的作用已被证实。啮齿类动物研究表明,BDNF合成受损的转基因小鼠对抗抑郁药物没有反应[24]。在人类研究中,抑郁症患者外周BDNF水平降低,服用抗抑郁药[25]可使其恢复正常。BDNF含量减少和单核苷酸位点突变被证明与PSD的发生发展具有相关性[26]。而miR-30a-5p可以调控BDNF基因从另一个角度验证了miR-30a-5p与PSD的相关性。而筛选出的其他HUB基因通过不同的蛋白信号传导通路参与神经的可塑性和轴突的生长发育,从而与缺血后神经的修复和海马区神经元的可塑性相关[27-31],且都与BNDF基因有不同程度的相关性。
综上所述,我们采用生物信息学方法对miR-30a-5p的生物学特性及其功能进行了分析,并通过小规模临床样本QRT-PCR进行了验证,提示外周血miR-30a-5p在卒中后抑郁患者和非卒中后抑郁患者中存在差异性表达,可能与卒中后抑郁的发病机制密切相关。miR-30a-5p可能是诊断缺血性脑卒中后3个月PSD的一个新的血液学标志物。通过调控miR-30a-5p的表达,从而调控BDNF,可能作为PSD的潜在诊疗靶点应用于临床实践中。但相关结论尚需要大规模临床样本进一步验证,miR-30a-5p作用于PSD的具体机制尚需动物实验进一步证实。
| [1] |
Ayis SA, Ayerbe L, Crichton SL, et al. The natural history of depression and trajectories of symptoms long term after stroke: The prospective south London stroke register[J]. J Affect Disord, 2016, 194: 65-71. DOI:10.1016/j.jad.2016.01.030 |
| [2] |
Sen A, Bisquera A, Wang YZ, et al. Factors, trends, and long-term outcomes for stroke patients returning to work: The south london stroke register[J]. Int J Stroke, 2019, 14(7): 696-705. DOI:10.1177/1747493019832997 |
| [3] |
Villa RF, Ferrari F, Moretti A. Post-stroke depression: Mechanisms and pharmacological treatment[J]. Pharmacol Ther, 2018, 184: 131-44. DOI:10.1016/j.pharmthera.2017.11.005 |
| [4] |
Robinson RG, Jorge RE. Post-stroke depression: a review[J]. Am J Psychiatry, 2016, 173(3): 221-31. DOI:10.1176/appi.ajp.2015.15030363 |
| [5] |
Roy B, Dunbar M, Shelton RC, et al. Identification of MicroRNA-124-3p as a putative epigenetic signature of major depressive disorder[J]. Neuropsychopharmacology, 2017, 42(4): 864-75. DOI:10.1038/npp.2016.175 |
| [6] |
Wang W, Li DB, Li RY, et al. Diagnosis of hyperacute and acute ischaemic stroke: the potential utility of exosomal MicroRNA-21-5p and MicroRNA-30a-5p[J]. Cerebrovasc Dis, 2018, 45(5/6): 204-12. |
| [7] |
Schwienbacher C, Foco L, Picard A, et al. Plasma and white blood cells show different miRNA expression profiles in Parkinson's disease[J]. J Mol Neurosci, 2017, 62(2): 244-54. DOI:10.1007/s12031-017-0926-9 |
| [8] |
Lv Z, Hu LC, Yang Y, et al. Comparative study of microRNA profiling in one Chinese family with PSEN1 G378E mutation[J]. Metab Brain Dis, 2018, 33(5): 1711-20. DOI:10.1007/s11011-018-0279-2 |
| [9] |
Kretschmann A, Danis B, Andonovic L, et al. Different microRNA profiles in chronic epilepsy versus acute seizure mouse models[J]. J Mol Neurosci, 2015, 55(2): 466-79. DOI:10.1007/s12031-014-0368-6 |
| [10] |
Müller S. In silico analysis of regulatory networks underlines the role of miR-10b-5p and its target BDNF in Huntington's disease[J]. Transl Neurodegener, 2014, 3: 17. DOI:10.1186/2047-9158-3-17 |
| [11] |
Long GW, Wang F, Li HP, et al. Circulating miR-30a, miR-126 and let-7b as biomarker for ischemic stroke in humans[J]. BMC Neurol, 2013, 13: 178. DOI:10.1186/1471-2377-13-178 |
| [12] |
Mellios N, Huang HS, Grigorenko A, et al. A set of differentially expressed miRNAs, including miR-30a-5p, act as posttranscriptional inhibitors of BDNF in prefrontal cortex[J]. Hum Mol Genet, 2008, 17(19): 3030-42. DOI:10.1093/hmg/ddn201 |
| [13] |
Sun AX, Crabtree GR, Yoo AS. MicroRNAs: regulators of neuronal fate[J]. Curr Opin Cell Biol, 2013, 25(2): 215-21. DOI:10.1016/j.ceb.2012.12.007 |
| [14] |
Jiang XG, Lin Y, Li YS. Correlative study on risk factors of depression among acute stroke patients[J]. Eur Rev Med Pharmacol Sci, 2014, 18(9): 1315-23. |
| [15] |
Mirzaei H, Momeni F, Saadatpour L, et al. MicroRNA: Relevance to stroke diagnosis, prognosis, and therapy[J]. J Cell Physiol, 2018, 233(2): 856-65. DOI:10.1002/jcp.25787 |
| [16] |
Acunzo M, Romano G, Wernicke D, et al. MicroRNA and cancer: a brief overview[J]. Adv Biol Regul, 2015, 57: 1-9. DOI:10.1016/j.jbior.2014.09.013 |
| [17] |
Li J, Zhao YD, Zeng JW, et al. Serum Brain-derived neurotrophic factor levels in post-stroke depression[J]. J Affect Disord, 2014, 168: 373-9. DOI:10.1016/j.jad.2014.07.011 |
| [18] |
Brosig A, Fuchs J, Ipek F, et al. The axonal membrane protein PRG2 inhibits PTEN and directs growth to branches[J]. Cell Rep, 2019, 29(7): 2028-40.e8. DOI:10.1016/j.celrep.2019.10.039 |
| [19] |
Ijaz S, Davies P, Williams CJ, et al. Psychological therapies for treatment-resistant depression in adults[J]. Cochrane Database Syst Rev, 2018, 5(2): CD010558. |
| [20] |
Lima IMM, Peckham AD, Johnson SL. Cognitive deficits in bipolar disorders: Implications for emotion[J]. Clin Psychol Rev, 2018, 59: 126-36. DOI:10.1016/j.cpr.2017.11.006 |
| [21] |
Farokhi-Sisakht F, Farhoudi M, Sadigh-Eteghad S, et al. Cognitive rehabilitation improves ischemic stroke-induced cognitive impairment: role of growth factors[J]. J Stroke Cerebrovasc Dis, 2019, 28(10): 104299. DOI:10.1016/j.jstrokecerebrovasdis.2019.07.015 |
| [22] |
Zhang JC, Yao W, Hashimoto K. Brain-derived neurotrophic factor (BDNF)-TRKB signaling in inflammation-related depression and potential therapeutic targets[J]. Curr Neuropharmacol, 2016, 14(7): 721-31. DOI:10.2174/1570159X14666160119094646 |
| [23] |
Phillips C. Brain-derived neurotrophic factor, depression, and physical activity: making the neuroplastic connection[J]. Neural Plast, 2017, 2017: 7260130. |
| [24] |
Nasrallah P, Haidar EA, Stephan JS, et al. Branched-chain amino acids mediate resilience to chronic social defeat stress by activating BDNF/TRKB signaling[J]. Neurobiol Stress, 2019, 11: 100170. DOI:10.1016/j.ynstr.2019.100170 |
| [25] |
Zhang Y, Shi J, Li JX, et al. Role of brain-derived neurotrophic factor in the molecular neurobiology of major depressive disorder[J]. Transl Perioper Pain Med, 2017, 4(1): 20-30. |
| [26] |
Chen MH, Lin WC, Wu HJ, et al. Antisuicidal effect, BDNF Val66Met polymorphism, and low-dose ketamine infusion: Reanalysis of adjunctive ketamine study of Taiwanese patients with treatment-resistant depression (AKSTP-TRD)[J]. J Affect Disord, 2019, 251: 162-9. DOI:10.1016/j.jad.2019.03.075 |
| [27] |
Cahill ME, Walker DM, Gancarz AM, et al. The dendritic spine morphogenic effects of repeated cocaine use occur through the regulation of serum response factor signaling[J]. Mol Psychiatry, 2018, 23(6): 1474-86. DOI:10.1038/mp.2017.116 |
| [28] |
Zhang L, Zhang P, Wang GF, et al. Ras and rap signal bidirectional synaptic plasticity via distinct subcellular microdomains[J]. Neuron, 2018, 98(4): 783-800.e4. DOI:10.1016/j.neuron.2018.03.049 |
| [29] |
Fujikura K, Akita M, Abe-Suzuki S, et al. Mucinous cystic neoplasms of the liver and pancreas: relationship between KRAS driver mutations and disease progression[J]. Histopathology, 2017, 71(4): 591-600. DOI:10.1111/his.13271 |
| [30] |
Eyileten C, Wicik Z, de Rosa S, et al. MicroRNAs as diagnostic and prognostic biomarkers in ischemic stroke-A comprehensive review and bioinformatic analysis[J]. Cells, 2018, 7(12): E249. DOI:10.3390/cells7120249 |
| [31] |
Pettai K, Milani L, Tammiste A, et al. Whole-genome expression analysis reveals genes associated with treatment response to escitalopram in major depression[J]. Eur Neuropsychopharmacol, 2016, 26(9): 1475-83. DOI:10.1016/j.euroneuro.2016.06.007 |
 2020, Vol. 40
2020, Vol. 40

