2. 南昌大学医学院,江西 南昌 330006
2. Medical School of Nanchang University, Nanchang 330006, China
阿尔茨海默病(AD)是一种神经退行性疾病,研究显示95%AD患者在大脑中存在β淀粉样蛋白(Aβ)沉淀[1-2]。从AD患者的大脑中分离出的Aβ25-35肽链可以在体内和体外诱导细胞凋亡[3-4],但是目前尚无有效的AD治疗方法[5]。中药在预防和治疗许多慢性疾病和心脑血管疾病方面取得了一定的进展,益母草常被用于妇科和产科疾病的临床治疗,水苏碱(STA)是从益母草中提取的水溶性生物碱,可以抑制细胞凋亡、抑制肿瘤生长、维持心肌细胞的稳态、减轻内皮功能障碍[6-8]。研究显示,STA可以通过降局灶性脑缺血再灌注小鼠脑细胞凋亡率[9],但STA是否对AD具有治疗作用,目前尚不清楚。
本研究首先使用GEO和STITCH生物信息学数据库分析STA的靶基因,预测STA的靶基因是与细胞衰老和细胞凋亡密切相关的基因RPS8和EED,并进一步分析RPS8和EED对凋亡相关基因BCl-2,TP53的关联和影响;其次,通过使用有Aβ25-35处理PC12细胞建立了AD体外模型,探讨STA对AD的影响及可能作用机制。
1 材料和方法 1.1 生物信息学分析从GEO数据库中下载数据GSE85871(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?Acc=GSE85871)作为芯片表达数据,并将其分类为表达矩阵(对数标准化)。使用Limma微阵列方法分析差异表达基因(log2FC > 1,P < 0.01)。选择差异表达最明显的基因来绘制热图。利用STITCH数据库(http://stitch.embl.de/)鉴定STA的靶基因,STA的靶基因是RPS8和EED[11-12](表 1)。
| 表 1 STITCH数据库的STA的靶基因 Tab.1 Target genes for STAin STITCH database |
PC12细胞(ATCC,美国)在含有1%青霉素和链霉素,10%FBS的RPMI 1640培养基中培养。细胞在95%湿度和5%CO2环境下于37 ℃孵育。RPMI 1640培养基每2 d更换1次。Aβ25-35购自Sigma(批号:29873242),并用无菌磷酸盐缓冲液(PBS)稀释至5 mmol/L。采用MTT法测定细胞活力,将PC12细胞在96孔板中培养24 h。然后将细胞与STA一起孵育,根据加入STA的浓度不同分为5组:0 μmol/L组(对照组)、0.1 μmol/L组、0.5 μmol/L组、1 μmol/L组和5 μmol/L组,孵育后测定细胞活性。
1.3 AD体外细胞模型建立及处理将Aβ25-35(25 μmol/L)添加到PC12细胞中作为AD的细胞模型[10],Aβ25-35(25 μmol/L)处理24 h后,然后添加STA,实验分为5组:空白对照组(control组)不加Aβ25-35、实验组添加Aβ25-35(25 μmol/L)和STA 0 μmol/L组(实验对照组)、0.1 μmol/L组、0.2 μmol/L组、0.5 μmol/L组。每组细胞在37 ℃下培养24 h。孵育后,将MTT以2 mg/mL的终浓度添加到每个培养孔中,并将细胞在37 ℃孵育4 h。然后添加100 μL二甲基亚砜;测量570 nm的吸光度。细胞转染培育48 h后,收集细胞,用冷PBS洗涤3次,并用冷70%乙醇固定过夜。接下来,在黑暗中4 ℃用碘化丙锭将细胞染色30 min,流式细胞仪分析以评估细胞周期。
1.4 qRT-PCR检测EED和RPS8基因表达水平使用Trizol试剂(Invitrogen)提取总RNA,并使用Qiagen RNeasy试剂盒(苏州凯杰公司)纯化,然后用DNase处理。使用上海三原生物工程技术服务有限公司(中国上海)合成的引物(表 2),通过一步cDNA合成试剂盒(中国大连宝生物工程)合成了cDNA。以GAPDH作为内参,通过实时PCR分析mRNA水平。
| 表 2 基因正反引物序列 Tab.2 Forward primer and reverse primer of gene |
将细胞孵育24 h,分为3组:对照组(培养基),25 μmol/L Aβ25-35组、25 μmol/L Aβ25-35+0.5 μmol/L STA组。从在裂解缓冲液中裂解的细胞中收集上清液。蛋白质样品通过SDS-PAGE分离,然后电转移到聚偏二氟乙烯(硝酸纤维素)膜上。然后将膜与5%脱脂牛奶一起孵育2 h,然后与一抗(抗RPS8,抗EED,抗Bcl-2,抗p53,美国,Sigma-Aldrich)在4 ℃下孵育过夜。用辣根过氧化物酶偶联的二抗,用HRP化学发光检测条带,凝胶图像分析系统检测蛋白质印迹条带灰度, 测定并计算RPS8,EED,Bcl-2,p53与β-actin的比值。
1.6 统计分析采用SPSS 15.0统计软件进行数据分析,计量资料以均数±标准差表示,组间比较采用采用单因素方差分析;检验水准为双侧α=0.05,P < 0.05为差异有统计学意义。
2 结果 2.1 STA作用的靶基因GEO数据库芯片的表达数据差异基因分析结果显示,其中上调基因37个,下调基因48个(图 1A)。首先选择23个差异表达最明显的基因进行热谱分析(图 1B),其中包括凋亡基因Bcl-2和MDM2。其次,从STITCH数据库中提取STA的靶基因,对来自GSE85871的23个差异基因与来自STITCH数据库的STA的两个靶基因之间的相互作用进行分析,结果显示,BCl-2、TP53和其他基因是通过RPS8和EED的作用从而作为STA的效应基因(图 1C)。
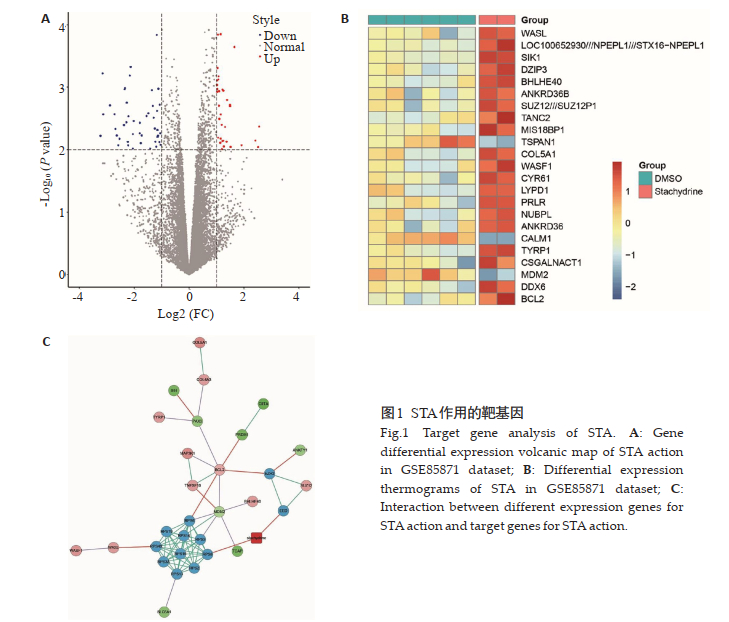
|
图 1 STA作用的靶基因 Fig.1 Target gene analysis of STA. A: Gene differential expression volcanic map of STA action in GSE85871 dataset; B: Differential expression thermograms of STA in GSE85871 dataset; C: Interaction between different expression genes for STA action and target genes for STA action. |
将0、0.1、0.5、1、5 μmol/L的STA应用于PC12细胞,MTT检测细胞活力结果显示,当STA的浓度达到5 μmol/L(71.13±6.22)时,与对照组0 μmol/L(90.24± 6.38)比较,STA明显抑制细胞活力(P < 0.05,图 2A)。Aβ25-35应用于PC12细胞后,MTT检测细胞的活力结果显示,Aβ25-35与对照组比较,细胞活力明显下降(61.06± 3.32 vs 93.11 ± 5.37,P < 0.05),给予STA(70.21 ± 5.02,78.15±5.31,84.04±4.12)处理后,与单纯的Aβ25-35处理比较,PC12的细胞活力明显升高(P < 0.05,图 2B)。细胞周期结果显示,Aβ25-35将PC12细胞周期阻滞至G2/M期,而STA恢复了Aβ25-35诱导的细胞周期停滞(图 2C)。
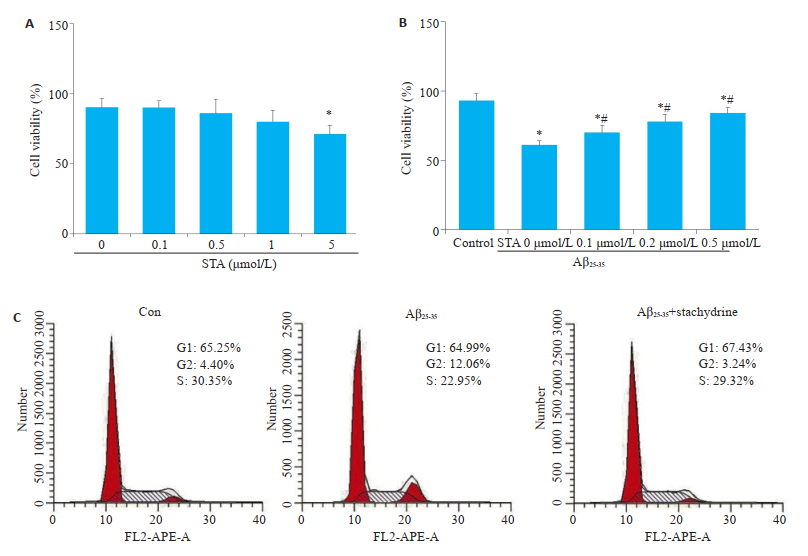
|
图 2 STA对体外AD模型细胞活力的影响(n=3) Fig.2 Effects of STA on the viability of AD model cells in vitro. A: After 24 h of pretreatment with STA (0, 0.1, 0.5, 1, 5 μmol/L) on PC-12 cells, MTT was used to detect cell viability; B: After STA (0, 0.1, 0.2 and 0.5 μmol/L) pretreatment in PC12 cells for 2 h and Aβ25-35 (25 μmol/L) for 24 h, MTT was used to detect cell viability; C: After STA (0, 0.1, 0.2 and 0.5 μmol/L)pretreatment in PC12 cells for 2 hours and Aβ25-35 (25 μmol/L) for 24 h, flow cytometry was used to detect the changes of PC-12 cell cycle. Mean±SD, n=3. *P < 0.05 vs control group; #P < 0.05 vs STA0 μmol/L +Aβ25-35 group. |
通过qRT-PCR检测目标基因RPS8和EED的表达水平,结果显示,用Aβ25-35处理后,与对照组相比较RPS8(0.52±0.11)和EED(0.47±0.12)表达下降。STA治疗改善了Aβ25-35诱导的RPS8(0.79±0.09)和EED(0.92±0.14)的作用(P < 0.05,图 3)。
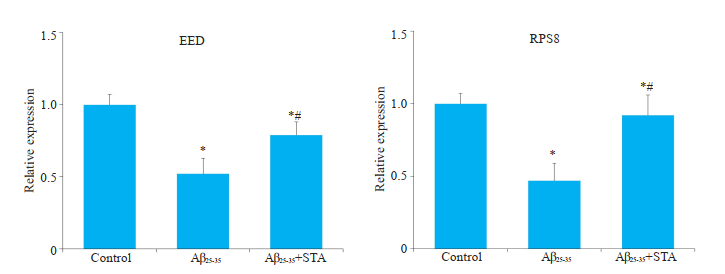
|
图 3 STA对体外AD模型RPS8和EED基因表达水平的影响 Fig.3 Effects of STAon the expression levels of RPS8 and EED genes in AD model in vitro. Mean±SD, n=3. *P < 0.05 vs control; #P < 0.05 vs Aβ25-35. |
通过免疫印迹法检测RPS8和EED蛋白以及凋亡相关蛋白Bcl-2和p53的表达水平,结果显示用Aβ25-35处理后,与对照组相比较RPS8(0.62±0.14)和EED(0.6± 0.13)表达下降(P < 0.05,图 4A),同时Bcl-2(0.36±0.02)和p53(0.35±0.03)表达下降(P < 0.05,图 4B)。与Aβ25-35组相比较,Aβ25-35+STA组RPS8(0.79±0.17)和EED(0.74± 0.19)表达明显升高(P < 0.05,图 4A),RPS8(0.53±0.04)和EED(0.34 ± 0.03)表达下降,Bcl-2(0.59 ± 0.08)和p53(0.64±0.11)的表达明显升高(P < 0.05,图 4B)。
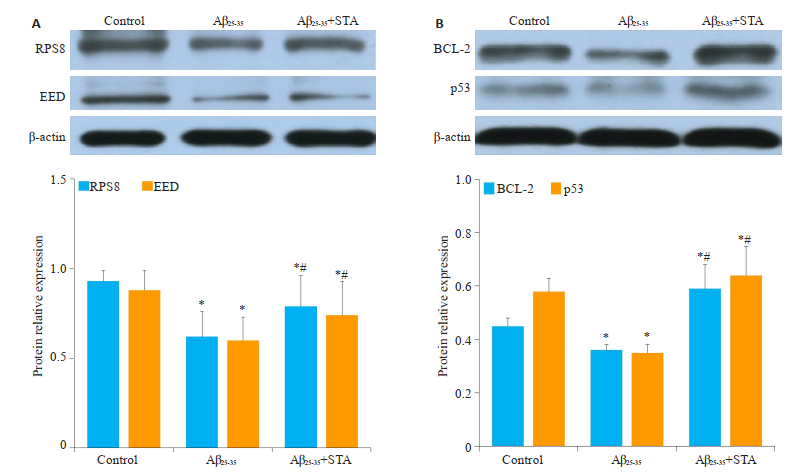
|
图 4 STA对体外AD模型RPS8和EED蛋白以及Bcl-2和p53蛋白表达的影响 Fig.4 Effects of STAon RPS8, EED, Bcl-2 and p53 proteins expression in AD model in vitro. A: The proteins expression of RPS8 and EED by Western blot and the relative expression; B: The proteins expression of Bcl-2 and p53 by western blot and the relative expression. Mean±SD, n=3. *P < 0.05 vs control; #P < 0.05 vs Aβ25-35. |
目前AD的诊断和治疗仍然存在困难,没有准确的生物标志物可以诊断早期AD[13-14]。即使诊断明确,诊断后仍没有比较理想的治疗方法,并且目前治疗AD药物只能缓解中度至重度疾病,减慢疾病进程[15]。有研究显示,STA对脑损伤具有一定的保护作用,可能通过激活Wnt/β-catenin信号通对大鼠急性脑梗死具有一定的疗效[16];而且STA可以通过PI3K/AKT/NF-κB信号通路改善脑梗死后的神经损伤,减少脑梗死体积,降低大鼠的氧化应激反应[17]。本文通过研究STA靶基因RPS8和EED与23个差异表达基因之间的关系,发现STA通过作用于靶基因RPS8和EED,从而影响AD相关基因TP53和Bcl-2的表达。RPS8是一种蛋白质编码基因,它与CDK11p46的结合以帽和内部核糖体进入位点依赖性方式抑制转录过程,并使细胞对Fas配体诱导的细胞凋亡更加敏感[11],RPS8的作用靶向基因是TP53基因[18]。EED也是一个编码基因,主要与细胞衰老和细胞凋亡有关。因此,STA可能通过作用于靶基因RPS8和EED从而影响细胞凋亡,而生物信息学分析也同样显示其与凋亡相关基因TP53和Bcl-2之间存在密切联系。TP53种众所周知的抑癌基因,TP53基因诱导表达p53蛋白,它通过调节DNA修复,促进细胞增殖和调亡,通过与细胞因子,病毒和小RNA的反应,加剧了神经退行性疾病的发展[19]。Bcl-2同样是细胞凋亡的相关基因[20]。在AD中,TP53和Bcl-2的异常表达,从而导致神经细胞凋亡[21-22]。本研究通过生物信息学分析认为,STA可能通过调控RPS8和EED基因表达从而促进AD凋亡相关蛋Bcl-2和p53表达,抑制细胞凋亡。
神经损伤及凋亡是AD的主要病理机制,Aβ是引发AD的主要因素,也是AD治疗的重要靶标。一方面Aβ能够影响细胞骨架的完整性。另一方面,Aβ的细胞毒性作用可能干扰线粒体的功能障碍,β-淀粉样蛋白积聚而成的毒性肽链和过氧化氢酶相互作用,导致神经细胞损伤。另外Aβ在体内沉积后,星形胶质细胞以及小胶质细胞被激活形成神经细胞的炎症反应、突触和神经元损伤,神经元离子平衡改变,造成神经细胞凋亡等[23-24]。研究者通过检测Aβ25-35致痴呆大鼠海马组织中的蛋白表达发现,Aβ25-35对大鼠海马区内的注射增加了Caspase-12蛋白及其mRNA的表达[25-27]。而激活的Caspase-12可进一步剪切Caspase-3从而引发细胞凋亡[28-31]。本研究体外实验显示,25 μmol/LAβ25-35诱导PC12细胞凋亡,成功构建了AD细胞模型。STA有效改善了Aβ25-35诱导的细胞凋亡和细胞周期停滞。其次,在用Aβ25-35处理后,RPS8和EED的表达降低,Bcl-2和p53的表达降低,并且凋亡增加。而STA改善了Aβ25-35的促进PC12凋亡作用。
综上所述,本研究发现STA通过抑制Aβ25-35诱导的凋亡而减轻AD,其机制可能是通过调节RPS8和EED从而促进Bcl-2和p53表达,抑制AD细胞凋亡。
| [1] |
Querfurth HW, LaFerla FM. Mechanism of disease: Alzheimer's disease[J]. N Engl J Med, 2010, 362(4): 329-44. DOI:10.1056/NEJMra0909142 |
| [2] |
Alzheimer's Association. 2016 Alzheimer's disease facts and figures[J]. Alzheimers Dement, 2016, 12(4): 459-509. DOI:10.1016/j.jalz.2016.03.001 |
| [3] |
Blasko I, Wagner M, Whitaker N, et al. The amyloid beta peptide abeta (25-35) induces apoptosis independent of p53[J]. FEBS Lett, 2000, 470(2): 221-5. DOI:10.1016/S0014-5793(00)01323-5 |
| [4] |
Naldi M, Fiori J, Pistolozzi M, et al. Amyloid β-peptide 25-35 selfassembly and its inhibition: a model undecapeptide system to gain atomistic and secondary structure details of the Alzheimer's disease process and treatment[J]. ACS Chem Neurosci, 2012, 3(11): 952-62. DOI:10.1021/cn3000982 |
| [5] |
Wang J, Gu BJ, Masters CL, et al. A systemic view of Alzheimer disease-insights from amyloid-β metabolism beyond the brain[J]. Nat Rev Neurol, 2017, 13(11): 703-15. |
| [6] |
Zhang C, Lu Y, Tong QQ, et al. Effect of stachydrine on endoplasmic Reticulum stress-induced apoptosis in rat kidney after unilateral ureteral obstruction[J]. JAsian Nat Prod Res, 2013, 15(4): 373-81. DOI:10.1080/10286020.2013.769964 |
| [7] |
Rathee P, Rathee D, Rathee D, et al. In vitro anticancer activity of stachydrine isolated from Capparis decidua on prostate cancer cell lines[J]. Nat Prod Res, 2012, 26(18): 1737-40. DOI:10.1080/14786419.2011.608673 |
| [8] |
Cao TT, Chen HH, Dong ZW, et al. Stachydrine protects against pressure overload-induced cardiac hypertrophy by suppressing autophagy[J]. Cell Physiol Biochem, 2017, 42(1): 103-14. |
| [9] |
刘保松, 白明, 彭孟凡, 等. 水苏碱对局灶性脑缺血再灌注小鼠的保护作用及其机制[J]. 中国临床药理学杂志, 2018, 34(19): 2295-8. |
| [10] |
Liu S, Li XH, Gao JM, et al. Icariside Ⅱ, a phosphodiesterase-5 inhibitor, attenuates beta-amyloid-induced cognitive deficits via BDNF/TRKB/CREB signaling[J]. Cell Physiol Biochem, 2018, 49(3): 985-93. |
| [11] |
Berthier A, Jiménez-Sáinz J, Pulido R. PINK1 regulates histone H3 trimethylation and gene expression by interaction with the polycomb protein EED/WAIT1[J]. Proc Natl Acad Sci USA, 2013, 110(36): 14729-34. DOI:10.1073/pnas.1216844110 |
| [12] |
Hao YQ, Kong XF, Ruan YY, et al. CDK11p46 and RPS8 associate with each other and suppress translation in a synergistic manner[J]. Biochem Biophys Res Commun, 2011, 407(1): 169-74. DOI:10.1016/j.bbrc.2011.02.132 |
| [13] |
Frozza RL, Lourenco MV, de Felice FG. Challenges for Alzheimer's disease therapy: insights from novel mechanisms beyond memory defects[J]. Front Neurosci, 2018, 12(5): 37-46. |
| [14] |
Cruz-Rivera YE, Perez-Morales J, Santiago YM, et al. A selection of important genes and their correlated behavior in Alzheimer's disease[J]. JAlzheimers Dis, 2018, 65(1): 193-205. DOI:10.3233/JAD-170799 |
| [15] |
Smith LM, Zhu R, Strittmatter SM. Disease-modifying benefit of Fyn blockade persists after washout in mouse Alzheimer's model[J]. Neuropharmacology, 2018, 130: 54-61. DOI:10.1016/j.neuropharm.2017.11.042 |
| [16] |
梁华峰, 王娟, 谢靖, 等. 盐酸水苏碱对实验性急性脑梗死大鼠的治疗作用[J]. 中国病理生理杂志, 2017, 33(10): 1768-72. DOI:10.3969/j.issn.1000-4718.2017.10.006 |
| [17] |
Yu NZ, Hu S, Hao Z. Benificial effect of stachydrine on the traumatic brain injury induced neurodegeneration by attenuating the expressions of Akt/mTOR/PI3K and TLR4/NFκ-B pathway[J]. Transl Neurosci, 2018, 9(1): 175-82. |
| [18] |
Chang JR, Ghafouri M, Mukerjee R, et al. Role of p53 in neurodegenerative diseases[J]. Neurodegener Dis, 2012, 9(2): 68-80. DOI:10.1159/000329999 |
| [19] |
Danilova N, Sakamoto KM, Lin S. Ribosomal protein S19 deficiency in zebrafish leads to developmental abnormalities and defective erythropoiesis through activation of p53 protein family[J]. Blood, 2008, 112(13): 5228-37. DOI:10.1182/blood-2008-01-132290 |
| [20] |
Adams JM, Cory S. The BCL-2 arbiters of apoptosis and their growing role as cancer targets[J]. Cell Death Differ, 2018, 25(1): 27-36. DOI:10.1038/cdd.2017.161 |
| [21] |
Hooper C, Meimaridou E, Tavassoli M, et al. P53 is upregulated in Alzheimer's disease and induces tau phosphorylation in HEK293a cells[J]. Neurosci Lett, 2007, 418(1): 34-7. DOI:10.1016/j.neulet.2007.03.026 |
| [22] |
Carvalho C, Santos MS, Oliveira CR, et al. Alzheimer's disease and type 2 diabetes-related alterations in brain mitochondria, autophagy and synaptic markers[J]. Biochim Biophys Acta, 2015, 1852(8): 1665-75. DOI:10.1016/j.bbadis.2015.05.001 |
| [23] |
Fernandez-Echevarria C, Díaz M, Ferrer I, et al. Aβ promotes VDAC1 channel dephosphorylation in neuronal lipid rafts. Relevance to the mechanisms of neurotoxicity in Alzheimer's disease[J]. Neuroscience, 2014, 278: 354-66. DOI:10.1016/j.neuroscience.2014.07.079 |
| [24] |
李芳, 李光荣, 满玉清. Aβ25-35双侧海马内注射痴呆模型大鼠空间学习记忆的改变[J]. 药物生物技术, 2005, 12(3): 190-2. DOI:10.3969/j.issn.1005-8915.2005.03.013 |
| [25] |
Galoyan AA, Sarkissian JS, Chavushyan VA, et al. Neuroprotection by hypothalamic peptide proline- rich peptide-1 in Aβ25-35 model of Alzheimer's disease[J]. Alzheimer's Dement, 2008, 4(5): 332-44. DOI:10.1016/j.jalz.2007.10.019 |
| [26] |
谢婧雯, 赵艳, 奉夏露, 等. 丁苯酞对Aβ25-35诱导的阿尔茨海默病细胞模型的保护作用[J]. 南方医科大学学报, 2017, 37(9): 1228-33. DOI:10.3969/j.issn.1673-4254.2017.09.15 |
| [27] |
吴竞婧, 徐平. 反式白藜芦醇对β-淀粉样肽致痴呆大鼠的保护作用[J]. 中国临床药理学杂志, 2015, 33(1): 38-40. |
| [28] |
Bond JP, Deverin SP, Inouye H, et al. Assemblies of Alzheimer's peptides Aβ25-35 and Aβ31-35: reverse-turn conformation and side-chain interactions revealed by X-ray diffraction[J]. J Struct Biol, 2003, 141(2): 156-70. DOI:10.1016/S1047-8477(02)00625-1 |
| [29] |
Hashimoto Y, Niikura T, Ito Y, et al. Detailed characterization of neuroprotection by a rescue factor humanin against various Alzheimer's disease-relevant insults[J]. J Neurosci, 2001, 21(23): 9235-45. DOI:10.1523/JNEUROSCI.21-23-09235.2001 |
| [30] |
Reix S, Mechawar N, Susin SA, et al. Expression of cortical and hippocampal apoptosis-inducing factor (AIF) in aging and Alzheimer's disease[J]. NeurobiolAging, 2007, 28(3): 351-6. |
| [31] |
Wang YR, Li Y, Yang W, et al. Ginsenoside Rb1 inhibit apoptosis in rat model of Alzheimer's disease induced by Aβ1-40[J]. Am J Transl Res, 2018, 10(3): 796-805. |
 2020, Vol. 40
2020, Vol. 40

