2. 西北大学附属医院神经外科,陕西 西安 710018;
3. 重庆 市中医院神经外科,重庆 400021
2. Department of Neurosurgery, Affiliated Hospital of Northwest University, Xi'an, 710018, China;
3. Department of Neurosurgery, Chongqing Traditional Chinese Medicine Hospital, Chongqing 400021, China
颅脑创伤是神经外科最常见的急危重症,发病率高,其继发性的创伤性脑水肿可导致不同程度的颅内压增高,甚至引发脑疝,是颅脑创伤致残和致死的重要原因[1-2]。血脑屏障的破坏则是导致创伤性脑水肿发生的最主要原因之一[3],其分子机制的研究和防治一直都是临床和科研的难题。细胞外调节蛋白激酶(ERK)是丝裂原活化蛋白激酶(MAPKs)超家族的一员,在颅脑创伤后病情发展的信号传导过程中发挥着重要作用[4-7]。基质金属蛋白酶-9(MMP-9)是脑内最重要的基质金属蛋白酶,在脑肿瘤、脑卒中等病理情况下的过表达,可降解细胞外基质成分,破坏血脑屏障,引发并加重脑水肿[8-11]。但ERK信号通路是否通过影响MMP-9的表达变化参与调节创性脑水肿的发生与发展,目前国内外均未见到相关的报道。所以,本研究通过相关实验旨在探讨ERK信号通路对大鼠创伤性脑损伤后MMP-9的表达及脑水肿形成的影响与意义。
1 材料和方法 1.1 实验动物及材料采用重庆医科大学实验动物中心提供的90只健康成年雄性SD大鼠,体质量200~250 g,符合国家二级实验动物标准。所有动物的处理符合重庆医科大学第一附属医院伦理委员会批准的有关用于研究目的相关规定。p-ERK1/2多克隆抗体及ERK1/2多克隆抗体(Cell Signaling),MMP-9多克隆抗体(Santa Cruz)。
1.2 实验分组实验分为对照组(Sham组)、脑创伤组(TBI组)和ERK抑制组(SCH组),每组30只大鼠。对照组:只在颅骨上做一直径约为4 mm的骨窗,不作脑创伤。脑创伤组:制作改进式Feeney's创伤性脑损伤模型,脑创伤前15 min股静脉注射等量DMSO。ERK抑制组:创伤性脑损伤前15 min股静脉注射ERK抑制剂(SCH772984,500 μg/kg)。在本研究的预实验中已完成空白对照组(大鼠无任何损伤)及单纯ERK抑制剂组(大鼠无任何损伤情况下给予SCH772984处理)的实验及数据分析,结果显示其与对照组和ERK抑制剂组之间没有明显统计学差异,故实验结果中未提供相关数据。
1.3 大鼠脑创伤模型的制作采用改进Feeney's自由落体硬膜外撞击法制作大鼠的脑创伤模型[12]。在大鼠创伤后2 h、2 d时麻醉,断头取脑,并行后续实验检测。若因各种不可控因素使造模失败或实验动物死亡,导致大鼠数目不足,则通过随机抽样原则重新造模补齐动物数目。
1.4 RT-PCR检测MMP-9 mRNA的表达情况按Trizol试剂盒说明书提取各组大鼠脑组织总RNA[13],采用MMLV逆转录试剂盒按操作说明书将其逆转录为cDNA产物进行PCR扩增。MMP-9的引物:上游为:5'ACCGCTAGGTTACACTCG3',下游为:5'GTTATGATGGTGCCACTTGA3',产物的长度212bp;β-actin上游为:5'GCAAGTTCAACGGCACA G3',下游为:5'CAGTCTTCTGAGTGGCAGTGAT3',产物长度402 bp。反应体系为25 μL。PCR扩增的条件为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸1 min,一共循环30次,最后72 ℃再次延伸10 min。PCR的产物以1.5%琼脂糖凝胶电泳检测,长波紫外灯观测照相,电泳的结果以Quantity One(美国Bio-Rad)图像分析系统进行电泳条带吸光度(A)的分析。MMP-9/β-actin的积分A值作为MMP-9 mRNA的表达水平(引物合成由上海生工公司提供)。
1.5 Western blotting检测p-ERK、ERK和MMP-9蛋白的表达情况以Western blotting测定p-ERK、ERK和MMP-9蛋白的表达[14],在各组大鼠脑组织中加入蛋白裂解液和PMSF,冰上裂解20 min,测定蛋白浓度,加入上样缓冲液,裂解液沸水变性5 min。每孔加入40 μg的蛋白样品电泳,用PDVF膜转膜,血清封闭后加入一抗(p-ERK1/2 1:1000,ERK1/2 1:1000,MMP-9 1:300,β-actin 1: 200),4 ℃孵育一抗过夜后,加入HRP标记的二抗,在37 ℃孵育1 h,用ECL显影,β-actin作为内对照参数。Quantity One软件分析荧光条带的平均光密度值,以pERK/ERK光密度值的积分A值为p-ERK的表达水平,MMP-9/β-actin光密度值的积分A值为MMP-9的表达水平。
1.6 伊文氏蓝(EB)荧光法检测大鼠血脑屏障通透性在各观察时间点麻醉并处死大鼠后,用EB荧光法测定创伤区周边脑组织血脑屏障(BBB)通透性[15]。EB含量的测定:大鼠处死前经股静脉注射2.5%的EB盐水液(5 mL/kg)。在断头取脑后,加入10%三氯醋酸沉淀脑组织的蛋白,用无水乙醇匀浆,提取伊文斯蓝,取上清液,放置于37 ℃水浴48 h后在波长620 nm处测定其光密度值。根据光密度数值,从标准曲线上计算出该脑组织中EB含量,以EB含量(g/g湿脑组织)代表血脑屏障的通透性。
1.7 干湿比重法测定脑组织含水量按干湿比重法各组大鼠脑组织含水量[16],将创伤脑组织放在有生理盐水浸湿滤纸的培养皿中,防止水分蒸发。用万分之一克电子天平称取湿质量,然后将脑组织放置于85 ℃恒温干燥箱中,持续烘干24 h至质量恒定后,称得干质量。计算脑含水量:脑组织含水量(BWC)=(湿质量-干质量)/湿质量×100%。
1.8 统计学处理计量资料均采用均数±标准差表示,采用SPSS 17.0进行统计分析,组间比较均采用单因素方差分析,两两比较均采用Turkey法,P < 0.05表示差异有统计学意义。
2 结果 2.1 Western blotting检测大鼠脑创伤后ERK磷酸化情况各组大鼠脑创伤后脑组织中总ERK蛋白表达均没有明显变化。对照组大鼠脑创伤后脑组织中有少量的p-ERK蛋白表达;与对照组相比,脑创伤组脑组织中的p-ERK水平在伤后2 h和2 d均显著上升(P < 0.01,图 1、表 1);ERK抑制组伤后脑组织中p-ERK与脑创伤组相比均明显降低(P < 0.01,图 1、表 1)。
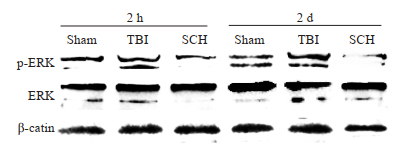
|
图 1 Western blot检测各组大鼠在脑创伤后时p-ERK的表达变化 Fig.1 p-ERK expression 2 h after TBI in each group detected by Western blotting. |
| 表 1 各组大鼠在脑创伤后p-ERK的表达水平 Tab.1 Level of p-ERK expression in each group after TBI (n=5, Mean±SD) |
对照组大鼠的脑组织有少量MMP-9 mRNA表达;脑创伤组大鼠脑组织中MMP-9 mRNA表达在创伤后2 h时较对照组无明显差异(P > 0.05),在伤后2d时表达出现了显著增高(P < 0.01)。与脑创伤组相比,ERK抑制组大鼠脑组织中MMP-9 mRNA在伤后2 h表达变化无明显差异(P > 0.05),至2 d时表达水平出现明显降低(P < 0.01,图 2A、表 2)。
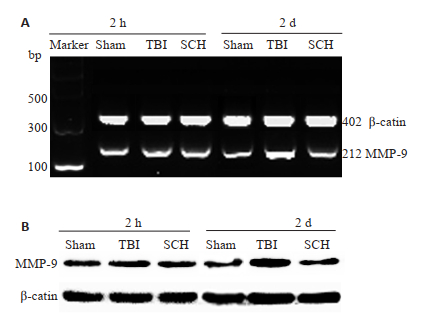
|
图 2 RT-PCR法(A)及Western blotting法(B)分别检测各组大鼠在脑创伤后2 h和2 d时MMP-9 mRNA和蛋白的表达变化 Fig.2 MMP-9 mRNA and protein expression in each group at 2 h and 2 days after TBI detected by RT-PCR (A) and Western blotting (B). |
| 表 2 各组大鼠在脑创伤后2 h和2 d时MMP-9 mRNA和蛋白的表达水平 Tab.2 Level of MMP-9 mRNA and protein expression in each group 2 h and 2 days after TBI (n=5, Mean±SD) |
在伤后各时间点,对照组大鼠脑组织中均有少量MMP-9蛋白表达;MMP-9蛋白表达水平在大鼠脑创伤后2 h时较对照组无明显差异(P > 0.05),在2 d时表达出现显著增高(P < 0.01)。ERK抑制组MMP-9蛋白表达在伤后2 h与脑创伤组相比无明显差异(P > 0.05),至2 d时表达水平出现明显降低(P < 0.01,图 2B、表 2)。
2.4 EB法测定血脑屏障变化对照组大鼠脑组织中EB含量很少;与对照组相比,脑创伤组EB含量在脑创伤后2 h时增高(P < 0.05),2 d时进一步增高(P < 0.01);ERK抑制组大鼠脑组织EB含量与脑创伤组相比在创伤后2 h和2 d均有明显降低(P < 0.05,表 3)。
| 表 3 各组大鼠在脑创伤后2 h和2 d时血脑屏障通透性和脑含水量水平 Tab.3 Level of EB permeability and brain edema in each group 2 h and 2 days after TBI (n=5, Mean±SD) |
对照组大鼠脑组织有一定量的水分;与对照组比较,脑创伤组大鼠脑含水量在伤后2 h时无明显差异(P > 0.05),至2 d时出现明显增高(P < 0.01);ERK抑制组大鼠脑含水量在伤后2 h与脑创伤组相比无显著差异(P > 0.05),至2 d时脑含水量出现明显降低(P < 0.01,表 3)。
3 讨论创伤性脑水肿是颅脑损伤后的重要继发性脑损害,是治疗创伤性脑损伤的关键环节,直接关系到脑伤患者预后的好坏[2, 17]。现有研究表明,脑创伤后可致血脑屏障破坏和通透性的增加,引发血管源性脑水肿,进一步引发并加重创伤后脑水肿的严重程度[18-19],但其发生发展的分子机制与临床的防治目前仍是一个难题。在本实验中,大鼠脑创伤后脑组织中ERK磷酸化水平明显增加,随后MMP-9表达也出现明显高表达,大鼠血脑屏障通透性增加,脑组织含水量升高,大鼠出现严重的创伤性脑水肿。这提示ERK通路在脑伤后的活化及MMP-9的表达上调在创伤后脑水肿的发生、发展过程中发挥了重要作用。
MMP-9属于基质金属蛋白酶家族,主要功能是维持降解和重塑细胞外基质的动态平衡[8, 20]。MMP-9在脑组织中主要由星形胶质细胞、血管内皮细胞、海马神经元和小胶质细胞等细胞表达,它的正常表达和活化对脑血管内皮细胞基底膜完整性的维持十分重要,可使血脑屏障保持有适宜通透性[21]。但有研究表明,MMP-9的过度表达却与颅脑创伤、脑卒中、脑肿瘤等众多神经系统疾病的发生与发展关系密切[9, 11, 21-22]。研究者[9, 23]分别在大鼠的脑卒中和自发性蛛网膜下腔出血模型中发现了MMP-9的高表达和激活可过度降解脑血管内皮细胞基底膜的Ⅳ型胶原、层粘连蛋白、纤黏蛋白等的主要成份,破坏血管结构的完整性,显著增加血脑屏障通透性,导致血管源性脑水肿甚至脑出血的发生,加重脑损伤。因此,MMP-9在脑损伤后过度表达可使血脑屏障受到破坏,导致或加重脑水肿的发生。
MAPKs超家族广泛分布于细胞的胞浆内,是引起细胞各种生物学反应的重要信号传导系统,它主要包括3种亚家族:分别是ERK、p38和JNK。ERK信号传导通路可在颅脑创伤、缺血再灌注损伤、渗透压变化和生理应激等情况下激活,在多种神经系统疾病脑损伤的过程中都发挥重要作用[24-29]。MMP-9作为ERK信号通路的下游效应蛋白,Nishikawa和Li等人在小鼠蛛网膜下腔出血及脑出血模型中研究发现,ERK通路在出血后早期出现明显活化,MMP-9表达上调,脑水肿加重;降低ERK通路活化程度,可下调MMP-9的表达水平,可防止血脑屏障的破坏,降低脑水肿[10, 30]。结合以上研究结论及本实验的结果,脑损伤后MMP-9的过度表达,血脑屏障的破坏,脑水肿的加重是通过ERK信号通路的过度激活介导的。
为了证实创伤后ERK通路活化是否可通过调控MMP-9表达在脑水肿的发生中发挥的重要作用,本研究在大鼠脑创伤之前静脉注入ERK通路特异性抑制剂SCH772984,阻断大鼠伤后脑组织中ERK的活化。此后,MMP-9 mRNA和蛋白在脑创伤后的表达明显下调,血脑屏障破坏程度缓解,脑含水量减少,创伤性脑水肿减轻。这些实验反向证实了ERK在脑创伤后的过度激活促进了下游MMP-9的高表达,损伤大鼠血脑屏障,导致了大鼠创伤性脑水肿的发生。
在本研究中,我们初步证实了ERK信号通路介导的MMP-9过表达在脑创伤后导致了血脑屏障的破坏和脑水肿的发生,为理解创伤性脑水肿发生机制的理解及其临床药物的研发提供了新的思路。
| [1] |
Hackenberg K, Unterberg A. Traumatic brain injury[J]. Nervenarzt, 2016, 87(2): 203-14; quiz 15-6. DOI:10.1007/s00115-015-0051-3 |
| [2] |
Jha RM, Kochanek PM, Marc Simard J. Pathophysiology and treatment of cerebral edema in traumatic brain injury[J]. Neuropharmacology, 2019, 145: 230-46. DOI:10.1016/j.neuropharm.2018.08.004 |
| [3] |
Sulhan S, Lyon KA, Shapiro LA, et al. Neuroinflammation and bloodbrain barrier disruption following traumatic brain injury: Pathophysiology and potential therapeutic targets[J]. J Neurosci Res, 2020, 98(1): 19-28. |
| [4] |
Mori T, Wang XY, Jung JC, et al. Mitogen-activated protein kinase inhibition in traumatic brain injury: in vitro and in vivo effects[J]. J Cereb Blood Flow Metab, 2002, 22(4): 444-52. DOI:10.1097/00004647-200204000-00008 |
| [5] |
Fujimoto M, Shiba M, Kawakita F, et al. Deficiency of tenascin-C and attenuation of blood-brain barrier disruption following experimental subarachnoid hemorrhage in mice[J]. J Neurosurg, 2016, 124(6): 1693-702. DOI:10.3171/2015.4.JNS15484 |
| [6] |
Machida T, Dohgu S, Takata F, et al. Role of thrombin-PAR1-PKCΘ/δ Axis in brain pericytes in thrombin-induced MMP-9 production and blood-brain barrier dysfunction in vitro[J]. Neuroscience, 2017, 350: 146-57. DOI:10.1016/j.neuroscience.2017.03.026 |
| [7] |
Johann S, Beyer C. Neuroprotection by gonadal steroid hormones in acute brain damage requires cooperation with astroglia and microglia[J]. J Steroid Biochem Mol Biol, 2013, 137: 71-81. DOI:10.1016/j.jsbmb.2012.11.006 |
| [8] |
Dang BQ, Duan XC, Wang Z, et al. A therapeutic target of cerebral hemorrhagic stroke: matrix metalloproteinase-9[J]. Curr Drug Targets, 2017, 18(12): 1358-66. |
| [9] |
Hayman EG, Wessell A, Gerzanich V, et al. Mechanisms of global cerebral edema formation in aneurysmal subarachnoid hemorrhage[J]. Neurocrit Care, 2017, 26(2): 301-10. DOI:10.1007/s12028-016-0354-7 |
| [10] |
Nishikawa H, Liu L, Nakano F, et al. Modified Citrus pectin prevents blood-brain barrier disruption in mouse subarachnoid hemorrhage by inhibiting galectin-3[J]. Stroke, 2018, 49(11): 2743-51. DOI:10.1161/STROKEAHA.118.021757 |
| [11] |
Pijet B, Stefaniuk M, Kostrzewska-Ksiezyk A, et al. Elevation of MMP-9 levels promotes epileptogenesis after traumatic brain injury[J]. Mol Neurobiol, 2018, 55(12): 9294-306. DOI:10.1007/s12035-018-1061-5 |
| [12] |
Feeney DM, Boyeson MG, Linn RT, et al. Responses to cortical injury: I. Methodology and local effects of contusions in the rat[J]. Brain Res, 1981, 211(1): 67-77. |
| [13] |
Al-Zharani M, Nasr FA, Abutaha N, et al. Apoptotic induction and anti-migratory effects of Rhazya stricta fruit extracts on a human breast cancer cell line[J]. Molecules, 2019, 24(21): E3968. DOI:10.3390/molecules24213968 |
| [14] |
Li XC, Tao YL, Li XZ. Expression of MMP-9/TIMP-2 in nasal polyps and its functional implications[J]. Int J Clin Exp Pathol, 2015, 8(11): 14556-61. |
| [15] |
Guo PP, Jin Z, Wu HS, et al. Effects of irisin on the dysfunction of blood-brain barrier in rats after focal cerebral ischemia/reperfusion[J]. Brain Behav, 2019, 9(10): e01425. DOI:10.1002/brb3.1425 |
| [16] |
Qiao M, Malisza KL, Del Bigio MR, et al. Correlation of cerebral hypoxic-ischemic T2 changes with tissue alterations in water content and protein extravasation[J]. Stroke, 2001, 32(4): 958-63. DOI:10.1161/01.STR.32.4.958 |
| [17] |
Winkler EA, Minter D, Yue JK, et al. Cerebral edema in traumatic brain injury: pathophysiology and prospective therapeutic targets[J]. Neurosurg Clin NAm, 2016, 27(4): 473-88. DOI:10.1016/j.nec.2016.05.008 |
| [18] |
Unterberg A, Stover JF, Kress B, et al. Edema and brain trauma[J]. Neuroscience, 2004, 129(4): 1019-27. DOI:10.1016/j.neuroscience.2004.06.046 |
| [19] |
Alluri H, Shaji CA, Davis ML, et al. A mouse controlled cortical impact model of traumatic brain injury for studying blood-brain barrier dysfunctions[J]. Methods Mol Biol, 2018, 1717: 37-52. |
| [20] |
Chang JJ, Emanuel BA, Mack WJ, et al. Matrix metalloproteinase-9: dual role and temporal profile in intracerebral hemorrhage[J]. J Stroke Cerebrovasc Dis, 2014, 23(10): 2498-505. DOI:10.1016/j.jstrokecerebrovasdis.2014.07.005 |
| [21] |
He T, Wang J, Wang XL, et al. Association between the matrix metalloproteinase-9 rs3918242 polymorphism and ischemic stroke susceptibility: a meta-analysis[J]. J Stroke Cerebrovasc Dis, 2017, 26(5): 1136-43. DOI:10.1016/j.jstrokecerebrovasdis.2016.12.036 |
| [22] |
Beroun A, Mitra S, Michaluk P, et al. MMPS in learning and memory and neuropsychiatric disorders[J]. Cell Mol Life Sci, 2019, 76(16): 3207-28. DOI:10.1007/s00018-019-03180-8 |
| [23] |
King ZA, Sheth KN, Kimberly WT, et al. Profile of intravenous glyburide for the prevention of cerebral edema following large hemispheric infarction: evidence to date[J]. Drug Des Devel Ther, 2018, 12: 2539-52. DOI:10.2147/DDDT.S150043 |
| [24] |
Lu HH, Ma K, Jin LW, et al. 17β-estradiol rescues damages following traumatic brain injury from molecule to behavior in mice[J]. J Cell Physiol, 2018, 233(2): 1712-22. DOI:10.1002/jcp.26083 |
| [25] |
Guo X, Yuan J, Wang J, et al. Calcitriol alleviates global cerebral ischemia-induced cognitive impairment by reducing apoptosis regulated by VDR/ERK signaling pathway in rat Hippocampus[J]. Brain Res, 2019, 1724: 146430. DOI:10.1016/j.brainres.2019.146430 |
| [26] |
Zuo G, Zhang DP, Mu RT, et al. Resolvin D2 protects against cerebral ischemia/reperfusion injury in rats[J]. Mol Brain, 2018, 11(1): 9. DOI:10.1186/s13041-018-0351-1 |
| [27] |
Cao CC, Dai L, Mu JY, et al. S1PR2 antagonist alleviates oxidative stress-enhanced brain endothelial permeability by attenuating p38 and Erk1/2-dependent cPLA2 phosphorylation[J]. Cell Signal, 2019, 53: 151-61. DOI:10.1016/j.cellsig.2018.09.019 |
| [28] |
吴光勇, 李亮, 廖达光, 等. Apelin-13对大鼠局灶性脑缺血-再灌注损伤的保护作用[J]. 南方医科大学学报, 2015, 35(9): 1335-9. DOI:10.3969/j.issn.1673-4254.2015.09.024 |
| [29] |
Deng XH, Zhong Y, Gu LZ, et al. MiR-21 involve in ERK-mediated upregulation of MMP9 in the rat Hippocampus following cerebral ischemia[J]. Brain Res Bull, 2013, 94: 56-62. DOI:10.1016/j.brainresbull.2013.02.007 |
| [30] |
Li L, Yun DB, Zhang Y, et al. A cannabinoid receptor 2 agonist reduces blood-brain barrier damage via induction of MKP-1 after intracerebral hemorrhage in rats[J]. Brain Res, 2018, 1697: 113-23. DOI:10.1016/j.brainres.2018.06.006 |
 2020, Vol. 40
2020, Vol. 40

