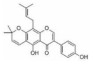
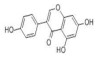
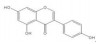
2. 时代生物(深圳)科技有限公司,广东 深圳 518000
2. ERA (Shenzhen) Biotechonology, Shenzhen 518000, China
三阴性乳腺癌是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER-2)均为阴性的一类乳腺癌,具有肿瘤体积大、分化低、转移率和复发率高等特点,发病率占乳腺癌总数的15%~25%[1-3],并且呈现出较高的致死率[4-5]。乳腺癌的治疗方式主要包括乳房切除、化疗、放疗以及联合疗法等[6]。与其他乳腺癌相比,三阴性乳腺癌易发生远处转移且无靶向治疗药物,主要依赖化疗方法[7-9],但总体预后较差,5年存活率低于30%[3],且存在较高的复发风险[10]。目前,临床上应用的化疗药物如环磷酰胺、5-氟尿嘧啶常常存在中性粒细胞减少[11]、衰老[12]、脱发[13]等副作用。因此,亟待开发一种用于乳腺癌尤其是三阴性乳腺癌治疗的低毒高效的药物。
鉴于肿瘤组织具有高通透性和滞留效应(EPR),以及温度稍高于正常组织等特性,温敏脂质体较易蓄积于肿瘤组织。因此,许多研究采用温敏脂质体靶向递送药物至肿瘤组织,进而释放药物发挥抗肿瘤作用[14]。文献报道,温敏脂质体包裹金纳米棒和多柔比星可以靶向递送多柔比星至肿瘤组织,进而释放多柔比星发挥抗癌作用[15]。目前,多柔比星脂质体已应用于乳腺癌临床治疗,但是对于三阴性乳腺癌效果较差,且可能导致骨髓抑制。
本研究以大豆异黄酮和金雀异黄酮为阳性对照,评价攀登鱼藤异黄酮作用于不同分型乳腺癌细胞增殖活性的影响,并进一步从细胞转移和侵袭水平探究攀登鱼藤异黄酮对三阴性乳腺癌细胞的抗乳腺癌活性;制备攀登鱼藤异黄酮温敏脂质体,鉴定其物理特性,并体外探究攀登鱼藤异黄酮温敏脂质体的抗乳腺癌活性,为临床开发攀登鱼藤异黄酮作为抗乳腺癌药物提供新思路。
1 材料和方法 1.1 主要试剂大豆异黄酮、金雀异黄酮和攀登鱼藤异黄酮(源叶生物)。DMEM、RPMI 1640和L15基础培养基,胎牛血清,双抗,胰酶和PBS(Gibco)。MTT、DMSO和结晶紫(Sigma-Aldrich)。PVDF膜(Millipore)。碳支持膜和磷钨酸(中镜)。MMP2和MMP9抗体(CST)。DPPC、DMPC、胆固醇和DSPE-PRG2000(瑞禧)。
1.2 主要实验方法 1.2.1 细胞培养不同分型的乳腺癌细胞MDA-MB-231(人源、三阴性)、MCF7(人源、ER+)、SKBR3(人源、HER 2+)和4T1(鼠源)均购于中科院上海生物细胞研究库。MDA-MB-231细胞、MCF7细胞、SKBR3细胞和4T1细胞分别用L15、DMEM、RPMI 1640和DMEM基础培养基含10%胎牛血清,1%双抗的完全培养基培养于37 ℃,含5% CO2湿润环境中。
1.2.2 MTT检测细胞活性将对数生长期的细胞消化稀释成2.5×104个/mL,接种于96孔板中。细胞贴壁后,吸弃原培养液并每孔加入199 μL完全培养基+ 1 μL DMSO溶解的药物。待药物作用24 h或者特定的时间后,加入20 μL 5 mg/mL的MTT溶液孵育4 h。然后吸弃上清液并加入150 μL的DMSO,于酶标仪上震荡10 min后波长490 nm检测吸光度A值。最后根据公式计算药物处理后的细胞活性(%)。计算公式如下:
| $ {\rm{Cell\;viability }}\left( \% \right) = \frac{{{A_{490\left( {{\rm{样品}}} \right)}} - {A_{490\left( {{\rm{空白}}} \right)}}}}{{{A_{490\left( {{\rm{对照}}} \right)}} - {A_{490\left( {{\rm{空白}}} \right)}}}} \times 100{\rm{\% }} $ |
将细胞消化后稀释到2×103个/mL,并以200/孔接种于6孔板中。待细胞贴壁后,以一定浓度的攀登鱼藤异黄酮溶液处理细胞10 d。利用PBS清洗细胞3次后,甲醇固定15 min,结晶紫染色液(0.05 mmol/L)染色20 min。PBS冲洗及空气干燥后,肉眼计数可见克隆数。
1.2.4 划痕实验在对培养皿标记后,将细胞消化接种于培养皿中,待细胞长至80%~90%后,利用200 μL枪头进行垂直划痕。经PBS小心清洗3遍后,加入一定浓度的攀登鱼藤异黄酮溶液处理细胞24 h及48 h,通过显微镜观察并利用image J软件计算选定位置的划痕面积。最后根据公式计算细胞迁移率。计算公式如下:
| $ Cell{\rm{ }}\;migration{\rm{ }}\;area{\rm{ }}\;of\;{\rm{ }}{A_0}(\% ) = \frac{{{A_0} - {A_n}}}{{{A_0}}} \times 100\% $ |
待细胞经不同浓度的攀登鱼藤异黄酮处理后,利用添加磷酸酶抑制剂和蛋白酶抑制剂的裂解液提取细胞蛋白,并制备蛋白样品。10% SDS-聚丙烯酰胺凝胶电泳,湿转法转膜,5%牛奶室温封闭2 h,MMP2/MMP9抗体1:1000和GAPDH抗体1:3000 4 ℃过夜孵育,TBST洗涤3次(10 min/次),二抗1:5000室温孵育2 h,TBST洗涤3次,ECL显影,曝光。利用Image J软件计算条带灰度值并进行统计分析。
1.2.6 脂质体制备将DPPC、DMPC、胆固醇和DSPE-PEG2000以57:3:30:3的比例溶于甲醇/氯仿溶液(体积比1:1)中,待超声溶解后,置于旋转蒸发以上50 ℃水浴下减压除去有机溶剂,形成一层均匀的磷脂膜。然后加入50 ℃预热的PBS于超声作用下水化薄膜15 min,待磷脂膜水化完全后,进一步将脂质体溶液于超声细胞破碎仪上超声(100 W,开/关:2 s/3 s)15 min,即得到温敏脂质体。同法,将攀登鱼藤异黄酮与磷脂材料以1:10的比例加入甲醇/氯仿溶液即可得到攀登鱼藤异黄酮温敏脂质体。
1.2.7 脂质体鉴定将制备好的温敏脂质体溶液滴在碳支持膜上,待其干燥后,滴加3%磷钨酸负染色液进行负染。负染结束后,即可在透射电子显微镜上进行观察,图中白色部分即为脂质体。利用动态光散射扫描仪检测新制备好以及4 ℃冰箱存放7 d后的攀登鱼藤异黄酮温敏脂质体的粒径、分布及表面电荷等特性。
1.2.8 脂质体包封率及稳定性检测利用紫外分光光度计对脂质体及攀登鱼藤异黄酮分别进行光谱扫描,得到攀登鱼藤异黄酮特征吸收峰。根据该特征吸收峰,进行攀登鱼藤异黄酮标准曲线的绘制。待离心去除未包裹的攀登鱼藤异黄酮后,用甲醇溶解脂质体并进行破膜,最后得到温敏脂质体载药前后吸光度A值,并通过标准曲线计算得到包封率。同法检测37 ℃放置24 h后温敏脂质体的包封率。
| $ {\rm{包封率}}\left( {\rm{\% }} \right){\rm{ = }}\frac{{{\rm{脂质体包裹的药量}}\left( {mg} \right)}}{{{\rm{投药量}}\left( {mg} \right)}} \times 100{\rm{\% }} $ |
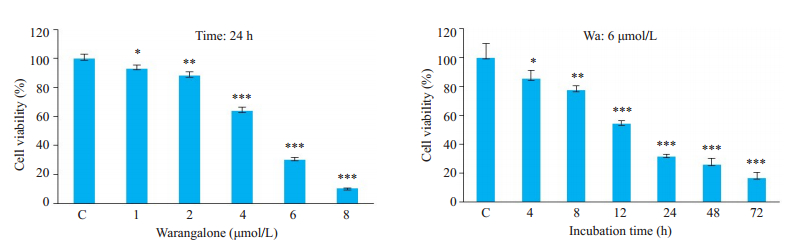
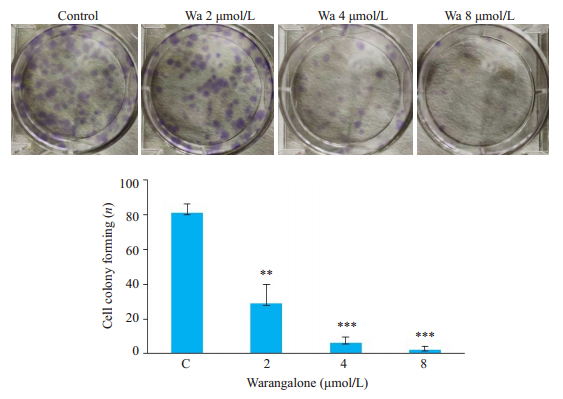
MTT法检测攀登鱼藤异黄酮对乳腺癌细胞(MDA-MB-231、MCF7、SKBR3)增殖的影响,确定其IC50值分别为4.713、7.766、3.024 μmol/L;大豆异黄酮和金雀异黄酮对乳腺癌细胞增殖的抑制作用明显弱于攀登鱼藤异黄酮,其IC50值均在10μmol/L以上(表 1)。图 1显示攀登鱼藤异黄酮对三阴性乳腺癌细胞MDA-MB- 231的增殖抑制作用呈浓度和时间依赖性(P < 0.001);图 2克隆形成实验结果显示攀登鱼藤异黄酮可有效抑制MDA-MB-231细胞克隆形成,且呈浓度依赖性(P < 0.001)。
|
图 1 攀登鱼藤异黄酮抑制乳腺癌细胞MDA-MB-231增殖 Fig.1 Warangalone (Wa) inhibits the proliferation of MDA-MB-231 cells. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group |
|
图 2 攀登鱼藤异黄酮度抑制乳腺癌细胞MDA-MB-231克隆形成 Fig.2 Warangalone (Wa) inhibits colony formation in MDA-MB-231 cells. **P < 0.01, ***P < 0.001 vs control group |
| 表 1 不同异黄酮对乳腺癌细胞细胞活性的影响 Tab.1 Viability of breast cancer cells treated with isoflavones |
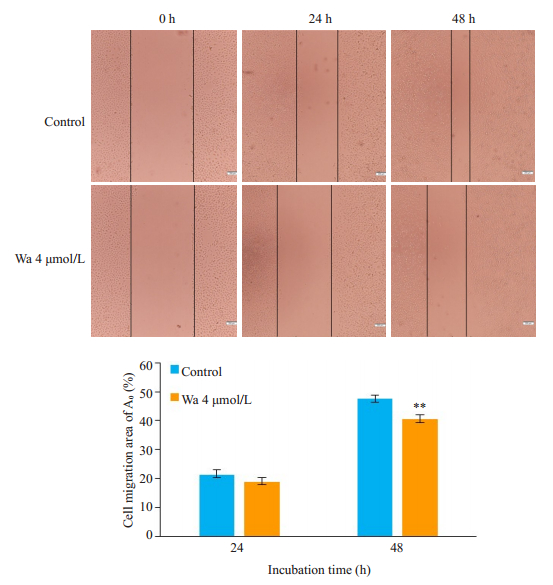
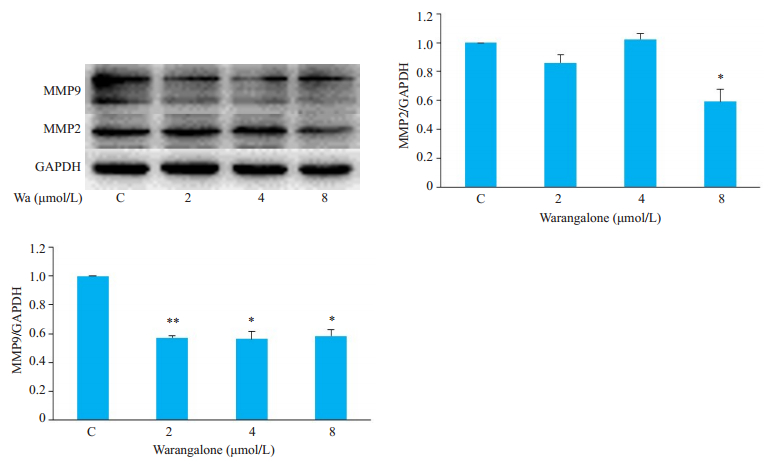
如图 3所示,4 μmol/L攀登鱼藤异黄酮处理48 h即可有效抑制乳腺癌细胞MDA-MB-231划痕的愈合(P < 0.01),表明攀登鱼藤异黄酮可抑制MDA-MB-231细胞的迁移。图 4结果显示,攀登鱼藤异黄酮显著下调乳腺癌细胞MDA-MB-231中MMP2(P < 0.05)和MMP9(P < 0.01)表达。
|
图 3 攀登鱼藤异黄酮抑制乳腺癌细胞MDA-MB-231划痕面积的愈合 Fig.3 Warangalone (Wa) inhibits migration of MDA-MB-231 cells. **P < 0.01 vs control group |
|
图 4 攀登鱼藤异黄酮下调乳腺癌细胞MDA-MB-231中MMP2和MMP9表达 Fig.4 Warangalone (Wa) down-regulates the expressions of MMP2 and MMP9 in MDA-MB-231 cells. *P < 0.05, **P < 0.01 vs control group |
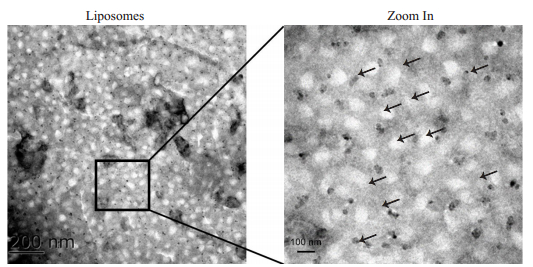
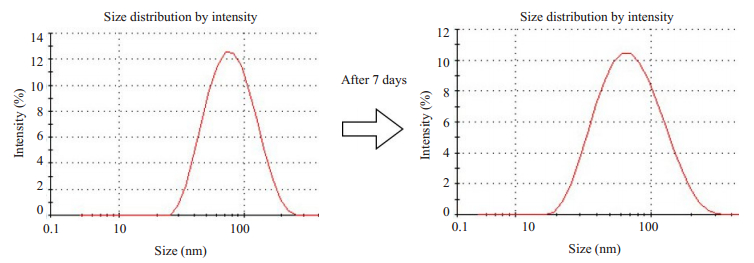
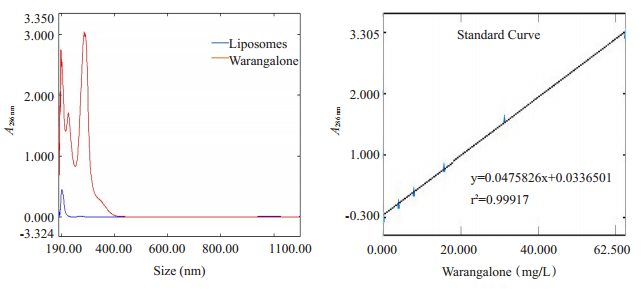
通过薄膜水化法制备得到的温敏脂质体呈不规则球型且较为均质,其粒径为100 nm左右(图 5)。攀登鱼藤异黄酮温敏脂质体粒径为56.23±0.61 nm(r),PDI值为0.241±0.014 < 0.300,Zeta电位为-40.40±0.46 mV < - 40 mV,表明粒径及均质性都与透射电子显微镜结果一致,且所制备的脂质体带负电、较为稳定(图 6、表 2)。然而,在4℃存放7 d后,攀登鱼藤异黄酮温敏脂质体其粒径变大、粒径峰变宽、电位降低(图 6、表 2)。基于攀登鱼藤异黄酮特征吸收峰286.00 nm,所绘制标准曲线为:y = 0.0475826x + 0.0336501,其r2为0.99917(图 7)。进一步检测攀登鱼藤异黄酮温敏脂质体的包封率和稳定性,确定其包封率可达(87.68±2.41)%,且置于37 ℃ 24 h后,其包封率仍可达到(78.54±3.42)%,(图 7)。
|
图 5 透射电子显微镜观察脂质体形态 Fig.5 Morphology of liposomes under transmission electron microscope |
|
图 6 攀登鱼藤异黄酮异黄酮温敏脂质体于4 ℃ 7 d前后动态光散射扫描仪检测粒径 Fig.6 Changes in particle size of warangalone-loaded liposomes after intubation at 4 ℃ for 7 days |
|
图 7 攀登鱼藤异黄酮紫外光谱图及标准曲线 Fig.7 Ultraviolet spectrogram and standard curve of warangalone |
| 表 2 攀登鱼藤异黄酮温敏脂质体4 ℃放置7 d前后表征 Tab.2 Characterization of warangalone-loaded liposomes after intubation at 4 ℃ for 7 days |
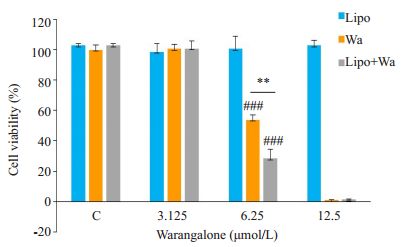
攀登鱼藤异黄酮和攀登鱼藤异黄酮温敏脂质体均显著抑制小鼠乳腺癌细胞4T1增殖,在6.25 μmol/L浓度时,攀登鱼藤异黄酮温敏脂质体抑制效果优于攀登鱼藤异黄酮(P < 0.01,图 8)。
|
图 8 攀登鱼藤异黄酮脂质体载药前后对小鼠乳腺癌细胞4T1细胞增值活性的影响 Fig.8 Cytotoxicity of liposomes (Lipo), warangalone (Wa) and warangalone-loaded liposomes (Lipo+Wa) in 4T1 cells. **P < 0.01, the Wa group vs the Lipo+Wa group; ###P < 0.001 vs Lipo group |
攀登鱼藤异黄酮是从拓树果实中提取分离得到的一种异黄酮类植物化合物,具有抗炎、降压和抗癌等多种生物学作用。Emmanuel等[16]研究表明攀登鱼藤异黄酮在小鼠体内具有抗炎作用;Danielle等[17]研究显示攀登鱼藤异黄酮在糖尿病高血压大鼠体内发挥降压降糖作用;也有研究报道攀登鱼藤异黄酮具有抗宫颈癌作用[18-19]。为探讨攀登鱼藤异黄酮是否具有抗乳腺癌作用,本研究首先选取不同乳腺癌细胞,并以大豆异黄酮和金雀异黄酮为对照探索攀登鱼藤异黄酮抗增殖活性。本研究结果表明,相较于大豆异黄酮和金雀异黄酮,攀登鱼藤异黄酮表现出更强的抗增殖活性,尤其是三阴性乳腺癌细胞。基于三阴性乳腺癌的特殊性,后续以三阴性乳腺癌细胞系MDA-MB-231为研究对象进一步探索攀登鱼藤异黄酮的抗乳腺癌作用。本研究结果显示,攀登鱼藤异黄酮以浓度和时间依赖性抑制三阴性乳腺癌细胞(MDA-MB-231)增殖。克隆形成表示细胞的独立生存能力,反映细胞群体依赖性和增殖能力。本研究发现攀登鱼藤异黄酮显著抑制三阴性乳腺癌细胞(MDA-MB- 231)克隆形成,即进一步明确攀登鱼藤异黄酮抗三阴性乳腺癌细胞增殖活性。
三阴性乳腺癌的浸润性和转移性是其突出的生物学特征[20-21]。划痕实验是检测细胞转移能力的一种方法,划痕面积愈合速度快表示细胞转移能力强,而愈合速度慢则表示细胞转移能力弱。本研究结果表明,攀登鱼藤异黄酮显著性降低乳腺癌细胞划痕面积的愈合速度,提示攀登鱼藤异黄酮具有抗迁移能力。基质金属蛋白酶能降解细胞外基质中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用[22, 22]。在基质金属蛋白酶家族成员中,MMP2和MMP9在癌症转移中起主导作用。研究表明,隐丹参酮可下调MMP2的表达从而抑制乳腺癌细胞侵袭发挥抗癌作用[24];辣椒碱可下调MMP2和MMP9的表达从而抑制乳腺癌细胞侵袭[25]。而本研究结果表明,攀登鱼藤异黄酮可下调乳腺癌细胞MMP2和MMP9的表达,提示攀登鱼藤异黄酮具有抗侵袭能力。结合上述结果,本研究发现攀登鱼藤异黄酮可通过抑制乳腺癌细胞增殖、转移和侵袭,进而发挥其抗乳腺癌作用。而基质金属蛋白酶抑制剂在21世纪初被广泛设计合成并应用于临床抗癌研究[26-27],这提示攀登鱼藤异黄酮未来可能作为一种新型的化疗药物应用于乳腺癌临床治疗。
然而,攀登鱼藤异黄酮水溶性较差限制了其进一步的生物利用,因而可能导致其临床应用前景较差。因此,本研究选择以脂质体为载体,通过薄膜水化法制备出攀登鱼藤异黄酮温敏脂质体,靶向递送药物至肿瘤组织,提高其生物利用度并减少其毒副作用。异黄酮类化合物一般在250~270 nm有较强的紫外吸收[28]。而本研究结果显示,攀登鱼藤异黄酮在286 nm处有强吸收,提示可能羟基基团较多导致红移现象。并且温敏脂质体在286 nm处无紫外吸收,表明脂质体不会对攀登鱼藤异黄酮检测产生干扰。因此,本研究得到的包封率是较为准确的。有研究报道,脂质体粒径在100 nm(d)左右可以有效地介导EPR效应穿过血管壁进入肿瘤组织[29]。而本研究所制备得到的攀登鱼藤异黄酮温敏脂质体粒径为112 nm(d)左右,可以较好的介导EPR效应将药物递送到肿瘤组织,从而发挥抗癌作用。此外,攀登鱼藤异黄酮温敏脂质体在4 ℃存放7 d后其粒径变大、粒径峰变宽、电位降低,推测部分脂质体可能发生相互融合,造成粒径变大和电位下降。但是攀登鱼藤异黄酮温敏脂质体物理性能整体变化不大,表明其结构较为稳定,可低温存放一定时间。一般情况下,正常人安静时血液循环整体一周时间约为20~25 s左右。本研究结果显示,将攀登鱼藤异黄酮温敏脂质体置于37 ℃ 24 h后,包封率仍然维持较好,提示在血液循环中其可以维持较好的载药稳定性,从而更多地将药物靶向递送到肿瘤组织发挥抗癌作用。并且当脂质体和肿瘤组织持续稳定的密切接触时,由于脂质体类细胞膜的磷脂双分子层结构,脂质体可与细胞相互融合介导胞吞作用直接将药物递送至细胞里面,从而促进癌细胞摄入药物[30]。本研究发现,6.25 μmol/L攀登鱼藤异黄酮和攀登鱼藤异黄酮温敏脂质体均可显著抑制小鼠乳腺癌细胞增殖,而攀登鱼藤异黄酮温敏脂质体抑制增殖作用更明显,可能是脂质体有利于癌细胞摄取药物,从而更好地发挥药物的抗癌作用。然而,当3.125 μmol/L攀登鱼藤异黄酮和攀登鱼藤异黄酮温敏脂质体处理小鼠乳腺癌细胞时,两种药物均未观察到明显的抑制增殖作用,推测该药物浓度未达到有效抑制增殖作用的阈值。当浓度增加到12.5 μmol/L时,两种药物对小鼠乳腺癌细胞增殖抑制率均超过95%,且两种药物之间差异没有统计学意义,可能是药物浓度过高,单纯攀登鱼藤异黄酮即可显著抑制小鼠乳腺癌细胞增殖。
综上所述,本研究证实攀登鱼藤异黄酮具有较好的抗乳腺癌活性,可抑制乳腺癌细胞增殖、迁移和侵袭。薄膜水化法制备的攀登鱼藤异黄酮温敏脂质体具有均质性好、粒径小、包封率高、稳定性好以及增强其抗乳腺癌活性的优点,为下一步小鼠动物实验的顺利开展奠定了基础。在未来的研究中,我们将进一步结合体内、体外实验深入探讨攀登鱼藤异黄酮抗乳腺癌活性的分子机制,为临床开发攀登鱼藤异黄酮作为抗乳腺癌药物提供研究基础。
| [1] |
Milioli HH, Tishchenko I, Riveros C, et al. Basal-like breast cancer: molecular profiles, clinical features and survival outcomes[J]. BMC Med Genomics, 2017, 10(1): 19. DOI:10.1186/s12920-017-0250-9 |
| [2] |
Sporikova Z, Koudelakova V, Trojanec R, et al. Genetic markers in triple-negative breast cancer[J]. Clin Breast Cancer, 2018, 18(5): e841-50. DOI:10.1016/j.clbc.2018.07.023 |
| [3] |
Bianchini G, Balko JM, Mayer IA, et al. Triple-negative breast cancer: challenges and opportunities of a heterogeneous disease[J]. Nat Rev ClinOncol, 2016, 13(11): 674-90. |
| [4] |
Lehmann BD, Bauer JA, Chen X, et al. Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies[J]. J Clin Invest, 2011, 121(7): 2750-67. |
| [5] |
Dent R, Trudeau M, Pritchard K I, et al. Triple-negative breast cancer: clinical features and patterns of recurrence[J]. Clinical cancer research: an official journal of the American Association for Cancer Research, 2007, 13(15 Pt 1): 4429-34. |
| [6] |
张佳玉, 李文倩, 赵博志, 等. 三阴性乳腺癌的治疗现状及研究新方向[J]. 现代肿瘤医学, 2019, 27(21): 3912-5. DOI:10.3969/j.issn.1672-4992.2019.21.042 |
| [7] |
Gray C, Campbell K. Regional Chemotherapy for the Treatment of Breast Cancer: A Review of Clinical Effectiveness, Cost Effectiveness and Guidelines[M]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health, 2018.
|
| [8] |
Jhan JR, Andrechek ER. Triple-negative breast cancer and the potential for targeted therapy[J]. Pharmacogenomics, 2017, 18(17): 1595-609. DOI:10.2217/pgs-2017-0117 |
| [9] |
倪晨, 李婷, 吴振华, 等. 三阴性乳腺癌化疗进展[J]. 中国癌症杂志, 2014, 24(4): 316-20. DOI:10.3969/j.issn.1007-3969.2014.04.013 |
| [10] |
Bonotto M, Gerratana L, Poletto E, et al. Measures of outcome in metastatic breast cancer: insights from a real-world scenario[J]. Oncologist, 2014, 19(6): 608-15. DOI:10.1634/theoncologist.2014-0002 |
| [11] |
Harbeck N, Gnant M. Breast cancer[J]. Lancet (London, England), 2017, 389(10074): 1134-50. DOI:10.1016/S0140-6736(16)31891-8 |
| [12] |
Demaria M, O'Leary MN, Chang JH, et al. Cellular senescence promotes adverse effects of chemotherapy and cancer relapse[J]. Cancer Discov, 2017, 7(2): 165-76. DOI:10.1158/2159-8290.CD-16-0241 |
| [13] |
Hesketh PJ, Batchelor D, Golant M, et al. Chemotherapy-induced alopecia: psychosocial impact and therapeutic approaches[J]. Support Care Cancer, 2004, 12(8): 543-9. |
| [14] |
May JP, Hysi E, Wirtzfeld LA, et al. Photoacoustic imaging of cancer treatment response: early detection of therapeutic effect from thermosensitive liposomes[J]. PLoS One, 2016, 11(10): e0165345. DOI:10.1371/journal.pone.0165345 |
| [15] |
Agarwal A, MacKey MA, El-Sayed MA, et al. Remote triggered release of doxorubicin in tumors by synergistic application of thermosensitive liposomes and gold nanorods[J]. ACS Nano, 2011, 5(6): 4919-26. DOI:10.1021/nn201010q |
| [16] |
Talla E, Njamen D, Mbafor JT, et al. Warangalone, the isoflavonoid anti-inflammatory principle of Erythrinaaddisoniae stem bark[J]. J Nat Prod, 2003, 66(6): 891-3. DOI:10.1021/np020599b |
| [17] |
Bilanda DC, Bidingha RÀG, DjomeniDzeufiet PD, et al. Antihyper tensive and antidiabetic activities of Erythrinasenegalensis DC (Fa baceae) stem bark aqueous extract on diabetic hypertensive rats[J]. J Ethnopharmacol, 2020, 246: 112200. DOI:10.1016/j.jep.2019.112200 |
| [18] |
Hu YF, Li ZH, Wang LF, et al. Scandenolone, a natural isoflavone derivative from Cudraniatricuspidata fruit, targets EGFR to induce apoptosis and block autophagy flux in human melanoma cells[J]. J Funct Foods, 2017, 37: 229-40. DOI:10.1016/j.jff.2017.07.055 |
| [19] |
白卫滨, 孙建霞, 王丽芳, 等.攀登鱼藤异黄酮在制备预防和/或治疗宫颈癌药物中的应用[P].
|
| [20] |
Bravo-Cordero JJ, Hodgson L, Condeelis J. Directed cell invasion and migration during metastasis[J]. Curr Opin Cell Biol, 2012, 24(2): 277-83. DOI:10.1016/j.ceb.2011.12.004 |
| [21] |
Jitariu AA, Cîmpean AM, Ribatti D, et al. Triple negative breast cancer: the kiss of death[J]. Oncotarget, 2017, 8(28): 46652-62. DOI:10.18632/oncotarget.16938 |
| [22] |
Hulkower KI, Herber RL. Cell migration and invasion assays as tools for drug discovery[J]. Pharmaceutics, 2011, 3(1): 107-24. DOI:10.3390/pharmaceutics3010107 |
| [23] |
Winer A, Adams S, Mignatti P. Matrix metalloproteinase inhibitors in cancer therapy: turning past failures into future successes[J]. Mol Cancer Ther, 2018, 17(6): 1147-55. DOI:10.1158/1535-7163.MCT-17-0646 |
| [24] |
周南阳, 赵虹. 隐丹参酮对乳腺癌MDA-MB-231细胞迁移、侵袭的影响及其机制[J]. 中国现代医生, 2017, 55(35): 16-20. |
| [25] |
李伯和, 袁磊. 辣椒碱对乳腺癌MDA-MB-231细胞迁移和侵袭的抑制作用及其机制[J]. 生理学报, 2017, 69(2): 183-8. |
| [26] |
Hirte H, Vergote IB, Jeffrey JR, et al. A phase Ⅲ randomized trial of BAY 12-9566 (tanomastat) as maintenance therapy in patients with advanced ovarian cancer responsive to primary surgery and paclitaxel/platinum containing chemotherapy: a National Cancer Institute of Canada Clinical Trials Group Study[J]. Gynecol Oncol, 2006, 102(2): 300-8. DOI:10.1016/j.ygyno.2005.12.020 |
| [27] |
Sparano JA, Bernardo P, Stephenson P, et al. Randomized phase Ⅲ trial of marimastat versus placebo in patients with metastatic breast cancer who have responding or stable disease after first-line chemotherapy: Eastern Cooperative Oncology Group trial E2196[J]. J Clin Oncol, 2004, 22(23): 4683-90. DOI:10.1200/JCO.2004.08.054 |
| [28] |
张玉梅, 孙学斌, 高旭年, 等. 紫外分光光度法测定大豆总异黄酮的含量[J]. 中国食品卫生杂志, 2000, 12(4): 7-9. DOI:10.3969/j.issn.1004-8456.2000.04.002 |
| [29] |
Kalyane D, Raval N, Maheshwari R, et al. Employment of enhanced permeability and retention effect (EPR): Nanoparticle-based precision tools for targeting of therapeutic and diagnostic agent in cancer[J]. Mater Sci Eng C Mater Biol Appl, 2019, 98: 1252-76. |
| [30] |
Li Z, Tan SR, Li S, et al. Cancer drug delivery in the nano era: an overview and perspectives (Review)[J]. Oncol Rep, 2017, 38(2): 611-24. DOI:10.3892/or.2017.5718 |
 2020, Vol. 40
2020, Vol. 40