2. 浙江中医药大学附属广兴医院, 浙江 杭州 310007
2. Guangxing Hospital Affiliated to Zhejiang Chinese Medicine University, Hangzhou 310007, China
邻苯二甲酸二乙酯(DEHP)是一种在环境中普遍存在的环境污染物,常用于工业产品的增塑剂中,包括食品和药品包装、化妆品、医用器材和设备、儿童玩具及其他商业和工业产品等[1-3]。大量研究证明,DEHP有明确的生殖发育毒性,可影响着床前胚胎发育,干扰胚胎植入以及影响胎儿发育及胎盘功能,最终影响妊娠结局[4-7]。
DEHP及其代谢产物具有明显的内分泌毒性及免疫毒性[8-9],对巨噬细胞具有免疫抑制作用,可抑制TNF-α分泌[10]和IL-2蛋白分泌[11],损伤免疫功能发挥。在较高的浓度下,所有邻苯二甲酸盐都可以抑制细胞因子的产生[12]。当前有较多关于DEHP对过敏性疾病的免疫毒性研究,但关于DEHP对妊娠期免疫毒性的实验研究有限。DEHP可诱发脂质过氧化反应,引起抗氧化酶的改变和过氧化物堆积,已有较多研究发现,DEHP可诱导多种生物的肝细胞、心肌细胞、神经细胞等活性氧增加,导致脂质过氧化反应和免疫抑制[13-17]。随着社会各行业化学物质的广泛应用,育龄女性不可避免的暴露于DEHP等行业材料环境中,如何对可能造成妊娠丧失或胎元不健的有害因素进行积极干预,以避免妊娠丧失、子代缺陷,保障孕妇健康是一个极其重要的课题。
临床中寿胎丸作为经典的补肾安胎方剂,被很广泛地应用于妇科疾病的治疗中,在先兆流产、复发性流产等妊娠病治疗中有较好的疗效[18-20]。然而,目前尚无中医药防治DEHP引起的妊娠期免疫功能失调和氧化损伤的相关研究。本研究以DEHP暴露妊娠大鼠为模型,观察寿胎丸干预后孕鼠免疫因子及氧化应激水平变化,探讨中药寿胎丸可能的作用机制。
1 材料和方法 1.1 实验动物健康未生育SPF级SD雌性大鼠36只,雄性大鼠36只,70日龄,雌性体质量230~260 g,雄性300~350 g,由浙江中医药大学动物实验研究中心代购自上海西普尔必凯实验动物有限公司,生产许可证号:SCXK(沪)2018-0006,均饲养于浙江中医药大学动物实验中心,作息模拟正常昼夜节律,饲养环境:室温20~25 ℃,相对湿度40%~60%,自由饮食和进水。
1.2 药物寿胎丸由菟丝子24 g、桑寄生12 g、川续断12 g、阿胶12 g组成,由杭州市中医院中药房提供,制备成含生药4.4 g/mL溶液。DEHP(分析纯,浓度≥99.5%,Sigma),玉米油(试剂级,杭州昊鑫生物科技有限公司)。
1.3 试剂及主要仪器试剂:雌二醇(批号:E189914)、孕激素(批号:E194362)、IL-6(批号:E190068)、TNF-a(批号:E194325)、IL-2(批号:E197026)ELISA试剂盒,ASSAY;T-AOC(批号:20190220)、SOD(批号:20190126)、GSH-Px(批号:20190124)、CAT(批号:20190413)、ROS(批号:20190421)、MDA(批号:20190108)试剂盒,南京建成生物研究所;HE染色液(货号:G1120),北京Solarbio公司。
仪器:RM2016切片机、EG1150包埋机(德国莱卡公司);BX51T-PHD-J11显微镜(日本奥林巴斯公司);GL-400SD超声波细胞破碎仪(南京先欧仪器制造有限公司);5810R型台式高速冷冻离心机(德国eppendorf);DSHZ-300恒温水浴箱(江苏太仓医用仪器厂);FilterMax F5多功能酶标仪(奥地利Molecular Devices);分光光度计NANODROP 2000(Therno scientific)。
1.4 实验动物分组及处理将雌性SD大鼠36只与雄性SD大鼠36只随机分为3组:对照组、模型组、中药组。适应性喂养1周后按雌雄比例1:1合笼,次日清晨检查有无阴栓,发现阴栓当天记录为妊娠0 d(0 d)。妊娠0 d开始,每日称量孕鼠体质量,根据体质量调整用药剂量。对照组每日上午予玉米油10 mL/kg灌胃,下午予生理盐水10 mL/kg灌胃;模型组每日上午予DEHP 500 mg/kg灌胃,下午予生理盐水10 mL/kg灌胃;中药组每日上午予DEHP 500 mg/kg灌胃,下午予中药寿胎丸10 mL/kg灌胃,共19 d。妊娠第19天腹腔麻醉后,腹主动脉取血,分离血清,剖腹取出胎鼠,称量胎鼠质量,记录各组孕鼠活胎数、死胎数;记录各组胎盘外观、色泽、质量情况,另取每只孕鼠胎盘组织2只,PBS缓冲液冲洗干净,1只用4%甲醛固定24 h后,石蜡包埋,连续切片做病理染色,1只研磨成组织均浆做氧化指标。
1.5 实验指标及方法 1.5.1 血清激素及免疫因子检测用酶联免疫法检测血清孕激素、雌二醇、IL-6、IL-2、TNF-α水平,具体操作步骤严格按照试剂盒说明书进行。
1.5.2 胎盘组织病理染色对4%甲醛固定24 h后胎盘组织(每个样本取相同部位)进行石蜡包埋后切片,采用苏木精—伊红染色法进行染色,置于100×显微镜观察。
1.5.3 氧化应激指标的测定制作成胎盘组织匀浆,分别用TBA法、比色法、WST-1法、ABTS法、化学荧光法、可见光法测定胎盘组织匀浆中MDA、GSH-Px、SOD、T-AOC、ROS、CAT的水平,具体操作步骤严格按照试剂盒说明书进行,参照标准曲线计算标本相应指标的测定值。
1.5.4 统计学方法采用SPSS22.0软件进行分析。计量资料以均数±标准误表示,计量资料间比较前,对数据进行正态性检验,满足正态性分布采用独立样本t检验和单因素方差分析,不满足则采用秩和检验,检验水准α=0.05。
2 结果 2.1 一般情况按照雌雄比例1:1连续合笼8 d(2个性周期,提示妊娠后即取出开始造模)后各组大鼠受孕情况如下:对照组11只,模型组10只,中药组10只。DEHP溶液及药物灌胃过程中,各组大鼠一般状况良好,饮食进水大便未见明显异常,毛发整齐,光亮润泽,精神状态正常,反应灵敏,无动物死亡。
2.2 各组孕鼠孕期体质量增加量及妊娠结局比较与对照组比较,模型组大鼠孕中后期(10~18 d)体质量增加明显减慢(P < 0.05,表 1)。与模型组比较,中药组大鼠孕中后期(10~18 d)体质量明显增加(P < 0.05)。各组每只孕鼠妊娠胎数(活胎数+死胎数)、活胎数、死胎数均未见明显统计学差异(P>0.05);各组均未发现明显外观畸形胎鼠,模型组总死胎数较对照组、中药组有较明显增加趋势。
| 表 1 各组大鼠孕期体质量增加量及妊娠结局表 Tab.1 Weight gain during pregnancy and pregnancy outcome of the rats in each group (Mean±SD) |
与正常组比较,模型组胎鼠质量明显降低(P < 0.05,表 2)。与模型组比较,中药组胎鼠质量有升高趋势(P> 0.05)。肉眼观察各组孕鼠胎盘无明显外观差异;各组大鼠胎盘质量无明显差异(P>0.05)。
| 表 2 各组胎鼠质量及胎盘质量表 Tab.2 Weight of the fetal rats and the placenta in each group (Mean±SD) |
与正常组比较,模型组血清IL-2、IL-6、TNF-α降低,雌二醇水平升高(P < 0.05,表 3)。与模型组比较,中药组IL-6、IL-2升高,雌二醇水平降低(P < 0.05),TNF-α呈现升高趋势,但无统计学意义(P>0.05)。孕激素各组皆无统计学差异(P>0.05)。
| 表 3 各组大鼠血清IL-2、IL-6、TNF-α、E2、P水平 Tab.3 Serum IL-2, IL-6, TNF-α, E2, and P levels of the rats in each group (Mean±SD) |
与正常组相比,模型组大鼠胎盘结构较差,其海绵滋养层明显疏松杂乱,出现较多空泡。与模型组相比,中药组大鼠胎盘结构完整,迷路带、海绵滋养层、巨细胞滋养层清晰可见,各层中细胞分布均优于模型组(图 1)。
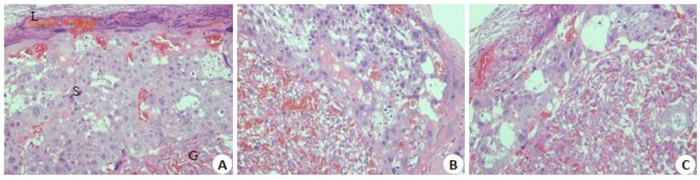
|
图 1 三组大鼠胎盘组织HE染色 Fig.1 HE staining of rat placental tissues in the 3 groups (Original magnification: ×100). L: Labyrinth zone S:Sponge trophoblast G: Macrophage trophoblast; A: Control group, B: Model group, C: Chinese medicine group. |
与正常组比较,模型组T-AOC、GSH-Px、SOD、CAT水平显著降低,ROS、MDA水平显著升高(P < 0.01,表 4)。与模型组比较,中药组T-AOC、GSH-Px、CAT明显升高,MDA明显降低(P < 0.05),SOD有升高趋势,ROS有降低趋势(P>0.05)。
| 表 4 各组大鼠胎盘T-AOC、GSH-Px、SOD、CAT、ROS、MDA水平 Tab.4 Levels of T-AOC, GSH-Px, SOD, CAT, ROS and MDA in rat placenta (Mean±SD) |
环境污染是一个全球性问题,其环境内分泌干扰物(EEDs)干扰内分泌系统,长期暴露可导致内分泌代谢紊乱,导致流产率升高[21-22]。有文献报道高剂量的DEHP会导致小鼠体质量显著降低,血甘油三酯、总胆固醇水平降低,其机制可能与DEHP干扰脂肪代谢,使脂质氧化分解代谢加强,脂质合成减少有关[23-25]。本研究结果提示,模型组大鼠孕期体质量增加较慢,胎鼠质量明显降低,总死亡胎数有所增加,研究结果与上述文献报道基本一致,初步认为DEHP暴露可导致大鼠及胎鼠脂质代谢紊乱,对大鼠胚胎发育有一定损伤作用。而经过中药寿胎丸干预后,大鼠孕期体质量增加、胎鼠质量均优于模型组,总死亡胎数有所减少,提示寿胎丸对DEHP生殖毒性具有一定的拮抗作用,对脂质代谢紊乱有一定调节作用。
环境内分泌干扰性物质具有雌激素活性,这些物质可与雌激素受体结合,竞争内源性雌激素的结合位点,诱导产生弱雌激素效应,并影响雌激素受体的合成和分解[26]。雌激素受体α(ERα)在子宫表皮中高度表达诱导上皮细胞增殖,而雌激素受体β(ERβ)具有抗子宫内膜营养效应,抑制雌二醇对ERα的作用[27],DEHP及其代谢产物可通过影响芳香化酶的表达增加雌激素转化,诱导雌激素受体表达水平改变[28],进一步影响雌二醇作用的发挥。另有研究表明[29],当DEHP剂量达到100 mg/(kg·d)时,ERα、ERβ表达量下降,卵巢类固醇生成增加,该结果与本研究部分一致。本研究中,模型组相较对照组雌二醇水平增加,其原因可能与DEHP竞争雌激素受体,影响雌二醇的代谢以及子宫中ER表达有关。中药组治疗后发现相较于模型组,雌二醇水平有所降低,考虑中药寿胎丸可通过拮抗DEHP,调整ER表达,调节雌二醇的体内代谢。3组孕酮无明显差异,这可能仍与DEHP的雌激素样活性有关。
免疫系统与神经内分泌系统可通过各种细胞信息介质联系,因此内分泌干扰物质可引起环境性免疫功能失调,随之出现免疫反应抑制或免疫反应增强。Th1和Th2具有不同的细胞因子产生谱。Th1/ Th2能分泌IL-2、TNF-α、IL-6等细胞因子[30],查找文献发现,较高剂量的DEHP通过抑制淋巴细胞IL-2蛋白分泌进而影响IL-2的分泌[11]。另有研究发现DEHP可上调IL-6的分泌[31],这与本研究结果不符,考虑可能与DEHP的剂量有关。T细胞由胸腺内的淋巴干细胞分化而来,一些研究发现在小鼠和人类中胸腺细胞、胸腺上皮细胞、T淋巴细胞中均有ER表达,雌激素可通过ER介导小鼠胸腺的一些免疫功能[32],在1999年已经发现ER敲除小鼠胸腺髓质区域减少,CD4+和CD4+ CD8+ T细胞发生率降低[33]。T细胞分化与ER表达相关联,胸腺的ER表达水平很大程度上受雌激素[34]、氧化应激[35]等方面影响。考虑DEHP作为常见的内分泌干扰物质之一,可能通过竞争胸腺ER结合位点,降低雌二醇的生物效能, 同时影响ER合成与分解,减少胸腺中的ERα,直接影响胸腺Th1细胞和Th2细胞的产生,降低IL-2、IL-6、TNF-α等细胞因子的产生,最终影响机体的免疫功能。上述文献报道中皆讨论非妊娠状态下免疫因子的分泌及变化,而本研究着重研究妊娠状态下DEHP对免疫因子的影响。在本研究中,模型组相较对照组IL-2、IL-6、TNF-α均有明显的降低,而中药治疗后发现相较于模型组IL-2、IL-6、TNF- α均有不同程度的回升。考虑DEHP可能有过度抑制机体免疫功能,抑制细胞因子分泌的作用;中药寿胎丸可能有一定的增强免疫功能的作用,以上结论有待进一步研究证明。
胎盘是胎儿与母体之间物质交换的重要器官, 胎盘发育与胎儿的正常发育密切相关,DEHP对胎盘组织的损伤可直接影响胚胎及胎儿发育。近年在人类孕妇胎盘组织及新生儿脐血中均检测到DEHP的代谢产物[36-37]。本研究结果中,模型组大鼠胎盘海绵滋养层疏松杂乱,出现较多空泡。中药组迷路带、海绵滋养层、巨细胞滋养层相对分明,各层细胞分布优于模型组。该结果表明寿胎丸有保护胎盘组织,促进胚胎成长的作用。
氧化应激是指体内氧化与抗氧化作用失衡,产生大量氧化中间产物自由基,进而损伤正常组织。机体中GSH-Px、SOD的活性水平和T-AOC、CAT的高低间接反映了机体清除氧自由基的能力,而MDA和ROS水平的高低又间接反映了机体受到自由基攻击的严重程度。为进一步确认寿胎丸拮抗DEHP,保护胎盘组织的机制,本实验组对胎盘GSH-Px、SOD、T-AOC、CAT、MDA、ROS等氧化应激指标进行了检测。现有文献报道DEHP及其代谢产物可刺激胎盘细胞氧化应激反应[38],但目前缺乏关于中药拮抗DEHP暴露下胎盘氧化应激反应的研究。对本研究检测结果显示,DEHP会显著消耗机体T-AOC,降低GSH-Px、SOD、CAT活性,导致组织ROS水平显著升高,产生过量脂质氧化终产物丙二醛(MDA),损伤胎盘组织。中药组可提高机体T-AOC、GSH-Px、CAT、SOD水平,降低ROS、MDA水平,进而降低胎盘组织的氧化损伤。研究结果提示DEHP通过增强胎盘内氧化应激水平影响大鼠胎盘功能,该结论与文献基本一致。中药寿胎丸拮抗DEHP对胎盘组织的氧化损伤是其保护胚胎、改善妊娠结局的机制之一。
从中医学角度考虑,各种污染皆属于“外毒”,毒邪内伏于体,是否发病与毒邪的强弱、体内正气盛衰密切相关。DEHP作为一种“毒邪”,可通过直接损伤胎元或伤及母体脏腑、气血、冲任,导致胎元不固或造成胎元缺陷,胎不成实,最终引起流产或胚胎发育受损。本研究采用张锡纯《医学衷中参西录》所载“寿胎丸”,该方“注重于胎,以变化胎之性情气质,使之善吸其母之气化以自养,自无流产之噳”。其中菟丝子“大能补肾,肾旺自能荫胎也”,补肾益精,为君。桑寄生、续断固肾强腰,系胎; 阿胶滋阴养血止血。现代医学认为,补肾药物具有调节内分泌的作用,菟丝子具有雌激素样作用,续断中含有大量的维生素E,维生素E具有较强的抗氧化作用,可以促进子宫和胚胎的发育。有研究表明[39-41],阿胶具有明确的调节免疫功能的作用,并有一定的抗氧化功能及雌激素样作用。本方全方四味药,用药简洁,古今相参,共奏补肾安胎之功。
综上,寿胎丸可调节孕鼠免疫功能,其机制可能与其拮抗DEHP的雌激素样作用,上调血清IL-2、IL-6、TNF-α等免疫因子含量有关;寿胎丸可能通过纠正DEHP引起的胎盘组织内氧化应激失衡状态,减少胎盘组织损伤,改善妊娠结局。
| [1] |
Erythropel HC, Maric M, Nicell JA, et al. Leaching of the plasticizer di (2-ethylhexyl)phthalate (DEHP) from plastic containers and the question of human exposure[J]. Appl Microbiol Biotechnol, 2014, 98(24): 9967-81. |
| [2] |
Zota AR, Calafat AM, Woodruff TJ. Temporal trends in phthalate exposures: findings from the National Health and Nutrition Examination Survey, 2001-2010[J]. Environ Health Perspect, 2014, 122(3): 235-41. DOI:10.1289/ehp.1306681 |
| [3] |
Sui HX, Zhang L, Wu PG, et al. Concentration of di(2-ethylhexyl) phthalate (DEHP) in foods and its dietary exposure in China[J]. Int J Hyg Environ Health, 2014, 217(6): 695-701. |
| [4] |
Marzano G, Mastrorocco A, Zianni R, et al. Altered morphokinetics in equine embryos from oocytes exposed to DEHP during IVM[J]. Mol Reprod Dev, 2019, 86(10): 1388-404. |
| [5] |
Mínguez- Alarcón L, Messerlian C, Bellavia A, et al. Urinary concentrations of bisphenol A, parabens and phthalate metabolite mixtures in relation to reproductive success among women undergoing in vitro fertilization[J]. Environ Int, 2019, 126(5): 355-62. DOI:10.1016/j.envint.2019.02.025 |
| [6] |
张璐, 张腾令, 宗滕, 等. 妊娠期邻苯二甲酸二(2-乙基)己酯暴露对小鼠胎盘生长发育的影响[J]. 南方医科大学学报, 2016, 36(4): 467-71. |
| [7] |
Sant KE, Dolinoy DC, Jilek JL, et al. Mono-2-ethylhexyl phthalate disrupts neurulation and modifies the embryonic redox environment and gene expression[J]. Reprod Toxicol, 2016, 63(8): 32-48. |
| [8] |
Rowdhwal SSS, Chen J. Toxic effects of Di-2-ethylhexyl phthalate: an overview[J]. Biomed Res Int, 2018(6): 1750368. DOI:10.1155/2018/1750368 |
| [9] |
Zhang L, Hu Y, Sun W, et al. Transcriptomic responses of Nile tilapia (Oreochromis niloticus) liver to environmental concentration of di(2-ethylhexyl)phthalate[J]. Ecotoxicol Environ Saf, 2018, 165(12): 70-7. |
| [10] |
韩佳萦, 苏伊玲, 熊丽, 等. 塑化剂DEHP暴露对小鼠巨噬细胞的免疫毒性作用[J]. 农业环境科学学报, 2018, 37(4): 673-9. |
| [11] |
郭丽, 裴秀丛, 张玉敏, 等. DEHP对小鼠淋巴细胞分泌IL-2影响[J]. 中国公共卫生, 2010, 26(2): 253-4. |
| [12] |
Jepsen KF, Abildtrup A, Larsen ST. Monophthalates promote IL-6 and IL- 8 production in the human epithelial cell line A549[J]. Toxicol in vitro, 2004, 18(3): 265-9. |
| [13] |
Huang Y, Wu C, Ye Y, et al. The increase of ROS caused by the interference of DEHP with JNK/p38/p53 pathway as the reason for hepatotoxicity[J]. Int J Environ Res Public Health, 2019, 16(3): 356. DOI:10.3390/ijerph16030356 |
| [14] |
Amara I, Timoumi R, Annabi E, et al. Di (2- ethylhexyl) phthalate cardiac disorders in BALB/c mice[J]. Environ Sci Pollut Res Int, 2019, 26(8): 7540-9. |
| [15] |
Wang S, Zhang P, Liu R, et al. A DEHP plasticizer alters synaptic proteins via peroxidation[J]. Toxicol Res (Camb), 2017, 6(1): 89-97. |
| [16] |
How CM, Yen PL, Wei CC, et al. Early Life exposure to di(2- ethylhexyl)phthalate causes age- related declines associated with insulin/IGF-1-like signaling pathway and SKN-1 in Caenorhabditis elegans[J]. Environ Pollut, 2019, 251(8): 871-8. DOI:10.1016/j.envpol.2019.04.141 |
| [17] |
Mo N, Zhang M, Wang R, et al. Effects of α-ethinyl estradiol (EE2) and diethylhexyl phthalate (DEHP) on growth performance, antioxidant status and immune response of juvenile yellow catfish Pelteobagrus fulvidraco[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2019, 226(12): 108615. |
| [18] |
Zhang J, Chen L, Zheng CH, et al. Effect of shoutai pills on Th1/ Th2 cytokines in serum and endometrium of rats with stimulated ovulation[J]. Cur Med Sci, 2019, 39(2): 285-90. DOI:10.1007/s11596-019-2032-4 |
| [19] |
Zhao LJ, Xu Y, Duo XL, et al. A probe into effect of Shoutai pill on endometrial receptivity[J]. Exp Ther Med, 2018, 15(4): 3765-8. DOI:10.3892/etm.2018.5874 |
| [20] |
梁程程, 雷磊, 毛思思, 等. 寿胎丸对复发性流产大鼠子宫蜕膜组织AQP表达的影响[J]. 中华中医药学刊, 2019, 37(11): 2657-61. |
| [21] |
Messerlian C, Wylie BJ, Mínguez-Alarcón L, et al. Urinary concentrations of phthalate metabolites and pregnancy loss among women conceiving with medically assisted reproduction[J]. Epidemiology, 2016, 27(6): 879-88. |
| [22] |
Yi H, Gu H, Zhou T, et al. A pilot study on association between phthalate exposure and missed miscarriage[J]. Eur Rev Med Pharmacol Sci, 2016, 20(9): 1894-902. |
| [23] |
Feige JN, Gelman L, Rossi D, et al. The endocrine disruptor monoethyl- hexyl- phthalate is a selective peroxisome proliferatoractivated receptor gamma modulator that promotes adipogenesis[J]. J Biol Chem, 2007, 282(26): 19152-66. |
| [24] |
杨振华, 陈云竹, 张月霞, 等. DEHP对高脂饮食大鼠血脂代谢的影响[J]. 山西大学学报:自然科学版, 2018, 41(1): 220-5. |
| [25] |
陈云竹. DEHP对高脂饮食大鼠脂质代谢及血压的影响[D].太原: 山西大学, 2018. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1018317238.nh
|
| [26] |
Harris RM, Waring RH, Kirk CJ, et al. Sulfation of "estrogenic" alkylphenols and 17beta-estradiol by human platelet phenol sulfotransferases[J]. J Biol Chem, 2000, 275(1): 159-66. |
| [27] |
Weihua Z, Saji S, Mäkinen S, et al. Estrogen receptor (ER) beta, a modulator of ERalpha in the uterus[J]. Proc Natl Acad Sci U S A, 2000, 97(11): 5936-41. |
| [28] |
叶婷, 杨丹, 李灿. MEHP对胚胎期海水青鳉(Oryzias melastigma)的内分泌干扰效应[J]. 海洋环境科学, 2018, 37(6): 857-63. |
| [29] |
Somasundaram DB, Manokaran K, Selvanesan B. Impact of di-(2- ethylhexyl) phthalate on the uterus of adult Wistar rats[J]. Hum Exp Toxicol, 2017, 36(6): 565-72. DOI:10.1177/0960327116657601 |
| [30] |
Abbas AK, Murphy KM, Sher A. Functional diversity of helper T lymphocytes[J]. Nature, 1996, 383(663): 787-93. DOI:10.1038/383787a0 |
| [31] |
Wang Y, Zhao M, Liu J, et al. Up regulation of IL-6 is involved in di (2-ethylhexyl) phthalate (DEHP) induced migration and invasion of non small cell lung Cancer (NSCLC) cells[J]. Biomed Pharmacother, 2017, 89(5): 1037-44. |
| [32] |
Kawashima I, Seiki K, Sakabe K, et al. Localization of estrogen receptors and estrogen receptor-mRNA in female mouse thymus[J]. Thymus, 1992, 20(2): 115-21. |
| [33] |
Staples JE, Gasiewicz TA, Fiore NC, et al. Estrogen receptor alpha is necessary in thymic development and estradiol-induced thymic alterations[J]. J Immunol, 1999, 163(8): 4168-74. |
| [34] |
Katayama M, Fukuda T, Hatabu T, et al. Changes in estrogen receptor expression in the chick thymus during late embryonic development[J]. Ani Sci J, 2014, 85(3): 277-85. |
| [35] |
Muehlfelder M, Arias- Loza PA, Fritzemeier KH, et al. Both estrogen receptor subtypes, ERα and ERβ, prevent aldosteroneinduced oxidative stress in VSMC via increased NADPH bioavailability[J]. Biochem Biophys Res Commun, 2012, 423(4): 850-6. DOI:10.1016/j.bbrc.2012.06.053 |
| [36] |
栗笑迎, 孙红文. 天津市孕妇胎盘中邻苯二甲酸单酯的分布特征[J]. 环境化学, 2018, 37(4): 636-43. |
| [37] |
于晓楠, 王颖珏, 王斌, 等. 新生儿脐血中酞酸酯类化合物(PAEs)暴露水平及其与新生儿生长发育的相关性研究[J]. 健康教育与健康促进, 2015, 10(2): 102-5. |
| [38] |
Tetz LM, Cheng AA, Korte CS, et al. Mono-2-ethylhexyl phthalate induces oxidative stress responses in human placental cells in vitro[J]. Toxicol Appl Pharmacol, 2013, 268(1): 47-54. DOI:10.1016/j.taap.2013.01.020 |
| [39] |
黄宏轶, 黄玲艳, 张海燕, 等. 参苓阿胶复方膏对气虚体质小鼠免疫调节和抗氧化作用[J]. 美食研究, 2016, 33(3): 35-7, 58. |
| [40] |
姜一朴, 邸志权, 王延涛, 等. 小分子阿胶抗疲劳, 抗氧化及止血作用研究[J]. 中国药理学通报, 2019, 35(2): 203-8. |
| [41] |
刘颖, 胡锐, 白璐, 等. 阿胶对正常雌性小鼠雌激素样作用研究[J]. 山东中医杂志, 2018, 37(8): 681-3. |
 2020, Vol. 40
2020, Vol. 40

