2. 广东医科大学附属医院 临床研究中心, 广东 湛江 524001;
3. 广东医科大学附属医院 肾病研究所, 广东 湛江 524001
2. Clinical Research Center, Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001, China;
3. Department of Nephrology, Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001, China
手足口病是亚洲一种常见伴随发热、皮疹或疱疹出现在口腔、手、足、臀等部位的儿童流行病,其主要的嗜神经病原体肠道病毒71型(EV71)可引起无菌性脑炎、神经炎性肺水肿、急性松弛性瘫痪等严重中枢神经系统(CNS)并发症甚至可导致死亡[1-2]。据报道,肠道病毒感染对西太平洋地区包括中国和台湾的影响更为显着,常出现周期性爆发和大规模流行[3]。目前使用灭活EV71疫苗接种后,手足口病和严重并发症的发病率相对下降[4],但是在全国普及率较低。2018年美国科罗拉多州儿童暴发肠道病毒性神经疾病,其中EV71患病率为58%,表现出脑膜炎症状的占93%和脑炎症状的占72%,说明EV71仍是全球手足口病重症死亡病例的重要病原体[5]。巨噬细胞调控微生物的感染集中在经典的杀伤途径上,如活性氧和活性氮中间体的产生、抗菌肽表达的上调、自噬的触发[6]。细胞程序性死亡包括自噬、凋亡和程序性坏死,在维持细胞内环境稳定有重要的意义[7]。然而,细胞凋亡与自噬之间的功能关系是复杂的,在某些应激情况下,自噬避免细胞死亡和抑制细胞凋亡,也可参与细胞死亡途径[8]。分离成年小鼠的巨噬细胞可以在体外逐渐杀死EV71病毒[9]。最近报道EV71感染THP-1巨噬细胞可能通过其2B蛋白抑制ILF2mRNA的表达从而拮抗ILF2介导的抗病毒作用[10]。EV71感染能促进巨噬细胞、小胶质细胞和中性粒细胞广泛浸润到中枢神经系统,导致严重的神经损伤[11]。本课题组在体外细胞实验中发现EV71感染能够诱导THP-1细胞凋亡。目前研究EV71作用THP-1细胞主要是为了阐明其相关免疫的机制来研发疫苗和药物[12-13],而没有相关研究报道自噬和凋亡的机制。为了能够及时准确预防和控制EV71致重症神经病变,阐明其致病机理至关重要。本研究主要探讨EV71是否能诱导THP-1巨噬细胞自噬和凋亡及其信号通路,拟为研究EV71致重症手足口病的机制提供理论依据。
1 材料和方法 1.1 材料Vero细胞和THP-1巨噬细胞为本课题组保存。EV71(KC122766)是本课题组前期从重症手足口病患儿的直肠拭子中分离的毒株[9]。PrimeScriptTM RT reagent Kit with gDNA Eraser和SYBR®Premix Ex TaqTM Ⅱ试剂盒(TaKaRa)。AnnexinV-FITC/PI凋亡检测试剂盒(联科),Bax、Bak、Bcl-2、Caspase-3、Caspase-8和LC3为Rabbit mAb,SQSTM1/p62为Mouse mAb(CST)。Anti-Enterovirus 71 Mouse mAb和PCR引物(生工),β- Actin Rabbit mAb(博士德),3-Methyladenine(3-MA)(Sigma),Ac-DEVD-CHO(碧云天)。
1.2 方法 1.2.1 增殖EV71并检测病毒滴度在二级生物安全实验室里进行有关活EV71的实验,用EV71悬液感染融合度为90%的贴壁Vero细胞,孵育时间为90 min,每隔15 min轻轻摇晃1次,倒弃病毒液,加入含2% FBS的高糖DMEM培养基维持培养,逐日观察细胞变化。收集脱落细胞及病毒上清,高速冷冻离心,细胞沉淀在-70 ℃和37 ℃反复冻融3次,用0.22 μL膜(Millipore, MA)过滤病毒上清,-70 ℃保存。TCID50法检测EV71病毒的滴度[14]。
1.2.2 CCK-8试验检测细胞存活率向104/孔的THP-1巨噬细胞中加入100 μL感染复数(MOI)分别为0.0001、0.001、0.01、0.1的EV71稀释液,分别在感染2、8和16 h后,吸弃病毒液后每孔加入100 μL含CCK-8溶液的培养基,避光孵育2 h,用全自动酶标仪450 nm检测光密度值A450(计算公式:细胞存活率=[A实验孔-A空白孔)/(A对照孔-A空白孔)]×100%)。
1.2.3 RT-qPCRTrizol法提取细胞内总病毒RNA,PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real time)合成cDNA,SYBR®Premix Ex TaqTM Ⅱ(TliRNaseH Plus)将cDNA进行实时荧光定量PCR。PCR引物序列:EV71-S(上游):5'-GCAGCCCAAAAGAACTTCAC-3',EV71-A(下游):5'-ATTTCAGCAGCTTGGAGTGC-3',GAPDH-F(上游):5'-TCTGACTTCAACAGCGACACC-3',GAPDH-R(下游):5'-CTGTTGCTGTAGCCAAATTCG T-3'。预变性:95 ℃ 30 s;变性:95 ℃ 5 s,退火:60 ℃ 34 s;延伸:60 ℃ 1 min,40个循环;降温:50 ℃ 30 s。ABI7500荧光定量PCR仪检测细胞内总核酸。
1.2.4 THP-1巨噬细胞中自噬小体的观察向含有1× 105/孔的单层THP-1巨噬细胞中加入MOI为0.1的病毒悬液感染,对照组用培养液代替病毒模拟感染。感染2 h后收集细胞,1000 r/min离心5 min后,用2.5%戊二醛固定1 h,1%锇酸盐后固定2 h,50%、70%、90%和100%梯度乙醇脱水,浸透包埋后超薄切片,在透射电镜(H- 7000FA,日立公司)下观察。
1.2.5 Hoechst 33342染色向含有5 × 104/孔的单层THP-1巨噬细胞中加入MOI为0.1的病毒悬液感染2、8和16 h后,每孔加入100 μL Hoechst 33342染色液充分覆盖细胞,避光染色30 min,无菌PBS洗涤后吸干液体,加入抗猝灭封片液,用莱卡荧光倒置显微镜(DMI3000B,德国)拍照保存。
1.2.6 流式细胞术AnnexinV/PI双染法检测细胞凋亡情况向含有1×105/孔的单层THP-1巨噬细胞中加入MOI为0.1的病毒悬液感染2、8和16 h后,用不含EDTA的0.25%胰酶消化后收集病毒上清和细胞于流式管中,1000 r/min离心3 min,取细胞加入100 μL预先配好的1×Annexin V Binding Solution,向细胞悬液中加入5 μL FITC-Annexin V和PI溶液,避光孵育15 min,再加入400 μL 1×Annexin V Binding Solution,用FACSCantoll流式细胞仪检测。
1.2.7 3-MA抑制EV71病毒诱导THP-1巨噬细胞自噬将浓度为5×105/mL的THP-1巨噬细胞加入到10 cm× 10 cm的培养皿中培养24 h,用PBS稀释抑制剂3-MA,使其浓度为10 μmol/L,孵育2 h后,加入MOI为0.1的EV71悬液感染8 h,分为PBS组、3-MA组、PBS+EV71组和3-MA+EV71组,收集细胞蛋白做免疫印迹实验。
1.2.8 Ac-DEVD-CHO抑制EV71病毒诱导THP-1巨噬细胞凋亡将浓度为5×104/mL的THP-1巨噬细胞加到6孔板中培养24 h后,用RPMI 1640培养基稀释DMSO和抑制剂,使Ac-DEVD-CHO浓度为20 μmol/L,孵育2 h后,加入MOI为0.1的EV71悬液感染8 h,分为DMSO组、DMSO+EV71组、Ac-DEVD-CHO组和AcDEVD-CHO+EV71组,收集细胞做AnnexinV/PI双染色,用FACSCantoll流式细胞仪检测。
1.2.9 Western blot检测蛋白表达向含有1×106/皿单层THP-1巨噬细胞加入MOI为0.1的病毒悬液,感染2、8和16 h后,加入细胞裂解液提取细胞内总蛋白并检测蛋白浓度。通过SDS-PAGE凝胶电泳分离蛋白,转膜后用5%脱脂奶粉进行封闭,加入一抗(1:1000)4 ℃孵育过夜。TBST洗涤后,分别加入二抗Goat Anti-Mouse IgG和Goat Anti- Rabbit IgG(1:5000)常温孵育60 min。TBST洗涤后,避光加发光液显色,Tanon5200全自动化学发光图像分析系统拍照检测,并进行蛋白灰度值分析。
1.3 统计学分析数据以均数±标准差表示,采用SPSS 21.0统计软件,采用单因素方差分析细胞存活率和蛋白表达量,方差分析细胞早期和晚期凋亡率,检验水准:α=0.05,采用ImageJ软件测量蛋白灰度值,GraphPad Prism 5统计作图。
2 结果 2.1 EV71病毒作用能够降低THP-1细胞存活率CCK-8检测结果显示,不同感染复数的EV71病毒作用THP-1巨噬细胞后细胞存活率均呈下降趋势,在相同病毒感染复数作用下,随着作用时间的延长细胞存活率显著降低,差异具有统计学意义(P < 0.05,表 1)。
| 表 1 EV71病毒感染THP-1细胞后的细胞存活率 Tab.1 Cell survival rate after EV71 infected with THP-1macrophages(Mean±SD, %, n=3) |
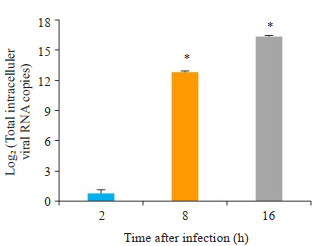
RT-qPCR实验结果显示,与对照组对比,EV71病毒感染组THP-1巨噬细胞内病毒核酸随着时间的延长而不断增多(图 1)细胞内不同时间点总病毒核酸均值具有显著差异(P < 0.01)。
|
图 1 RT-qPCR检测THP-1巨噬细胞内病毒核酸浓度 Fig.1 Detection of viral nucleic acid concentration in THP-1 macrophage by RT-qPCR. *P < 0.01 vs the 2 h group |
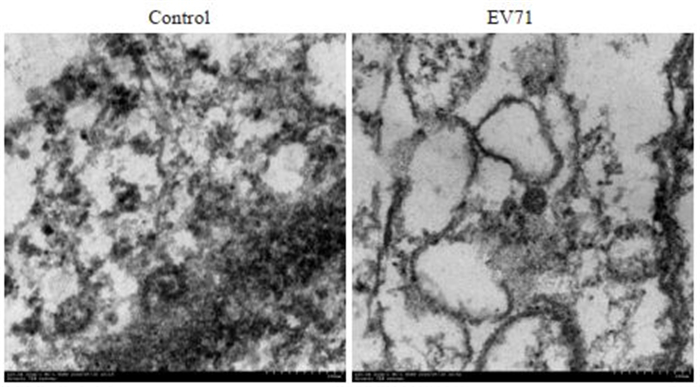
透射电镜下观察结果显示,与对照组比较,EV71病毒感染THP-1巨噬细胞2 h后细胞内出现自噬小体和病毒颗粒(图 2),而对照组细胞中未出现类似自噬小体和病毒颗粒(图 2),说明EV71可诱导THP-1巨噬细胞自噬。
|
图 2 透射电镜检测EV71病毒(KC122766)作用THP-1巨噬细胞的情况 Fig.2 EV71 induced THP-1 macrophage autophagy detected by transmission electron microscopy. left: Normal THP-1 macrophage; right:EV71 infected THP-1 macrophage for 2 h (Original magnification: ×20 000) |
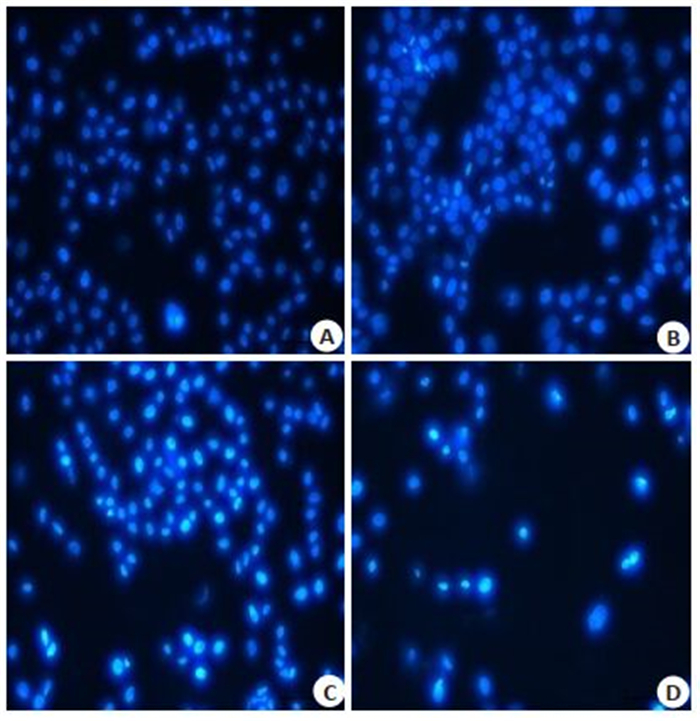
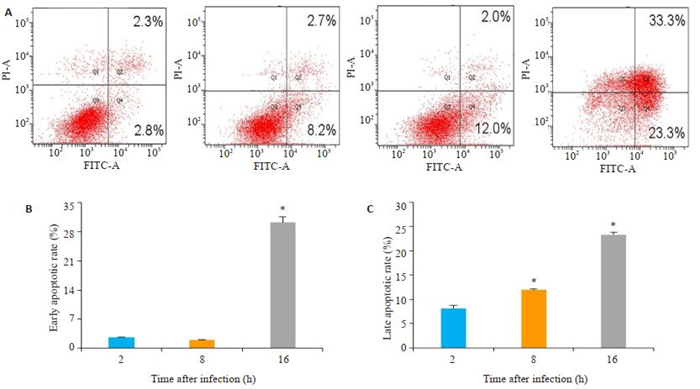
Hoechst 33342染色结果显示,与对照组比较,EV71感染组细胞核染色加深变亮,细胞核内染色质聚集,凋亡率均明显增高(图 3),在16 h时大部分细胞发生晚期凋亡或坏死脱落。通过流式细胞术进一步检测了EV71感染不同时间对THP-1巨噬细胞凋亡的影响,结果显示,与2 h比较,8 h和16 h感染组细胞凋亡率显著增加(图 4),细胞早期凋亡与晚期凋亡比较具有显著差异(P < 0.01)。
|
图 3 Hoechst 33342染色观察THP-1凋亡细胞核形态变化 Fig.3 The nuclearmorphological changes of THP- 1 apoptotic cells were detected by Hoechst 33342 staining method (×100). A: 0 h; B: 2 h; C: 8 h; D: 16 h |
|
图 4 流式细胞术分析THP-1巨噬细胞的凋亡率 Fig.4 THP-1 macrophage apoptosis rate analyzed by flow cytometry. A-C: Apoptotic rate of THP-1 cells infected with EV71 by. *P < 0.01 vs the 2 h group |
通过Western blot检测自噬相关蛋白表达结果显示,与0 h对比,EV71感染2、8和16 h组LC3转化量(LC3-Ⅱ/LC3-Ⅰ)逐渐增多,而p62蛋白表达水平逐渐减少(图 5),差异具有统计学意义(P < 0.01),表明EV71感染可以诱导THP-1巨噬细胞发生自噬。
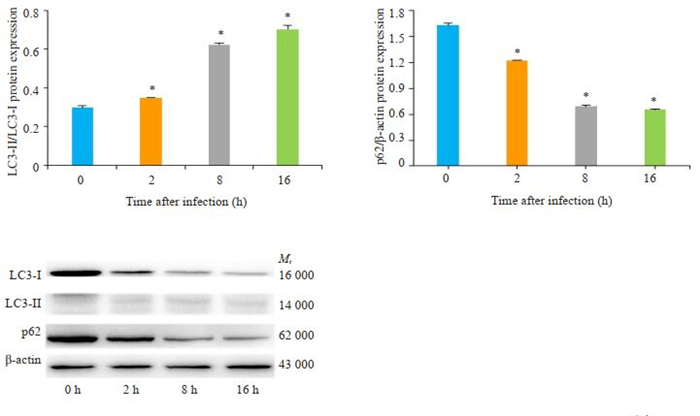
|
图 5 Western blot分析EV71对THP-1巨噬细胞的LC3和p62蛋白表达的影响 Fig.5 Western blot analyzed the expression of p62 and LC3in THP-1 macrophages infected with EV71. A: Changes in LC3-II/LC3-I in THP-1 cells. B: Changes in p62 protein expression in THP-1 cells. C: LC3/p62 signal protein expression bands detected by Western blotting. *P < 0.01 vs the 0 h group |
通过Western blot检测自噬相关蛋白表达结果显示,与PBS+EV71对比,3-MA预先孵育THP-1巨噬细胞2 h,EV71感染8 h时THP-1巨噬细胞内LC3转化量(LC3-Ⅱ/LC3-Ⅰ)减少,而EV71病毒感染8 h时p62蛋白表达水平增多(图 6),有显著差异(P < 0.01),表明3-MA能够抑制EV71病毒诱导THP-1巨噬细胞自噬。
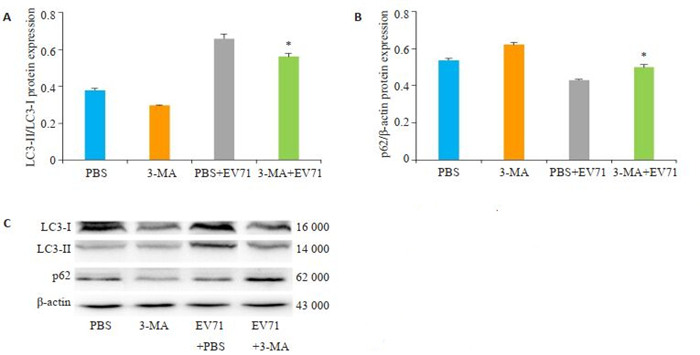
|
图 6 Western blot分析3-MA对EV71感染THP-1巨噬细胞内LC3和p62蛋白的影响 Fig.6 Western blot analyed the effects of 3-MA on LC3 and p62 proteins in THP-1 macrophages infected with EV71. A:Changes in LC3-II/LC3-I in THP-1 cells. B:Changes in p62 protein expression in THP-1 cells. C: LC3/p62 signal protein expression bands detected by Western blotting. *P < 0.01 vs the PBS+EV71 group |
通过Western blot检测细胞自噬相关蛋白表达结果显示,与0 h对比,EV71感染2、8和16 h时cleaved caspase3蛋白表达水平升高,caspase3和Bcl-2蛋白表达降低,差异有统计学意义(P < 0.01)。与0 h对比,EV71感染2、8和16 h时cleaved caspase-8、Bak蛋白和Bax蛋白差异无统计学意义(P>0.05)。
2.8 Ac-DEVD-CHO抑制EV71病毒诱导THP-1巨噬细胞的凋亡EV71感染8 h时,与DMSO对照组比较,AcDEVD-CHO组THP-1巨噬细胞凋亡无差异,凋亡率为6.5%和5.7%(P>0.05);DMSO+EV71组和Ac-DEVDCHO+EV71组的凋亡率为15.5%和7.7%,两组比较差异具有统计学意义(P < 0.01)。
3 讨论EV71可以激活细胞信号网络,包括多个细胞表面和细胞内受体、细胞内激酶、钙通量和调节抗病毒先天免疫和炎症反应的转录因子[15]。已知THP-1巨噬细胞被广泛用于研究单核/巨噬细胞功能、机制、信号通路以及营养和药物转运,并且成为评估单核细胞和巨噬细胞活性调节的模型[16]。另外有研究发现自噬和凋亡是多叶林素诱导THP-1细胞死亡的原因[17]。目前EV71作用THP-1自噬细胞的机制未完全阐明,需要进一步研究其具体信号通路。首先,本研究CCK-8试验检测结果显示EV71病毒作用THP-1巨噬细胞随着时间的延长而细胞存活率不断下降(表 1),说明EV71病毒作用可以损伤并阻止THP-1巨噬细胞增殖。荧光定量PCR检测EV71病毒作用THP-1巨噬细胞后病毒核酸随着时间的延长而不断增多(图 1),说明EV71病毒能够感染THP-1巨噬细胞并且不断复制。与Liao等[18]研究发现利用去甲肾上腺素和肾上腺素处理THP-1巨噬细胞后增加EV71病毒核酸复制的结论一致。另外,透射电镜检测EV71病毒感染THP-1巨噬细胞后在细胞内可见自噬小体和病毒颗粒(图 2),说明EV71病毒感染可以诱导THP- 1巨噬细胞自噬。Hoechst 33342染色和AnnexinV/PI双染法检测EV71病毒感染THP-1巨噬细胞8 h时明显可见细胞核染色质凝聚浓染,总细胞凋亡率不断增加(图 3),本研究结果与Li、Bai等[19-20]报道EV71诱导细胞凋亡的结论一致。从而推测EV71诱导THP-1巨噬细胞自噬和凋亡可能参与重症手足口病的过程,为进一步研究EV71发病机制奠定基础。
研究证实自噬基因家族在生理上具有多样性,一方面可以选择性地靶向诱导功能失调的细胞器、细胞内微生物和致病蛋白的自噬,从而维持内环境的稳定,另一方面其出现缺陷可能导致疾病的发生[21]。文献报道自噬可能是维持THP-1巨噬细胞HIV贮库的原因,而HIV病毒蛋白R可以通过上调自噬来促进巨噬细胞的存活[22]。实验结果显示,EV71病毒1感染THP-1巨噬细胞后LC3转化量(LC3-Ⅱ/LC3-Ⅰ)逐渐增加而p62蛋白逐渐减少(图 5),这与Wang等[23]研究EV71诱导Vero细胞自噬的结果相一致,证实EV71感染可以诱导THP-1巨噬细胞自噬。本研究再利用细胞早期自噬抑制剂3-MA验证,结果与对照组比较,LC3-Ⅱ/LC3-Ⅰ比值减少和p62蛋白增多(图 6),进一步说明EV71感染可以诱导THP-1巨噬细胞自噬的作用。有研究表明p62的稳定过表达显著抑制了登革热病毒复制[24]。而本实验结果显示p62减少可能是由于THP-1巨噬细胞对EV71产生自噬溶酶体降解的原因[25],从而促进自噬发生来保护细胞。这可能是因为不同病毒体外感染引起细胞内P62蛋白的改变和作用不一样,其具体机制还需进一步探讨。有研究报道EV71感染可诱导自噬发生来增强病毒在体内外的复制,而自噬可能以一种病毒特异性的方式起降解病毒或促进病毒复制的作用[26]。在本实验中利用电镜和免疫印迹可见EV71病毒感染后刺激THP-1巨噬细胞发生自噬,早期病毒复制增加不明显,但是晚期细胞自噬减少而病毒复制的明显增加促进THP-1巨噬细胞凋亡的发生,进一步揭示了EV71诱导THP-1巨噬细胞自噬的机制。
细胞凋亡是进化上保守的细胞死亡途径,在正常真核发育过程中负责细胞程序化选择和维持机体内稳态[27]。在不同信号触发的细胞凋亡进程中,线粒体的各种成分几乎都参与细胞凋亡,其中定位于线粒体膜上的Bcl-2蛋白家族具有重要作用[28]。研究结果说明EV71感染SH-SY5Y细胞后抑制凋亡蛋白Bcl-2的水平显著降低,但是细胞凋亡促进因子Bax、caspase-7和活性caspase-3显著升高[29]。还有文献报道称EV71利用其3C蛋白在caspase-3依赖性途径中诱导凋亡[30]。另外研究证明抗凋亡蛋白Bcl-X的过表达减少了EV71的病毒蛋白2B诱导的Cyt c释放和caspase激活[31]。本研究发现,随着感染时间的延长,Bcl-2和caspase-3不断减少,cleaved caspase-3不断增加,而cleaved caspase-8蛋白差异无统计学意义(图 7)。Song等[32]研究发现caspase-3抑制剂可保护宿主细胞,有利于防止EV71感染后病毒复制引起细胞病变作用和细胞周期停滞。本实验进一步用caspase-3抑制剂Ac-DEVD-CHO处理THP-1巨噬细胞后利用EV71病毒感染THP-1巨噬细胞,发现细胞总凋亡率比未处理组降低(图 8)。说明EV71感染THP-1巨噬细胞可能通过激活caspase凋亡途径诱导细胞凋亡。
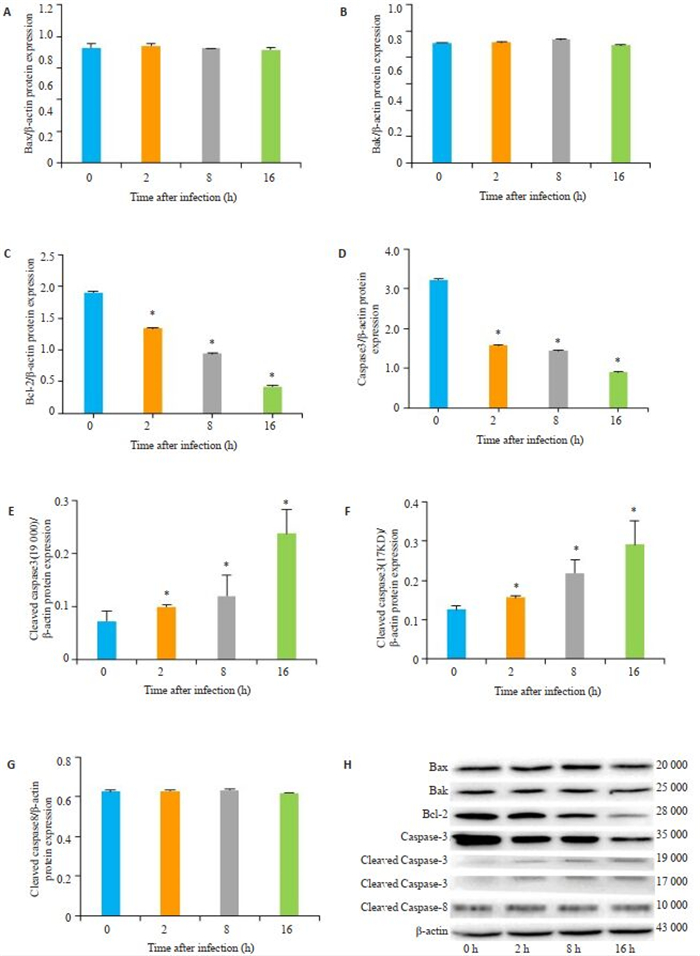
|
图 7 Western blot分析EV71对THP-1细胞线粒体凋亡蛋白的表达 Fig.7 Western blot analyed the expression of mitochondrial apoptotic protein in THP-1 cellsinfected with EV71. A-H:Caspasesignal protein expression bands detected by Western blotting. *P < 0.05 vs control group |
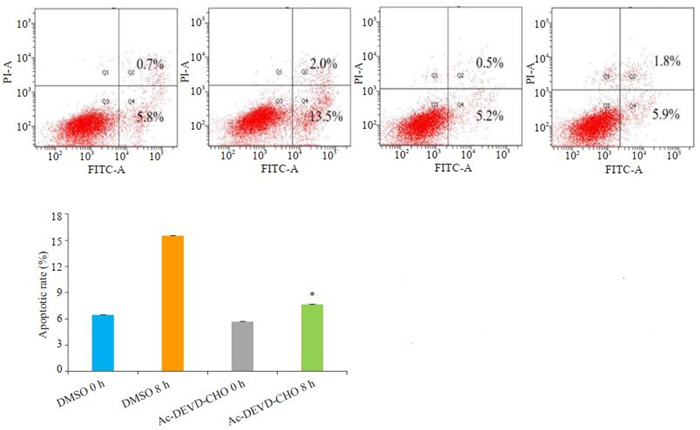
|
图 8 流式细胞术检测Ac-DEVD-CHO对EV71作用THP-1巨噬细胞的影响 Fig.8 Flow cytometry analyzed the effect of Ac-DEVD-CHO on EV71 infected THP-1 macrophages. *P < 0.01 vs the DMSO group |
总之,本研究证实EV71可以感染THP-1巨噬细胞,并且可能通过激活LC3/p62途径诱导细胞自噬和激活caspase途径诱导细胞凋亡,从而破坏宿主细胞免疫系统导致手足口病的发生。然而EV71诱导细胞自噬和凋亡的相互作用机制还未完全清楚,需要更多的研究来进一步阐明EV71感染致病的具体机制,为寻找新药物靶点和制定预防措施提供理论依据。
| [1] |
Baggen J, Thibaut HJ, Strating JRPM, et al. The life cycle of non-polio enteroviruses and how to target it[J]. Nat Rev Microbiol, 2018, 16(6): 368-81. DOI:10.1038/s41579-018-0005-4 |
| [2] |
Koh WM, Bogich T, Siegel K, et al. The epidemiology of hand, foot and mouth disease in Asia: a systematic review and analysis[J]. Pediatr Infect Dis J, 2016, 35(10): e285-e300. DOI:10.1097/INF.0000000000001242 |
| [3] |
Chang PC, Chen SC, Chen KT. The current status of the disease caused by Enterovirus 71 infections: epidemiology, pathogenesis, molecular epidemiology, and vaccine development[J]. Int J Environ Res Public Health, 2016, 13(9): E890. DOI:10.3390/ijerph13090890 |
| [4] |
Head JR, Collender PA, Lewnard JA, et al. Early evidence of inactivated Enterovirus 71 vaccine impact against hand, foot, and mouth disease in a major center of ongoing transmission in China, 2011-2018: a longitudinal surveillance study[J]. Clin Infect Dis, 2019, ciz1188. DOI:10.1093/cid/ciz1188 |
| [5] |
Messacar K, Spence-Davizon E, Osborne C, et al. Clinical characteristics of Enterovirus A71 neurological disease during an outbreak in children in Colorado, USA, in 2018: an observational cohort study[J]. Lancet Infect Dis, 2020, 20(2): 230-9. DOI:10.1016/S1473-3099(19)30632-2 |
| [6] |
Russell DG, Huang L, VanderVen BC. Immunometabolism at the interface between macrophages and pathogens[J]. Nat Rev Immunol, 2019, 19(5): 291-304. DOI:10.1038/s41577-019-0124-9 |
| [7] |
Nagata S, Tanaka M. Programmed cell death and the immune system[J]. Nat Rev Immunol, 2017, 17(5): 333-40. DOI:10.1038/nri.2016.153 |
| [8] |
Maiuri MC, Zalckvar E, Kimchi A, et al. Self-eating and selfkilling: crosstalk between autophagy and apoptosis[J]. Nat Rev Mol Cell Biol, 2007, 8(9): 741-52. DOI:10.1038/nrm2239 |
| [9] |
Liu JN, Li XY, Fan XX, et al. Adoptive transfer of macrophages from adult mice reduces mortality in mice infected with human Enterovirus 71[J]. Arch Virol, 2013, 158(2): 387-97. DOI:10.1007/s00705-012-1495-4 |
| [10] |
Jin J, Wang WB, Ai S, et al. Enterovirus 71 represses interleukin enhancer-binding factor 2 production and nucleus translocation to antagonize ILF2 antiviral effects[J]. Viruses, 2019, 12(1): E22. DOI:10.3390/v12010022 |
| [11] |
Yu P, Gao ZF, Zong YY, et al. Distribution of Enterovirus 71 RNA in inflammatory cells infiltrating different tissues in fatal cases of hand, foot, and mouth disease[J]. Arch Virol, 2015, 160(1): 81-90. DOI:10.1007/s00705-014-2233-x |
| [12] |
Wang SM, Chen IC, Su LY, et al. Enterovirus 71 infection of monocytes with antibody-dependent enhancement[J]. Clin Vaccine Immunol, 2010, 17(10): 1517-23. DOI:10.1128/CVI.00108-10 |
| [13] |
Peng NF, Yang XC, Zhu CL, et al. MicroRNA-302 cluster downregulates Enterovirus 71-induced innate immune response by targeting KPNA2[J]. J Immunol, 2018, 201(1): 145-56. |
| [14] |
Luo WY, Zhong JY, Zhao W, et al. Proteomic analysis of human brain microvascular endothelial cells reveals differential protein expression in response to Enterovirus 71 infection[J]. Biomed Res Int, 2015, 2015: 864169. |
| [15] |
Jin YF, Zhang RG, Wu WD, et al. Antiviral and inflammatory cellular signaling associated with Enterovirus 71 infection[J]. Viruses, 2018, 10(4): E155. DOI:10.3390/v10040155 |
| [16] |
Chanput W, Mes JJ, Wichers HJ. THP-1 cell line: an in vitro cell model for immune modulation approach[J]. IntImmunopharmacol, 2014, 23(1): 37-45. DOI:10.1016/j.intimp.2014.08.002 |
| [17] |
Liao YT, Wang SM, Chen SH. Anti-inflammatory and antiviral effects of minocycline in Enterovirus 71 infections[J]. Biomedecine Pharmacother, 2019, 118: 109271. DOI:10.1016/j.biopha.2019.109271 |
| [18] |
Liao YT, Wang SM, Wang JR, et al. Norepinephrine and epinephrine enhanced the infectivity of Enterovirus 71[J]. PLoS One, 2015, 10(8): e0135154. DOI:10.1371/journal.pone.0135154 |
| [19] |
Bai J, Chen X, Liu Q, et al. Characteristics of enterovirus 71-induced cell death and genome scanning to identify viral genes involved in virus-induced cell apoptosis[J]. Virus Res, 2019, 265: 104-14. DOI:10.1016/j.virusres.2019.03.017 |
| [20] |
Levine B, Kroemer G. Biological Functions of Autophagy Genes: A Disease Perspective[J]. Cell, 2019, 176(1-2): 11-42. DOI:10.1016/j.cell.2018.09.048 |
| [21] |
Zhou H, Zheng Y, He Y, et al. The role of autophagy in THP-1 macrophages resistance to HIV- vpr-induced apoptosis[J]. Exp Cell Res, 2017, 351(1): 68-73. DOI:10.1016/j.yexcr.2016.12.024 |
| [22] |
Wang H, Li K, Ma L, et al. Berberine inhibits enterovirus 71 replication by downregulating the MEK/ERK signaling pathway and autophagy[J]. Virol J, 2017, 14(1): 2. DOI:10.1186/s12985-016-0674-4 |
| [23] |
Metz P, Chiramel A, Chatel-Chaix L, et al. Dengue Virus Inhibition of Autophagic Flux and Dependency of Viral Replication on Proteasomal Degradation of the Autophagy Receptor p62[J]. J Virol, 2015, 89(15): 8026-41. DOI:10.1128/JVI.00787-15 |
| [24] |
Xi X, Zhang X, Wang B, et al. The interplays between autophagy and apoptosis induced by enterovirus 71[J]. PLoS One, 2013, 8(2): e56966. DOI:10.1371/journal.pone.0056966 |
| [25] |
Fu Y, Xu W, Chen D, et al. Enterovirus 71 induces autophagy by regulating has-miR-30a expression to promote viral replication[J]. Antiviral Res, 2015, 124: 43-53. DOI:10.1016/j.antiviral.2015.09.016 |
| [26] |
Singh R, Letai A, Sarosiek K. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins[J]. Nat Rev Mol Cell Biol, 2019, 20(3): 175-93. DOI:10.1038/s41580-018-0089-8 |
| [27] |
Bock F J, Tait S. Mitochondria as multifaceted regulators of cell death[J]. Nat Rev Mol Cell Biol, 2020, 21(2): 85-100. DOI:10.1038/s41580-019-0173-8 |
| [28] |
Du X, Wang H, Xu F, et al. Enterovirus 71 induces apoptosis of SHSY5Y human neuroblastoma cells through stimulation of endogenous microRNA let-7b expression[J]. Mol Med Rep, 2015, 12(1): 953-9. DOI:10.3892/mmr.2015.3482 |
| [29] |
Li M, Lin J, Chen B, et al. EV71 3C protease induces apoptosis by cleavage of hnRNP A1 to promote apaf-1 translation[J]. PLoS One, 2019, 14(9): e221048. DOI:10.1371/journal.pone.0221048 |
| [30] |
Cong H, Du N, Yang Y, et al. Enterovirus 71 2B Induces Cell Apoptosis by Directly Inducing the Conformational Activation of the Proapoptotic Protein Bax[J]. J Virol, 2016, 90(21): 9862-77. DOI:10.1128/JVI.01499-16 |
| [31] |
Song F, Yu X, Zhong T, et al. Caspase-3 Inhibition Attenuates the Cytopathic Effects of EV71 Infection[J]. Front Microbiol, 2018, 9: 817. DOI:10.3389/fmicb.2018.00817 |
 2020, Vol. 40
2020, Vol. 40

