既往多项研究表明,双相情感障碍(BD)患者不论是急性期还是情绪稳定期均存在生物节律紊乱[1-3],即睡眠觉醒节律异常、入睡困难、睡眠时长异常,活动饮食不规律及伴发阻塞性睡眠呼吸暂停综合征等,不仅损害双相情感障碍患者在缓解期的社会功能[4],还会增加双相情感障碍复发的风险[5-6],提示生物节律紊乱是双相情感障碍重要生物学标志。视交叉上核(SCN)是哺乳动物中节律控制中心[7-9],其背内侧作为输出部分,主要传出至室旁核,丘脑,外侧下丘脑背内侧,纹状体以及室旁核上区[10],整体通路调节机体生物节律,如体温、睡眠、清醒、运动活动和皮质类固醇生产[11]。
虽然证实SCN参与生物节律的病理生理过程[12-14],但尚未有报道应用影像学技术来研究双相情感障碍生物节律异常的机制,也没有研究探索节律相关指标是否可作为双相情感障碍分类指标。本研究利用静息态磁共振生物节律中心视交叉上核脑通路功能连接数据和无监督机器学习,旨在揭示双相情感障碍患者视交叉上核功能连接是否存在异常,并探讨SCN功能连接(FC)值是否可作为双相情感障碍生物亚型分类的生物指标。
1 对象和方法 1.1 研究对象本研究共纳入138名双相情感障碍患者和150名正常对照,所有研究对象均来自于四川大学华西医院心理卫生中心。患者入组标准:16≤年龄≤60岁,汉族,右利手(根据根据Annett利手问卷[15]评定结果),符合DSM-IV-TR中双相情感障碍的诊断标准,包括各个时相期患者(抑郁发作,轻躁狂发作,混合发作以及躁狂发作,情绪平稳相)。排除患有脑器质性疾病、神经系统疾病及严重的内分泌或代谢性疾病者及不能完成核磁工作扫描者。正常对照入组标准:16≤年龄≤60岁,汉族,右利手,具有良好的社会功能(能正常上班、上学、非病退),具有完全行为能力及责任能力。正常对照排除标准:患有精神疾病、躯体器质性疾病,精神病家族史阳性,服用过精神类药物或(和)6月内接受连续的药物治疗及不能完成磁共振扫描。所有受试均在纳入时签署知情同意书,未成年(< 18岁)受试的知情同意书由本人及其法定监护人共同签署。本研究符合赫尔辛基宣言并由四川大学华西医院伦理委员会批准。
1.2 方法 1.2.1 临床评估精神专科医生经过规范化培训并通过一致性检验后,对临床初步诊断为双相情感障碍的患者和正常健康受试者进行全面系统的精神检查,分别采用美国精神疾病诊断与统计手册第四版轴I障碍临床定式访谈,病人版(SCID-I/P)[16]及美国精神疾病诊断与统计手册第四版轴I障碍临床定式访谈,非病人版(SCID-I/ NP)[17]进行诊断。并收集所有被试的一般信息及临床资料。采用17项汉密尔顿抑郁量表(HDRS)[18]和杨氏躁狂量表(YMRS)[19]评估双相情感障碍患者症状严重程度。
1.2.2 静息态脑功能磁共振图像采集及处理 1.2.2.1 磁共振图像采集所有研究对象均采用飞利浦3.0特斯拉磁共振成像系统采集脑磁共振数据,即结构高分辨T1加权及T2加权图像扫描数据。具体扫描参数设置如下:重复时间(repetition time,TR)=2000 ms,回波时间(echo time,TE)=3.711ms,矩阵(Matrix Size,MS)=256×256,翻转角(Flip angle,FA)=7°,视野(field of view, FOV)=256×256 mm2,扫描层数=38,体素大小=1×1×1 mm3。静息态核磁共振扫描中,冠状、矢状、轴状位三个方向的平移头动(translation)不超过2 mm,或绕三个轴的转动(rotation)不超过2°(数据预处理时剔除头动超过2 mm的数据)。
1.2.2.2 磁共振数据预处理在基于Matlab 2013b(MathWorks,Natick,MA,USA)的平台上,使用SPM12(Statistical Parametric Mapping, Wellcome Department of Imaging Neuroscience, London; http://www.fil.ion.ucl.ac.uk/spm)和DPARSF(DPARSF 4.4, http://rfmri.org/DPARSF)[20]对脑磁共振数据进行分析处理。预处理的步骤如下:手动去除前10个时间点的数据,进行头动校正、空间标准化和去线性漂移,将频率限制在0.01~0.08 Hz。
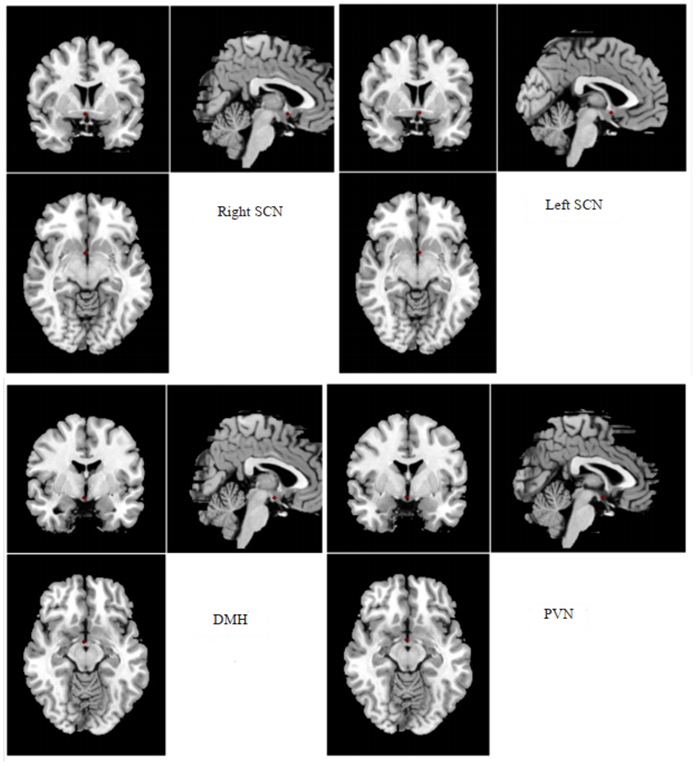
1.2.3 计算静息态功能连接值以视交叉上核(sSCN)传出通路脑区为感兴趣区(ROI)。右侧视交叉上核脑区:以x=3、y=5、z=-8为坐标原点,2 mm为半径的球形区域;左侧视交叉上核脑区:以x=-2、y=5、z=-8为坐标原点,2 mm为半径的球形区域[21-22]。下丘脑室旁核(PVN):以x=2.2、y=-1.4、z=-12.3为坐标原点,2 mm为半径的球形区域;下丘脑背内侧核(DMH):以x=3.2、y=-3.0、z=-12.0为坐标原点,2 mm为半径的球形区域[23]。提取以上脑区及丘脑的时间序列平均值,分别将左右视交叉上核与室旁核、下丘脑背内侧核及左右丘脑进行相关分析,使用Fisher Z变换将相关系数转化成FC值。
1.3 统计分析 1.3.1 一般人口学资料及临床资料分析使用SPSS22.0软件对一般人口学资料及FC值进行统计分析。符合正态分布且方差齐者使用独立样本t检验或协方差分析进行组间比较;不符合正态分布的采用非参数检验。采用卡方检验对患者及正常对照组的性别差异进行检验。计量资料均采用均数±标准差进行表示。所有检验均采用双侧检验,P < 0.05为差异有统计学意义。
1.3.2 基于FC值的K-means聚类分析使用基于Python 3.7.1的Anaconda Navigator软件进行统计分析。提取与正常对照有差异的双相情感障碍患者左右视交叉上核与传出通路脑区的FC值,使用Scikit-learn 0.20.1中的主成分分析(PCA)和K-means对双相情感障碍患者聚类分析。通过网格搜索得出最高轮廓系数和最优聚类数,从而得到最终聚类结果。
2 结果 2.1 一般资料及临床评估分析结果本研究纳入双相情感障碍患者138例,正常受试150例。两组间在年龄、性别、教育年限和BMI上差异无统计学意义(表 1)。
| 表 1 受试一般资料及临床评估信息 Tab.1 Demographic data and rating scale scores of patients and controls |
与正常对照相比,双相情感障碍患者右侧视交叉上核与室旁核、右侧视交叉上核与下丘脑背内侧核、左侧视交叉上核与室旁核、左侧视交叉上核与下丘脑背内侧核功能连接增强,差异有统计学意义(P < 0.05,表 2、图 1)。
| 表 2 双相情感障碍患者和正常对照功能连接(z分)的比较 Tab.2 Comparison of FC between patients and controls |
|
图 1 感兴趣脑区(ROI)影像学资料 Fig.1 ROI of the suprachiasmatic nucleus (SCN), dorsomedial hypothalamic nucleus (DMH) and paraventricular nucleus of the hypothalamus (PVN). |
提取双相情感障碍4个差异脑区间(左侧视交叉上核与室旁核、左侧视交叉上核与下丘脑背内侧核、右侧视交叉上核与室旁核、右侧视交叉上核与下丘脑背内侧核)功能连接z值,使用无监督机器学习K-means的方法聚类。训练结果示:最佳K值为2,轮廓系数为0.49(图 1)。
亚组1和亚组2间性别、教育年限和BMI无显著统计学差异。两个亚组间病程、发病年龄、抑郁发作次数、躁狂及轻躁狂发作次数、HDRST、YMRST、首次发作形式、双相情感障碍亚型(亚组1:55/26/1,亚组2:41/14/1,P=0.503)差异无统计学意义(表 3)。
| 表 3 聚类亚组一般资料及临床评估信息 Tab.3 General data and clinical information of cluster subgroup |
本研究使用静息态磁共振对双相情感障碍患者视交叉上核功能连接进行了研究。研究发现:与正常对照相比,双相情感障碍患者视交叉上核与室旁核、与下丘脑背内侧核功能连接增强。且基于FC值,使用无监督机器学习K-means的方法可将双相情感障碍分成两个亚组,轮廓系数为0.49。
双相情感障碍患者视交叉上核与室旁核和下丘脑背内侧功能连接异常,可能是和视交叉上核结构功能相关。1972年一系列关键实验证实视交叉上核(SCN)接收了传入下丘脑的大部分视网膜神经束信号[7, 24],而SCN的病变会导致活动节律、饮食节律及昼夜节律的丧失[25-26],确定了视交叉上核是生物节律中心。SCN有三条传出通路[11],其中第三条通路是视交叉上核最主要传出通路,通过从SCN向上和向后拱起的组织柱,终止于下丘脑室旁核上区和下丘脑的背内侧核,室旁核上区背侧内的神经元是组织体温昼夜节律所必需的,而室旁核上区腹侧内的神经元则是睡眠-觉醒昼夜节律所必需的[27]。室旁核上区腹侧内神经元依次传递到背内侧核,而下丘脑背内侧核对产生睡眠和清醒的昼夜节律、静坐活动、进食和皮质类固醇的产生至关重要[28-31]。少量的SCN轴突也直接支配与调节进食、睡眠-觉醒周期和激素分泌如褪黑素和促肾上腺皮质激素释放激素(CRH)有关的区域。室旁核背侧部分的投射激活了连接至上段胸椎脊髓中间柱的神经元,上段胸椎脊髓中间柱神经元与控制松果体褪黑激素分泌的交感神经节前神经元连接[32-33],这一途径被认为是调节褪黑素周期的主要机制。以上研究表明视交叉上核与下丘脑室旁核、下丘脑室旁核上区及下丘脑背内侧核的连接通路是调节活动、饮食、昼夜节律及皮质醇激素分泌等生物节律的主要调节通路。因为下丘脑体积小,静息态MRI下丘脑室旁核的定位包括下丘脑室旁核、室旁核上区及其周边区域。综上所述,我们研究发现的双相情感障碍患者SCN脑通路功能连接异常,即是生物节律神经调节通路异常,为双相情感障碍患者生物节律紊乱提供神经生物学理论支持。
我们用基于节律通路脑功能连接数据,使用无监督机器学习方法在双相情感障碍中识别两种独特的表型(亚组1、亚组2),它们与DSM-IV双相情感障碍分类(BD I、BD II和BD-NOS)并不重叠。Mon等[34]也曾使用无监督机器学习方法分析患者神经认知数据,确定两种不同双相情感障碍的亚型,并可使用磁共振影像学数据进行识别,提示双相情感障碍可能存在两种生物学上截然不同的临床表型。既往无节律指标区分双相情感障碍的研究,但也有一些研究间接提示生物节律可作为识别双相情感障碍亚型的重要特征。一项双相情感障碍患者48周随访研究结果显示,伴有非24 h和不规则型睡眠-觉醒障碍的双相情感障碍患者更易出现病情复发[6],提示不同类型昼夜节律双相情感障碍患者可能有不同的结局。Bradley等[35]发现睡眠正常的双相情感患者认知功能与对照组没有差异,而睡眠异常的患者却有差异,认为双相情感障碍认知功能局限于双相睡眠异常患者。本结果也进一步提示生物节律是双相情感障碍潜在的生物标记物之一。
我们的研究表明,双相情感障碍患者视交叉上核与室旁核、下丘脑背内侧核功能连接的改变,可能是双相情感障碍患者生物节律紊乱的神经机制。SCN节律通路功能连接数据可将双相情感障碍分为两种亚型,提示生物节律是潜在的双相情感障碍的表型生物特征。
本研究也有一定局限,首先本研究因双相情感障碍病情特殊性未排除药物的影响,但患者即使在服用镇静催眠药物也存在睡眠-觉醒节律紊乱,更进一步说明双相情感障碍患者生物节律异常。其次本研究进行静息态磁共振功能连接分析时,对脑区的定位可能欠准确,因为下丘脑体积小,功能脑区较多,但本研究使用的脑区与既往研究一致。最后,本研究缺乏受试生物节律行为数据,在未来研究需进一步结合客观节律指标进一步论证。
| [1] |
Iyer A, Palaniappan P. Biological dysrhythm in remitted bipolar I disorder[J]. Asian J Psychiatr, 2017, 30: 218-24. DOI:10.1016/j.ajp.2017.05.012 |
| [2] |
Rosa AR, Comes M, Torrent C, et al. Biological rhythm disturbance in remitted bipolar patients[J]. Int J Bipol Disord, 2013, 1: 6. DOI:10.1186/2194-7511-1-6 |
| [3] |
Cardoso TD, Mondin TC, Reyes AN, et al. Biological Rhythm and Bipolar Disorder Twelve-Month Follow-Up of a Randomized Clinical Trial[J]. J Nerv Ment Dis, 2015, 203(10): 792-7. DOI:10.1097/NMD.0000000000000369 |
| [4] |
Giglio LM, Magalhaes PVS, Kapczinski NS, et al. Functional impact of biological rhythm disturbance in bipolar disorder[J]. J Psychiat Res, 2010, 44(4): 220-3. DOI:10.1016/j.jpsychires.2009.08.003 |
| [5] |
Gruber J, Miklowitz DJ, Harvey AG, et al. Sleep matters:Sleep functioning and course of illness in bipolar disorder[J]. J Affect Dis, 2011, 134(1-3): 416-20. DOI:10.1016/j.jad.2011.05.016 |
| [6] |
Takaesu Y, Inoue Y, Ono K, et al. Circadian rhythm sleep-wake disorders predict shorter time to relapse of mood episodes in euthymic patients with bipolar disorder:a prospective 48-week study[J]. J Clin Psychiatry, 2018, 79(1): 17m11565. DOI:10.4088/JCP.17m11565 |
| [7] |
Moore RY, Lenn NJ. A retinohypothalamic projection in the rat[J]. J Comparat Neurol, 1972, 146(1): 1-14. |
| [8] |
Stopa EG, Volicer L, Kuo LV, et al. Pathologic evaluation of the human suprachiasmatic nucleus in severe dementia[J]. J Neuropathol Experiment Neurol, 1999, 58(1): 29-39. DOI:10.1097/00005072-199901000-00004 |
| [9] |
Moore RY. Organization of the primate circadian system[J]. J Biolog Rhyth, 1993, 8(Supp): S3-9. |
| [10] |
Moore RY. Entrainment pathways and the functional organization of the circadian system[J]. Progress Brain Res, 1996, 111: 103-19. DOI:10.1016/S0079-6123(08)60403-3 |
| [11] |
Saper CB, Lu J, Chou TC, et al. The hypothalamic integrator for circadian rhythms[J]. Trend Neurosci, 2005, 28(3): 152-7. DOI:10.1016/j.tins.2004.12.009 |
| [12] |
Roybal K, Theobold D, Graham A, et al. Mania-like behavior induced by disruption of CLOCK[J]. Proceed Nation Acad Sci USA, 2007, 104(15): 6406-11. DOI:10.1073/pnas.0609625104 |
| [13] |
Mukherjee S, Coque L, Cao JL, et al. Knockdown of Clock in the ventral tegmental area through RNA interference results in a mixed state of mania and depression-like behavior[J]. Biolog Psychiat, 2010, 68(6): 503-11. DOI:10.1016/j.biopsych.2010.04.031 |
| [14] |
Enkhuizen J, Minassian A, Young JW. Further evidence for ClockΔ 19 mice as a model for bipolar disorder mania using cross-species tests of exploration and sensorimotor gating[J]. Behav Brain Res, 2013, 249: 44-54. DOI:10.1016/j.bbr.2013.04.023 |
| [15] |
Annett M. A classification of hand preference by association analysis[J]. Brit J Psychol, 1970, 61(3): 303-21. |
| [16] |
Spitzer RL, Gibbon M, Williams JB.User's guide for the Structured clinical interview for DSM-IV axis I disorders SCID-I: clinician version[M].American Psychiatric Pub 1997.
|
| [17] |
First M.Structured Clinical Interview for Axis I DSM-IV DisordersNon-Patient Ed-(SCID-I/NP, Version 2.0)[M].New York State Psychiatric Institute 1996.
|
| [18] |
Hamilton M. A rating scale for depression[J]. J Neurol Neurosurg Psychiat, 1960, 23: 56-62. DOI:10.1136/jnnp.23.1.56 |
| [19] |
Young RC, Biggs JT, Ziegler VE, et al. A rating scale for mania:reliability, validity and sensitivity[J]. Brit J Psychiat, 1978, 133: 429-35. DOI:10.1192/bjp.133.5.429 |
| [20] |
Chao GY, Yu FZ. DPARSF:A MATLAB roolbox for "Pipeline" data analysis of resting-state fMRI[J]. Front Syst Neurosci, 2010, 4: 13. |
| [21] |
Vimal RL, Pandey MU, Vimal LS, et al. Activation of suprachiasmatic nuclei and primary visual cortex depends upon time of day[J]. Eur J Neurosci, 2009, 29(2): 399-410. DOI:10.1111/j.1460-9568.2008.06582.x |
| [22] |
Tao S, Chattun MR, Yan R, et al. TPH-2 gene polymorphism in major depressive disorder patients with early-wakening symptom[J]. Front Neurosci, 2018, 12: 827. DOI:10.3389/fnins.2018.00827 |
| [23] |
Marc Baroncini PJ, Eglantine Balland, et al. MRI atlas of the human hypothalamus[J]. NeuroImage, 2012, 59(1): 168-80. DOI:10.1016/j.neuroimage.2011.07.013 |
| [24] |
Hendrickson AE, Wagoner N, Cowan WM. An autoradiographic and electron microscopic study of retino-hypothalamic connections[J]. Zeitschrift fur Zellforschung und mikroskopische Anatomie (Vienna, Austria:1948), 1972, 135(1): 1-26. DOI:10.1007/BF00307084 |
| [25] |
Moore RY, Eichler VB. Loss of a circadian adrenal corticosterone rhythm following suprachiasmatic lesions in the rat[J]. Brain Res, 1972, 42(1): 201-6. |
| [26] |
Stephan FK, Zucker I. Circadian rhythms in drinking behavior and locomotor activity of rats are eliminated by hypothalamic lesions[J]. Proceed Nation Acad Sci USA, 1972, 69(6): 1583-6. DOI:10.1073/pnas.69.6.1583 |
| [27] |
Lu J, Zhang YH, Chou TC, et al. Contrasting effects of ibotenate lesions of the paraventricular nucleus and subparaventricular zone on sleep-wake cycle and temperature regulation[J]. J Neurosci, 2001, 21(13): 4864-74. DOI:10.1523/JNEUROSCI.21-13-04864.2001 |
| [28] |
Chou TC, Scammell TE, Gooley JJ, et al. Critical role of dorsomedial hypothalamic nucleus in a wide range of behavioral circadian rhythms[J]. J Neurosci, 2003, 23(33): 10691-702. DOI:10.1523/JNEUROSCI.23-33-10691.2003 |
| [29] |
Bellinger LL, Bernardis LL, Mendel VE. Effect of ventromedial and dorsomedial hypothalamic lesions on circadian corticosterone rhythms[J]. Neuroendocrinol, 1976, 22(3): 216-25. |
| [30] |
Kalsbeek A, Drijfhout WJ, Westerink BH, et al. GABA receptors in the region of the dorsomedial hypothalamus of rats are implicated in the control of melatonin and corticosterone release[J]. Neuroendocrinol, 1996, 63(1): 69-78. |
| [31] |
Gold RM. Hypothalamic obesity:the myth of the ventromedial nucleus[J]. Science, 1973, 182(4111): 488-90. DOI:10.1126/science.182.4111.488 |
| [32] |
Vrang N, Larsen PJ, Mikkelsen JD. Direct projection from the suprachiasmatic nucleus to hypophysiotrophic corticotropin-releasing factor immunoreactive cells in the paraventricular nucleus of the hypothalamus demonstrated by means of Phaseolus vulgarisleucoagglutinin tract tracing[J]. Brain Res, 1995, 684(1): 61-9. |
| [33] |
Teclemariam MR, Ter GJ, Postema F, et al. Anatomical demonstration of the suprachiasmatic nucleus-pineal pathway[J]. J Comparat Neurol, 1999, 406(2): 171-82. |
| [34] |
Wu MJ, Mwangi B, Bauer IE, et al. Identification and individualized prediction of clinical phenotypes in bipolar disorders using neurocognitive data, neuroimaging scans and machine learning[J]. Neuro Image, 2017, 145(Pt B): 254-64. |
| [35] |
Bradley AJ, Anderson KN, Gallagher P, et al. The association between sleep and cognitive abnormalities in bipolar disorder[J]. Psychol Med, 2020, 50(1): 125-32. DOI:10.1017/S0033291718004038 |
 2020, Vol. 40
2020, Vol. 40

