2. 皖南医学院药物研发中心,安徽 芜湖 241002;
3. 活性生物大分子研究安徽省重点实验室,安徽 芜湖 241002;
4. 皖南医学院药物筛选与评价研究所,安徽 芜湖 241002
2. Drug Research & Development Center, Wannan Medical College, Wuhu 241002, China;
3. Anhui Province Key Laboratory of Active Biological Macromolecules, Wuhu 241002, China;
4. Research Institute for Pharmaceutical Screening & Evaluation, Wannan Medical College, Wuhu 241002, China
HER3与EGFR、HER2同属人跨膜酪氨酸激酶生长因子受体家族成员,其突变、表达上调及其信号通路的异常活化常可见于靶向EGFR、HER2单克隆抗体及酪氨酸激酶抑制剂治疗后耐药的非小细胞肺癌、头颈部鳞状细胞癌、乳腺癌等[1-5]。HER3由胞外区、跨膜区及胞内区3部分组成,胞外区为配体结合域,胞内域含有缺陷的酪氨酸激酶区以及C末端区域。当受体与配体-神经调节素(NRG)结合后两分子间或与另一分子该受体家族成员相互作用形成同源二聚体或异源二聚体[6]。二聚体的形成导致胞内酪氨酸激酶的活化及C末端区几个关键酪氨酸位点的磷酸化,进而激活PI3K-Akt和Ras-Erk等胞内信号通路,最终导致一系列与细胞增殖、生存和迁移等相关基因的表达[7]。因HER3无或较弱活性的酪氨酸激酶,目前靶向HER3的药物开发策略主要以抗体为主[8-10],但临床试验效果均不佳[11-15],可能与靶向部位选择不当有关。
二聚化是HER家族受体信号转导的共有关键步骤,而HER3 183-227aa(HER3Ⅰ)位于其胞外域Ⅰ区,结构上属于HER3二聚化界面区肽段[6],能否通过抗体结合该区域阻碍HER3参与的二聚体的形成,进而阻断其介导的信号通路,目前尚不清楚。本研究拟通过基因工程手段构建和表达重组抗原肽MVF-HER3Ⅰ,以此为抗原免疫大鼠制备特异性多克隆抗体,并鉴定该抗体的HER3靶向性。
1 材料和方法 1.1 材料pET21b和pET32a质粒(广东药科大学生命科学与生物制药学院李黄金教授惠赠);MCF7细胞系(中科院上海细胞库);大肠杆菌感受态细胞E.coli Rosetta(DE3)、E.coli DH5α、Pfu DNA聚合酶和神经调节素1β(NRG1β)(生工生物工程(上海)公司);NcoⅠ、NdeⅠ、HindⅢ和XhoⅠ(宝生物公司);DNA Marker、T4 DNA Ligase、异丙基硫代半乳糖苷(IPTG)、氨苄西林和蛋白A/G琼脂糖、Bradford法蛋白浓度测定试剂盒和Gelred核酸染料(碧云天生物技术有限公司);琼脂粉、四甲基联苯胺(3, 3ʹ, 5, 5ʹ-TMB)溶液(索莱宝科技有限公司)。磺酰罗丹明B(SRB)、弗氏不完全佐剂、胰蛋白胨、弗氏完全佐剂和酵母粉(默克公司);辣根过氧化物酶(HRP)标记的山羊抗大鼠IgG、DyLight 488标记的山羊抗大鼠IgG(合肥锐捷生物技术公司);兔抗人HER3抗体(CST);胎牛血清、MEM培养基、胰酶和化学发光液(Thermo);HiTrap脱盐柱和亲和层析介质(GE);可拆卸酶标板(Jet);SD大鼠(合肥大蜀山实验动物繁殖场);其他化学试剂为国产分析纯试剂。
1.2 方法 1.2.1 MVF-HER3Ⅰ表达质粒的构建与鉴定在NCBI数据库中检索HER3全长氨基酸序列(GenBank登录号:2065),结合HER3 3D结构,运用表位预测工具选择暴露于二聚化结构表面、易于接近且具有线性B细胞表位的肽段[6, 16],以GPSL四聚短肽为接头将其连接于MVF构建重组抗原肽MVF-HER3Ⅰ。参照大肠杆菌高频使用密码子进行全基因合成。设计含有酶切位点的引物,PCR法扩增目的基因。pET21b和目的基因经NdeⅠ和XhoⅠ双酶切及T4 DNA连接酶连接构建重组抗原肽单独表达重组质粒pET21b-MVF-HER3Ⅰ,目的基因和pET32a经NcoⅠ和HindⅢ双酶切后连接于载体自带硫氧环蛋白(Trx)基因片段后构建融合表达载体pET32a-Trx-MVF-HER3。引物和目的基因的合成及测序由商业公司进行,重组质粒的鉴定用双酶切法进行。
1.2.2 MVF-HER3Ⅰ原核表达将重组质粒pET32aTrx-MVF-HER3Ⅰ和pET-21b-MVF-HER3Ⅰ转化E.coli BL21(DE3)感受态细胞后,涂布于新制灭菌的LB固体培养基(含100 μg/mL氨苄西林)上,37 ℃培养16 h。随机挑取数个单菌落接种至新鲜LB液体培养基中(含有90 μg/mL氨苄西林),待菌体生长达对数期时,加入IPTG至终浓度为1 mmol/L,37 ℃诱导表达6 h。以12%聚丙烯酰胺凝胶电泳检测MVF-HER3Ⅰ原核表达情况。
1.2.3 Trx-MVF-HER3Ⅰ诱导时长的优化将上述可表达Trx-MVF-HER3Ⅰ的工程菌接种至液体LB培养基中(含有90 mg/L氨苄青霉素),37 ℃培养至对数生长期后,加入IPTG至终浓度为1.0 mmol/L诱导融合蛋白表达,收集相同重量第1、3、5、7、9、11 h的时间点菌体,以12%聚丙烯酰胺凝胶电泳结合Image J软件分析Trx-MVF-HER3Ⅰ表达情况和表达量。
1.2.4 Trx-MVF-HER3Ⅰ IPTG诱导浓度的优化表达Trx-MVF-HER3Ⅰ工程菌株于20 ℃、28 ℃和37 ℃培养至对数期后,分别加入至终浓度为0.1、0.3、0.5、0.7和1.0 mmol/L的IPTG,诱导表达6 h。离心收集等量菌体,以12%聚丙烯酰胺凝胶电泳检测不同温度条件下不同浓度IPTG对Trx-MVF-HER3Ⅰ表达的影响。
1.2.5 Trx-MVF-HER3Ⅰ诱导温度的优化在20、28、37 ℃条件下诱导培养7 h后,用含500 mmol/L NaCl,1 mmol/L EDTA的PBS(20 mmol/L,pH7.4)溶液重悬离心收集的菌体,冰浴中超声裂解菌体,裂解后的上清液和沉淀于离心后分开收集,Trx-MVF-HER3Ⅰ的表达形式用12%聚丙烯酰胺凝胶电泳检测。
1.2.6 MVF-HER3Ⅰ的纯化表达菌株在优化的培养诱导参数下培养后,离心并用PBS缓冲液重悬收集的菌体,超声破碎30 min,离心取上清,加入研细的硫酸铵细粉至终浓度为30%(m/v)沉淀粗提融合蛋白,重溶后用镍离子亲和层析纯化融合蛋白,利用融合蛋白序列上Trx和重组肽之间的肠激酶酶切位点,将纯化后的融合蛋白用肠激酶酶切,酶切产物再次进行镍离子亲和层析,目的肽穿透,带组氨酸标签的Trx保留在柱上。层析过程中及酶切前后均留样进行12%聚丙烯酰胺凝胶电泳检测。
1.2.7 MVF-HER3Ⅰ多克隆抗体的制备将纯化得到的MVF-HER3Ⅰ免疫大鼠制备多克隆抗体。首次免疫时,将等体积的弗氏完全佐剂和MVF-HER3Ⅰ(200 μg/只)溶液混合乳化后,于SD大鼠腹股沟皮下多点注射。首次免疫15 d后进行第2次免疫,用MVF-HER3Ⅰ溶液和弗氏不完全佐剂充分乳化后进行腹部皮下注射。约2周后,取少量血清,以ELISA法进行效价测定。当抗血清效价达到1:100 000,则从全血中分离抗血清备用。
1.2.8 抗MVF-HER3Ⅰ多克隆抗体效价测定根据参考文献所述方法进行抗MVF-HER3Ⅰ多克隆抗体效价测定[17]。首先将100 μL 5 mg/L的MVF-HER3Ⅰ溶液加入96孔酶标板的每孔中,4 ℃包被过夜后用5%脱脂奶粉封闭2 h,倍比稀释的大鼠抗血清按100 μL每孔(稀释比例从1:8000到1:1 024 000)、浓度从低到高依次加入,每组3个复孔,免疫前血清稀释方法同实验组,37 ℃孵育1 h。加入HRP标记的山羊抗大鼠IgG孵育1 h。在抗原包被、封闭、孵一抗和孵二抗的操作之间均用PBST洗板。最后用TMB显色和2 mol/L硫酸终止显色后,用酶标仪测定450 nm吸光度值A450 nm。S/N=A稀释抗血清/ A阴性对照组,当S/N≥2.5时判定为阳性。
1.2.9 抗MVF-HER3Ⅰ多克隆抗体抗原特异性鉴定纯化的MVF-HER3Ⅰ(1、2、4 μg)经12%聚丙烯酰胺凝胶电泳后转至PVDF膜,用大鼠抗MVF-HER3Ⅰ多克隆抗体为一抗,HRP标记的羊抗大鼠抗体为二抗,用化学发光液显影,检测抗MVF-HER3Ⅰ多克隆抗体能否结合MVF-HER3Ⅰ。
1.2.10 抗MVF-HER3Ⅰ多克隆抗体对非变性HER3的识别根据文献所述方法[18],将交联有蛋白A/G的琼脂糖凝胶颗粒分别与免疫前大鼠血清和免疫后血清4 ℃孵育2 h,PBS洗3次后,沉淀与新鲜MCF7细胞裂解液4 ℃孵育过夜,PBS洗4次,离心,沉淀加入适量Loading Buffer煮沸变性,样品经8%聚丙烯酰胺凝胶电泳后转膜,用商品化抗HER3抗体分析抗MVFHER3Ⅰ抗体能否结合非变性HER3。
1.2.11 激光共聚焦分析抗MVF-HER3Ⅰ多克隆抗体的细胞结合情况将HER3高表达细胞株MCF7细胞用4%多聚甲醛固定,经1% BSA封闭0.5 h后,依次加入50 mg/L大鼠抗MVF-HER3Ⅰ多克隆抗体和Dylight488标记的山羊抗大鼠IgG(1:200),以50 mg/L的免疫前大鼠多克隆抗体为对照,室温孵育30 min,PBS洗涤3次,DAPI染核,PBS洗涤3次,以激光共聚焦显微镜(Leica SP8)观察Anti-MVF-HER3Ⅰ抗体与MCF7细胞结合情况。
1.2.12 SRB法分析抗MVF-HER3Ⅰ多克隆抗体对MCF7细胞的增殖抑制作用将MCF7细胞按5000个/孔种入96孔板中。待细胞贴壁后分为3组,第一组加入含不同浓度纯化的免疫前大鼠多克隆抗体和5 μg/L的NRG1β的培养基作为阴性对照,第二组加入含不同浓度纯化的大鼠抗MVF-HER3Ⅰ多克隆抗体的培养基,第三组加入含不同浓度纯化的大鼠抗MVF-HER3 Ⅰ多克隆抗体和5 μg/L的NRG1β的培养基,共同孵育72 h,每组中所加抗体分为0、10、100、200和400 mg/L五个浓度小组,每小组3个复孔。72 h后,弃去培养基,经10%三氯醋酸固定及0.4% SRB染液染色后,每孔加入100 μL 10 mmol/L Tris溶液溶解染料,在540 nm波长处测定其吸光度值。
1.3 统计学分析数据用SPSS 20.0软件处理和分析,计量数据用均数±标准差表示,两实验组之间的差异分析采用t检验,P < 0.01为差异具有统计学意义。
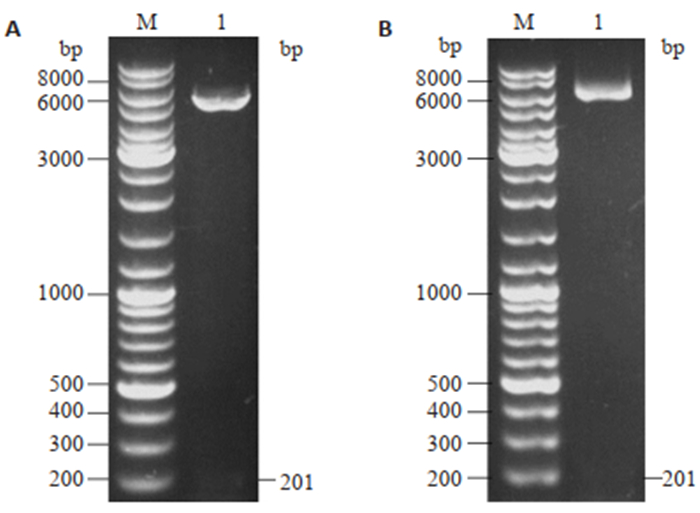
2 结果 2.1 MVF-HER3Ⅰ原核表达质粒的鉴定重组质粒pET32a-MVF-HER3Ⅰ和pET21b-MVFHER3Ⅰ使用与相应构建时相同的核酸内切酶双酶切,琼脂糖凝胶电泳结果显示,两种构建质粒酶切后均得到一大一小两个片段,小片段约201 bp,与MVF-HER3Ⅰ编码基因理论长度一致(图 1)。
|
图 1 重组质粒pET21b-MVF-HER3Ⅰ和pET32a-MVF-HER3Ⅰ的双酶切鉴定 Fig.1 Dual-restriction enzyme digestion map for pET21b-MVF-HER3 Ⅰ and pET32-Trx-MVF-HER3Ⅰ plasmid. A: M: DNA marker; 1: pET21b and MVF-HER3Ⅰ gene product; B: M: DNA marker; 1: pET32a and MVF-HER3Ⅰ gene product. |
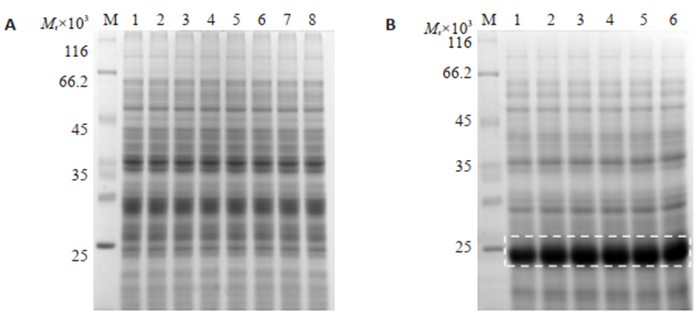
随机挑取的多株转化了pET32a-MVF-HER3Ⅰ或PET21b-MVF-HER3Ⅰ的工程菌经IPTG诱导后,用12%聚丙烯酰胺凝胶电泳分析,结果显示,构建于pET21b的MVF-HER3Ⅰ基因不能单独表达,但和Trx融合后可见明显的蛋白表达条带(图 2)。融合蛋白TrxMVF-HER3Ⅰ相对分子质量约为24 000和理论值一致。
|
图 2 MVF-HER3Ⅰ的原核融合表达 Fig.2 Bacterial expression of MVF-HER3Ⅰ protein. M: Protein marker; A: 1-8: whole cell proteins (WCP) of the induced pET21b-MVF-HER3Ⅰ positive clones; B: 1-6: WCP of the induced pET32a-Trx-MVF-HER3Ⅰ positive clones. |
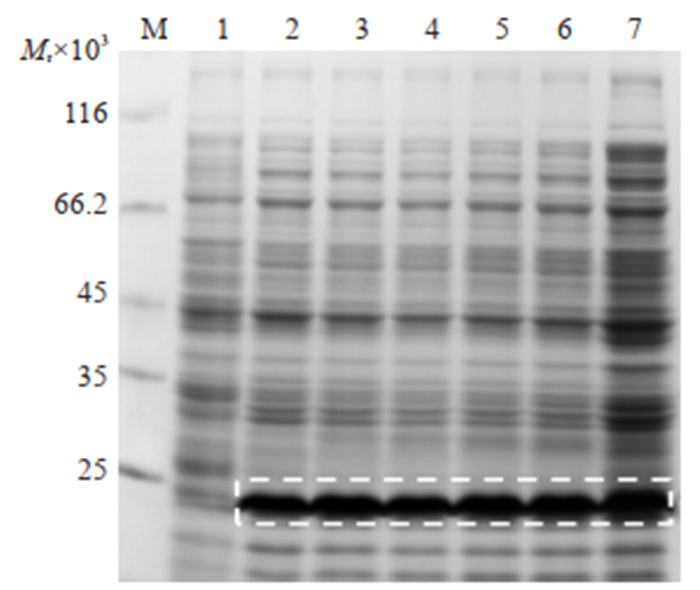
12%聚丙烯酰胺凝胶电泳结果表明,工程菌在培养温度为37 ℃,1 mmol/L IPTG诱导培养7 h时,对TrxMVF-HER3Ⅰ的表达量达峰值,约为20%(图 3)。据此确定工程菌在此条件下对Trx-MVF-HER3Ⅰ最优诱导表达时间为7 h。
|
图 3 MVF-HER3Ⅰ最适诱导时间的确定 Fig.3 Determination of optimal induction time for high yield of Trx-MVF-HER3Ⅰ protein. M: Protein marker; 1: Negative control; 2: WCP, 1 h; 3: WCP, 3 h; 4: WCP, 5 h; 5: WCP, 7 h; 6: WCP, 9 h; 7: WCP, 11 h. |
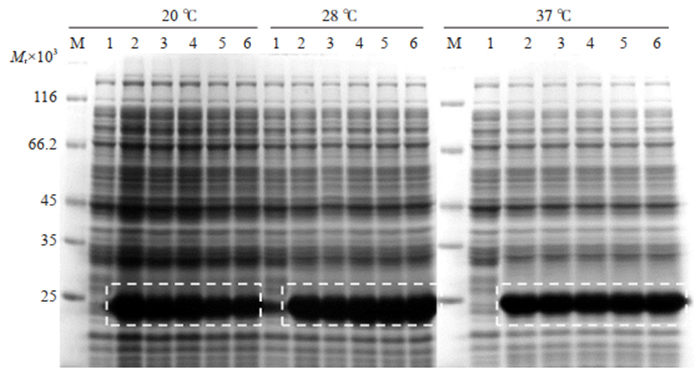
12%聚丙烯酰胺凝胶电泳结果表明,3个温度条件下不同IPTG浓度诱导的效果均较好,在诱导温度为37 ℃时、IPTG终浓度为0.1 mmol/L,目的蛋白相对表达量较高,诱导效果最佳(图 4)。
|
图 4 不同温度下Trx-MVF-HER3Ⅰ最适IPTG诱导浓度的确定 Fig.4 Determination of an optimal IPTG concentration under different temperature for high yield of Trx-MVF-HER3Ⅰ protein. M: Protein marker; 1: 0 mmol/L IPTG; 2: 0.1 mmol/L IPTG; 3: 0.3 mmol/L IPTG; 4: 0.5 mmol/L IPTG: 5: 0.7 mmol/L IPTG; 6: 1.0 mmol/L IPTG. |
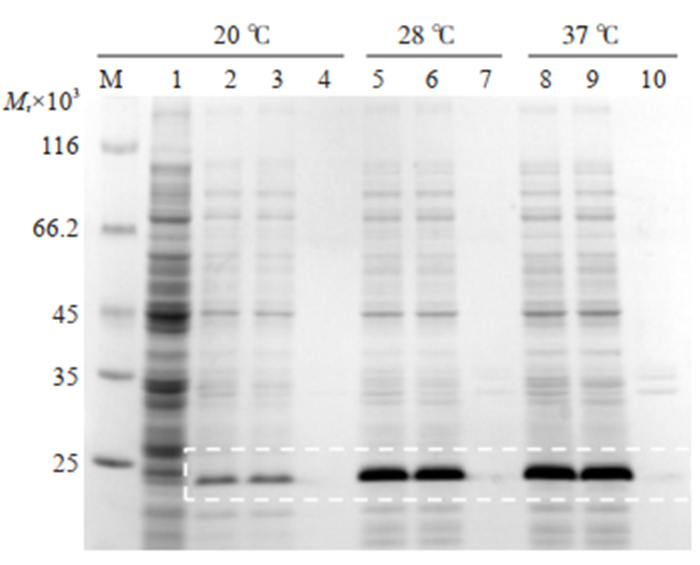
工程菌分别在20、28、37 ℃下诱导7 h后,目的蛋白均主要存在于菌体裂解上清中(图 5),Trx-MVF-HER3 Ⅰ融合蛋白呈可溶表达,37 ℃时目的蛋白相对表达量最高。
|
图 5 Trx-MVF-HER3Ⅰ最适诱导温度的确定 Fig.5 Determination of optimal induction temperature for high yield of Trx-MVF-HER3Ⅰ protein. M: Protein marker; 1: Negative control; 2: WCP (20 ℃); 3: supernatant (20 ℃); 4: pellet (20 ℃); 5: WCP (28 ℃); 6: supernatant (28 ℃); 7: pellet (28 ℃); 8: WCP (37 ℃); 9: supernatant (37 ℃); 10: pellet (37 ℃). |
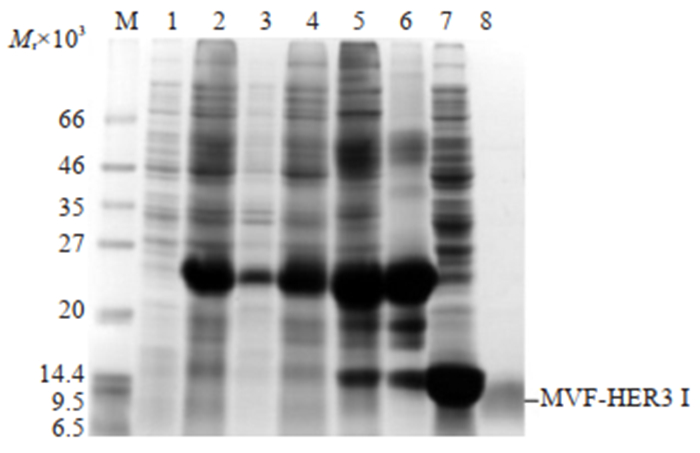
工程菌在最优条件下大量诱导培养后,菌体裂解上清经30%硫酸铵溶液沉淀、镍离子亲和层析、置换缓冲液、肠激酶酶切和再次亲和层析后得到纯化的重组肽。12%聚丙烯酰胺凝胶电泳结果显示,在相对分子质量7000左右呈单一条带,获得了具有较高纯度的MVFHER3Ⅰ(图 6)。脱盐及浓缩后,Bradford法测定纯化的MVF-HER3Ⅰ浓度为1.2 mg/mL。
|
图 6 Trx-MVF-HER3Ⅰ的酶切与纯化 Fig.6 Enzyme digestion and purification of Trx-MVF-HER3 Ⅰ protein. M: Protein marker; 1: Negative control; 2: WCP of induced cell; 3: Lysis precipitation; 4: Lysis supernatant; 5: Precipitated Trx-MVF-HER3 protein by 30% saturated ammonium sulfate solution; 6: Trx-MVF-HER3 Ⅰ; 7: Trx and other protein; 8: MVF-HER3Ⅰ. |
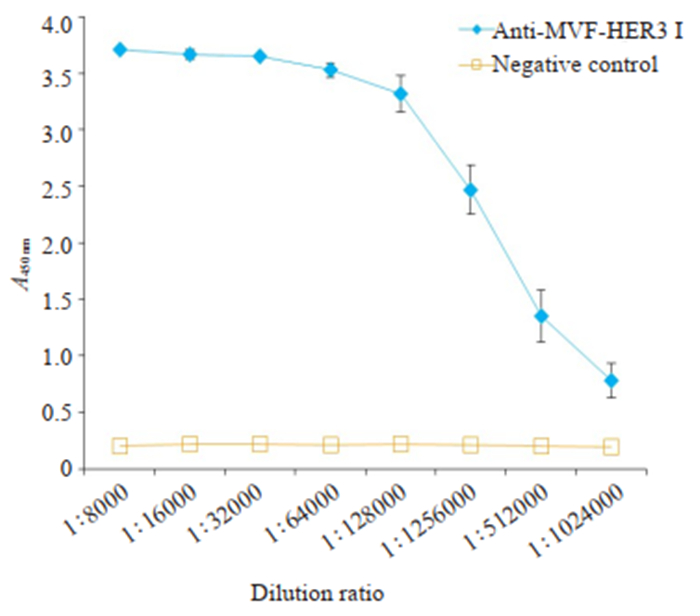
在大鼠用纯化的MVF-HER3Ⅰ为抗原进行第2次加强免疫后抗体滴度基本达到峰值时,取其全血制备抗血清。ELISA结果显示,当抗血清稀释倍数为512 000时,S/N值为2.95(图 7)。
|
图 7 抗MVF-HER3Ⅰ抗体效价 Fig.7 Analysis of anti-MVF-HER3 Ⅰ PcAb titer using ELISA. |
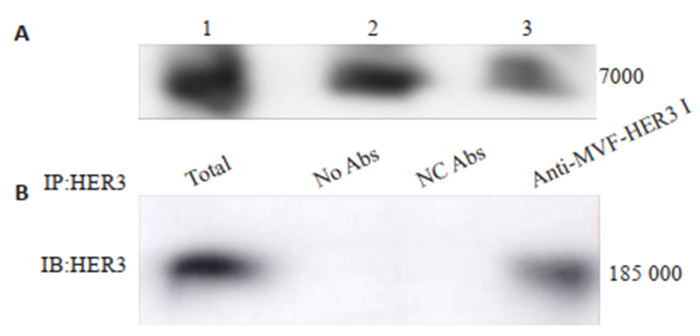
Immunoblotting实验结果显示,以抗MVF-HER3 Ⅰ多克隆抗体作为一抗可在相对分子质量为7000的MVF-HER3Ⅰ位置显现特异条带,条带灰度随MVFHER3Ⅰ转印量减少而减弱(图 8A)。IP结果显示,以HER3高表达的MC7细胞裂解总蛋白作为阳性对照,抗MVF-HER3Ⅰ抗体沉淀的蛋白可以被商品化的抗HER3抗体识别,呈现特异性条带,相对分子质量为185 000和理论值一致。无抗体和阴性抗体组没有条带。抗MVF-HER3Ⅰ抗体可特异性识别并沉淀天然状态的HER3蛋白(图 8B)。
|
图 8 抗MVF-HER3Ⅰ多克隆抗体识别重组抗原肽和沉淀非变性HER3 Fig.8 Analysis of the antigenic specificity of anti- MVF-HER3 Ⅰ PcAb. A: Western blotting for analyzing antigenic specificity of anti-MVF-HER3 Ⅰ PcAb against purified MVF-HER3 Ⅰ protein. 1: 0.8 μg MVF-HER3Ⅰ protein; 2: 0.4 μg MVF-HER3 Ⅰ protein; 3: 0.2 μg MVF-HER3Ⅰ protein; B: anti-MVF-HER3 Ⅰ PcAb precipitate native HER3 of MCF7 cells. |
用抗MVF- HER3 Ⅰ多克隆抗体为一抗,Dylight488标记山羊抗大鼠抗体为二抗,通过激光共聚焦显微镜观察和分析抗体与细胞结合情况。结果表明,与对照组相比,绿色荧主要分布于MCF7细胞的细胞膜上,抗MVF-HER3Ⅰ抗体可识别并结合细胞膜上的HER3(图 9)。
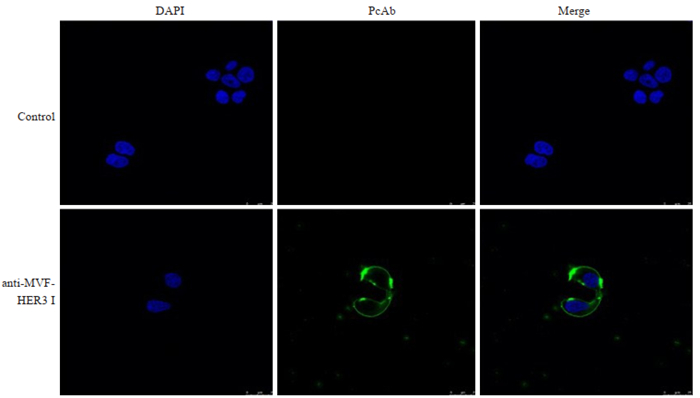
|
图 9 抗MVF-HER3Ⅰ多克隆抗体结合MCF7细胞膜上的HER3 Fig.9 Analysis of the binding capability of anti-MVF-HER3Ⅰ PcAb to HER3 on the membrane of MCF7 cells using laser scanning confocal microscope. |
SRB结果显示,和对照组相比,不管HER3配体NRG1β存在与否,抗MVF-HER3Ⅰ抗体均可呈浓度依赖性抑制HER3高表达细胞系MCF7细胞的增殖(P < 0.01,图 10)。
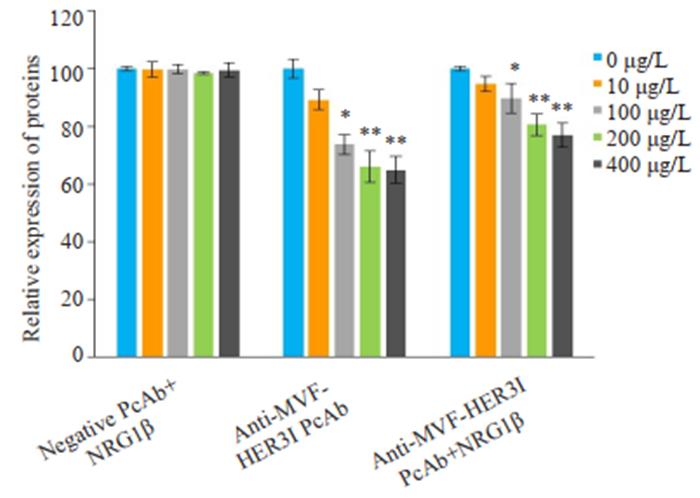
|
图 10 抗MVF-HER3Ⅰ多克隆抗体抑制MCF7细胞增殖 Fig.10 Anti-MVF-HER3 Ⅰ PcAb inhibits the growth of MCF7 cells. **P < 0.01, *P < 0.05 vs 0 μg/L PcAb treatment group. |
高表达的HER3与其他膜受体形成二聚体介导激活细胞旁路信号通路是抗EGFR、HER2治疗获得性耐药产生的重要机制之一,是潜在的药物治疗靶[19-21]。目前报道的靶向HER3的药物开发主要以抗体为主[9, 22],按其结合区域分主要有两类,一类是和配体竞争结合HER3配体结合区以阻断其信号通路[4, 8, 23];另外一类抗体,如LJM716在HER3没有结合配体时,通过结合由Ⅱ、Ⅳ区形成的构象表位,以阻止HER3二聚化所必须的构象的形成,进而阻断其信号通路[10]。尽管这两类抗体对HER3高表达和EGFR/HER2靶向药物耐药细胞株均表现出较好的抑制作用[24-26],但在临床试验中和对照组相比,并不能使相关指标得到改善[11-15]。有研究表明,NRG等HER3配体存在高水平的自分泌和旁分泌表达[27-28],造成抗体在与其竞争结合受体上存在劣势。同时HER3在结合配体后,空间构象改变,可能造成结合构象表位的LJM716类抗体脱靶。因此开发新的特异性高、不受配体影响且具有阻断HER3介导信号通路功能的靶点及抗体具有重要意义。
HER3 183-227aa肽段位于其二聚化界面区,无论配体结合与否都暴露于HER3胞外域表面,理论上靶向该区域的抗体可不受配体影响且可阻断HER3参与的二聚体的形成,目前尚无靶向该区域的相关研究。本研究使用在线B细胞表位预测工具发现该段具有线性B细胞表位,但是膜受体分子在物种间具有高度的结构保守性,且短肽一般免疫原性较弱,需要和特定载体融合构建融合抗原肽,以提高其免疫原性。MVF 288-302aa是含有经过验证的辅助T细胞表位的短肽[17, 29-30],本研究将其通过柔性四聚短肽接头GPSL和HER3Ⅰ融合构建了重组肽MVF-HER3Ⅰ。
重组肽MVF-HER3Ⅰ是由67个氨基酸组成,由于氨基酸残基较多,以现有的固相化学合成法制备该肽生产周期长、成本高且无法保证结构的完整性[31]。虽然基因工程法具有成熟、容易扩大生产,广泛被研究者用于制备功能蛋白[32],但也存在表达像MVF-HER3Ⅰ这类小肽时易于将其降解和下游纯化工作一般较为困难等问题[33-35]。为解决此问题,本研究把MVF-HER3Ⅰ基因与pET32a载体自带的可溶表达标签蛋白Trx及纯化标签His6基因连接,实现了可溶性高表达。尽管有Trx标签,但融合蛋白在工程菌中表达形式及表达量还受温度、IPTG浓度和诱导时间参数的影响,对这些参数的优化主要目的是提高蛋白表达量和便于后续纯化获得目的蛋白。原核表达优化实验表明,0.2 mmol/L的IPTG浓度,37 ℃诱导培养7 h是融合蛋白Trx-MVF-HER3Ⅰ的最优表达条件。我们利用His6标签及Trx与重组肽相交处的肠激酶酶切位点,通过亲和层析、酶切和再次亲和层析后获得了较高纯度的MVF-HER3Ⅰ重组肽,为后续免疫大鼠制备多克隆抗体打下基础。
ELISA和Immunobloting实验表明,经MVF-HER3Ⅰ免疫后的大鼠可产生滴度达1:512 000的MVF-HER3 Ⅰ特异性多克隆抗体,证明此重组肽具有良好的免疫原性。抗MVF-HER3Ⅰ抗体能否特异性结合天然状态的HER3,对以HER3 183-227aa区域为靶标,开发具有阻断HER3介导信号通路的功能抗体具有决定性作用。为此我们设计了IP和激光共聚焦实验,结果证实抗MVF-HER3Ⅰ多克隆抗体可特异性地与天然状态的HER3及MCF7细胞膜上的HER3特异结合,具有良好的HER3靶向性。SRB实验初步表明,不管是否有NRG1β刺激,抗MVF- HER3Ⅰ多克隆抗体对HER3高表达细胞MCF7都具有一定的增殖抑制作用。但作用较为温和,可能和纯化的大鼠血清抗体中能有效结合HER3的抗体相对量较少有关。
综上所述,本研究成功进行了MVF-HER3Ⅰ小分子重组肽的原核表达、纯化,为基因工程法高效制备小分子肽提供参考。用此法制备的MVF-HER3Ⅰ重组肽为抗原成功获得了可特异性结合HER3的大鼠多克隆抗体,为进一步研究其精确的靶向区域和对HER3介导的相关生物学功能的影响奠定了基础。
致谢:衷心感谢广东药科大学生命科学和生物制药学院李黄金教授在重组抗原肽的构建、原核表达和纯化方面给予的指导和无私帮助!
| [1] |
Maennling AE, Tur MK, Niebert M, et al. Molecular targeting therapy against EGFR family in breast cancer:progress and future potentials[J]. Cancers, 2019, 11(12): 1826-35. DOI:10.3390/cancers11121826 |
| [2] |
Chang YF, Lim KH, Chiang YW, et al. STAT3 induces G9a to exacerbate HER3 expression for the survival of epidermal growth factor receptor-tyrosine kinase inhibitors in lung cancers[J]. BMC Cancer, 2019, 19(1): 959-66. DOI:10.1186/s12885-019-6217-9 |
| [3] |
Husain H, Scur M, Murtuza A, et al. Strategies to overcome bypass mechanisms mediating clinical resistance to EGFR tyrosine kinase inhibition in lung cancer[J]. Mol Cancer Ther, 2017, 16(2): 265-72. |
| [4] |
Gala K, Chandarlapaty S. Molecular pathways:HER3 targeted therapy[J]. Clin Cancer Res, 2014, 20(6): 1410-6. DOI:10.1158/1078-0432.CCR-13-1549 |
| [5] |
Luhtala S, Staff S, Kallioniemi A, et al. Clinicopathological and prognostic correlations of HER3 expression and its degradation regulators, NEDD4-1 and NRDP1, in primary breast cancer[J]. BMC Cancer, 2018, 18(1): 1045-9. DOI:10.1186/s12885-018-4917-1 |
| [6] |
Zhang XW, Gureasko J, Shen K, et al. An allosteric mechanism for activation of the kinase domain of epidermal growth factor receptor[J]. Cell, 2006, 125(6): 1137-49. DOI:10.1016/j.cell.2006.05.013 |
| [7] |
Appert-Collin A, Hubert P, Crémel G, et al. Role of ErbB receptors in cancer cell migration and invasion[J]. Front Pharmacol, 2015, 6: 283-8. |
| [8] |
Mirschberger C, Schiller CB, Schräml M, et al. RG7116, a therapeutic antibody that binds the inactive HER3 receptor and is optimized for immune effector activation[J]. Cancer Res, 2013, 73(16): 5183-94. DOI:10.1158/0008-5472.CAN-13-0099 |
| [9] |
Jacob W, James I, Hasmann M, et al. Clinical development of HER3-targeting monoclonal antibodies:Perils and progress[J]. Cancer Treat Rev, 2018, 68: 111-8. DOI:10.1016/j.ctrv.2018.06.011 |
| [10] |
Garner AP, Bialucha CU, Sprague ER, et al. An antibody that locks HER3 in the inactive conformation inhibits tumor growth driven by HER2 or neuregulin[J]. Cancer Res, 2013, 73(19): 6024-35. DOI:10.1158/0008-5472.CAN-13-1198 |
| [11] |
Forster MD, Dillon MT, Kocsis J, et al. Patritumab or placebo, with cetuximab plus platinum therapy in recurrent or metastatic squamous cell carcinoma of the head and neck:A randomised phase Ⅱ study[J]. Eur J Cancer, 2019, 123: 36-9. DOI:10.1016/j.ejca.2019.08.017 |
| [12] |
Sequist LV, Gray JE, Harb WA, et al. Randomized phase Ⅱ trial of seribantumab in combination with erlotinib in patients with EGFR wild-type non-small cell lung cancer[J]. Oncologist, 2019, 24(8): 1095-2. DOI:10.1634/theoncologist.2018-0695 |
| [13] |
Reynolds KL, Bedard PL, Lee SH, et al. A phase I open-label doseescalation study of the anti-HER3 monoclonal antibody LJM716 in patients with advanced squamous cell carcinoma of the esophagus or head and neck and HER2-overexpressing breast or gastric cancer[J]. BMC Cancer, 2017, 17(1): 646-53. DOI:10.1186/s12885-017-3641-6 |
| [14] |
Hill AG, Findlay MP, Burge ME, et al. Phase Ⅱ study of the dual EGFR/HER3 inhibitor duligotuzumab (MEHD7945A) versus cetuximab in combination with FOLFIRI in second-Line RAS wild-type metastatic colorectal cancer[J]. Clin Cancer Res, 2018, 24(10): 2276-4. DOI:10.1158/1078-0432.CCR-17-0646 |
| [15] |
Cejalvo JM, Jacob W, Fleitas T, et al. A phase Ib/Ⅱ study of HER3-targeting lumretuzumab in combination with carboplatin and paclitaxel as first-line treatment in patients with advanced or metastatic squamous non-small cell lung cancer[J]. ESMO Open, 2019, 4(4): e000532-9. DOI:10.1136/esmoopen-2019-000532 |
| [16] |
Geuijen CAW, de Nardis C, Maussang D, et al. Unbiased combinatorial screening identifies a bispecific IgG1 that potently inhibits HER3 signaling via HER2-guided ligand blockade[J]. Cancer Cell, 2018, 33(5): 922-36. DOI:10.1016/j.ccell.2018.04.003 |
| [17] |
Miller MJ, Foy KC, Overholser JP, et al. HER-3 peptide vaccines/mimics:combined therapy with IGF-1R, HER-2, and HER-1 peptides induces synergistic antitumor effects against breast and pancreatic cancer cells[J]. Oncoimmunology, 2014, 3(11): e000532-9. |
| [18] |
Nadège G, Ali Abdul H, Maicol M, et al. Examination of HER3 targeting in cancer using monoclonal antibodies[J]. Proc Natl Acad Sci USA, 2015, 112(3): 839-4. DOI:10.1073/pnas.1423645112 |
| [19] |
Lyu H, Han A, Polsdofer E, et al. Understanding the biology of HER3 receptor as a therapeutic target in human cancer[J]. Acta Pharm Sin, 2018, 8(4): 503-10. DOI:10.1016/j.apsb.2018.05.010 |
| [20] |
Vlacich G, Coffey RJ. Resistance to EGFR-targeted therapy:a family affair[J]. Cancer Cell, 2011, 20(4): 423-5. DOI:10.1016/j.ccr.2011.10.006 |
| [21] |
Arteaga CL, Engelman JA. ERBB receptors:from oncogene discovery to basic science to mechanism-based cancer therapeutics[J]. Cancer Cell, 2014, 25(3): 282-303. DOI:10.1016/j.ccr.2014.02.025 |
| [22] |
Liu XL, Liu S, Lyu H, et al. Development of effective therapeutics targeting HER3 for cancer treatment[J]. Biol Proced Online, 2019, 21: 5-12. DOI:10.1186/s12575-019-0093-1 |
| [23] |
Schoeberl B, Faber AC, Li DN, et al. An ErbB3 antibody, MM-121, is active in cancers with ligand-dependent activation[J]. Cancer Res, 2010, 70(6): 2485-94. DOI:10.1158/0008-5472.CAN-09-3145 |
| [24] |
Yonesaka K, Hirotani K, Kawakami H, et al. Anti-HER3 monoclonal antibody patritumab sensitizes refractory non-small cell lung cancer to the epidermal growth factor receptor inhibitor erlotinib[J]. Oncogene, 2016, 35(7): 878-86. DOI:10.1038/onc.2015.142 |
| [25] |
Wang D, Qian G, Zhang H, et al. HER3 targeting sensitizes HNSCC to cetuximab by reducing HER3 activity and HER2/HER3 dimerization:evidence from cell line and patient-derived xenograft models[J]. Clin Cancer Res, 2017, 23(3): 677-6. DOI:10.1158/1078-0432.CCR-16-0558 |
| [26] |
Watanabe S, Yonesaka K, Tanizaki J, et al. Targeting of the HER2/HER3 signaling Axis overcomes ligand-mediated resistance to trastuzumab in HER2-positive breast cancer[J]. Cancer Med, 2019, 8(3): 1258-68. DOI:10.1002/cam4.1995 |
| [27] |
Yonesaka K, Iwama E, Hayashi H, et al. Heregulin expression and its clinical implication for patients with EGFR-mutant non-small cell lung cancer treated with EGFR-tyrosine kinase inhibitors[J]. Sci Rep, 2019, 9(1): 19501-10. DOI:10.1038/s41598-019-55939-5 |
| [28] |
Baro M, Lopez SC, Burtness BA, et al. Neuregulin signaling is a mechanism of therapeutic resistance in head and neck squamous cell carcinoma[J]. Mol Cancer Ther, 2019, 18(11): 2124-4. DOI:10.1158/1535-7163.MCT-19-0163 |
| [29] |
Foy KC, Miller MJ, Overholser J, et al. IGF-1R peptide vaccines/mimics inhibit the growth of BxPC3 and JIMT-1 cancer cells and exhibit synergistic antitumor effects with HER-1 and HER-2 peptides[J]. Oncoimmunology, 2014, 3(11): e956005-13. DOI:10.4161/21624011.2014.956005 |
| [30] |
Zhu L, Zhao L, Wu MZ, et al. B-cell epitope peptide vaccination targeting dimer interface of epidermal growth factor receptor (EGFR)[J]. Immunol Lett, 2013, 153(1/2): 33-40. |
| [31] |
Stráner P, Taricska N, Szabó M, et al. Bacterial expression and/or solid phase peptide synthesis of 20-40 amino acid long polypeptides and miniproteins, the case study of Class B GPCR ligands[J]. Curr Protein Pept Sci, 2016, 17(2): 147-55. DOI:10.2174/1389203716666151102105215 |
| [32] |
彭亮, 区静怡, 潘嘉韵, 等. 奇异变形杆菌聚磷酸盐激酶多克隆抗体的制备和鉴定[J]. 南方医科大学学报, 2017, 37(3): 312-6. |
| [33] |
Yoo S, Zhang S, Kreutzer AG, et al. An efficient method for the expression and purification of Aβ(M1-42)[J]. Biochemistry, 2018, 57(26): 3861-6. DOI:10.1021/acs.biochem.8b00393 |
| [34] |
Wu MZ, Zhao L, Zhu L, et al. Expression and purification of chimeric peptide comprising EGFR B-cell epitope and measles virus fusion protein T-cell epitope in Escherichia coli[J]. Protein Expr Purif, 2013, 88(1): 7-12. DOI:10.1016/j.pep.2012.11.010 |
| [35] |
Rahman I, Fang L, Wei Z, et al. Highly efficient soluble expression and purification of recombinant human basic fibroblast growth factor (hbFGF) by fusion with a new collagen-like protein (Scl2) in Escherichia coli[J]. Prep Biochem Biotechnol, 2020, 6: 1-9. |
 2020, Vol. 40
2020, Vol. 40

