2. 陆军第74集团军医院超声诊断科,广东 广州 510318
2. Department of Ultrasound Diagnosis, 74th Army Group Hospital, Guangzhou 510318, China
弓形虫(Toxoplasma gondii)是一种细胞内寄生原虫,可感染人类和其他温血动物[1]。弓形虫速殖子可以感染人的白细胞并随着血液到达全身各处,造成机会性弓形虫病[2]。弓形虫感染刺激免疫细胞产生IL-12和γ-IFN等细胞因子,通过促进强烈的Th1反应在抗弓形虫感染中起关键作用[3]。弓形虫速殖子调控宿主细胞的免疫及凋亡,从而在宿主细胞内大量增殖并造成扩散[4]。
外泌体是一类由细胞分泌的直径在30~150 nm的细胞外小囊泡[5],在正常的生理过程中发挥着介导细胞间通讯的重要功能,还能够调节宿主-病原体的相互作用,参与传染性、炎性和神经性疾病及癌症等多种疾病的病理过程[6]。外泌体含有丰富的具生物标志物潜力的物质[7],如小RNA和蛋白质,可用于监测临床状态、治疗反应、疾病进展,还有发展成临床药物递送载体的潜力[8]。外泌体在寄生虫-宿主互作中也起重要作用[9]。DC2.4是小鼠骨髓来源的树突状细胞,可以高效率的对抗原进行摄取、加工及递呈[10];还能有效激活初始T细胞,启动、调控、维持免疫应答[11]。piRNA主要存在于哺乳动物的生殖细胞和干细胞中,调控其生长发育,通过与Piwi亚家族蛋白结合形成piRNA复合物(piRC)来调控基因沉默途径[12-15]。
已有文献对弓形虫外泌体及其调控功能做了详细分析,发现弓形虫感染后调控宿主细胞外泌体的分泌,影响宿主细胞的细胞周期和增殖[16-17],弓形虫来源的外泌体对宿主的免疫调控也有报道[18-19],而对于外泌体中piRNA的研究尚未见报道。本研究以小鼠树突状细胞DC2.4为细胞模型,分析弓形虫感染调控宿主细胞外泌体中piRNA的差异表达,及其对宿主细胞免疫的作用和作为感染标志物的可能性,为弓形虫感染的致病机制和诊断研究提供重要信息。
1 材料和方法 1.1 材料 1.1.1 细胞系和弓形虫虫株HFF细胞和DC2.4细胞以及弓形虫RH野生型均由本实验室保存。
1.1.2 试剂DMEM基础培养基、RPMI 1640基础培养基、0.25% Trypisin-EDTA (Gibco)、胎牛血清(Gibco)。1×PBS缓冲液、庆大霉素、青霉素/链霉素等(北京鼎国昌盛生物技术有限责任公司)。
1.1.3 仪器Nu-5810E型CO2细胞培养箱、SW-CJ-II型超净工作台、冷冻离心机Universal32R、MDF-382E超低温冰箱、OLYMPUS CS21正置显微镜、HITACHI高速离心机、HITACHI超高速离心机、Hitachi 7650透射电子显微镜、Nanosight NS500纳米颗粒追踪仪。
1.2 方法 1.2.1 弓形虫RH虫株的培养通过在HFF中连续传代维持弓形虫RH虫株。HFF细胞系于含有10%胎牛血清和1%青霉素/链霉素/庆大霉素的DMEM完全培养基中,在37 ℃,5%CO2恒温培养箱中培养。
1.2.2 DC2.4细胞的培养DC2.4细胞于含有10%无外泌体胎牛血清和1%青霉素/链霉素/庆大霉素的RPMI 1640完全培养基中,在37 ℃,5%CO2恒温培养箱中培养。
1.2.3 无外泌体胎牛血清的制备通过以100 000×g过夜超速离心胎牛血清,取上层的90%分离液通过0.22 μm的滤膜过滤,即可获得无外泌体的胎牛血清。
1.2.4 弓形虫RH虫株感染DC2.4细胞将RH野生型弓形虫虫株在HFF细胞中培养至细胞被裂解,经过抽吸、过滤、计数后,对DC2.4细胞进行感染复数为3的弓形虫感染,感染时间为28 h。
1.2.5 外泌体的提取收集细胞上清液,将上清液转移到50 mL离心管中,在4 ℃下以300×g离心10 min,保留上清液,在4 ℃下以2000×g离心20 min。这两个步骤是为了去除细胞和细胞碎片。然后将上清液收集并在4 ℃下10 000×g离心30 min。将上清液用0.22 μm过滤器过滤。在4 ℃下以100 000×g超速离心1 h,丢弃上清液,将沉淀重悬于1 mLPBS中,并在4 ℃以100 000×g再次超速离心1 h以收集外泌体。弃上清液,将含有外泌体的沉淀物重悬于100 μL PBS中,用0.22 μm过滤器过滤,保存在-80 ℃用于下一步实验。
1.2.6 外泌体的形态学鉴定将提取好的外泌体样品滴在铜网上。2 min后,用滤纸从铜网边缘擦去多余的液体。然后将磷钨酸(3%,pH7.0)逐滴加入到铜网中,2 min后,用滤纸从铜网边缘擦去多余的液体。最后,将纯水滴到铜网上,然后用滤纸从铜网边缘擦去多余的水。在空气中干燥后,将准备好的铜网在透射电子显微镜下观察,检测外泌体形态。
1.2.7 外泌体的粒径大小检测使用Nanosight NS500仪器进行纳米追踪分析(NTA),是基于直接检测和可视化悬浮液中各个纳米颗粒的技术,提供关于颗粒的大小、浓度和分布的信息。通过从激光源散射的光跟踪粒子,并且随时间计算路径以确定由于布朗运动引起的速度。
1.2.8 外泌体小RNA测序由华大基因完成,通过数据处理得到可信的RNA序列,对其进行序列长度分布的统计及样品间序列统计、分类注释,获得各样品中包含的RNA种类及数量信息。
1.2.9 piRNA的生物信息学分析采用miRanda和Targetscan软件对piRNA进行靶基因预测,并对得到的靶基因进行关键调控基因分析(Key Driver Analysis,KDA)以及Kyoto Encyclopedia of Genes and Genomes (KEGG)分析。
2 结果 2.1 感染与未感染弓形虫的DC2.4细胞外泌体形态鉴定及比较外泌体作为一种细胞外囊泡亚群,有着特属的粒径大小,以及特殊的囊泡结构,以在纳米级别观察到茶托状结构作为形态学的鉴定,所以本文采用了Hitachi 7650透射电镜,在加速电压80 kv,放大倍数10~30 k进行拍摄。首先,从感染或未感染弓形虫RH虫株,约7.52×108个DC2.4细胞的培养上清液中提取外泌体。在实验组中,在感染后28 h后,从RH株(MOI=3)感染的DC2.4细胞培养上清液中提取外泌体。对照组则是在培养28 h后,从DC2.4细胞培养物中提取的外泌体。透射电镜结果分析表明这些囊泡具有完整的连续双层膜,直径约为100 nm (图 1),在大视野和小视野都可以清晰的观察到外泌体的经典茶托状结构,由此可以证明外泌体被成功提取,而对比实验组和对照组中的外泌体形态可以发现,弓形虫感染与否对细胞分泌的外泌体形态没有可观察到的影响。
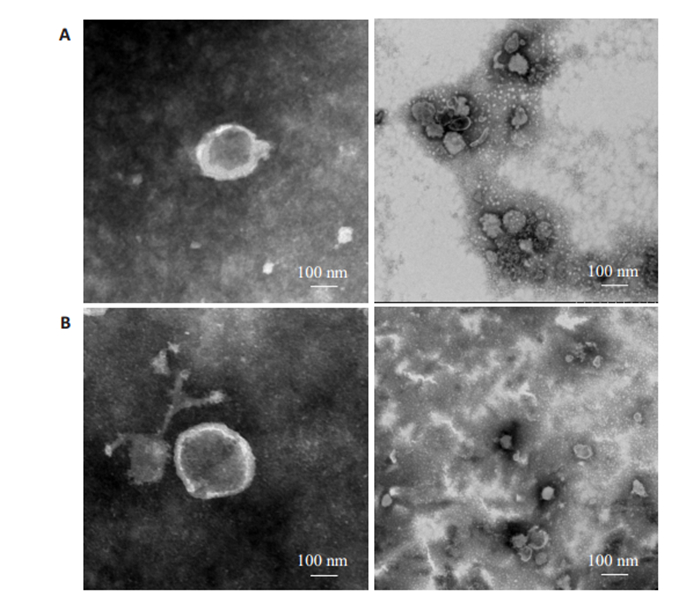
|
图 1 外泌体形态学鉴定图 Fig.1 Morphological identification of exosomes secreted by DC2.4 cells with and without Toxoplasma gondii infection under a Hitachi 7650 projection electron microscope. A: Infection group; B: Control group. |
纳米颗粒跟踪分析(NTA)是一种可以用于确定囊泡大小的技术,用来鉴定外泌体粒径大小。NTA结果如图 2,外泌体的大小达到平均直径为50~200 nm的峰值,常规而言,水合粒直径的尺寸会略微大于外泌体在电镜下的测量尺寸,即大于30~150 nm而接近于50~ 200 nm。通过对比实验组和对照组,我们发现实验组的外泌体颗粒密度比对照组高;即在同等条件下,弓形虫感染的DC2.4细胞分泌的外泌体颗粒数更多。
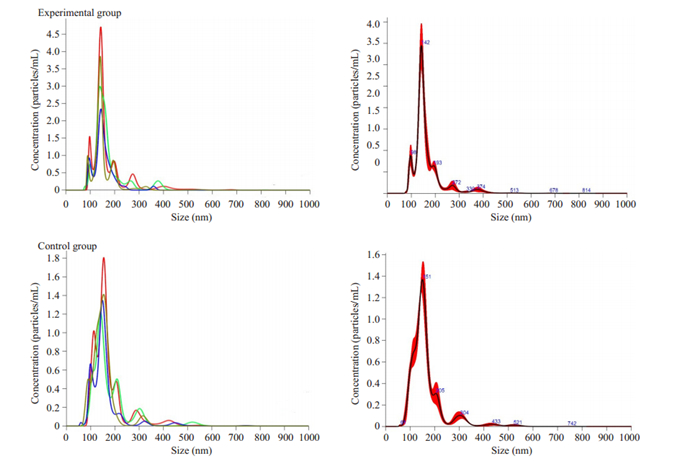
|
图 2 纳米颗粒追踪分析结果图 Fig.2 Nanoparticle tracking analysis of the exosomes secreted by DC2.4 cells with and without Toxoplasma gondii infection. The average values were obtained after 4 adjustments to the field of view of the instrument. |
通过对弓形虫感染与否的DC2.4细胞分泌的外泌体进行小RNA组高通量测序,得到小RNA在外泌体中的数目统计表(表 1)。对比小RNA组的数量,可以发现在感染组中,外泌体内富集的小RNA数目增加。
| 表 1 弓形虫感染组与正常对照组DC2.4细胞外泌体检测到的小RNA数 Tab.1 Number of small RNAs detected in the exosomes of DC2.4 cells with and without Toxoplasma infection |
通过对比弓形虫感染组和实验对照组的piRNA数据,筛选出各生物重复样本中差异倍数稳定且倍数大于2的piRNA。结果共筛选出5个感染与未感染组水平差异显著的piRNA (表 2)。
| 表 2 筛选出的差异表达的piRNA Tab.2 Differentially expressed piRNA screened in the exosomes from DC2.4 cells with and without Toxoplasma gondii infection |
通过miRanda和Targetscan软件对筛选出的piRNA进行靶基因预测,对得到的3869个靶基因进行关键驱动因素分析(KDA,Key Driver Analysis),结果显示Sema6a、Plxna3、Nrp1、Pxn、Src、Dlg4、Dlgap1、Notch1、Acvt2a、Bmp8a等11个基因是处于调控关键节点的靶基因(图 3)。
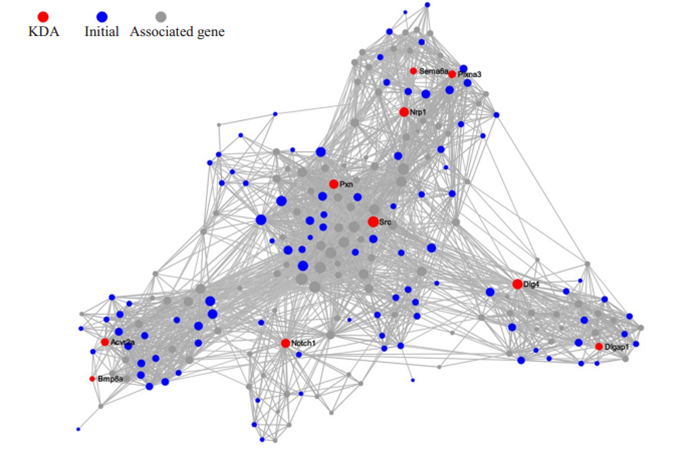
|
图 3 KDA分析结果图 Fig.3 Key driver analysis of the 3869 target genes showing 11 target genes at the key nodes. |
根据KEGG-pathway注释分类,使用R软件中的phyper函数进行富集分析,计算P值,然后对P值进行FDR校正,以FDR≤0.01的功能视为显著富集(图 4)。这些靶基因显著富集到的信号通路包括MAPK、Ras、cAMP、actin细胞骨架调节、粘着斑形成、轴突导向等信号通路。
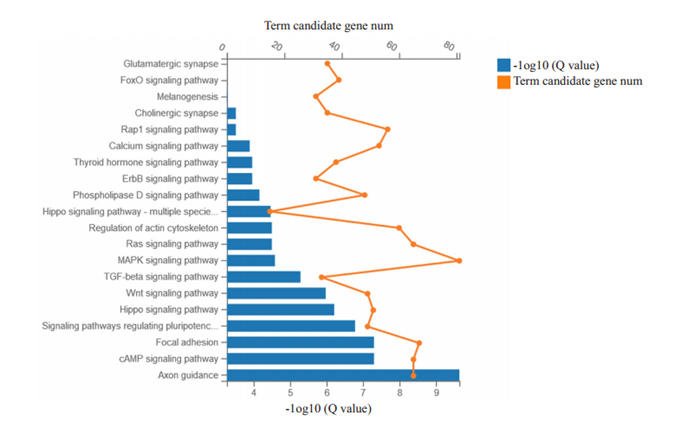
|
图 4 靶基因的KEGG-pathway注释分类 Fig.4 Target gene aggregation map obtained by KEGG pathway annotation classification of the 3869 target genes. |
DC2.4属于树突状细胞细胞系,是免疫系统中最有效的抗原提呈细胞,可以存在于所有外周血及组织中,能进行抗原摄取和加工[10]。作为免疫系统的哨兵,树突状细胞向T细胞呈递抗原并调节T淋巴细胞进行免疫应答,而弓形虫的感染以及DC2.4细胞外泌体也和免疫系统息息相关[20-22]。已经发现弓形虫抗原处理的细胞分泌的外泌体会引发宿主细胞的增殖和周期发生变化[17]。也有研究发现弓形虫相关的外泌体在免疫调节中起作用[18]。
宿主细胞感染弓形虫28 h后,弓形虫在宿主细胞内大量增殖,并且大量的弓形虫物质分泌到宿主细胞内,参与宿主细胞的调控,因而此阶段对弓形虫感染致病过程十分重要[23]。我们用弓形虫感染DC2.4细胞28 h后,对感染与未感染弓形虫的DC2.4细胞进行外泌体提取,通过透射电镜的形态学鉴定,我们发现DC2.4细胞分泌的外泌体的形态与弓形虫感染无太大关联。而经过纳米颗粒追踪鉴定,我们发现由于弓形虫的感染,会导致DC2.4细胞分泌的外泌体在同样提取的条件下密度升高。在对外泌体的小RNA进行高通量测序后,我们发现感染组的外泌体富集的小RNA数比未感染组高,这表明弓形虫感染可能通过外泌体途径将自身的一些小RNA分泌出细胞,或者是由于弓形虫的感染导致DC2.4细胞外泌体富集的小RNA组发生变化的结果。
已有文献报道弓形虫外泌体RNA组的研究[24],而对于外泌体中piRNA的研究还未见报道。作为小RNA组的一员,piRNA的研究很少,2006年首次报道了piRNA在生殖细胞中启动免疫应答及基因沉默的作用[25]。piRNA通路被认为是维持动物基因组完整性的一种重要的通路,piRNA能够区分敌我,启动应答[26]。piRNA沉默转座子的功能是人们目前唯一了解的部分[27]。本研究首次报道了弓形虫感染导致宿主细胞分泌的外泌体piRNA的变化。对在弓形虫感染DC2.4细胞后,所分泌的外泌体中含量显著变化的piRNA,我们进行生物信息学分析,结果提示我们这些piRNA存在沉默转座子的功能,可能在弓形虫调控宿主的过程中起着重要作用。
外泌体在细胞间通讯中起着不可或缺的作用[28],我们的研究结果显示弓形虫感染后DC2.4细胞分泌的外泌体尺寸峰值增大和密度增加,miRNA及piRNA数目增加,以及外泌体内富集的piRNA的变化及其在细胞免疫中的作用,提示外泌体在弓形虫-宿主细胞互作过程中起着重要作用,为探究弓形虫入侵、细胞免疫调节的机制提供新的实验数据和信息,具有重要价值。
| [1] |
Hou Z, Liu D, Su S, et al. Comparison of splenocyte microRNA expression profiles of pigs during acute and chronic toxoplasmosis[J]. BMC Genomics, 2019, 20(1): 97. DOI:10.1186/s12864-019-5458-y |
| [2] |
Courret N, Darche S, Sonigo P, et al. CD11c- and CD11b-expressing mouse leukocytes transport single Toxoplasma gondii tachyzoites to the brain[J]. Blood, 2006, 107(1): 309-316. DOI:10.1182/blood-2005-02-0666 |
| [3] |
Benson A, Pifer R, Behrendt CL, et al. Gut commensal bacteria direct a protective immune response against Toxoplasma gondii[J]. Cell Host Microbe, 2009, 6(2): 187-196. DOI:10.1016/j.chom.2009.06.005 |
| [4] |
Conseil V, Soête M, Dubremetz JF. Serine protease inhibitors block invasion of host cells by Toxoplasma gondii[J]. Antimicrob Agents Ch, 1999, 43(6): 1358-61. DOI:10.1128/AAC.43.6.1358 |
| [5] |
Bobrie A, Colombo M, Krumeich S, et al. Diverse subpopulations of vesicles secreted by different intracellular mechanisms are present in exosome preparations obtained by differential ultracentrifugation[J]. J Extracell Vesicles, 2012, 1(1): 18397. DOI:10.3402/jev.v1i0.18397 |
| [6] |
Yan X, Yan Z, Han Y. RRP42, a subunit of exosome, plays an important role in female gametophytes development and mesophyll cell morphogenesis in Arabidopsis[J]. Front Plant Sci, 2017, 8: 981. DOI:10.3389/fpls.2017.00981 |
| [7] |
Skotland T, Ekroos K, Kauhanen D, et al. Molecular lipid species in urinary exosomes as potential prostate cancer biomarkers[J]. Eur J Cancer, 2017, 70: 122-32. DOI:10.1016/j.ejca.2016.10.011 |
| [8] |
Liu T, Mendes DE, Berkman CE. Functional prostate-specific membrane antigen is enriched in exosomes from prostate cancer cells[J]. Int J Oncol, 2014, 44(3): 918-22. DOI:10.3892/ijo.2014.2256 |
| [9] |
Twu O, De MN, Lustig G, et al. Trichomonas vaginalis exosomes deliver cargo to host cells and mediate host:parasite interactions[J]. PLoS Pathog, 2013, 9(7): e1003482. DOI:10.1371/journal.ppat.1003482 |
| [10] |
Xia W, Pinto CE, Kradin RL. The antigen-presenting activities of Ia+ dendritic cells shift dynamically from lung to lymph node after an airway challenge with soluble antigen[J]. J Exp Med, 1995, 181(4): 1275-83. DOI:10.1084/jem.181.4.1275 |
| [11] |
Aghdami N, Gharibdoost F, Moazzeni SM. Experimental autoimmune encephalomyelitis (EAE) induced by antigen pulsed dendritic cells in the C57BL/6 mouse: influence of injection route[J]. Exp Anim, 2008, 57(1): 45-55. |
| [12] |
A G, R S, Gj H, et al. A germline-specific class of small RNAs binds mammalian Piwi proteins[J]. Nature, 2006, 442(7099): 199-202. DOI:10.1038/nature04917 |
| [13] |
Brennecke J, Al E. Discrete small RNA-generating loci as master regulators of transposon activity in Drosophila[J]. Cell, 2007, 128(6): 1089-103. DOI:10.1016/j.cell.2007.01.043 |
| [14] |
Houwing S, Kamminga LM, Berezikov E, et al. A Role for Piwi and piRNAs in germ cell maintenance and transposon silencing in zebrafish[J]. Cell, 2007, 129(1): 69-82. DOI:10.1016/j.cell.2007.03.026 |
| [15] |
Moyano M, Stefani G. piRNA involvement in genome stability and human cancer[J]. J Hematol Oncol, 2015, 8: 38. DOI:10.1186/s13045-015-0133-5 |
| [16] |
Długońska H, Gatkowska J. Exosomes in the context of Toxoplasma gondii-host communication[J]. Ann Parasitol, 2016, 62(3): 169-74. |
| [17] |
Minjae K, Bongkwang J, Jaeeun C, et al. Exosomes secreted by Toxoplasma gondii-infected L6 cells: their effects on host cell proliferation and cell cycle changes[J]. Korean J Parasitol, 2016, 54(2): 147-54. DOI:10.3347/kjp.2016.54.2.147 |
| [18] |
Li Y, Xiu F, Mou Z, et al. Exosomes derived from Toxoplasma gondii stimulate an inflammatory response through JNK signaling pathway[J]. Nanomedicine (Lond), 2018, 13(5): 2018. |
| [19] |
Li Y, Liu Y, Xiu F, et al. Characterization of exosomes derived from Toxoplasma gondii and their functions in modulating immune responses[J]. Int J Nanomedicine, 2018, 13: 467-77. DOI:10.2147/IJN.S151110 |
| [20] |
Aline F, Bout D, Amigorena S, et al. Toxoplasma gondii antigenpulsed-dendritic cell-derived exosomes induce a protective immune response against T. gondii infection[J]. Infect Immun, 2004, 72(7): 4127-37. DOI:10.1128/IAI.72.7.4127-4137.2004 |
| [21] |
Garg R, Shrivastava P, Van D L-V DHS. The role of dendritic cells in innate and adaptive immunity to respiratory syncytial virus, and implications for vaccine development[J]. Expert Rev Vaccines, 2012, 11(12): 1441-57. DOI:10.1586/erv.12.117 |
| [22] |
Kim JO, Jung SS, Kim SY, et al. Inhibition of Lewis lung carcinoma growth by Toxoplasma gondii through induction of Th1 immune responses and inhibition of angiogenesis[J]. J Korean Med Sci, 2007, 22(Suppl): S38. DOI:10.3346/jkms.2007.22.S.S38 |
| [23] |
Boothroyd J. The Phosphoproteomes of Plasmodium falciparum and Toxoplasma gondii reveal unusual adaptations within and beyond the parasites' boundaries[J]. Cell Host Microbe, 2011, 10(4): 410-9. DOI:10.1016/j.chom.2011.09.004 |
| [24] |
Pope SM, Lässer C. Toxoplasma gondii infection of fibroblasts causes the production of exosome-like vesicles containing a unique array of mRNA and miRNA transcripts compared to serum starvation[J]. J Extracell Vesicles, 2013, 2(1): 22484. DOI:10.3402/jev.v2i0.22484 |
| [25] |
Girard A, Sachidanandam R, Hannon GJ, et al. A germline-specific class of small RNAs binds mammalian Piwi proteins[J]. Nature, 2006, 442(7099): 199-202. DOI:10.1038/nature04917 |
| [26] |
Aravin AA, Sachidanandam R, Girard A, et al. Developmentally regulated piRNA clusters implicate MILI in transposon control[J]. Science, 2007, 316(5825): 744-7. DOI:10.1126/science.1142612 |
| [27] |
Yin H, Lin H. An epigenetic activation role of Piwi and a piwiassociated piRNA in Drosophila melanogaster[J]. Nature, 2007, 450(7167): 304. DOI:10.1038/nature06263 |
| [28] |
Théry C. Exosomes: secreted vesicles and intercellular communications[J]. F1000 Biol Rep, 2011, 3: 15. |
 2020, Vol. 40
2020, Vol. 40

