2. 安徽中医药大学 新安医学教育部重点实验室, 安徽 合肥 230012
2. Key Laboratory of Xin'an Medicine of Ministry of Education, Hefei 230012, China
糖尿病肾病(DN)是糖尿病的一种常见并发症, 在糖尿病患者中, 出现肾脏并发症约占25%, 已成为发达国家终末期肾脏病的首要病因[1-2]。严重威胁着患者的生存与预后, 已成为中西医研究的热点和难点。西医对其治疗的方法较少, 且多伴有不良反应, 中医药在治疗本病中取得了不错的疗效, 具有一定的优势[3-4]。
DN在病理上, 早期主要为肾小球滤过率增加, 并伴随肾小球系膜增生、细胞外基质增厚、肾小球硬化、肾小管间质纤维化等; 后期肾小球滤过率逐渐下降, 伴随肾小球基膜弥漫性增厚、基质增生, 形成典型的结节性病变, 肾小管萎缩, 肾功能减退, 最终发展为终末期肾病[5]。吕仁和认为糖尿病肾病是消渴病久治不愈, 伤阴耗气, 痰郁热瘀互相胶结于络脉, 形成"微型癥瘕"[6], 中医的"癥瘕"意味着内有痰瘀。已有研究表明, 糖尿病大鼠病程4周时肾脏组织出现肾小球基底膜和系膜增厚和结构不清的早期病理学改变, 后期肾小球系膜与基底膜胶原沉积和纤维化等病变, 造成气血运行不畅或闭阻[7], 符合中医"脉络瘀阻"病机; 而以晚期糖基化终末产物(AGEs)为代表的代谢废物蓄积及其所引发的病变又具有中医"痰"的特征。两者相互交联, 形成了DN "痰瘀互结"病机。DN的病理变化与糖尿病心肌病类似, 课题组前期采取化瘀通络法干预糖尿病的心肌病变, 发现具有化瘀通络作用的抵当汤能改善糖尿病大鼠心肌纤维化的病理程度, 对糖尿病心肌病模型大鼠心肌组织微血管也具有较好的保护作用[8-9]。本实验进一步采用痰瘀同治法, 观察其干预DN肾脏纤维化的病变效果。
已知转化生长因子β1 (TGF-β1)被认为是与组织纤维化关系最密切的细胞因子, 在肾脏、心肌、肝脏等组织均有表达[10-12]。研究认为, TGF-β1可以通过促进ECM的合成和抑制ECM的降解以及调节肾小管上皮细胞向成纤维细胞的转化来促进肾脏纤维化[13], TGF-β1也可诱导上皮细胞间充质转化促进肾脏纤维化[14]。TGF-β/ Smads信号通路是TGF-β下游最经典的信号通路。TGF-β1可激活其下游Smad3途径在DN发生中起着重要的调控作用。故本实验将TGF-β1/Smad3信号通路作为指标, 以抵当陷胸汤作为代表方药, 观察该治法对该通路的干预效应。
1 材料和方法 1.1 材料 1.1.1 实验动物选鼠龄为12周、体质量180~220 g雄性清洁级SD大鼠50只, 购于安徽医科大学实验动物中心, 许可证编号:SCXK-(皖)2017-001。
1.1.2 药物抵当陷胸汤:制大黄10 g, 桃仁15 g, 水蛭10 g, 虻虫10 g, 黄连5 g, 清半夏10 g, 全瓜蒌30 g; 小陷胸汤:清半夏10 g, 黄连5 g, 全瓜蒌30 g; 血府逐瘀汤:当归9 g, 生地黄9 g, 桃仁12 g, 红花9 g, 川芎4.5 g, 桔梗4.5 g, 赤芍6 g, 牛膝9 g, 枳壳6 g, 柴胡3 g, 甘草6 g; 购于安徽中医药大学国医堂门诊部, 煎煮浓缩制成冻干粉备用。
1.1.3 试剂和仪器链脲佐菌素溶液(STZ, Sigma); 山羊抗小鼠IgG、山羊抗兔IgG (Zs-BIO); RevertAidTM first Strand cDNA Synthesis Kit(Thermo Scientific); Novostart SYBR qPCR SuperMix Plus (Novoprotein); TG16-W台式高速离心机型号(安徽嘉文); StepOneTM荧光定量PCR仪(Thermo Scientific); TS-1000水平摇床(江苏海门); JS- 1070P自动曝光仪(上海培清)。
1.2 方法 1.2.1 分组、模型制备及给药干预将50只SD大鼠适应喂养1周, 随机分组:空白组(NC) 10只, 其余40只大鼠按剂量55 mg/kg单次腹腔注射STZ溶液, 3 d后, 尾静脉法测随机血糖>16.7 mmol/L者即糖尿病模型造模成功[15], 根据文献方法, 继续饲养4周, 糖尿病大鼠肾脏组织即有早期病理改变[7], 将造模成功32只大鼠随机分为模型组(MC)、痰瘀同治组(RPDBS)、化瘀组(DBS)和化痰组(RP), 每组8只。参照《药理实验方法学》中人与大鼠剂量换算方法[16], NC组和MC组:按等体积蒸馏水灌胃; RPDBS组, RP组与DBS组:分别按8.10、4.05、6.30 g/(kg·d)剂量灌胃相应汤剂8周。用3%戊巴比妥钠(30 mg/kg)于第12周末腹腔注射麻醉下取材。
1.2.2 肾脏组织形态学观察采用HE染色法观察肾小球结构和肾小管排列顺序, 取左侧肾脏组织, 于10%中性福尔马林溶液固定, 常规石蜡包埋切片(厚度为4 μm), 伊红-苏木素复染, 梯度脱水后二甲苯通透, 中性树脂胶封片, 光学显微镜下观察肾脏组织肾小球及肾小管的形态变化。
1.2.3 TGF-β1、Smad3和p-Smad3的蛋白表达采用Western blotting法检测蛋白表达水平, 每组取肾脏组织100 mg, 加入RIPA细胞裂解液1 mL, 离心后提取蛋白; 上样后, 恒流转膜(TGF-β1转膜55 min, Smad3转膜50 min; p-Smad3转膜50 min); 转膜结束后用5%脱脂奶粉室温封闭2 h; 参考一抗的说明书:TGF-β1、Smad3和p-Smad3抗体属性为兔抗按照1:1000稀释(10%分离胶), 4℃缓慢摇动孵育过夜; 洗3次, 参考二抗的说明书, 按照1:10 000用二抗稀释液稀释过氧化物酶标记的二抗, 室温孵育2 h; 最后用JS-1070P自动曝光仪来检测TGF-β1、Smad3和p-Smad3的蛋白表达情况。
1.2.4 TGF-β1、Smad3基因的表达采用实时荧光定量PCR法检测, 每组取肾脏组织100 mg, 液氮研磨成粉末加入1 mL Trizol, 冰浴匀浆, 提取RNA并测量其浓度和纯度; 每组取质量为1 µg RNA逆转录成cDNA; 以β- actin为内参, 按照实验指导书进行基因表达水平的检测。引物TGF-β1序列:正义5'-AGGTCCTTGCCCT CTACAAC-3', 反义5'-CGTAGTAGACGATGGGCA GT-3', 扩增片段长度为96 bp; 引物Smad3序列:正义5'- GAGTGGAGAGCAGGGACTTT-3', 反义5'-ACACA CTCTCAGGTCAGTGG-3', 扩增片段长度为74 bp。PCR的反应条件:预变性温度95℃, 时间60 s; 变性温度为95℃, 时间20s, 退火温度为60℃, 时间60 s, 40个循环。分析方法为:Relative Quantification Study, 计算方法为2-△△CT。
1.3 统计学方法采用SPSS 23.0软件对数据进行处理分析, 计量资料采用均数±标准差表示, 3组及以上比较用单因素方差分析, 两组间比较用两样本独立t检验, P < 0.05为差异有统计学意义。
2 结果 2.1 肾组织形态变化HE染色下, NC组肾小球结构和形态正常, 肾小管排列整齐, 未出现肾小管损伤, 肾间质无增宽, 未出现明显病理改变; MC组肾小球结构紊乱, 发生空泡样变化, 基底膜增厚, 肾小管排列杂乱, 损伤明显, 间质增宽, 出现不同程度的水肿, 并出现大量纤维组织增生和炎性细胞; 各治疗组与MC组比较, 肾小球结构较清晰, 空泡样变化减轻, 肾小管排序基本正常, 肾间质病变减轻和有少量的纤维组织增生; RPDBS组与RP组和DBS组比较, 肾小球结构, 肾小管排列和间质损伤、纤维化情况均改善明显(图 1)。
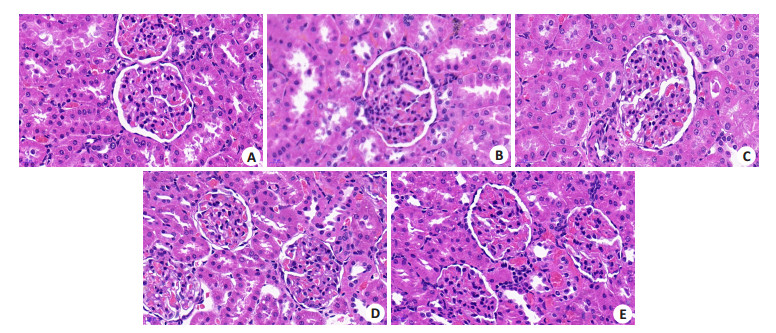
|
图 1 肾组织形态变化 Fig.1 Morphological changes of the kidney tissue (HE staining, original magnification:×400). A: NC; B: MC; C: RP; D: DBS; E: RPDBS. |
与NC组比较, MC组的TGF-β1、Smad3和p-Smad3蛋白表达水平显著上调(P < 0.01);各治疗组的TGF-β1、Smad3和p-Smad3蛋白表达水平较MC组均下调(P < 0.01, P < 0.05), RPDBS组与RP组和DBS组比较, 蛋白表达水平下调显著(P < 0.01, 图 2)。
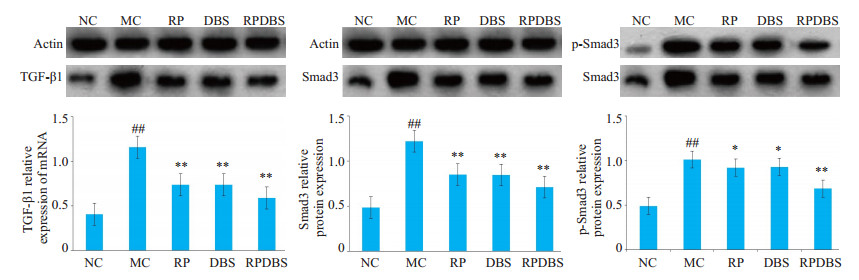
|
图 2 肾脏组织TGF-β1、Smad3和p-Smad3蛋白表达 Fig.2 TGF-β1, Smad3 and p-Smad3 protein expression in the kidney tissue. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs MC group. |
Western blot结果显示, MC组TGF-β1、Smad3基因表达水平较NC组均明显上调(P < 0.01), 各治疗组较MC组TGF-β1、Smad3基因表达水平均显著下调(P < 0.05, P < 0.01), RPDBS组与RP组和DBS组比较, 基因水平下调明显(P < 0.05, 图 3)。
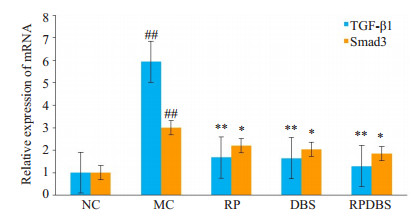
|
图 3 肾脏组织TGF-β1、Smad3基因表达水平 Fig.3 TGF-β1 and Smad3 mRNA expression levels in the kidney of the rats. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs MC group. |
关于DN的中医病机, 江旭锋、扈丽萍等认为是本虚标实。本虚是气虚和阴虚、五脏虚, 最终阴损及阳, 而导致阴阳俱虚, 肾脾亏虚为本; 标实是指瘀血、燥热、水湿、痰浊等[17-18]。韩世辉将本病分为蛋白尿期初期, 主要病机为肝克脾, 脾克肾; 血清肌酐上升的中期, 病机为脾肾失藏, 浊阴泛滥; 肾心异常的晚期, 病机为任督精气损伤, 手足少阴有浊毒[19]。卢洪梅等提出本病以水肿、尿浊为主要表现, 病位为肾, 和脾、心、肝有关, 病机是气虚血瘀, 可分为气虚、气滞、血郁、血瘀4个阶段论治[20]。可见, 中医界多数观点认为DN的病机为本虚标实证, 本虚以脾肾肝心为主, 标实以水湿、瘀血、痰浊、热毒为主。我们认为, 应该高度关注DN的肾纤维化病变所导致的"微型癥瘕"存在着脉络瘀阻和痰浊相互交织的痰瘀互结病机。
关于DN的中医治疗, 不同学者基于不同的病机认识采取了不同的治疗方法。国医大师邹燕勤认为DN的主要病机是脾肾亏虚为本、湿瘀阻络为标, 治疗应以健脾补肾、标本兼治为主[21]。徐远认为糖尿病日久必会造成瘀血内停, 阻于肾络, 认为"瘀"是该病的重要病机, 并自拟益肾利水汤治疗DN[22]。孙伟治疗采用健脾益肾、活血利水、益气养阴、泄浊解毒等法[23]。朴春丽以解毒通络保肾法治疗DN[24]。王耀献、王暴魁等提出"血热"是始终贯穿于DN的病机要素, 并制订出分期论治热邪"、清热凉血"为治疗大法[25-26]。刘德山教授运用血浊理论, 将DN分为痰湿血浊、寒客血浊、气滞血浊、热毒血浊、正虚血浊等不同证型, 施以化痰祛浊、祛邪散寒、行气导滞、清热解毒、扶正补虚等不同治法[27]。张茂平提出从玄府、络病理论的视角论治DN, 其认为本病多因玄府升降障碍、肾络受损所致, 治以开通玄府、疏通络脉为主[28]。以上治法主要是根据DN的临床表现而施予的治法, 虽有补益、化瘀、泄浊等方法, 但关注DN的纤维化病变而实施痰瘀同治之法尚不多见, 因此, 运用痰瘀同治之法干预DN纤维化病变, 一定程度上是对已有临床治法的拓展, 并深入到了病理改变层面, 而以TGF-β1/Smad3信号通路作为观察指标在一定程度上可以揭示该治疗方法的作用机制。
目前已知TGF-β及其下游信号分子是公认的肾脏纤维化的关键调控因素[29], 在慢性肾脏疾病(CKD)的进展中具有最重要的作用[30]。肾脏固有的成纤维样细胞包括肾小球系膜细胞、间质成纤维细胞和周细胞等, 均可被诱导激活为肌纤维母细胞表型。其中TGF-β1是最重要的诱导因素。小剂量TGF-β1即可诱导系膜细胞增殖、α-SMA的表达和胶原蛋白生成[31-32]。TGF-β1可以上调Nox4介导的活性氧产生, 进而激活肾间质成纤维细胞, 诱发纤维化[33]。因此, 阻断TGF-β1信号通路可以延缓肾小球硬化的进程[34]。Smads是TGF-β下游的主要效应蛋白, 当TGF-β受体被激活时, 磷酸化的Smad2和Smad3可与Smad4结合, 形成复合体转移入细胞核, 调控下游基因转录[35], 其中Smad3是公认的导致纤维化的因子, 可直接结合胶原的启动子区域, 参与ECM的生成和降解。在糖尿病肾病、高血压肾病等模型中发现, 敲除Smad3可以明显减轻肾脏纤维化水平。TGF-β还是内皮细胞-间充质细胞转分化(EndMT)的重要诱导剂[36]。条件性敲除内皮细胞中的TGF-β受体或使用Smad3的抑制剂SIS3, 均可抑制EndMT水平, 减轻肾间质纤维化, 延缓链脲霉素诱导的糖尿病肾病进展[37-38]。
抵当陷胸汤是抵当汤与小陷胸的合方, 均为《伤寒论》经典方。小陷胸汤由黄连、半夏、全瓜蒌组成, 是化痰散结的代表方。抵当汤由桃仁、大黄、水蛭、虻虫组成, 其中水蛭、虻虫均为虫类药, 有化瘀通络作用; 大黄有泻热化瘀作用; 桃仁有化瘀作用, 全方总的功效是以化瘀和通络为主。将抵当汤与小陷胸合方组成了具有化痰化瘀通络作用的方剂, 可实现痰瘀同治。而血府逐瘀汤为活血化瘀的代表方, 其功效主要是活血化瘀, 其通络作用没有抵当汤强。
本实验结果显示, 造模12周后, MC组肾小球结构紊乱, 肾小球基底膜增厚, 炎性细胞浸润, 肾间质纤维化明显。而采用痰瘀同治以及化痰、化瘀治疗后, 肾脏组织形态学均有改善, RPDBS组与MC组比较, 肾小球结构较清晰, 肾小管损伤和肾间质纤维化情况好转; RPDBS组与RP组和DBS组比较, 肾间质纤维化情况改善更为明显, 说明化痰化瘀法均对肾脏病变有一定防治作用, 而采用痰瘀同治法为优。从TGF-β1/Smad3信号通路指标来看, 与NC组比较, MC组的TGF-β1、Smad3和p-Smad3蛋白表达水平显著上调(P < 0.01), 各治疗组的TGF-β1、Smad3和p-Smad3蛋白表达水平较MC组均下调(P < 0.01, P < 0.05), 其中RPDBS组与RP组和DBS组比较, 蛋白表达水平下调显著(P < 0.01)。从基因表达来看, MC组TGF-β1、Smad3基因表达水平较NC组均明显上调(P < 0.01), 各治疗组较MC组TGF-β1、Smad3基因表达水平均显著下调(P < 0.05, P < 0.01), RPDBS组与RP组和DBS组比较, 基因水平下调明显(P < 0.05)。综上可见, 采用痰瘀同治法干预TGF-β1/ Smad3信号通路的作用明显, 结果与肾脏形态学变化吻合。因此, 本实验表明, 采用痰瘀同治法和化痰、化瘀法及其相应方剂对糖尿病大鼠肾纤维化病程具有一定延缓作用, 且痰瘀同治法效果优于单独化痰或化瘀法, 其作用机制与干预TGF-β1/Smad3信号通路有关, 这为中医药干预DN提供了新的防治思路。
| [1] |
Saran R, Li Y, Robinson B, et al. US renal data system 2015 annual data report:epidemiology of kidney disease in the United States[J]. Am J Kidney Dis, 2016, 67(3 Suppl 1): S1-Svii, S305. |
| [2] |
Boer IH, Rue TC, Hall YN, et al. Temporal trends in the prevalence of diabetic kidney disease in the United States[J]. JAMA, 2011, 305(24): 2532-9. |
| [3] |
张海力, 李靖, 王世长, 等. 中医药治疗糖尿病肾病最新进展[J]. 中国中西医结合肾病杂志, 2019, 20(9): 831-3. |
| [4] |
谢秋芳, 梁贵廷, 段俊红, 等. 糖尿病肾病的中药治疗进展[J]. 中国医药导报, 2019, 16(12): 46-9. |
| [5] |
张晶露, 邱琳, 雒晓春. 糖尿病肾病发病机制研究进展[J]. 医学综述, 2017, 23(8): 1623-7. |
| [6] |
王耀献, 刘尚建, 付天昊, 等. 肾络微型症瘕探微[J]. 中医杂志, 2006, 47(4): 247-9. |
| [7] |
Shan YE, Yan C, Ying XW, et al. Renoprotection of diabeticrats with losartan[J]. Chin J New Drug, 2007, 16(8): 610-3. |
| [8] |
储全根, 刘新萍, 张凯, 等. 抵当汤及其拆方对糖尿病大鼠心肌TGF-β1, TGF-βRⅡ及Smad7蛋白表达的影响[J]. 中国实验方剂学杂志, 2016, 22(1): 93-7. |
| [9] |
储全根, 张凯, 刘新萍, 等. 抵当汤及其拆方对糖尿病大鼠心肌Ang Ⅱ含量和TGF-β/Smads信号通路的影响[J]. 中药材, 2016, 39(2): 408-10. |
| [10] |
孟晓明, 蓝辉耀. 转化生长因子-β与肾脏纤维化的研究进展[J]. 生理学报, 2018, 70(6): 612-22. |
| [11] |
陈铭林, 吴铿. TGF-β1对糖尿病心肌病的影响[J]. 临床医学工程, 2014, 21(2): 260-1, 264. |
| [12] |
Attar AM, Alsalmi FA. Influence of olive leaves extract on hepatorenal injury in streptozotocin diabetic rats[J]. Saudi J Biol Sci, 2019, 26(7): 1865-74. |
| [13] |
Lan HY, Chung AC. TGF-beta/Smad signaling in kidneydisease[J]. Semin Nephrol, 2012, 32(3): 236-43. |
| [14] |
吴素珍, 李加林, 吴冰, 等. 转化生长因子-β在糖尿病肾病肾小球硬化中的作用[J]. 赣南医学院学报, 2017, 37(2): 312-6. |
| [15] |
邵晓丽, 余江毅, 倪卫惠. 芪葵颗粒对STZ诱导糖尿病肾病大鼠的肾脏保护作用及机制研究[J]. 中药材, 2017, 40(10): 2437-40. |
| [16] |
徐叔云.药理实验方法学[M].北京: 人民卫生出版社, 2002: 192.
|
| [17] |
江旭锋, 曾庆春, 黄岑汉, 等. 糖尿病肾病中医病因病机探要[J]. 河南中医, 2016, 36(5): 924-6. |
| [18] |
扈丽萍. 刘文峰教授对糖尿病肾病中医病机之探析[J]. 长春中医药大学学报, 2014, 30(5): 831-3. |
| [19] |
韩世辉. 糖尿病肾病的中医病机及用药[J]. 中国中医药现代远程教育, 2018, 16(2): 82-3. |
| [20] |
卢洪梅, 吕雄. 糖尿病肾病中医证型研究及其"气虚血瘀"机理探讨[J]. 中国中医基础医学杂志, 2015, 21(4): 388-9. |
| [21] |
严倩华, 邹燕勤. 国医大师邹燕勤教授从脾肾论治糖尿病肾病[J]. 南京中医药大学学报, 2018, 34(2): 109-11. |
| [22] |
王思轩, 王艳梅, 武曦蔼, 等. 徐远教授从瘀论治糖尿病肾病经验[J]. 中医药学报, 2017, 45(3): 82-4. |
| [23] |
沙鑫, 孙伟. 孙伟教授治疗糖尿病肾病[J]. 吉林中医药, 2016, 36(4): 350-2. |
| [24] |
董晗硕. 朴春丽教授治疗糖尿病肾病[J]. 长春中医药大学学报, 2013, 29(6). DOI:10.13463/j.cnki.cczyy.2013.06.021 |
| [25] |
王珍, 王梦迪, 刘笑慈, 等. 王耀献教授从热邪论治糖尿病肾病经验[J]. 中国中西医结合肾病杂志, 2014, 15(5): 379-80. |
| [26] |
闫凯, 温乔, 谢璇, 等. 王暴魁"清热凉血"法治疗糖尿病肾病经验介绍[J]. 环球中医药, 2017, 10(6): 712-3. |
| [27] |
孙余余, 刘德山. 刘德山教授运用血浊理论治疗糖尿病肾病经验[J]. 云南中医中药杂志, 2017, 38(8): 1-3. |
| [28] |
赵庆, 张茂平, 王明杰, 等. 张茂平教授从络脉、玄府论糖尿病肾病[J]. 中医临床研究, 2017, 9(4): 50-1. |
| [29] |
Meng XM, Nikolic DJ, Lan HY. TGF-β:the master regulator of fibrosis[J]. Nat Rev Nephrol, 2016, 12(6): 325-38. |
| [30] |
Sureshbabu A, Muhsin SA, Choi ME. TGF-beta signaling in the kidney:profibrotic and protective effects[J]. Am J Physiol Renal Physiol, 2016, 310(7): F596-606. |
| [31] |
Mishra R, Cool BL, Laderoute KR, et al. AMP-activated protein kinase inhibits transforming growth factor-beta-induced Smad3-dependent transcription and myofibroblast transdifferentiation[J]. J Biol Chem, 2008, 283(16): 10461-9. |
| [32] |
Schnaper HW, Hayashida T, Hubchak SC, et al. TGF-beta signal transduction and mesangial cell fibrogenesis[J]. Am J Physiol Renal Physiol, 2003, 284(2): F243-52. |
| [33] |
Barnes JL, Gorin Y. Myofibroblast differentiation during fibrosis:role of NAD(P)H oxidases[J]. Kidney Int, 2011, 79(9): 944-56. |
| [34] |
Border WA, Okuda S, Languino LR, et al. Suppression of experimental glomerulonephritis by antiserum against transforming growth factor beta 1[J]. Nature, 1990, 346(6282): 371-4. |
| [35] |
Meng XM, Chung AC, Lan HY. Role of the TGF-β/BMP-7/Smad pathways in renal diseases[J]. Clin Sci, 2013, 124(4): 243-54. |
| [36] |
Meeteren LA, Dijke P. Regulation of endothelial cell plasticity by TGF-Β[J]. Cell Tissue Res, 2012, 347(1): 177-86. |
| [37] |
Xavier S, Vasko R, Matsumoto K, et al. Curtailing endothelial TGF-β signaling is sufficient to reduce endothelial-mesenchymal transition and fibrosis in CKD[J]. JAm Soc Nephrol, 2015, 26(4): 817-29. |
| [38] |
Li JH, Qu XL, Yao J, et al. Blockade of endothelial-mesenchymal transition by a Smad3 inhibitor delays the early development of streptozotocin-induced diabetic nephropathy[J]. Diabetes, 2010, 59(10): 2612-24. |
 2020, Vol. 40
2020, Vol. 40

