2. 北京大学国际医院睡眠中心, 北京 102206;
3. 解放军总医院第二医学中心心血管内科, 北京 100853;
4. 解放军总医院大数据中心, 北京 1000853;
5. 解放军总医院国家老年疾病临床医学研究中心, 北京 100853
2. PKU-UPenn Sleep Center, Peking University International Hospital, Beijing 102206, China;
3. Department of Geriatric Cardiology, Second Medical Center of General Hospital of PLA, Beijing 100853, China;
4. Big Data Center, General Hospital of PLA, Beijing 100853, China;
5. National Clinical Research Center for Geriatric Diseases, General Hospital of PLA, Beijing 100853, China
阻塞性睡眠呼吸暂停综合征(OSAS)的患病率随年龄增长而明显增加, 研究显示, 60岁以上社区人群患病率可高达63.7%[1], 反复发作的低血氧、高碳酸血症可致神经、内分泌功能紊乱, 导致全身多器官多系统损害, 严重影响老年人健康。研究表明红细胞分布宽度(RDW)是反应红细胞体积异质性的参数, 与慢性缺氧关系密切[2]。在OSAS患者中, 中度及重度组OSAS患者RDW水平显著升高, 与睡眠暂停低通气指数(AHI)呈正相关, 提示与OSAS患者严重程度密切相关[3-4]。但也有研究显示OSAS患者与对照组相比, 未发现两组之间RDW的统计学差异[5-6]。目前OSAS与RDW的相关研究, 平均年龄均小于60岁, 未见老年人群的相关报道。且鉴于OSAS与RDW关系尚存在争议, 本研究对此进行初步探讨, 观察老年OSAS严重度与RDW变化的相关性, 旨在为疾病的评估与预后判断提供一些参考。
1 资料和方法 1.1 研究对象选择2015年1月~2016年10月在解放军总医院鼾症门诊确诊为OSAS患者311例(年龄≥ 65岁)为观察组, 其中男性213例, 女性98例; 同期入选体检人群排除OSAS的老年人120例为对照组, 其中男性76例, 女性44例。两组的年龄、性别、冠心病、血脂紊乱、慢性阻塞性肺疾病等差异无统计学意义(P>0.05)。OSAS诊断及分级标准参照《阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)》[7]:成人在7 h的夜间睡眠时间内, 至少有30次呼吸暂停, 每次发作时口鼻气流停止至少10 s以上, 呼吸暂停时血氧饱和度下降4%以上; AHI大于5次/h。排除标准:(1)有心衰; (2)有急性感染; (3)有OSAS以外的其他全身炎性疾病:(4)有重度贫血或其他血液系统疾病; (5)慢性肝病或肾病; (6)有恶性肿瘤; (7)近3月使用消炎药或激素; (8)对检查不能配合者。该研究得到解放军总医院伦理委员会批准(伦理号S2019-352-01)。
1.2 方法所有研究对象常规进行睡眠呼吸监测, 方法:均使用多导睡眠监测仪进行睡眠监测(Compmedics, Melboume, Australia), 在睡眠呼吸室应用睡眠呼吸记录分析系统对OSAS组患者进行多导睡眠监测, 记录AHI平均血氧饱和度(MSaO2), 连续监测时间均>7 h, 全部数据自动分析, 并经由专人手工校正。OSAS组依据AHI共分为3组:轻度组AHI为5~14.9次/h, 中度组AHI为15~29.9次/h、重度组AHI ≥ 30次/h。其中轻度组90例, 男56例, 女34例, 体质量指数25.45±4.5 kg/m2; 中度组113例, 男81例, 女32例, 体质量指数26.69± 4.54 kg/m2; 重度组108例, 男76例, 女32例, 体质量指数27.92± 4.76 kg/m2。
血液标本采集:所有老年人均于睡眠呼吸状态监测的当日早上空腹状态下抽取静脉血, 检查血常规与生化指标, 检测方法:应用全自动XE2100血细胞分析仪(SYSMEX, Kobe)检测红细胞计数、血红蛋白、RDW及白细胞(WBC)计数及测定生化指标。观察各组间SpO2、血小板计数、平均血小板体积、血小板分布宽度、血小板比积、红细胞体积分布宽度、中性粒细胞/淋巴细胞比值、血小板/淋巴细胞比值、尿酸、肌酐、空腹血糖水平、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-C)变化, 同时进行相关分析。
1.3 统计学处理应用SPSS 20.0软件包对数据进行分析, 连续变量采用均数±标准差表示, 4组间比较采用成组设计方差分析, 如方差不齐采用多组间Kruskal-Wallis H法的非参数检验。分类变量以率表示, 组间比较用卡方检验; 两变量相互关系采用Pearson相关性分析法, 非正态分布采用spearman相关性分析, 多变量采用多因素线性回归。P < 0.05为差异有统计学意义。
2 结果 2.1 一般临床情况各组间平均氧饱和度、最低氧饱和度、AHI水平之间差异存在统计学意义(P < 0.01)。对照组高血压和糖尿病患病率、吸烟比例上均低于重度OSAS组(P < 0.01);重度OSAS组RDW、甘油三酯水平高于其他各组(P < 0.01);重度OSAS组和中度OSAS组空腹血糖水平、体质量指数均高于轻度OSAS组和正常对照组(P < 0.05或P < 0.01), 重度OSAS组和中度OSAS组尿酸、肌酐水平高于轻度OSAS组(P < 0.01);对照组中性粒细胞/淋巴细胞比值、血小板分布宽度水平低于其他各组(P < 0.01);而对照组总胆固醇、低密度脂蛋白水平高于其他各组OSAS组(P < 0.01, 表 1)。
| 表 1 一般临床情况比较 Tab.1 Clinical characteristics of patients with obstructive sleep apnea and the control subjects |
AHI与体质量指数、肌酐、尿酸、RDW、血小板分布宽度(PDW))、尿酸、低密度脂蛋白胆固醇呈正相关, 与平均SpO2、最低SpO2、甘油三酯呈负相关(P < 0.05, 表 2)。将AHI作为因变量, 多元线性回归分析显示, AHI与体质量指数(Beta=0.111, P=0.032)、RDW (Beta=0.106, P= 0.029)呈正相关(表 3)。RDW预测OSA的严重程度的ROC曲线下面积为0.687 (P=0.0001, 图 1)。
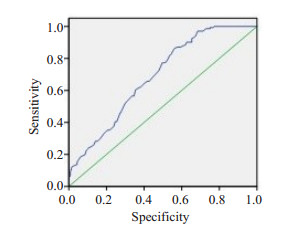
|
图 1 RDW预测OSA的严重程度的ROC曲线 Fig.1 ROC curve of severity of OSA predicted by Red cell distribution width. |
| 表 2 AHI与连续变量的相关性分析 Tab.2 Correlations ofAHI with continuous variables |
| 表 3 AHI与连续变量的多元线性回归分析 Tab.3 Linear regression analyses of continuous variables andAHI |
本研究显示, 在老年OSAS患者中, 重度OSAS组RDW水平高于轻中度OSAS组和对照组, 进一步多元线性回归分析显示RDW水平与AHI呈正相关, RDW预测OSA的严重程度的ROC曲线下面积为0.687, 提示在老年OSAS患者中RDW与OSAS严重度密切相关, 与既往一些研究结果一致[3-4]。其原因可能为老年OSAS患者机体慢性缺氧状态, 诱导促红细胞生成素分泌增多, 导致红细胞、血红蛋白增多[8]。红细胞增生加速导致RDW增大, 高水平的RDW可能包括炎症、年龄和肥胖等多种相关因素。RDW是反映外周血红细胞体积离散程度的指标, 是反映红细胞体积大小变异性的参数, 主要用于各种贫血的诊断及鉴别诊断, 近年研究表明RDW与慢性缺氧、冠心病及脑梗死等关系密切[9-10], 是急性缺血性脑卒中患者近期预后不良的预测指标[11], RDW不仅与心血管疾病的严重程度有关[12], 也是机体炎性反应的重要标志[13], 严重缺氧也会刺激神经内分泌系统激活和释放炎性因子, 如白细胞介素-6、促红细胞生成素等均可刺激红细胞增生, 引起RDW升高[2, 14-15]。尤其AHI指数高的OSAS患者, 睡眠间隙性缺氧状态时间长、程度重, 促红细胞生成素分泌增多, 红细胞生成加速, RDW增大的趋势更加明显。已有研究显示RDW本身即与老年人死亡风险增加有关, RDW是全因及特定病因死亡的预测因子, RDW每增加1%, 死亡风险增加14%[16]。老年OSAS患者的潜在心血管风险高, 尤其中重度的老年患者, 基础疾病多, 病程时间长, 缺氧程度重, 抵抗力低, 组织器官对缺氧的耐受程度低, 缺氧持续时间及严重程度均较重, 慢性缺氧带来的影响更大。重度老年OSAS患者与轻、中度患者比较, RDW增高更加明显, 差异显著。老年人由于细胞衰老, 脏器功能衰退, 代谢能力差, 是高血压、糖尿病等疾病的高危人群, OSAS可导致心脑血管、内分泌等全身多系统及器官的损害, 其是心血管死亡的独立危险因素[17-18]。有部分研究显示, OSAS患者与对照组相比, 未发现两组之间RDW的统计学差异[5-6], 这可能与研究入选患者, 尤其是排除标准、研究样本量以及年龄有关, 下一步需要更大样本量的研究来关注OSAS患者与RDW的关系, 尤其是老年OSAS患者。
老年睡眠呼吸障碍的发生率随年龄增长而增加, 是影响老年健康的常见病之一[19]。既往研究显示, OSAS的严重程度与年龄和BMI呈正相关[3], 本研究与既往研究基本相同。本研究中OSAS组患者较正常对照组中性粒细胞/淋巴细胞比值、PDW、RDW、总胆固醇、低密度脂蛋白水平显著增高, 考虑与老年OSAS患者夜间睡眠时段反复发生呼吸暂停、低通气造成的慢性缺氧状态及炎性反应为主要因素。既往研究中PDW与OSAS患者疾病严重程度及AHI呈正相关[20-22], 本研究发现OSAS组与正常对照组比较PDW虽增高, 但不同AHI分组之间比较则无显著差异, 可能研究群体不同或入组病例数尚不足, 有待进一步研究。
随着OSAS严重程度加重, 体内炎性反应程度及代谢紊乱情况可能进一步加剧, 本研究发现, 重度OSAS组高血压和糖尿病患病率、体质量指数、甘油三酯、空腹血糖水平显著增高, 血糖、血脂代谢异常及炎性指标升高, 总胆固醇、低密度脂蛋白水平显著低于其他各组。中、重度OSAS患者尿酸、肌酐水平显著高于轻度组和正常对照组, 提示老年OSAS患者有更高的疾病风险度。可能是由于OSAS患者夜间反复发生的呼吸暂停和低通气造成慢性间歇低氧血症、二氧化碳潴留、交感神经兴奋性升高、全身炎症反应, 多种炎症因子相互影响, 以及氧化应激反应增强、抗氧化能力不足, 从而引发或加重代谢紊乱[23]。炎症因子的产生和氧化应激的增加有关, 老年OSAS患者间歇性缺氧和反复再氧合, 使机体氧化与抗氧化间的平衡失调, 产生大量活性氧自由基在体内蓄积, 诱发组织和细胞毒性损伤, 缺氧及氧化应激反应均诱发OSAS患者出现全身炎症反应, 而炎症反应是OSAS继发其他器官损伤的基础, 慢性间歇性低氧引起的的氧化应激状态是OSAS产生机体损伤的关键[24-25]。
既往研究认为, 与青年组比较老年OSAS患者即使AHI值偏高, 动脉血氧饱和度下降并不明显[16], 但本研究发现老年OSAS患者随着AHI的增加呈现低氧血症逐渐加重的趋势, 各组间平均氧饱和度、最低氧饱和度、AHI水平之间均存在统计学差异, 轻度OSAS患者与正常对照组比较平均氧饱和度、最低氧饱和度明显下降, 中、重度OSAS组间比较最低氧饱和度差异显著, 重度OSAS组患者平均氧饱和度、最低氧饱和度下降程度与其各组比较均呈现显著差异。考虑本研究组均为老年人群, 由于老年OSAS患者长期处于间歇性低氧状态, AHI越高导致慢性缺氧问题越严重, 夜间睡眠时段反复出现呼吸暂停, 低氧血症程度重、持续时间长, 对机体造成的损害大。本研究发现平均氧饱和度、最低氧饱和度与AHI呈显著负相关, 随着OSAS程度的加重而降低, 这点与既往一些研究相似[5]。
本研究显示老年OSAS患者RDW水平随OSAS程度的加重而增高, RDW预测OSAS的严重程度的ROC曲线下面积为0.687, 提示RDW可能作为OSAS严重度评估的潜在辅助指标, 评估老年OSAS患者病情程度及进展情况, 是否可以认为老年OSAS患者RDW增高, OSAS程度加重, 罹患心脑血管急症事件风险增大, 因此, 建议临床上应持续关注对老年人群RDW的变化的监测。RDW可作为缺氧状况和系统性炎症的程度评估一项简便的实验室指标, 推测老年OSAS患者是否发生心脑血管事件的标志物。通过定期检测RDW水平, 评价OSAS程度, 分析疾病进展情况, 进而预测老年OSAS患者发生潜在心脑血管急性事件的风险, 可能对临床工作中对老年OSAS患者判断预后、疾病预警具有一定的指导意义。
| [1] |
Ng SS, Chan TO, To KW, et al. Prevalence of obstructive sleep apnea syndrome and CPAP adherence in the elderly Chinese population[J]. PLoS One, 2015, 10(3): e0119829-37. |
| [2] |
杜永亮, 徐永红, 马雷, 等. 阻塞性睡眠呼吸暂停综合征患者红细胞分布宽度水平及其意义[J]. 山西医科大学学报, 2015, 46(12): 1227-9. |
| [3] |
Kıvanc T, Kulaksızoglu S, Lakadamyalı H, et al. Importance of laboratory parameters in patients with obstructive sleep apnea and their relationship with cardiovascular diseases[J]. J Clin Lab Anal, 2018, 32(1): e22199-207. |
| [4] |
朱盈盈. 红细胞分布宽度在阻塞性睡眠呼吸暂停低通气综合征患者中的变化与意义[J]. 中医临床研究, 2019, 11(10): 18-21. |
| [5] |
Fan ZQ, Lu XX, Long H, et al. The association of hemocyte profile and obstructive sleep apnea[J]. J Clin Lab Anal, 2019, 33(2): e22680-6. |
| [6] |
Sökücü SN, Ozdemir C, Dalar L, et al. Complete blood count alterations after six months of continuous positive airway pressure treatment in patients with severe obstructive sleep apnea[J]. J Clin Sleep Med, 2014, 10(8): 873-8. |
| [7] |
中华医学会呼吸病学分会睡眠呼吸疾病学组. 阻塞性睡眠呼吸暂停低通气综合征诊治指南(草案)[J]. 中华结核和呼吸杂志, 2002, 25(4): 9-12. |
| [8] |
Yčas JW. Toward a blood-borne biomarker of chronic hypoxemia:red cell distribution width and respiratory disease[J]. Adv Clin Chem, 2017, 82: 105-97. |
| [9] |
Li YM, Li M, Teng YF, et al. The association between red cell distribution width, erythropoietin levels, and coronary artery disease[J]. CoronArtery Dis, 2018, 29(1): 74-80. |
| [10] |
Söderholm M, Borné Y, Hedblad B, et al. Red cell distribution width in relation to incidence of stroke and carotid atherosclerosis:a population-based cohort study[J]. PLoS One, 2015, 10(5): e0124957. |
| [11] |
Turcato G, Cervellin G, Cappellari M, et al. Early function decline after ischemic stroke can be predicted by a nomogram based on age, use of thrombolysis, RDW and NIHSS score at admission[J]. J Thromb Thrombolysis, 2017, 43(3): 394-400. |
| [12] |
Danese E, Lippi G, Montagnana M. Red blood cell distribution width and cardiovascular diseases[J]. J Thorac Dis, 2015, 7(10): E402-11. |
| [13] |
Hu ZD, Lippi G, Montagnana M. Diagnostic and prognostic value of red blood cell distribution width in sepsis:a narrative review[J]. Clin Biochem, 2020, 77: 1-6. |
| [14] |
Salvagno GL, Sanchis-Gomar F, Picanza A, et al. Red blood cell distribution width:a simple parameter with multiple clinical applications[J]. Crit Rev Clin Lab Sci, 2015, 52(2): 86-105. |
| [15] |
Zhang W, Si LY. Obstructive sleep apnea syndrome (OSAS) and hypertension:pathogenic mechanisms and possible therapeutic approaches[J]. Ups J Med Sci, 2012, 117(4): 370-82. |
| [16] |
黄樱硕, 黄蔚, 张侃, 等. 红细胞体积分布宽度与老年急性失代偿射血分数保留心力衰竭预后的关系[J]. 中华老年多器官疾病杂志, 2018, 17(3): 172-7. |
| [17] |
Lee JE, Lee CH, Lee SJ, et al. Mortality of patients with obstructive sleep apnea in Korea[J]. J Clin Sleep Med, 2013, 9(10): 997-1002. |
| [18] |
Fu YQ, Xia YY, Yi HL, et al. Meta-analysis of all-cause and cardiovascular mortality in obstructive sleep apnea with or without continuous positive airway pressure treatment[J]. Sleep Breath, 2017, 21(1): 181-9. |
| [19] |
Punchik B, Press Y, Goldbart A. Syndrome of obstructive sleep apnea in the elderly population-prevalence, clinical characteristics and treatment strategy[J]. Harefuah, 2017, 156(1): 41-4. |
| [20] |
Nena E, Papanas N, Steiropoulos P, et al. Mean Platelet Volume and Platelet Distribution Width in non-diabetic subjects with obstructive sleep apnoea syndrome:new indices of severity[J]. Platelets, 2012, 23(6): 447-54. |
| [21] |
盛维伟, 董艳彬, 金琳羚, 等. 阻塞性睡眠呼吸暂停综合征严重度与血小板参数相关性的探讨[J]. 内科理论与实践, 2019, 14(1): 35-8. |
| [22] |
Bülbül Y, Aydın Özgür E, Örem A. Platelet indices in obstructive sleep apnea:the role of mean platelet volume, platelet distribution widht and plateletcrit[J]. Tuberk Toraks, 2016, 64(3): 206-10. |
| [23] |
何权瀛, 王莞尔. 阻塞性睡眠呼吸暂停低通气综合征诊治指南(基层版)[J]. 中国呼吸与危重监护杂志, 2015, 14(4): 398-405. |
| [24] |
Cofta S, Winiarska HM, Płóciniczak A, et al. Oxidative stress markers and severity of obstructive sleep apnea[J]. Adv Exp Med Biol, 2019, 1222: 27-35. |
| [25] |
Berger S, Polotsky VY. Leptin and leptin resistance in the pathogenesis of obstructive sleep apnea:a possible link to oxidative stress and cardiovascular complications[J]. Oxid Med Cell Longev, 2018, 23: 5137947. |
 2020, Vol. 40
2020, Vol. 40

