2. 新疆维吾尔自治区人民医院 北院护理部, 新疆 乌鲁木齐 830000
2. Department of Nursing, Northen Branch of Xinjiang Uygur Autonomous Region People's Hospital, Urumqi 830000, China
长链非编码RNA(LncRNA)和miRNA分别是大于200个核苷酸和18-15个核苷酸的基因组转录本, 没有蛋白编码功能[1], 其参与转录、转录后和表观遗传学基因调控[2], 在机体的正常发育及肿瘤发生中具有重要作用[3]。LncRNA与miRNA在肿瘤进程中具有重要作用[4-5]。转移相关的肺腺癌转录物1 (MALAT1)是大量表达的lncRNA, 长度约为8000个核苷酸, 被鉴定为与非小细胞癌转移和存活相关的第一个lncRNA[6], 在没有开放阅读框架的情况下, MALAT1在体外翻译中没有表达出蛋白质[7]。MALAT1调节基因表达并在转录后修饰初级转录物, 这些转录物在哺乳动物中高度保守[8]。MALAT1在乳腺癌中发挥致癌作用[9], 但是其对乳腺癌细胞紫杉醇耐药的作用机制尚未清楚。miR-485-3p在多种癌症中均出现失调, 包括乳腺癌[10-13], 但是其是否参与乳腺癌紫杉醇耐药及其与MALAT1的关系尚未有报道。本研究将建立紫杉醇耐药乳腺癌细胞SK-BR-3/PR, 检测其中MALAT1、miR-485-3p的表达, 观察沉默MALAT1、过表达miR-485-3p对SK-BR-3/PR的紫杉醇敏感性, 揭示其作用机制与MALAT1靶向miR-485-3p相关, 将可为乳腺癌的治疗提供新方向。
1 材料和方法 1.1 材料人乳腺癌细胞SK-BR-3购自ATCC; 紫杉醇(Sigma); MALAT1沉默载体(sh-MALAT1)、空载体(sh-NC)的构建及引物(上海生工); PRMI 1640培养基、胎牛血清、MTT、胰蛋白酶(Sellect); LipofectamineTM2000、BCA蛋白定量试剂盒、逆转录试剂盒(Takara); PVDF膜(罗氏); SDS-PAGE试剂盒、ECL发光液和RIPA蛋白裂解液(碧云天); 双荧光素酶报告基因检测试剂盒(Promeg)。
1.2 方法 1.2.1 细胞培养及紫杉醇耐药细胞的建立将SK-BR-3细胞用含10%胎牛血清的PRMI 1640培养基, 置于37℃, 5% CO2的恒温培养箱中常规培养, 待细胞生长至融合度75%左右, 用胰蛋白酶消化约1 min, 按照1:3的比例更换培养基, 每2 d传1次。参考赵遵兰[9]的方法, 将培养24 h的SK-BR-3细胞用1 μmol/L紫杉醇培养24 h后, 恢复不含紫杉醇的培养基培养, 待细胞正常生长后, 继续用1 μmol/L紫杉醇培养24 h, 再次更换正常培养液培养。如此重复, 待细胞稳定生长后, 逐渐呈梯度增加紫杉醇的浓度, 最后SK-BR-3细胞在25 μmol/L紫杉醇的浓度下稳定耐药性, 建立紫杉醇耐药SK-BR-3细胞, 标记为SK-BR-3/PR。
1.2.2 细胞转染与分组将si-NC、si-MALAT1、pc DNA、pc DNA-MALAT1、miR-NC、miR-485-3p、si-MALAT1+ anti-miR-NC、si-MALAT1+anti-miR-485-3p均用脂质体法转染至SK-BR-3/PR细胞, 转染6 h后, 更换新鲜培养液培养48 h, 检测转染成功后, 分别标记为si-NC组、si-MALAT1组、pc DNA组、pc DNA-MALAT1组、miR-NC组、miR-485-3p组、si-MALAT1+anti-miR-NC组、si-MALAT1+anti-miR-485-3p组, 用于后续试验。
1.2.3 MTT实验检测细胞的IC50调整细胞密度至104个/mL, 然后接种至96孔板, 取适量1.2.2各组细胞, 每孔加MTT溶液(5 mg/mL) 20 μL, 孵育4 h, 终止培养, 弃去培养液上清, 然后每孔加150 μL DMSO, 振荡使结晶充分融解, 在490 nm波长下检测细胞吸光度(A)。细胞抑制率=[1-A490样品/A490对照] ×100%。生长抑制率达到50%时的药物浓度为半数抑制率(IC50)。每个样本重复5次, 实验重复3次。
1.2.4 qRT-PCR实验检测细胞中MALAT1、miR-485-3p的表达Trizol法提取组织样本或对数生长期的细胞样本总RNA, 并用Nano-Drop 2000微量分光光度计进行RNA定量。DNaseⅠ消化RNA中可能污染的DNA。逆转录反应采用逆转录试剂盒方式, 操作按照试剂盒说明书进行, 合成模板链cDNA。按照反应体系进行, 每个样品重复3次, 取平均值, 反应结束后通过分析Ct值, 计算定量结果, 以2-△△Ct法测定miR-124-3p的相对表达水平。每个样本重复5次, 实验重复3次。
1.2.5 Western blot实验检测细胞中P-gp、Bax、Bcl-2的蛋白表达提取细胞蛋白, 用BCA蛋白定量试剂盒进行蛋白定量。各组蛋白上样量60 μg, SDS-PAGE后, 经电转将蛋白转移至PVDF膜上。用5%脱脂牛奶室温封闭90 min, 分别加入LRP4的一抗, 4℃孵育过夜, PBS洗涤3次, 每次5 min; 再加入相对应的二抗室温孵育2 h, PBS洗涤3次, 每次10 min, 后在暗室中曝光显影, 再浸入定影, 最后洗去残液晾干, 将胶片用Quantity One凝胶分析软件处理, 测定各组蛋白条带的吸光度, 以目的条带和GAPDH条带的比值作为蛋白表达水平。每个样本重复5次, 实验重复3次。
1.2.6 双荧光素酶报告基因检测实验检测细胞中MALAT1、miR-485-3p的结合力化学合成的目的基因序列(MALAT1-WT)和突变序列(MALAT1-MUT)的两端加上XhoⅠ和NotⅠ酶切位点, 由吉玛公司合成, 再将其克隆到PUC-T载体。然后用XhoⅠ和NotⅠ酶切目的片段2 h, 进行琼脂糖凝胶电泳, 回收纯化酶切产物。psiCHECK-2载体也用同样的方法回收线性化的目的片段。将连接目的序列与psiCHECK-2载体, 加入至冰浴的DH5α感受态细胞中, 42℃水浴热休克60 s, 快速将管转移至冰上, 静置3 min。然后加入500 μL LB液体培养基, 在37℃的摇床上200 r/min振荡培养1 h。将菌液涂抹在含氨苄青霉素的LB固体培养基上, 37℃培养过夜。次日, 挑取单个菌落克隆, 再次进行电泳、测序鉴定, 保留所需克隆株, 并用含氨苄青霉素的LB液体培养基扩大培养, 提取质粒DNA。取适量对数生长期1.2.2各组细胞, 遵照双荧光素酶报告基因检测试剂盒技术手册要求操作。psiCHECK2载体以萤火虫荧光素酶活性为内参, psiCHECK2-MALAT1-3'UTR WT和psiCHECK2-MALAT1-3'UTR MUT的表达为对照, 转染24 h后, 检测荧光强度。海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值即反应MALAT1与miR-485-3p的结合力。
1.2.7 统计学处理实验中所有数据均采用SPSS 21.0软件进行分析。计量资料用均数±标准差表示, 多组间数据比较采用单因素方差分析, 两组比较采用t检验, 以P < 0.05表示差异有统计学意义。
2 结果 2.1 MALAT1、miR-485-3p在SK-BR-3/PR细胞中的表达与SK-BR-3组相比, SK-BR-3/PR组细胞的IC50值显著升高, MALAT1表达显著升高, miR-485-3p表达显著降低(P < 0.001, 表 1)。
| 表 1 MALAT1、miR-485-3p在紫杉醇耐药乳腺癌细胞中的表达 Tab.1 Expression of MALAT1 and miR-485-3p in paclitaxelresistant breast cancer cells (Mean±SD, n=15) |
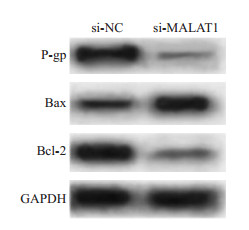
与si-NC组相比, si-MALAT1组细胞中MALAT1表达显著降低, IC50值显著降低, P-gp、Bcl-2蛋白表达均显著降低, Bax蛋白表达显著升高(P < 0.001, 图 1, 表 2)。
|
图 1 沉默MALAT1对耐药相关蛋白表达的影响 Fig.1 Effect of silencing MALAT1 on the expression of drug resistance-related proteins. |
| 表 2 沉默MALAT1对SK-BR-3/PR耐药性及耐药相关蛋白表达的影响 Tab.2 Effects of MALAT1 silencing on expressions of drug resistance and expressions of drug resistance-related proteins in SK-BR-3/PR (Mean±SD, n=15) |
生物信息学预测MALAT1与miR-485-3p存在互补的结合位点(图 2)。与miR-NC组相比, miR-485-3p组WT-MALAT1细胞的荧光活性显著降低; 与si-NC组相比, si-MALAT1组细胞中miR-485-3p表达显著降低, 与pc DNA组相比, pc DNA-MALAT1组miR-485-3p表达显著升高(P < 0.001, 表 2~4)。

|
图 2 靶向结合位点 Fig.2 Target binding sites. |
| 表 3 双荧光素酶报告基因检测实验结果 Tab.3 Results of double luciferase reporter gene detection (Mean± SD, n=15) |
| 表 4 MALAT1对miR-485-3p表达的影响 Tab.4 Effects of MALAT1 on the expression of miR-485-3p (Mean±SD, n=15) |
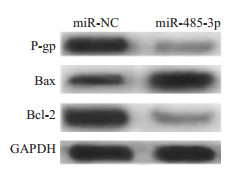
与miR-NC组相比, miR-485-3p组细胞中miR- 485-3p表达显著升高, IC50值显著降低, P-gp、Bcl-2蛋白表达均显著降低, Bax蛋白表达显著升高(P < 0.001, 图 3, 表 5)。
|
图 3 过表达miR-485-3p对SK-BR-3/PR耐药相关蛋白表达的影响 Fig.3 Effects of overexpression of miR-485-3p on expression of drug resistance-related proteins in SK-BR-3/PR cells. |
| 表 5 过表达miR-485-3p对SK-BR-3/PR耐药性及耐药相关蛋白表达的影响 Tab.5 Effects of overexpression of miR-485-3p on drug resistance and expressions of drug resistance-related proteins in SK-BR-3/PR cells (Mean±SD, n=15) |
与si-MALAT1+anti-miR-NC组相比, si-MALAT1+ anti-miR-485-3p组细胞中MALAT1的表达显著升高, IC50值显著升高, P-gp、Bcl-2蛋白表达均显著升高, Bax蛋白表达显著降低(P < 0.001, 图 4, 表 6)。

|
图 4 抑制miR-485-3p对SK-BR-3/PR耐药相关蛋白表达的影响 Fig.4 Effects of inhibition of miR-485-3p on expression of resistance-related proteins in SK-BR-3/PR cells. |
| 表 6 抑制miR-485-3p对SK-BR-3/PR耐药性及耐药相关蛋白表达的影响 Tab.6 Effects of miR-485-3p inhibition on drug resistance and expressions of drug resistance-related proteins in SK-BR-3 /PR cells (Mean±SD, n=15) |
MALAT1在乳腺癌中的促癌作用已得到大量研究的证实, 并且其在多种癌症中的化疗抗性长生中的作用也得到报道[14-16], 其在乳腺癌化疗药物紫杉醇抗性长生中的功能尚未有人报道。Zhang[17]研究报道, MALAT1在乳腺癌组织中高表达并与疾病进展相关, 并且外泌体促进乳腺癌细胞增殖和外来体介导的MALAT1诱导的细胞增殖, 这些发现表明, 外泌体MALAT1可以调节癌症进展, 可代表一种克服乳腺癌的新策略。Huang等[18]研究报道, MALAT1在乳腺癌中可促进血管的生成, 发挥促进肿瘤生长的作用。Tang等[19]报道, MALAT1通过靶向miR-20b-5p调节HCT-116和HCT-116/5-FU细胞的转移和侵袭, 揭示MALAT1和miR-20b-5p之间的相互作用可能是结肠癌有效治疗的新型靶点。Bai等[20]发现, MALAT1与Notch1相互作用, 而且Notch1敲低可减弱顺铂抗性, 并下调了卵巢癌细胞中多药耐药相关蛋白1的蛋白表达, 提示, 敲除MALAT-1通过抑制Notch1信号通路增强卵巢癌细胞对顺铂的化疗敏感性。本研究检测了紫杉醇诱导的乳腺癌细胞SK-BR-3/PR中MALAT1的表达发现, MALAT1高表达, 沉默MALAT1可增强紫杉醇对SK-BR-3/PR细胞的敏感性, 这与MALAT1在化疗抗性的结直肠癌、肺癌、宫颈癌中的表达及增敏作用相呼应; 沉默MALAT1还可下调SKBR-3/PR细胞耐药基因P-gp、Bcl-2的表达, 上调Bax的表达, 这也说明MALAT1参与乳腺癌对化疗药物抗性的产生过程。这是首次发现MALAT1参与乳腺癌细胞对化疗药物紫杉醇的耐药调控作用, 为MALAT1在乳腺癌中的治疗功能的开发奠定基础。深入研究发现, MALAT1可靶向负调控miR-485-3p的表达, 推测MALAT1在乳腺癌中的功能可能与miR-485-3p相关。
miRNA不仅在人类肿瘤的发生发展中具有重要作用, 其对肿瘤放化疗耐药的产生中也具有重要作用[21-24], 如miR-17、miR-20b、均可调控乳腺癌细胞对紫杉醇的耐药性[25-27]。据报道, miR-485-3p可通过部分改变NFYB来调节Top2α的下调, 参与细胞对药物的敏感性调节[28]。Lucotti[29]发现, miR-485-3p参与前列腺癌对氟达拉滨治疗的敏感性调节。本研究检测了SK-BR-3/PR中miR-485-3p的表达发现, miR-485-3p低表达, 过表达miR-485-3p可增强SK-BR-3/PR对紫杉醇的敏感性, 并下调耐药基因P-gp、Bcl-2的表达, 上调Bax的表达, 这是国内外首次发现miR-485-3p在乳腺癌细胞化疗药耐药中的作用, 为miR-485-3p在癌症化疗中的功能研究提供参考依据; 深入研究发现, 抑制miR-485-3p可逆转沉默MALAT1对SK-BR-3/PR的紫杉醇增敏作用, 这即说明MALAT1可靶向调控miR-485-3p影响对紫杉醇的敏感性, 又说明miR-485-3p也可逆向负调控MALAT1及其功能。
综上所述, 长链非编码RNA MALAT1促进乳腺癌细胞对紫杉醇的耐药性, 其机制可能与靶向miR-485-3p有关, 为乳腺癌的治疗提供新的靶点。
| [1] |
Peng WX, Koirala P, Mo YY. LncRNA-mediated regulation of cell signaling in cancer[J]. Oncogene, 2017, 36(41): 5661-7. DOI:10.1038/onc.2017.184 |
| [2] |
Xu SP, Wang PY, Zhang J, et al. Ai-lncRNA EGOT enhancing autophagy sensitizes paclitaxel cytotoxicity via upregulation of ITPR1 expression by RNA-RNA and RNA-protein interactions in human cancer[J]. Mol Cancer, 2019, 18(1): 89. DOI:10.1186/s12943-019-1017-z |
| [3] |
Tsai MC, Spitale RC, Chang HY. Long intergenic noncoding RNAs:new links in cancer progression[J]. Cancer Res, 2011, 71(1): 3-7. DOI:10.1158/0008-5472.CAN-10-2483 |
| [4] |
Li LJ, Leng RX, Fan YG, et al. Translation of noncoding RNAs:Focus on lncRNAs, pri-miRNAs, and circRNAs[J]. Exp Cell Res, 2017, 361(1): 1-8. DOI:10.1016/j.yexcr.2017.10.010 |
| [5] |
祝烨, 宋鑫. miRNA与lncRNA的相互调控作用在肿瘤中的研究进展[J]. 基础医学与临床, 2015, 35(11): 1554-8. |
| [6] |
Wilusz JE, Sunwoo H, Spector DL. Long noncoding RNAs:functional surprises from the RNA world[J]. Genes Dev, 2009, 23(13): 1494-504. DOI:10.1101/gad.1800909 |
| [7] |
Ji P, Diederichs S, Wang WB, et al. MALAT-1, a novel noncoding RNA, and thymosin beta4 predict metastasis and survival in earlystage non-small cell lung cancer[J]. Oncogene, 2003, 22(39): 8031-41. DOI:10.1038/sj.onc.1206928 |
| [8] |
Schorderet P, Duboule D. Structural and functional differences in the long non-coding RNA hotair in mouse and human[J]. PLoS Genet, 2011, 7(5): e1002071. DOI:10.1371/journal.pgen.1002071 |
| [9] |
Jadaliha M, Zong XY, Malakar P, et al. Functional and prognostic significance of long non-coding RNA MALAT1 as a metastasis driver in ER negative lymph node negative breast cancer[J]. Oncotarget, 2016, 7(26): 40418-36. DOI:10.18632/oncotarget.9622 |
| [10] |
Lou C, Xiao M, Cheng S, et al. MiR-485-3p and miR-485-5p suppress breast cancer cell metastasis by inhibiting PGC-1α expression[J]. Cell Death Dis, 2016, 7(3): e2159. DOI:10.1038/cddis.2016.27 |
| [11] |
Wang M, Cai WR, Meng R, et al. miR-485-5p suppresses breast cancer progression and chemosensitivity by targeting survivin[J]. Biochem Biophys Res Commun, 2018, 501(1): 48-54. DOI:10.1016/j.bbrc.2018.04.129 |
| [12] |
Hu XX, Xu XN, He BS, et al. microRNA-485-5p functions as a tumor suppressor in colorectal cancer cells by targeting CD147[J]. J cancer, 2018, 9(15): 2603-11. DOI:10.7150/jca.24918 |
| [13] |
Huang RS, Zheng YL, Li C, et al. MicroRNA-485-5p suppresses growth and metastasis in non-small cell lung cancer cells by targeting IGF2BP2[J]. Life Sci, 2018, 199: 104-11. DOI:10.1016/j.lfs.2018.03.005 |
| [14] |
Rovira-Rigau M, Raimondi G, Marín MÁ, et al. Bioselection reveals miR-99b and miR-485 as Enhancers of adenoviral oncolysis in pancreatic cancer[J]. Mol Ther, 2019, 27(1): 230-43. DOI:10.1016/j.ymthe.2018.09.016 |
| [15] |
Wang ZQ, Zhang MY, Deng ML, et al. Low serum level of miR-485-3p predicts poor survival in patients with glioblastoma[J]. PLoS One, 2017, 12(9): e0184969. DOI:10.1371/journal.pone.0184969 |
| [16] |
赵遵兰, 蔡颖, 王洋洋, 等. 微小RNA-21对人乳腺癌细胞株紫杉醇耐药性的影响及其机制[J]. 浙江大学学报:医学版, 2015, 44(4): 400-9. |
| [17] |
Zhang P, Zhou HX, Lu KF, et al. Exosome-mediated delivery of MALAT1 induces cell proliferation in breast cancer[J]. Onco Targets Ther, 2018, 11: 291-9. DOI:10.2147/OTT.S155134 |
| [18] |
Huang XJ, Xia Y, He GF, et al. MALAT1 promotes angiogenesis of breast cancer[J]. Oncol Rep, 2018, 40(5): 2683-9. |
| [19] |
Tang DX, Yang Z, Long FX, et al. Inhibition of MALAT1 reduces tumor growth and metastasis and promotes drug sensitivity in colorectal cancer[J]. Cell Signal, 2019, 57: 21-8. DOI:10.1016/j.cellsig.2019.01.013 |
| [20] |
Bai L, Wang AH, Zhang YL, et al. Knockdown of MALAT1 enhances chemosensitivity of ovarian cancer cells to cisplatin through inhibiting the Notch1 signaling pathway[J]. Exp Cell Res, 2018, 366(2): 161-71. DOI:10.1016/j.yexcr.2018.03.014 |
| [21] |
黄耀孟, 吴珺. miRNA在乳腺癌诊断、预后和预测中的应用[J]. 河北医科大学学报, 2018, 39(9): 1100-6. DOI:10.3969/j.issn.1007-3205.2018.09.027 |
| [22] |
Bach DH, Hong JY, Park HJ, et al. The role of exosomes and miRNAs in drug-resistance of cancer cells[J]. Int J Cancer, 2017, 141(2): 220-30. |
| [23] |
许雷来, 朱星瑜, 谢璐帆, 等. miRNA失控表达在乳腺癌耐药中的研究进展[J]. 浙江中西医结合杂志, 2016, 26(7): 683-7. DOI:10.3969/j.issn.1005-4561.2016.07.038 |
| [24] |
杜红梅, 张玉超, 李静, 等. 循环miRNA用于乳腺癌早期诊断的meta分析[J]. 郑州大学学报:医学版, 2016, 51(6): 752-7. |
| [25] |
Ao X, Nie PP, Wu BY, et al. Decreased expression of microRNA-17 and microRNA-20b promotes breast cancer resistance to taxol therapy by upregulation of NCOA3[J]. Cell Death Dis, 2016, 7(11): e2463. DOI:10.1038/cddis.2016.367 |
| [26] |
蒋雪梅, 权毅. 上调miRNA-27a-3p对乳腺癌MCF-7细胞增殖、侵袭和迁移能力的影响[J]. 郑州大学学报:医学版, 2019, 54(2): 279-83. |
| [27] |
李文晶, 冯同保, 戚春建. miR-124参与紫杉醇诱导的乳腺癌细胞株MCF -7生长抑制[J]. 实用肿瘤学杂志, 2014(4): 289-93. |
| [28] |
Chen CF, He XL, Arslan AD, et al. Novel regulation of nuclear factorYB by miR-485-3p affects the expression of DNA topoisomerase IIα and drug responsiveness[J]. Mol Pharmacol, 2011, 79(4): 735-41. DOI:10.1124/mol.110.069633 |
| [29] |
Lucotti S, Rainaldi G, Evangelista M, et al. Fludarabine treatment favors the retention of miR-485-3p by prostate cancer cells:implications for survival[J]. Mol Cancer, 2013, 12(1): 52. DOI:10.1186/1476-4598-12-52 |
 2020, Vol. 40
2020, Vol. 40

