2. 皖南医学院生理科学研究所 心理生理学研究室,安徽 芜湖 241002;
3. 皖南医学院细胞电生理研究室,安徽 芜湖 241002
2. Neurobiology Laboratory, Institute of Physiological Sciences, Wannan Medical College, Wuhu 241002, China;
3. Cell Electrophysiology Laboratory, Wannan Medical College, Wuhu 241002, China
烟碱型乙酰胆碱受体(nAChR)在脊髓腹角广泛分布,对于脊髓运动控制具有重要的调节功能,尼古丁(烟碱)是其选择性激动剂[1-2]。已有研究证实人类多种神经系统疾病与nAChR有关,如阿尔茨海默氏病、帕金森氏病、精神分裂症、抑郁症、慢性疼痛和成瘾等[3]。依托咪酯(ET)是一种静脉麻醉药,具有起效快、恢复迅速并且镇痛效果确切等优点,被广泛用于临床麻醉。目前关于ET、丙泊酚等发挥麻醉作用的中枢机制研究结果表明,这些麻醉药主要是通过加强γ-氨基丁酸能系统的作用而抑制中枢神经细胞的兴奋性[4-6]。有关ET在脊髓水平的研究仅限于背角,在脊髓腹角水平上的研究也主要集中在谷氨酸受体方面[7],然而有关ET对脊髓腹角神经元上的nAChR功能是否存在直接或间接作用未见报道。因此,本研究拟应用7~12 d新生大鼠的脊髓腹角神经元急性机械分离同时结合穿孔膜片钳记录技术和药理学方法,记录分析ET对脊髓腹角神经元电生理特性及nAChR的影响。这不仅有助于深化麻醉药ET对脊髓运动控制作用机制的进一步认识,也将为指导临床用药提供理论依据。
1 材料和方法 1.1 实验动物选用19只7~12 d的SD新生大鼠,雌雄不限,由江苏南京青龙山动物繁殖场提供。动物合格证号:SCXK(苏)2017-0001。动物使用遵循皖南医学院实验室动物饲养和使用规章条例。
1.2 实验药品人工脑脊液(ACSF)、标准细胞外液、电极内液以及膜片钳穿孔药的配制方法均参照实验室前期工作[8-9]。ET、Nicotine、HEPES、EGTA、K-gluconate、Na2-ATP、Na-GTP、Tris-base(Sigma-Aldrich);Amphotericin B(AB,Tocris Bioscience);其他试剂均购自国药集团化学试剂有限公司。
1.3 脊髓腹角神经元的分离脊髓切片按照实验室前期工作的程序制备[8-9],简而言之,7~12 d的SD新生大鼠麻醉后,将含腰骶膨大的脊髓从椎管内游离出,修剪神经根后,应用震荡切片机(Vibratome, Technical Products International Inc, USA)切取4~5片厚度为400~500 μm的切片,并在室温(23~ 25 ℃)ACSF中孵育至少30 min,ACSF含有124 mmol/L NaCl、24 mmol/L NaHCO23、5 mmol/L KCl、2.4 mmol/L CaCl2、21.3 mmol/L MgSO4、1.2 mmol/L KH2PO4和10 mmol/L葡萄糖,pH为7.35~7.45,并持续通以95%O2和5%CO2的混合气。从剥离脊髓至切片结束应在15 min内完成;将切片移入含木瓜蛋白酶的ACSF(恒温水浴锅控温33 ℃)中进行酶消化20~30 min;之后,将其置于新鲜ACSF中室温下孵育60 min终止消化,全程继续通混合O2;在体视显微镜下以中央管为中心对半切取脊髓腹角,并转移至35mm×10mm培养皿(Corning, NY)中,培养皿内充满氧饱和的标准细胞外液(配方:5 mmol/L KCl、2 mmol/L CaCl2、150 mmol/L NaCl、1 mmol/L MgCl2、10 mmol/L葡萄糖和10 mmol/L HEPES,用Tris碱调节pH至7.4)。最后,使用经火抛光的不同口径的巴斯德吸管机械分离出单细胞,单个分离的神经元通常在10 min内粘附在培养皿底部,保持良好的形态和功能达2~4 h。
1.4 穿孔膜片钳记录对分离的脊髓腹角神经元进行穿孔膜片钳记录,具体步骤参照实验室前期工作[8-9]。将含分离细胞的培养皿置于倒置显微镜(Leica DMI 3000 B)的载物台上,观察并选取胞体大而通透、突起较多、状态较好的神经元,调整好给药管与目标细胞的位置;将拉制成形的玻璃微电极(Sutter Instrument, Inc.)充灌含穿孔药的电极内液(电极内液含120 mmol/L K-gluconate、20 mmol/L KCl、2 mmol/L MgCl2、0.5 mmol/L EGTA、20 mmol/L HEPES、2 mmol/L Na2-ATP、0.5 mmol/L Na-GTP且pH调节至7.26,将含穿孔药AB的原液(DMSO中40 mg/mL)用上述电极内液稀释至最终浓度(200 μg/mL))。在电流钳模式下,记录不同浓度的ET对分离的脊髓腹角神经元自发放电的影响;在电压钳模式下,神经元基础钳制电位(VH)设置为-70 mV,当接入电阻(Ra) < 60 MΩ时可进行记录,给予nAChR选择性激动剂尼古丁,观察ET对尼古丁电流的作用。
1.5 实验模式与给药方法本实验中所有的给药途径均是通过快速灌流给药系统(SF-77B Perfusion Fast-step, Warner Instrument Corporation)实现的,并且每次用药结束后均用标准细胞外液冲洗2 min,待尼古丁电流稳定后再给药并记录。
在电流钳模式下,取静息电位负值大于-60 mV且动作电位中有超射,记录稳定、状态良好的细胞进行实验。首先记录在没给药前神经元的自发放电,然后对同一神经元分别经0.3、3.0、30.0 μmol/L(3.0 μmol/L相当于临床浓度[7])不同浓度的ET持续灌流2 min后,记录自发放电变化。
为了探讨ET对nAChR的作用,在电压钳模式下,首先分别单独应用0.4 mmol/L的尼古丁以及30.0 μmol/L的ET作用于同一神经元,记录其诱发电流情况,以确定ET自身能否直接诱导出电流,对实验是否存在干扰作用。再应用相同浓度的ET对钳制的神经元预处理2 min后,观察对尼古丁电流的影响。
在浓度依赖实验中,在相同钳制电位(VH=-70 mV)下,分别应用不同浓度(0.3、3.0、30.0 μmol/L)的ET对钳制的神经元预处理2 min,观察对尼古丁电流的影响。
在电压依赖实验中,将钳制电位分别设置为-30、-50和-70 mV,观察在不同钳制电位下,ET对钳制细胞的尼古丁电流的影响。
在使用依赖性实验中,首先,在10 min之内,记录细胞每隔2 min持续2 s暴露于0.4 mmol/L的尼古丁,记录电流变化,以确定电流记录的稳定性;然后,对同一细胞用30.0 μmol/L的ET预处理6 min,在此过程中分别于0、2、4、6 min时将神经元先后4次暴露于同浓度的尼古丁,记录电流变化;最后,用标准细胞外液冲洗细胞6 min,待尼古丁电流完全恢复后,再用相同浓度的ET预处理6 min,但仅在开始和结束时(即0、6 min)两次暴露于同浓度的尼古丁,记录电流变化。
1.6 数据采集与分析应用图像采集软件(LAS V3.8, Leica)拍摄目标细胞形态;Clampex 10.6软件记录保存数据,Clampfit 10.6软件、SPSS18.0等软件进行数据统计分析及制图。数据以均数±标准差表示,采用配对t检验和单因素方差分析进行检验,P < 0.05为差异有统计学意义。
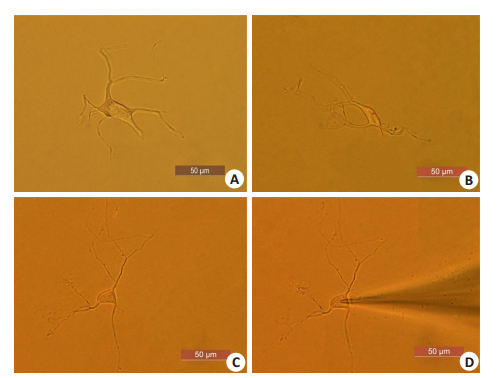
2 结果 2.1 脊髓腹角神经元的形态学观察在显微镜下观察,分离的脊髓腹角神经元形态完整,胞体形状各异,从极端发出的突起较多且有分支(图 1),适于膜片钳记录。
|
图 1 显微镜下脊髓腹角神经元的形态 Fig.1 Morphology of neurons in the ventral horn of spinal cord under the microscope.A: a quadrilateral neuron; B, C: Neurons with rhomboids and triangles, respectively; D: A Neuron clamped by a glass microelectrode |
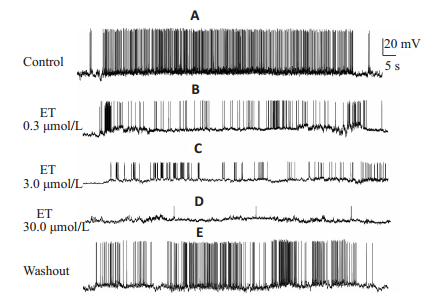
记录到21例脊髓腹角神经元有自发AP,其中在12例神经元观察到ET对AP的幅度、超射以及锋电位幅度呈浓度依赖性抑制(P < 0.01),并减少了自发放电频率(P < 0.01),但对静息电位无显著影响。在另外9例神经元中,AP被3.0或30.0 μmol/L的ET完全取消(图 2,表 1)。
|
图 2 不同浓度的ET对脊髓腹角神经元自发动作电位的影响 Fig.2 Effect of different concentrations of ET on spontaneous action potentials of spinal ventral neurons. A: Spontaneous discharge of a neuron in the ventral horn of spinal cord within 1 minute; B-D: Spontaneous discharge of the same neuron after pretreatment with 0.3, 3.0, and 30.0 μmol/L ET for 2 min, respectively; E: Spontaneous discharge of the same neuron after 2 min ofwashing with standard extracellular fluid |
| 表 1 不同浓度的ET对新生大鼠离体脊髓腹角神经元电生理特性的影响 Tab.1 Effects of different concentrations of ET on the electrophysiological characteristics of isolated ventral horn neurons of spinal cord in neonatal rats (Mean±SD, n=12) |
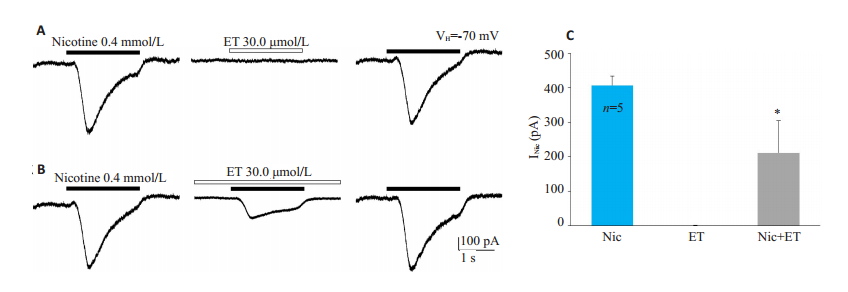
0.4 mmol/L的尼古丁可以在脊髓腹角神经元中诱导出内向电流,其电流平均幅度为407.30±27.27 pA,而单独应用30.0 μmol/L ET并不能诱导出电流(图 3A),但对尼古丁电流具有可逆的压抑作用(图 3B),压抑后的电流平均幅度为212.04±93.35 pA(P < 0.05,n=5,图 3C)。
|
图 3 ET对尼古丁电流的作用 Fig.3 Effect of ET on nicotinic currents (VH=- 70 mV, n=5). A: Nicotine alone (0.4 mmol/L) could induce inward current, while ET alone (30.0 μmol/L) could not induce current; B: After pretreatment with ET for 2 minutes, nicotinic current was reversibly suppressed; C: Bar chart showing the effect of ET on nicotinic currents. *P < 0.05 vs the Nic group |
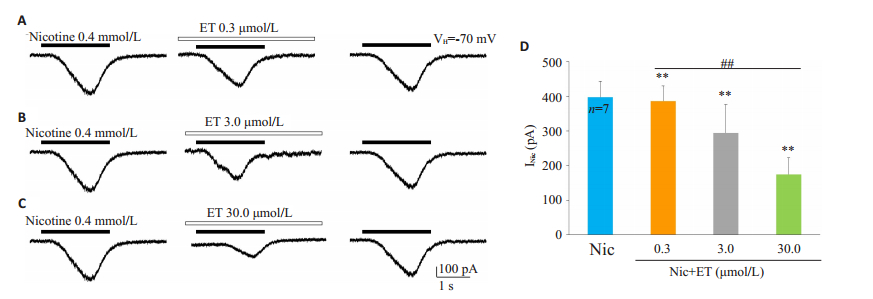
在记录的7例腹角神经元中,0.4 mmol/L的尼古丁诱导出内向电流的平均幅度为397.43±45.43 pA,0.3、3.0、30.0 μmol/L的ET将尼古丁电流幅度分别压抑至386.53±43.15、294.30±81.53、174.80±47.26 pA(P < 0.01),抑制率分别为(2.86±1.68)%、(26.57±15.48)%、(56.29±8.20)%(P < 0.01,图 4)。
|
图 4 ET对脊髓腹角神经元尼古丁电流的浓度依赖性抑制作用 Fig.4 ET concentration-dependently inhibits nicotinic currents in ventral horn neurons of spinal cord(VH=-70 mV, n=7). |
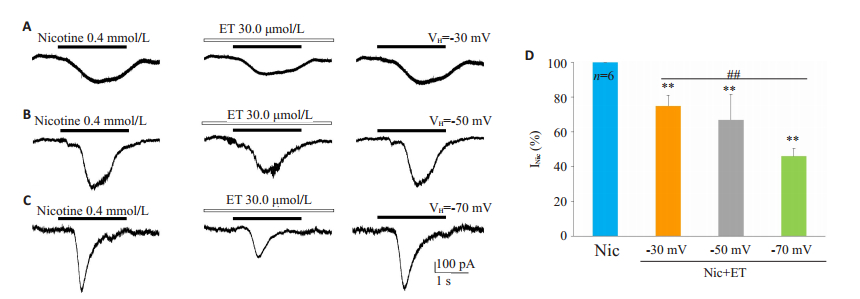
当VH=-30、-50、-70 mV时,0.4 mmol/L的尼古丁诱导出的内向电流平均幅度分别为160.47±6.48、316.43±51.80、436.43±81.68 pA(P < 0.01,n=6),在以上3种不同钳制电位下,30.0 μmol/L的ET将尼古丁电流幅度分别压抑至120.88±12.17、207.88 ±34.87、200.29± 43.52 pA(P < 0.01),抑制率分别为(24.83 ± 6.08)%、(33.17±14.58)%、(54.33±4.50)%(P < 0.01,图 5)。
|
图 5 ET对脊髓腹角神经元尼古丁电流的电压依赖性抑制作用 Fig.5 ET-induced voltage-dependent inhibition of nicotinic currents in spinal ventral horn neurons (n=6 for each holding potential). |
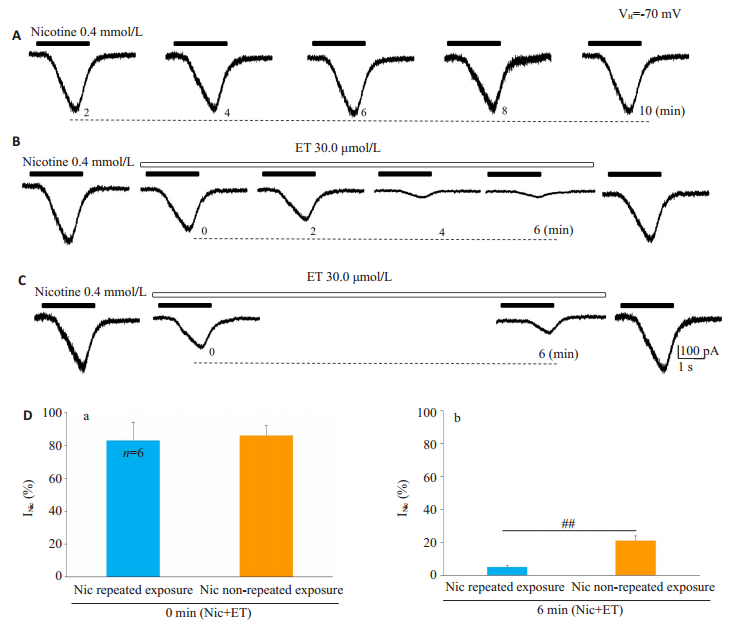
在10 min之内的5次尼古丁暴露过程中,所记录的电流幅度稳定,在ET预处理6 min的4次暴露过程中,ET逐渐压抑了尼古丁电流的幅度,并且在0、6 min所获得的电流幅度分别为对照组电流的(82.50 ±10.54)%、(5.17±1.47)%。在ET预处理6 min的两次暴露中,电流幅度分别为对照组的(85.83 ± 5.78)%、(21.00±3.46)%。针对同一记录的细胞,ET对尼古丁重复暴露诱发的电流[占对照组电流的(5.17±1.47)%]比尼古丁非重复暴露诱发的电流[占对照组电流的(21.00±3.46)%]产生了更强的抑制作用(P < 0.01,图 6)。
|
图 6 ET以使用依赖的方式抑制尼古丁电流 Fig.6 ET inhibits nicotinic currents in a use-dependent manner (n=6). A: Within 10 min, the neuron in the ventral horn of spinal cord was repeatedly exposed to 0.4 mmol/L nicotine (for 2 s every 2 min), and the amplitude of the currents remained unchanged; B: During continuous treatment with ET (30.0 μmol/L) for 6 min, the spinal ventral horn neurons were repeatedly exposed to 0.4 mmol/L nicotine, and the nicotinic currents were significantly inhibited; C: During the 6 min of continuous ET treatment, nicotinic currents were recorded only at the beginning and the end of the treatment; D: Bar chart showing the effect of ET on the currents when exposed to nicotine repeatedly or only at the beginning (0 min) and the end (6 min); a: There was no significant difference in the amplitude of the currents at 0 min of ET treatment between repeated and non-repeated nicotine exposure; b: Therewas a significant difference in magnitude of the currents at 6 min of ET treatment between repeated nicotine exposure and non-repeated exposure, ##P < 0.01 |
本实验发现ET以浓度依赖的方式抑制脊髓腹角神经元的自发放电,同时还以浓度、电压和使用依赖的方式压抑nAChR介导的电流。目前有关ET在脊髓水平的研究仅限于背角神经元,在腹角水平上的研究也主要集中在谷氨酸受体以及某些离子通道方面[7]。脊髓腹角中最主要的神经元是运动神经元,运动神经元在全麻药抗伤害性作用中是一重要环节,但现阶段关于ET发挥麻醉作用的脊髓机制尚不完全清楚。本实验采用膜片钳记录技术,且实验结果表明:0.3、3.0、30.0 μmol/L的ET呈可逆地、浓度依赖地抑制脊髓腹角神经元AP的幅度,甚至取消其产生,说明ET可能对脊髓运动神经元在单细胞水平上呈现直接抑制作用。
AP是生物电信号传导和生物膜反应的基础,适宜刺激能诱发可兴奋细胞膜内外离子流动从而改变膜电位,电压门控Na+(VGSC)、K+、Ca2+及Cl-通道的功能状态影响AP的幅度及发放频率[10]。其中抑制VGSC开放或致其失活是导致AP抑制的直接原因[11],已证明VGSC对所有常规的麻醉药均敏感[12-13]。本实验中有9例脊髓腹角神经元的AP被3.0、30.0 μmol/L ET完全抑制,这可能就是Na+通道失活或开放速率减小所致。就本实验而言,ET浓度依赖性抑制脊髓腹角神经元AP幅度、超射和锋电位幅度,这些结果也可能源于Na+通道失活或开放速率减小。另外该实验研究结果与本实验室前期通过细胞内记录技术所获得的结果基本一致[7]。
脊髓腹角中的运动神经元具有较高的放电频率,本实验中ET浓度依赖性地抑制脊髓腹角神经元的放电频率,但之后均可被标准细胞外液洗脱,所以ET可能是通过抑制运动神经元的放电频率而抑制运动。在新生大鼠心内神经节神经元研究发现,静脉麻醉药硫喷妥钠能可逆地、选择性抑制nAChR介导的胞内钙水平的瞬时增加[14]。已知nAChR能介导兴奋性突触传递[15-17],本研究提示ET对尼古丁受体介导电流的压抑也可能是造成对自发放电频率抑制的原因之一。
ET对脊髓腹角神经元尼古丁电流呈浓度依赖性抑制,提示ET是一种有效的nAChR拮抗剂。已有研究表明,ET对nAChR发挥抑制作用时,其所需浓度要高于临床麻醉浓度[18]。该实验应用的3.0 μmol/L的浓度相当于临床浓度,30.0 μmol/L的浓度属于较高浓度,且ET对nAChR呈浓度依赖性抑制,这与实验室前期研究ET对脊髓运动神经元上NMDA受体和非NMDA受体的作用结果基本一致[7]。
nAChR是变构蛋白,依据nAChR拮抗剂作用机制与作用位点不同,拮抗剂分为两大类[19]:非变构拮抗剂和变构拮抗剂,而那些效应位点称作变构调节位点。nAChR中存在变构调节位点,由于这些位点使nAChR发生变构,使得nAChR对激动剂不敏感即处于失敏状态。因此,变构拮抗剂能加速nAChR失敏[20]。一般来说,拮抗剂对受体介导电流的电压依赖性抑制,其主要机制为受体拮抗剂作用在受体通道内部或通道与脂质分子层交界部位[21]。如果变构拮抗剂作用在nAChR的离子通道内部,那么,伴随膜电位的增大,更多药物分子能够顺电压梯度进入nAChR的离子通道内部,因而阻断通道电流,并表现出电压依赖性。脊髓腹角中的nAChR属于神经元型烟碱受体,在本实验中,ET对脊髓腹角神经元尼古丁电流呈电压依赖性的抑制,说明ET是变构拮抗剂且在nAChR上的作用位点可能位于通道内部。
本实验中,ET对尼古丁重复暴露诱发的电流比尼古丁非重复暴露诱发的电流产生了更强的抑制作用,即存在使用依赖性抑制作用。这表明ET对尼古丁电流的抑制可能涉及激动剂诱导的nAChR转变为对拮抗剂具有更高亲和力或者允许其自由进入其结合位点的构象,但前提是需要通道处于开放的状态下,ET才能发挥作用[22-23],即发挥开放通道阻滞的作用,这与相关报道的使用依赖的通道阻断机制一致[24]。
综上所述,ET主要适用于短时手术麻醉和全麻诱导,在临床上可以与其他麻醉剂联合应用,从而应用于全麻的维持阶段。还有研究发现,脊髓损伤后若立即给予ET,能起到神经保护作用[25]。故ET在临床上将具有很大的应用前景。本实验发现ET对脊髓腹角神经元nAChR有抑制作用,提示ET具有抑制胆碱能作用,且进一步揭示了ET麻醉的脊髓机制,表明ET在麻醉过程中兼有肌松作用,但其对nAChR的作用是否存在亚型选择性等问题,仍需进一步探讨和研究。
| [1] |
Gonzalez-Gutierrez JP, Hodar M, Viscarra F, et al. Minimal structural changes determine full and partial nicotinic receptor agonist activity for nicotine analogues[J]. Molecules, 2019, 24(15): 1-11. |
| [2] |
Dineley KT, Pandya AA, Yakel JL. Nicotinic ACh receptors as therapeutic targets in CNS disorders[J]. Trends Pharmacol Sci, 2015, 36(2): 96-108. |
| [3] |
Pan ZH, Zhao MW, Peng YL, et al. Functional divergence analysis of vertebrate neuronal nicotinic acetylcholine receptor subunits[J]. J Biomol Struct Dyn, 2019, 37(11): 2938-48. |
| [4] |
黄蕊, 肖辉, 崔小岱. 麻醉影响神经系统的作用机制研究进展[J]. 神经损伤与功能重建, 2017, 12(6): 547-9. |
| [5] |
Hong Z, Wang DS. Potentiation, activation and blockade of GABAA receptors by etomidate in the rat sacral dorsal commissural neurons[J]. Neuroscience, 2005, 132(4): 1045-53. |
| [6] |
Chen L, Yang ZL, Cheng J, et al. Propofol decreases the excitability of cholinergic neurons in mouse basal forebrain via GABAA receptors[J]. Acta Pharmacol Sin, 2019, 40(6): 755-61. |
| [7] |
郑超, 汪萌芽. 依托咪酯对新生大鼠离体脊髓运动神经元下行激活的影响[J]. 生理学报, 2012, 64(2): 155-62. |
| [8] |
高凌云, 张环环, 查盈盈, 等. 急性分离的脊髓腹角神经元膜片钳记录技术[J]. 皖南医学院学报, 2017, 36(6): 511-5. |
| [9] |
黄艳, 高凌云, 朱苏月, 等. Orexin-A对脊髓腹角神经元基本电生理参数及尼古丁电流的作用[J]. 皖南医学院学报, 2019, 38(3): 205-10. |
| [10] |
于婵娟, 蒋晖, 黄春阳, 等. 依托咪酯对大鼠海马CA1区神经元动作电位及离子通道的影响[J]. 中国临床药理学杂志, 2014, 30(7): 611-4. |
| [11] |
郑超, 汪萌芽. 依托咪酯对离体大鼠脊髓运动神经元感觉传入的差异性作用[J]. 中国危重病急救医学, 2011, 23(10): 593-8. |
| [12] |
Raju SG, Barber AF, LeBard DN, et al. Exploring volatile general anesthetic binding to a closed membrane- bound bacterial voltagegated sodium channel via computation[J]. PLoS Comput Biol, 2013, 9(6): e1003090-8. |
| [13] |
Yang E, Zhi LT, Liang QS, et al. Electrophysiological analysis of voltage-gated Ion channel modulation by general anesthetics[J]. Meth Enzymol, 2018, 602(4): 339-68. |
| [14] |
Weber M, Motin L, Gaul S, et al. Intravenous anaesthetics inhibit nicotinic acetylcholine receptor- mediated currents and Ca2+ transients in rat intracardiac ganglion neurons[J]. Br J Pharmacol, 2005, 144(1): 98-107. |
| [15] |
Finnegan TF, Li DP, Chen SR, et al. Activation of mu-opioid receptors inhibits synaptic inputs to spinally projecting rostral ventromedial medulla neurons[J]. J Pharmacol Exp Ther, 2004, 309(2): 476-83. |
| [16] |
Perrins R, Roberts A. Cholinergic and electrical synapses between synergistic spinal motoneurones in the Xenopus laevis embryo[J]. J Physiol (Lond), 1995, 485(Pt1): 135-44. |
| [17] |
Nishimaru H, Restrepo CE, Kiehn O. Activity of Renshaw cells during locomotor-like rhythmic activity in the isolated spinal cord of neonatal mice[J]. J Neurosci, 2006, 26(20): 5320-8. |
| [18] |
Tassonyi E, Charpantier E, Muller D, et al. The role of nicotinic acetylcholine receptors in the mechanisms of anesthesia[J]. Brain Res Bull, 2002, 57(2): 133-50. |
| [19] |
郑建全, 何湘平, 杨爱珍, 等. 三环哌酯对培养交感神经元烟碱受体的阻断作用[J]. 中国药理学报, 2000, 21(11): 1016-20. |
| [20] |
Léna C, Changeux JP. Allosteric modulations of the nicotinic acetylcholine receptor[J]. Trends Neurosci, 1993, 16(5): 181-6. |
| [21] |
刘振伟. 实用膜片钳技术[M]. 北京: 军事医学科学出版社, 2006.
|
| [22] |
Zhao XL, Salgado VL, Yeh JZ, et al. Kinetic and pharmacological characterization of desensitizing and non-desensitizing glutamategated chloride channels in cockroach neurons[J]. Neurotoxicology, 2004, 25(6): 967-80. |
| [23] |
Zheng C, Wang MY, Liu Q, et al. U18666A, a cholesterol-inhibition agent, modulates human neuronal nicotinic acetylcholine receptors heterologously expressed in SH-EP1 cell line[J]. J Neurochem, 2009, 108(6): 1526-38. |
| [24] |
MacDonald JF, Miljkovic Z, Pennefather P. Use-dependent block of excitatory amino acid currents in cultured neurons by ketamine[J]. J Neurophysiol, 1987, 58(2): 251-66. |
| [25] |
Cayli SR, Ates O, Karadag N, et al. Neuroprotective effect of etomidate on functional recovery in experimental spinal cord injury[J]. Int J Dev Neurosci, 2006, 24(4): 233-9. |
 2020, Vol. 40
2020, Vol. 40

