急性淋巴细胞白血病(ALL)是儿童最常见的恶性肿瘤[1], 其中急性T淋巴细胞白血病(T-ALL)恶性程度高, 疾病进展快且易复发[2-5], 其五年无事件生存率(EFS)为60%~75%, 显著低于其他类型ALL [6]。目前, T-ALL在高强度联合化疗下儿童患者的总体存活率提高[7], 但难治性T-ALL尚不能完全缓解,且药物反应差[8]。T-ALL的发病新机制和治疗新靶点亟待研究。
β-arrestin1是多功能支架蛋白,参与和调控多种肿瘤相关信号通路[9-11]。我们课题组前期研究发现,β-arrestin1鼠T-ALL患者样本中表达降低,且过表达β-arrestin1可抑制人T-ALL细胞系Jurkat细胞增殖,促进Jurkat细胞凋亡[11]。β-arrestin1在体内对T-ALL进展的影响还未明确,且未标记的肿瘤细胞在小鼠体内的增殖和转移无法实时监控。故本文构建了荧光素酶标记的人Molt-4细胞系,并在其基础上过表达或敲低β-arrestin1,探讨β-arrestin1对T-ALL进展的影响。
1 对材料和方法 1.1 材料T-ALL细胞系Molt-4细胞购自美国ATCC细胞库;RPMI 1640培养基(Gibco);胎牛血清(FBS)、嘌呤霉素(Sigma);聚凝胺(polybrene)(汉恒);荧光素酶底物(Promaga);逆转录试剂盒、SYBR GreenⅡ、RIPA细胞裂解液及Trizol RNA提取液(TaKaRa);BCA蛋白质定量检测试剂盒(碧云天);兔源单克隆抗体β-arrestin1(Abcam);兔源单克隆抗体GAPDH(武汉山鹰);辣根过氧化物酶标记的羊抗兔IgG(中杉金桥);ECL发光试剂盒(Millipore);编码荧光素酶的慢病毒、过表达β-arres-tin1慢病毒、β-arrestin1基因siRNA病毒和对照空载慢病毒由吉凯提供;其他试剂均为分析纯。
1.2 实验动物健康NCG小鼠,雄性,6~8周龄,体质量20~25 g,由南方模式动物中心提供,并饲养于重庆医科大学实验动物中心IVC动物房,许可证号[SCXK(渝)2007-002]。本研究符合重庆医科大学实验动物伦理委员会所制定的伦理学标准。
1.3 方法 1.3.1 细胞培养10% FBS的RPMI 1640培养Molt-4细胞,并置于37℃、5% CO2的培养箱培养。
1.3.2 构建稳定表达荧光素酶Molt-4细胞系取5×105对数生长期的Molt-4细胞,重悬于2 mL RPMI 1640培养基中,加入10 μL慢病毒(滴度为5×108 TU/mL),聚凝胺(6 μg/mL),感染6 h后将悬液离心取细胞沉淀再次感染,重复3次。用10% FBS RPMI 1640继续培养。感染后48 h加入2 μg/mL嘌呤霉素筛选感染细胞,药筛24 h后更换为10% FBS RPMI 1640继续培养,待细胞状态恢复后继续药筛直至无细胞死亡,即为Molt-4-Luc细胞。
1.3.3 荧光素酶表达强度测定取1×105 Molt-4及Molt-4-Luc细胞,磷酸盐缓冲液(PBS)洗涤1次,在细胞沉淀中加入50 μL细胞裂解液,室温摇床震荡15 min,12 000 r/min离心3 min,取10 μL上清加入10 μL 20 mg/mL荧光素酶底物混匀后立即置于生物化学发光检测仪检测。
1.3.4 构建过表达或敲低β-arrestin1Molt-4-Luc细胞株取5×105对数生长期的Molt-4-Luc细胞,以相同的方法感染,感染后72 h荧光显微镜观察细胞,流式细胞术分选绿色荧光蛋白(GFP)阳性细胞株。将稳定过表达β-arrestin1 Molt- 4- Luc细胞命名为β1,稳定敲低β-arrestin1 Molt-4-Luc细胞命名为Siβ1,其对照细胞命名为Scram。β-arrestin1 shRNA序列如下:
Top: 5'CcggGGAAGCTCAAGCACGAAGACAC CTCGAGGTGTCTTCGTGCTTGAGCTTCCTTTTTg -3'; Bottom: 5'-GATCCAAAAAGGAAGCTCAAGCA CGAAGACACCTCGAGGTGTCTTCGTGCTTGAGC TTCC-3'。
1.3.5 qRT-PCR检测收集白血病细胞,提取总RNA,检测RNA浓度并按照逆转录试剂盒说明书完成逆转录,以cDNA为模板进行RT-PCR。扩增体系如下:SYBR Green RT-PCR Master Mix 10 μL,上游和下游引物(10 μmol/L)各0.5 μL,模板2 μL,ddH2O补齐至20 μL。扩增程序:95 ℃ 5 min;95 ℃ 20 s,58 ℃ 20 s,72 ℃ 30 s,35个循环,每个循环结束检测荧光。以GAPDH作为内参,2-△△CT计算基因相对表达量。引物如下:β-arrestin1 qRT- PCR扩增引物:Forward:5'-GACAAAGGGACC CGAGTGTT-3';Reverse:5'-GCAGGTCAGCGTCAC ATAGA-3';GAPDH qRT- PCR扩增引物:Forward:5'-CAGCGACACCCACTCCTCCACCTT-3';Reverse:5'-CATGAGGTCCACCACCCTGTTGCT-3'。
1.3.6 Western blot检测取1×107细胞沉淀加入1 mL RIPA,超声破碎细胞,4 ℃离心20 min,取上清加入5× Loading Buffer,100 ℃煮沸10 min,取15 μL蛋白进行SDS-PAGE电泳,室温封闭1 h,β-arrestin1抗体(1: 1000),GAPDH抗体(1:10 000)4 ℃孵育过夜,TBST洗膜,室温孵育辣根酶标记山羊抗兔IgG抗体(1:5000)1 h,TBST洗膜,ECL发光检测结果。
1.3.7 建立Molt-4细胞异种移植小鼠模型移植前24 h所有NCG鼠经亚致死剂量γ射线全身照射(TBI),照射剂量2.3 Gy,照射剂量率2 Gy/min。β1组、Siβ1组和Scram组分别尾静脉注射5×105 β1、Siβ1和Scram细胞。建模后每日观察小鼠状态,称量小鼠体质量。
1.3.8 小鼠模型荧光活体成像移植后第8、16、24天小鼠进行荧光成像。开启活体分子成像仪预冷20 min,小鼠称质量,腹腔注射200 mg/kg荧光底物;注射10 min后,将小鼠放入活体成像仪内,每只小鼠观测2 min,整个操作过程小鼠均处于异氟烷麻酔状态。
1.3.9 小鼠模型组织病理学检测在细胞移植后16 d处死造模小鼠并解剖。将小鼠肝、脾取出置于4%多聚甲醛溶液固定36~48 h;石蜡包埋,切4 μm厚组织切片,苏木素-伊红染色;光学显微镜下观察并拍照,检测其中肿瘤细胞浸润情况。
1.4 统计学分析数据分析采用SPSS 13.0软件包进行统计分析,并以均数±标准差表示,两组数据间比较采用两独立样本的t检验。以P < 0.05为差异有统计学意义。
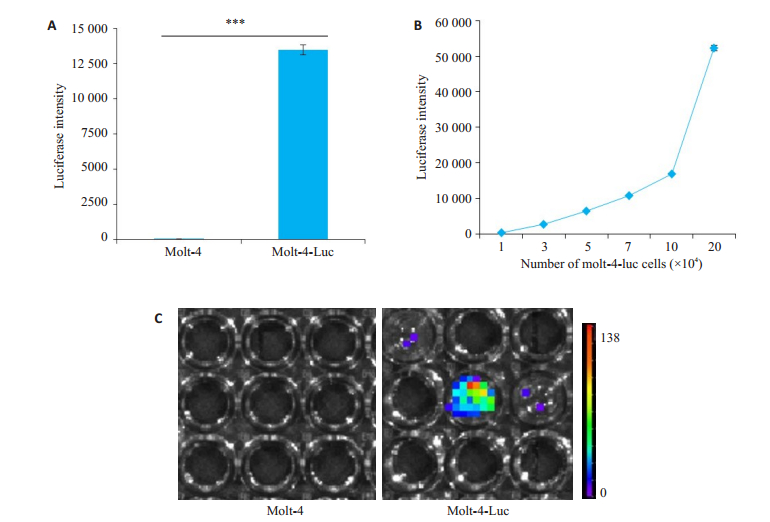
2 结果 2.1 建立荧光素酶标记Molt-4细胞系Molt-4细胞经慢病毒感染后,嘌呤霉素筛选,得到稳定感染的Molt-4-Luc细胞。通过加入荧光素酶底物,检测Molt-4-Luc细胞与亲本Molt-4细胞荧光素酶表达,结果显示,Molt-4-Luc细胞裂解物催化底物发光(图 1A,C),且荧光强度随细胞增多而升高(图 1B),而未标记F-Luc的Molt-4亲本细胞未检测到荧光。
|
图 1 建立荧光素酶标记Molt-4细胞系 Fig.1 Establishment of firefly- luciferase tagged Molt- 4-Luc cell line. A: Luciferase intensity of Molt-4 and Molt-4-Luc cells. ***P < 0.001; B: Molt-4-Luc cell luciferase intensity is proportional to the number of cells; C: Imaging of Molt-4 and Molt-4-Luc cells |
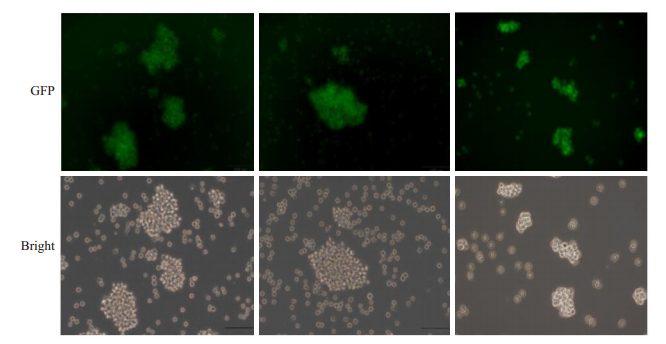
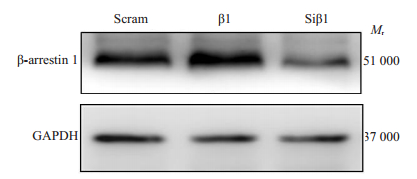
利用β-arrestin1基因表达慢病毒、β-arrestin1基因siRNA病毒及对照空载慢病毒转染Molt-4-Luc细胞,72 h后利用荧光显微镜可观察到绿色荧光,提示细胞成功感染相应慢病毒(图 2)。流式细胞术分选GFP阳性细胞,得到GFP%为90%以上Molt-4-Luc-β1(β1)细胞系、Molt-4-Luc-Siβ1(Siβ1)细胞系及对照空载组细胞系(Scram),检测其β-arrestin1 mRNA和蛋白表达水平。qRT-PCR结果显示,β1细胞与对照细胞(Scram)相比,β-arrestin1 mRNA表达增高(P < 0.01)、Siβ1细胞与对照细胞(Scram)相比,β-arrestin1 mRNA表达降低(P < 0.01)。Western blot结果显示,与对照组相比,β1细胞β-arrestin1蛋白表达水平增加,Siβ1细胞β-arrestin1蛋白表达水平降低(图 3)。
|
图 2 荧光显微镜下Molt-4-Luc细胞感染过表达或敲低β-arrestin1慢病毒及其对照病毒 Fig.2 Representative fluorescent images of Molt-4 cells with β-arrestin1 overexpression or knockdown or cells infected with scrambled lentiviral vectors (Original magnification: × 200). β1: Overexpression of β-arrestin1; Siβ1: β-arrestin1 knockdown; Scram: Control |
|
图 3 Western blotting检测β1、Siβ1和Scram细胞β-arrestin1蛋白表达水平 Fig.3 Western blotting for detecting β-arrestin1 protein level in β1, Siβ1 and Scram cells |
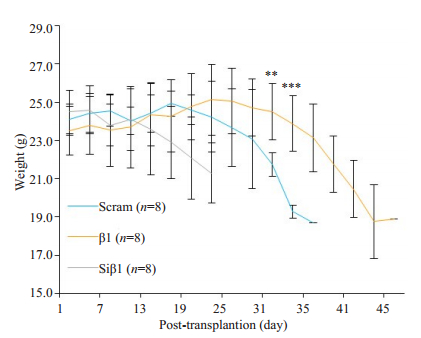
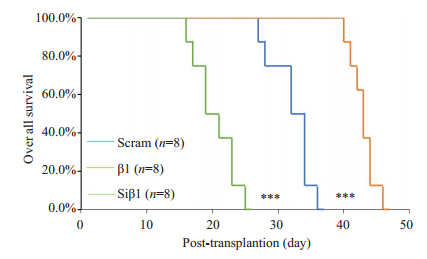
为检测β-arrestin1蛋白对人T-ALL细胞在小鼠体内进展的作用,我们将β1细胞、Siβ1细胞及Scram细胞经尾静脉注射入经辐射清髓的NCG小鼠体内,构建Molt-4细胞小鼠异种移植模型。小鼠注射白血病细胞后,β1组、Siβ1组和对照组(Scram)小鼠分别在25、10和16d左右体质量开始下降(图 4),并出现毛皮粗糙,萎靡少动等表现。终末阶段小鼠可见其枯瘦、弓背、步态不稳、部分小鼠后肢无法活动,中位生存时间分别为43、20和33 d(图 5)。且β1组移植小鼠生存时间显著长于Scram组小鼠(P < 0.001),Siβ1组移植小鼠生存时间显著短于Scram组小鼠(P < 0.001),提示β-arrestin1蛋白在小鼠体内有抑制Molt-4细胞进展作用。
|
图 4 荧光素酶标记的人T-ALL细胞移植后NCG小鼠体质量 Fig.4 Body weight of the luciferase tagged human T-ALL cell xenograft NCG mice model, **P < 0.01, ***P < 0.001, β1 vs Scram |
|
图 5 荧光素酶标记的人T-ALL细胞移植后NCG小鼠生存率 Fig.5 Overall survival of NCG mice bearing luciferase tagged human T-ALL cell xenografts. ***P < 0.001 vs Scram |
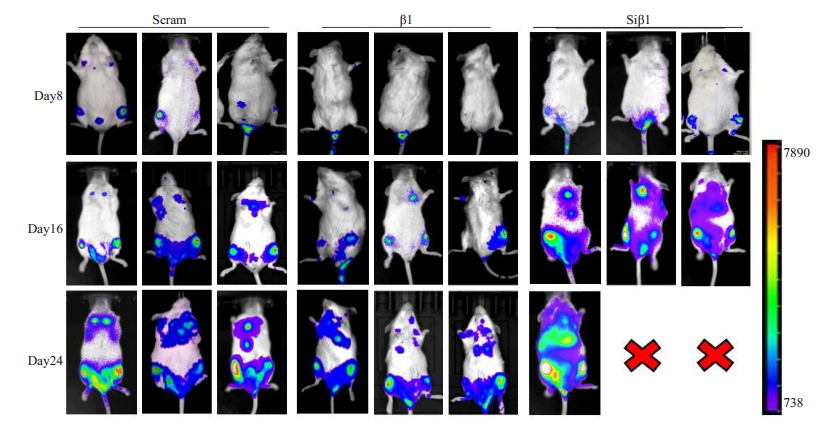
为进一步了解β-arrestin1对Molt-4细胞在小鼠体内进展的作用,我们对移植小鼠腹腔注射荧光素酶底物,通过Molt-4细胞中带有的荧光素酶催化底物发光,对不同时间段小鼠体内肿瘤细胞进行示踪。结果显示,在白血病细胞接种第8天,β1组移植小鼠模型肿瘤细胞主要集中于尾骨,Siβ1组和Scram组移植小鼠模型肿瘤细胞已发展至脊柱及股骨。在白血病细胞接种第16天,β1组移植小鼠模型肿瘤细胞发展到股骨,Scram组移植小鼠模型肿瘤细胞已扩散到上肢及胸骨,且强度明显高于β1组,Siβ1组移植小鼠模型肿瘤细胞已扩散至肝脏和肺部,且强度明显高于Scram组。在白血病细胞接种第24天,β1组移植小鼠模型肿瘤细胞扩散至上肢及胸骨,Scram组移植小鼠模型肿瘤细胞已扩散至肝脾及肺部,且强度明显高于β1组(图 6),Siβ1组仅剩余1只小鼠,且肿瘤细胞在肝脾及肺部有大量扩散。上述结果与小鼠生存时间曲线结果一致,共同提示β-arrestin1蛋白在小鼠体内有抑制Molt-4细胞进展作用。
|
图 6 荧光素酶标记的人T-ALL细胞移植后NCG小鼠活体成像图 Fig.6 Bioluminescence images of NCG mice bearing luciferase-tagged human T-ALL cell xenograft |
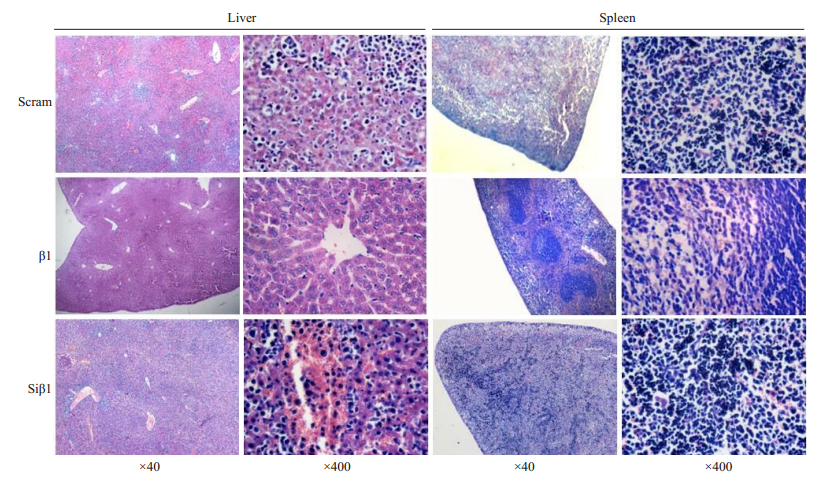
为进一步验证小鼠体内β-arrestin1蛋白对肿瘤进展抑制作用,我们在移植后第16天处死小鼠,收集组织,切片检测肿瘤浸润情况。组织染色结果显示,β1组移植建模小鼠肝、脾组织结构多无异常,少见肿瘤细胞浸润;而Scram组和Siβ1组小鼠肝脾切片中则发现各组织结构大量破坏,且大量肿瘤细胞浸润(图 7),结果与荧光素酶体内示踪结果一致。综上所述,我们通过构建Molt-4细胞小鼠异种移植模型,证明β-arrestin1蛋白在小鼠体内有抑制Molt-4细胞进展作用。
|
图 7 T-ALL异种移植NCG小鼠模型的肝脏、脾脏H & E染色结果 Fig.7 Histological characteristics of T-ALL xenografts in NCG mice (HE staining) |
β-arrestin1属于arrestin蛋白家族成员, 参与了激动剂介导的G蛋白偶联受体(GPCRs)脱敏、内化及信号传导[10, 12]。近年来研究发现, 除了调控GPCRs, β-arrestin1还可通过调控蛋白泛素化, 进入细胞核调控组蛋白修饰等, 参与细胞相关生理病理调控[10, 13-14]。在肿瘤发生发展中, 大量研究发现β-arrestin1在肺癌、前列腺癌、肝癌等肿瘤中发挥癌基因作用[15]。我们前期研究中发现, β- arrestin1在急性B淋巴细胞白血病(B-ALL)及慢性粒细胞白血病(CML)中表达增高, 促进肿瘤发展[16-17]。而近期通过对大量T-ALL临床病人及健康对照标本检测, 我们发现在T-ALL细胞中β-arrestin1表达降低, 且在体外有抑制T-ALL细胞增殖, 促进细胞凋亡作用[11, 18]。为进一步揭示β-arrestin1对T-ALL细胞在体内的影响,我们在本研究中通过构建荧光素酶标记的人Molt-4细胞,并在此基础上过表达或敲低β-arrestin1蛋白及构建相应异种移植小鼠模型,检测不同时间点肿瘤在小鼠体内进展,观察小鼠生存时间,发现β-arrestin1蛋白在小鼠体内有抑制Molt-4细胞进展作用。该发现与之前我们的体外实验结果一致,共同提示T-ALL细胞中,β-arrestin1可能的抑癌基因作用。
T-ALL作为一种常见的儿童恶性肿瘤,其发病率高,病情重,预后不佳,为目前研究热点[19]。在T-ALL发病过程中NOTCH1信号通路异常激活发挥关键作用[20-22]。研究显示,70% T-ALL患者肿瘤细胞中包含NOTCH1激活性突变[23-24]。同时,研究发现在造血干细胞中导入NOTCH1活性形式ICN1可导致小鼠T-ALL发生[25]。有趣的是,β-arrestin1在NOTCH1蛋白降解过程中发挥着促进作用[3-4]。在果蝇细胞中,β-arrestin1可通过和DTX1蛋白结合,促进NOTCH1泛素化降解[20, 26],抑制NOTCH1信号通路;在小鼠细胞中,研究发现,β-arrestin1可通过与NEDD4结合[27],促进NOTCH1泛素化降解,抑制NOTCH1信号[28]。
在此之前,我们通过在Jurkat细胞系中过表达β-arrestin1,发现其可抑制Jurkat细胞在体外增殖[11]。本次研究结果表明,β-arrestin1可抑制Molt-4细胞在小鼠模型中进展。Jurkat细胞中存在Fbxw7失活突变[29],导致NOTCH1泛素化及降解减少[30],而Molt-4细胞中存在NOTCH11基因激活性突变[31-32]。此两种细胞均有NOTCH1信号异常激活,考虑到β-arrestin1在多种细胞中介导NOTCH1降解,β-arrestin1是否通过抑制NOTCH1发挥抑制小鼠体内T-ALL进展的作用,值得进一步研究。
综上所述,本研究成功构建了表达荧光素酶和过表达或敲低β-arrestin1的稳定细胞系,证明过表达β-arrestin1可抑制Molt-4细胞异种移植小鼠模型的T-ALL进展,为后续进行β-arrestin1调控白血病细胞机制研究与白血病的治疗提供了实验工具和理论基础。
| [1] |
Yu L, Easton J, Ying S, et al. The genomic landscape of pediatric and young adult T-lineage acute lymphoblastic leukemia[J]. Nat Genet, 2017, 49(8): 1211-8. DOI:10.1038/ng.3909 |
| [2] |
Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia[J]. Lancet, 2013, 381(9881): 1943-55. DOI:10.1016/S0140-6736(12)62187-4 |
| [3] |
Medyouf H, Gusscott S, Wang H, et al. High-level IGF1R expression is required for leukemia-initiating cell activity in T-ALL and is supported by Notch signaling[J]. J Exp Med, 2011, 208(9): 1809-22. DOI:10.1084/jem.20110121 |
| [4] |
Junker F, Chabloz A, Koch U, et al. Dicer1 imparts essential survival cues in Notch-driven T-ALL via miR-21-mediated tumor suppressor Pdcd4 repression[J]. Blood, 2015, 126(8): 993-1004. DOI:10.1182/blood-2014-12-618892 |
| [5] |
Bhojwani D, Pui CH. Relapsed childhood acute lymphoblastic leukaemia[J]. Lancet Oncol, 2013, 14(6): e205-17. DOI:10.1016/S1470-2045(12)70580-6 |
| [6] |
den Hoed MA, Pluijm SM, te Winkel ML, et al. Aggravated bone density decline following symptomatic osteonecrosis in children with acute lymphoblastic leukemia[J]. Haematologica, 2015, 100(12): 1564-70. DOI:10.3324/haematol.2015.125583 |
| [7] |
Hunger SP, Mullighan CG. Acute lymphoblastic leukemia in children[J]. N Engl J Med, 2015, 373(16): 1541-52. DOI:10.1056/NEJMra1400972 |
| [8] |
Ballesteros-Arias L, Silva JG, Paiva RA, et al. T cell acute lymphoblastic leukemia as a consequence of thymus autonomy[J]. J Immunol, 2019, 202(4): 1137-44. |
| [9] |
Peterson YK, Luttrell LM. The diverse roles of arrestin scaffolds in G protein coupled receptor signaling[J]. Pharmacol Rev, 2017, 69(3): 256-97. |
| [10] |
Grundmann M, Merten N, Malfacini D, et al. Lack of beta-arrestin signaling in the absence of active G proteins[J]. Nat Commun, 2018, 9(1): 341. DOI:10.1038/s41467-017-02661-3 |
| [11] |
郭维, 刘姗, 刘海燕, 等. β-arrestin1促进急性T淋巴细胞白血病Jurkat细胞衰老[J]. 中国实验血液学杂志, 2019, 27(3): 777-84. |
| [12] |
O'Hayre M, Degese MS, Gutkind JS. Novel insights into G protein and G protein-coupled receptor signaling in cancer[J]. Curr Opin Cell Biol, 2014, 27: 126-35. DOI:10.1016/j.ceb.2014.01.005 |
| [13] |
Zhou XE, He Y, De Waal PW, et al. Identification of phosphorylation codes for arrestin recruitment by G protein-vcoupled receptors[J]. Cell, 2017, 170(3): 457-69. DOI:10.1016/j.cell.2017.07.002 |
| [14] |
Campisi J. Aging, Cellular senescence, and cancer[J]. Annu Rev Physiol, 2013, 75: 685-705. DOI:10.1146/annurev-physiol-030212-183653 |
| [15] |
Lefkowitz RJ. Arrestins come of age: a personal historical perspective[J]. Prog Mol Biol Transl Sci, 2013, 118: 3-18. DOI:10.1016/B978-0-12-394440-5.00001-2 |
| [16] |
Qin R, Li K, Qi X, et al. β-Arrestin1 promotes the progression of chronic myeloid leukaemia by regulating BCR/ABL H4 acetylation[J]. BrJCancer, 2014, 111(3): 568-76. |
| [17] |
Shu Y, Zhou X, Qi X, et al. β-Arrestin1 promotes the self-renewal of the leukemia initiating cell-enriched subpopulation in b-lineage acute lymphoblastic leukemia related to DNMT1 activity[J]. Cancer Lett, 2015, 357(1): 170-8. DOI:10.1016/j.canlet.2014.11.025 |
| [18] |
Liu S, Liu HY, Qin R, et al. The cellular senescence of leukemiainitiating cells from acute lymphoblastic leukemia is postponed by β- Arrestin1 binding with P300-Sp1 to regulate hTERT transcription[J]. CellDeathDis, 2017, 8(4): e2756. |
| [19] |
Kramer AC, Kothari A, Wilson WC, et al. Dnmt3a regulates T-cell development and suppresses T-ALL transformation[J]. Leukemia, 2017, 31(11): 2479-90. DOI:10.1038/leu.2017.89 |
| [20] |
Haydu JE, De Keersmaecker K, Duff MK, et al. An activating intragenic deletion in NOTCH1 in human T-ALL[J]. Blood, 2012, 119(22): 5211-4. DOI:10.1182/blood-2011-10-388504 |
| [21] |
Correia NC, Arcangeli ML, Pflumio F, et al. Stem cell leukemia:how a TALented actor can go awry on the hematopoietic stage[J]. Leukemia, 2016, 30(10): 1968-78. DOI:10.1038/leu.2016.169 |
| [22] |
Mavrakis K, Van Der Meulen J, Wolfe AL, et al. A cooperative microRNA-tumor suppressor gene network in acute T-cell lymphoblasticleukemia(T-ALL)[J]. NatGenet, 2011, 43(7): 673-8. |
| [23] |
Lobry C, Oh P, Mansour MR, et al. Notch signaling: switching an oncogenetoatumorsuppressor[J]. Blood, 2014, 123(16): 2451-9. DOI:10.1182/blood-2013-08-355818 |
| [24] |
Zhang J, Ding L, Holmfeldt L, et al. The genetic basis of early T-cell precursor acute lymphoblastic leukaemia[J]. Nature, 2012, 481(7380): 157-63. DOI:10.1038/nature10725 |
| [25] |
O'neil J1, Calvo J, Mckenna K, et al. Activating notch1 mutations in mousemodelsofT-ALL[J]. Blood, 2006, 107(2): 781-5. DOI:10.1182/blood-2005-06-2553 |
| [26] |
Shenoy SK, Lefkowitz RJ. Receptor regulation:beta-arrestin moves upanotch[J]. NatCellBiol, 2005, 7(12): 1159-61. |
| [27] |
Meurette O, Mehlen P. Notch signaling in the tumor microenvironment[J]. CancerCell, 2018, 34(4): 536-48. |
| [28] |
Shea FF, Rowell JL, Li Y, et al. Mammalianarrestins Link activated seven transmembrane receptors to Nedd4 family e3 ubiquitin ligases andinteractwith β-arrestins[J]. PLoSOne, 2012, 7(12): e50557. DOI:10.1371/journal.pone.0050557 |
| [29] |
Moharram SA, Shah K, Ju KZ. T-cell acute lymphoblastic leukemia cells display activation of different survival pathways[J]. J Cancer, 2017, 9(19): 4124-9. |
| [30] |
Jean-François S, Cassart P, Richer C. Genomic characterization of pediatric T-cell acute lymphoblastic leukemia reveals novel recurrentdrivermutations[J]. Oncotarget, 2016, 7(40): 65485-503. DOI:10.18632/oncotarget.11796 |
| [31] |
Isabelle Bartram, Ulrike Erben, Jutta Ortiz-Tanchez. Inhibition of IGF1-R overcomes IGFBP7-induced chemotherapy resistance in TALL[J]. BMCCancer, 2015, 8(15): 663-74. |
| [32] |
Wei Wu, Li Nie, Li Zhang. The notch pathway promotes NF-κB activation throughAsb2 in T cell acute lymphoblastic leukemia cells[J]. CellMolBiolLett, 2018, 9: 23-37. |
 2020, Vol. 40
2020, Vol. 40

