2. 西安交通大学医学院第一附属医院肝胆外科,陕西 西安 710061
2. Department of Hepatobiliary Surgery, First Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710061, China
良性胆管狭窄(BBS)指由外伤、手术等因素导致的胆管损伤及慢性胆管炎,进而引起的胆管瘢痕性挛缩[1]。BBS的患病人群随着近年来胆囊炎、胆囊结石等发病率的上升有着逐年增加的趋势[2]。目前,BBS的治疗主要集中在控制胆道感染、物理方法解除胆管狭窄上,尚无有效的药物治疗方法[3]。研究认为,BBS发病的分子机制主要为转化生长因子-β1(TGF-β1)、血小板源性生长因子(PDGF)等细胞因子或炎症介质刺激的胆管成纤维细胞异常增殖导致的胶原等细胞外基质(ECM)的沉积[4-5]。因此,揭示胆管成纤维细胞胶原异常生成的分子信号机制,并探索出有效的治疗靶点,对BBS的防治有着十分重要的意义。
TGF-β1是一种重要的促纤维化因子,被认为与组织、器官重塑关系最为密切[6]。TGF-β1在多种细胞的增殖及ECM生成方面发挥了重要的作用[7]。Smad作为TGF-β激活途径下游的关键蛋白,是TGF-β分子信号跨细胞传导的转换器,广泛参与对细胞活化及胶原等ECM生成的调控[8]。TGF-β通过激活TGF-β/Smads信号通路上调结缔组织生长因子(CTGF)表达,诱导肝星状细胞合成并分泌ECM[9]。TGF-β1、Smad3、CTGF在胆管狭窄的局部组织中均有很高的表达[10]。然而,TGF-β1是否通过活化Smad3信号刺激CTGF表达,进而诱导了胶原合成目前尚未见报道。
腺苷酸激活蛋白激酶(AMPK)隶属于代谢敏感性蛋白激酶超家族成员,其具有丝氨酸/苏氨酸蛋白激酶活性并可广泛表达于真核细胞中。低氧、热休克及低糖环境下可激活其活性,而降糖药物二甲双胍被证实具有激活AMPK信号通路的作用。AMPK的激活除具有调节糖代谢紊乱、抗炎等功能外,还具有抗纤维化的作用[13-14]。研究证实激活AMPK可通过抑制TGF-β诱导的CTGF蛋白生成,抑制小鼠肾间质纤维化的发生[15]。而二甲双胍能否通过激活AMPK抑制胆管成纤维细胞胶原生成尚未见报道。本研究将首次揭示二甲双胍是否通过激活AMPK,抑制TGF-β诱导的胆管成纤维细胞胶原合成进而抑制BBS的发生,并探索其分子信号机制。
1 材料和方法 1.1 原代大鼠胆管成纤维细胞的获取取雌雄各半的SD大鼠共50只(体质量150~200 g),CO2窒息的方法处死后,无菌条件下采用如下方法获取胆管成纤维细胞:无菌操作台内分离胆管,刮净内外膜后将剩余胆管剪成细小的组织块,置于含0.5 mg/mL弹性蛋白酶(Sigma)和1.5 mg/mL胶原酶(Sigma)的混合液中孵育40 min。800 r/min下离心以收集细胞,重悬并培养于含100 mL/L胎牛血清的DMEM/高糖培养基中。分别采用差速消化法、差速贴壁法分离并纯化所培养的胆管成纤维细胞。细胞经异硫氰酸荧光素-(FITC-)标记的波形蛋白(Sigma)孵育并染色,荧光倒置显微镜发现成纤维细胞阳性率大于90%,不同体质量及性别的大鼠所获取的细胞形态及活性无差异。本研究所有实验所用细胞均在5代内,细胞干预前均预先予以10 mL/L胎牛血清饥饿12 h。采用TGF-β1(Sigma)孵育胆管成纤维细胞诱导胶原生成,Compound C(Sigma)抑制AMPK活性,二甲双胍(Sigma)用于激活AMPK的活性。
1.2 实验分组及干预方法采用随机数字表法将所培养的原代大鼠胆管成纤维细胞进行随机分组,分别设置对照组、TGF-β1组、Smad3 siRNA干预组、结缔组织生长因子(CTGF)siRNA干预组、二甲双胍干预组、Compound C干预组,每组3个样本。设置对照组仅进行大鼠胆管成纤维细胞正常培养;TGF-β1组:10 ng/mLTGF-β1孵育细胞;Smad3 siRNA干预组:Smad3 siRNA转染24 h后+10 ng/mLTGF-β1孵育细胞;CTGF siRNA干预组:CTGF siRNA转染24 h后+ 10 ng/mLTGF-β1孵育细胞;二甲双胍干预组:10 mmol/L二甲双胍2 h后+10 ng/mLTGF-β1孵育细胞;Compound C干预组:10 μmol/L Compound C+10 mmol/L二甲双胍2 h后+10 ng/mL TGF-β1孵育细胞。
1.3 ELISA检测采用ELISA的方法检测胆管成纤维细胞CTGF及胶原I的生成。于4 ℃下,800 r/min离心10 min,收集培养基上清并保存于-20 ℃冰箱内备用。分别使用CTGF及胶原I的ELISA检测试剂盒(MyBioSource, San Diego, USA)检测上述蛋白的表达水平(具体操作按照相应的说明书进行),于A450 nm处读取吸光度值。
1.4 免疫印迹法检测目标蛋白的表达水平收集预孵育的大鼠胆管成纤维细胞,采用RIPA裂解液(Bioteke Corporation)破碎细胞。4 ℃下12 000 r/min离心10 min并收集上清,采用BCA试剂盒(Pierce)检测细胞总蛋白浓度。等量总蛋白上样于100 g/L SDSPAGE胶,并转移至硝酸纤维素膜(NC; Bio-Rad)。4 ℃下以抗-p-Smad3/t-Smad3(Cell Signal Technology)、pAMPK/t-AMPK(Cell Signal Technology)、CTGF(Cell Signal Technology)及GAPDH(Sigma)的一抗孵育细胞过夜,清洗后采用HRP-标记的二抗(Sigma)孵育30 min。West Pico(Pierce)化学荧光底物激发荧光并曝光于胶片上,采用Scion NIH图像分析软件测定免疫印迹强度,从而明确目标蛋白的表达水平。
1.5 siRNA转染使用脂质体TM 2000(LipofectamineTM 2000,Invitrogen)转染Smad3、CTGF特异性siRNA。首先,将原代胆管成纤维细胞制成单细胞悬液并接种于6孔板中。当细胞汇片至40% ~50%时,按1:1比例将LipofectamineTM2000与siRNA混合均匀,并转染至胆管成纤维细胞,6 h后更换培养基并继续培养。于24 h后收集细胞或培养基上清,分别采用免疫印迹法或ELISA法检测目标蛋白的表达水平。
1.6 统计学处理采用均数±标准差表示本研究所获得的实验数据,采用SPSS17.0进行研究结果的统计与分析。经数据分析证实,所有研究结果均符合方差齐性,采用单因素方差分析进行组间数据的比较;Tukey post hoc方法进行组间多重比较,P < 0.05为差异具有统计学意义。
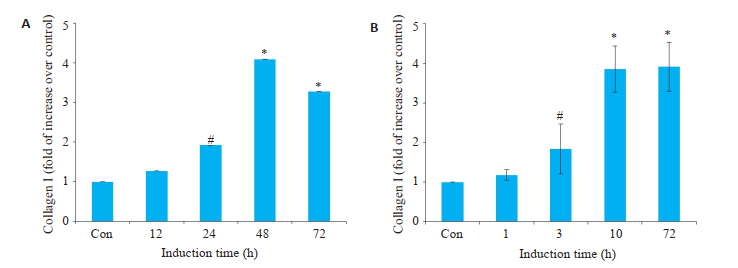
2 结果 2.1 TGF-β1时间及剂量依赖性诱导大鼠胆管成纤维细胞胶原分泌为明确TGF-β1能否激活原代培养的大鼠胆管成纤维细胞胶原分泌,分别于TGF-β1刺激细胞后12、24、48、72 h,使用ELISA试剂盒检测培养基上清胶原(I Col I)的分泌水平。TGF-β1以时间依赖的方式刺激大鼠胆管成纤维细胞胶原I合成,TGF-β1组诱导细胞胶原I生成的峰时间为48 h(图 1A,P < 0.01)。
|
图 1 TGF-β1时间及剂量依赖性诱导胆管成纤维细胞胶原I生成 Fig.1 TGF-β1 time-dependently (A) and dose-dependently (B) induces collagen I production in rat biliary fibroblasts (n=3). #P < 05, *P < 01 vs control group. |
TGF-β1刺激细胞后48 h收集培养基上清并检测胶原I表达,随着TGF-β1浓度的升高,胆管成纤维细胞胶原I分泌逐渐升高,10 ng/mL TGF-β1组使细胞胶原I合成水平较对照组增加3.86倍(图 1B,P < 0.01)。
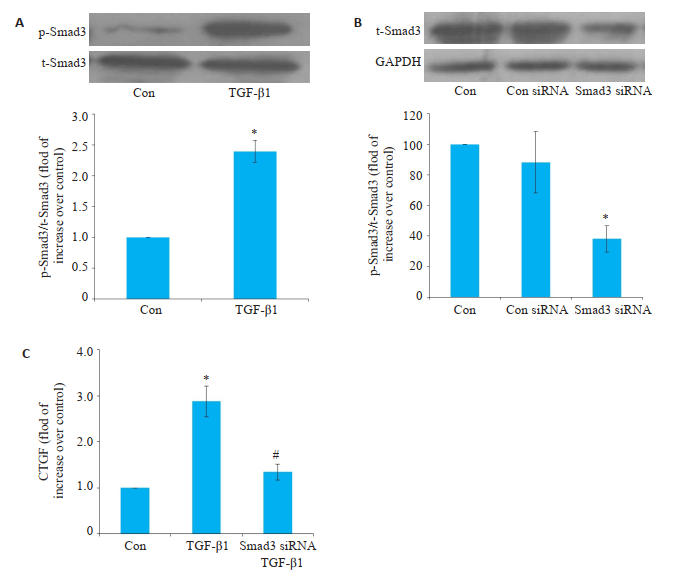
2.2 CTGF特异性介导TGF-β1刺激的大鼠胆管成纤维细胞胶原生成TGF-β1(10 ng/mL)刺激细胞后1 h,收集细胞并进行免疫印迹法检测,TGF-β1组p-Smad3水平较对照组显著升高(图 2A,P < 0.01)。其次,空白对照组t-Smad3表达水平最高,siRNA对照组与空白对照组表达量一致,Smad3 siRNA组与空白对照组相比显著降低(图 2B,P < 0.01)。在此基础上,TGF-β1刺激后24 h采用ELASA法检测CTGF蛋白表达水平,TGF-β1组CTGF蛋白表达较对照组显著升高,Smad3 siRNA组显著低于TGF-β1组(图 2C,P < 0.01)。
|
图 2 TGF-β1通过磷酸化-Smad3(p-Smad3)激活Smad3信号通路上调胆管成纤维细胞CTGF蛋白表达 Fig.2 TGF-β1 upregulates CTGF expression by activating Smad3 signaling in rat biliary fibroblasts (n=3). A: TGF-β1 significantly induced phosphorylation of Smad3 in rat biliary fibroblasts; B: Cells pre-treated with Smad3 siRNA show reduced total Smad3 expression; C: Cells pre-transfected with Smad3 siRNA show reduced TGF-β1-striggered CTGF expression. *P < 0.01 vs control group; #P < 01 vs TGF-β1 group. |
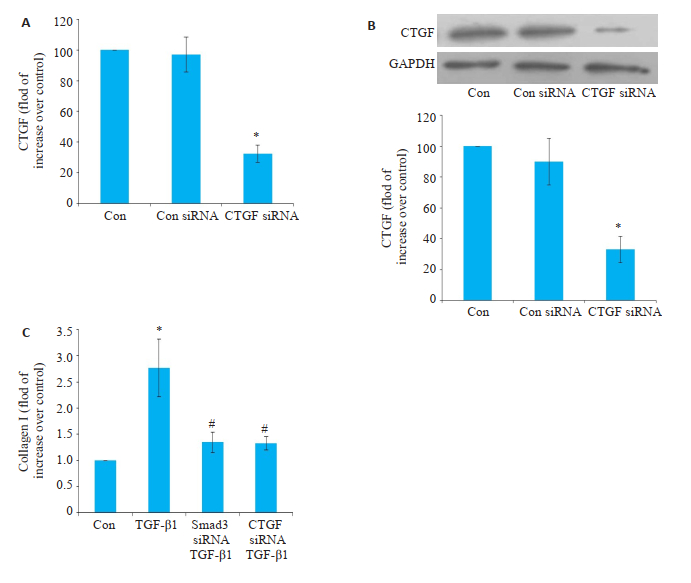
为进一步揭示Smad3和CTGF是否序贯性介导了TGF-β1刺激的胶原I生成,siRNA转染后24 h收集培养基上清采用ELISA方法检测CTGF蛋白表达,发现空白对照组CTGF表达水平最高,siRNA对照组与空白对照组表达量一致,CTGF siRNA组与空白对照组相比显著降低(图 3A,P < 0.01);采用免疫印迹法检测CTGF蛋白表达,免疫印迹结果(图 3B,P < 0.01)与ELISA结果一致。其次,TGF-β1刺激后48 h检测胶原I蛋白水平,TGF-β1组胶原I水平较对照组显著升高,Smad3、CTGF siRNA干预组同等程度地低于TGF-β1组(图 3C,P < 0.01)。
|
图 3 CTGF特异性介导TGF-β1/Smad3信号通路激活诱导的胆管成纤维细胞胶原I蛋白表达 Fig.3 CTGF mediate TGF-β1-activated collagen I production in rat biliary fibroblasts (n=3). A: CTGF expression in the cells transfected with CTGF siRNA for 24 h (detected using ELISA); B: Level of CTGF in cell lysis measured using immunoblotting; C: TGF-β 1-induced collagen I production in cells pre-treated with Smad3 or CTGF siRNA. *P < 01 vs control group; #P < 01 vs TGF-β1 group. |
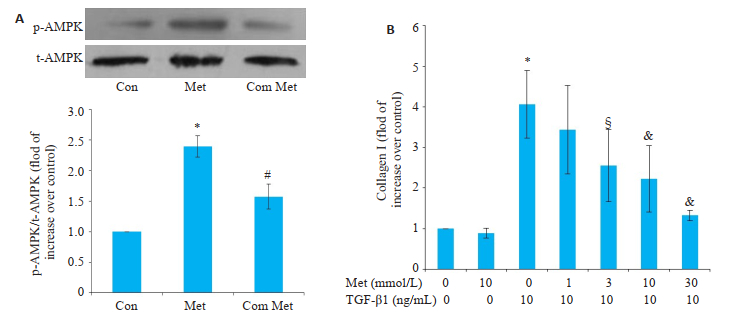
二甲双胍组采用10 mmol/L二甲双胍孵育细胞,Compound C组同时予以AMPK抑制剂Compound C(10 μmol/L)孵育细胞,2 h后免疫印迹法检测p-AMPK的活性水平,结果发现,二甲双胍组p-AMPK活性较对照组增加2.39倍(图 4A,P < 0.01),Compound C组pAMPK水平较二甲双胍组显著下降(图 4A,P < 0.01)。
|
图 4 二甲双胍激活的AMPK剂量依赖性抑制TGF-β1刺激的胆管成纤维细胞胶原I分泌 Fig.4 Metformin-activated AMPK dose-dependently inhibits TGF-β1-induced collagen I production in rat biliary fibroblasts (n=3). A: Effects of metformin and Compound C on AMPK phosphorylation; B: Metformin dose-dependent inhibits TGF-β1-induced collagen I production. *P < 01 vs control group; #P < 01 vs Metformin group; §P < 05 vs TGF-β1 group; & P < 01 vs TGF-β1 group. |
其次,TGF-β1(10 ng/mL)干预大鼠胆管成纤维细胞前2 h,予以不同浓度的二甲双胍(1、3、10、30 mmol/L)孵育细胞,48 h后检测胶原I蛋白水平。发现TGF-β1组胶原I水平最高,浓度越高的二甲双胍干预组胶原I水平越低,10 mmol/L二甲双胍干预组胶原I蛋白的表达水平降至对照组的2.23倍(图 4B,P < 0.01)。
2.4 二甲双胍激活的AMPK抑制TGF-β1刺激的大鼠胆管成纤维细胞胶原分泌的分子机制分别对TGF-β1刺激细胞后1、24、48 h检测pSmad3、CTGF或胶原I蛋白水平。结果表明,TGF-β1组p-Smad3、CTGF蛋白及胶原I与对照组相比水平最高(图 5A~C,P < 0.01),二甲双胍组干预组的p-Smad3水平与TGF-β1组一致;二甲双胍干预组CTGF蛋白及胶原I的水平显著低于TGF-β1组,而Compound C干预组CTGF蛋白及胶原I的水平显著高于二甲双胍组干预组(图 5B,C,P < 0.01)。
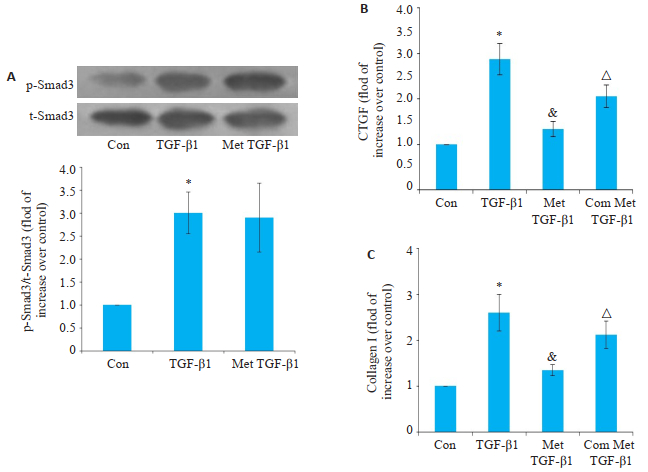
|
图 5 二甲双胍激活的AMPK通过抑制Smad3磷酸化诱导的CTGF表达抑制胆管成纤维细胞胶原I产生 Fig.5 Metformin-activated AMPK suppresses TGF-β1-induced collagen I production in rat biliary fibroblasts by inhibiting p-Smad3-driven CTGF expression (n=3). A: Metformin had no effect on TGF-β1- induced Smad3 phosphorylation in biliary fibroblasts (P>0.05); B: Inhibition of AMPK by Compound C restored the effect of metformin on CTGF expression and collagen I production. *P < 01 vs control group; & P < 01 vs TGF-β1 group; △P < 01 vs Metformin+TGF-β1 group. |
作为BBS发病的主要功能细胞,胆管成纤维细胞被认为主要通过活化增殖并分泌大量ECM参与BBS的发生[16]。目前,针对BBS的治疗主要集中在手术切除瘢痕组织并放置内支架上[17],尚无有效抑制其发生的药物。课题组曾针对BBS研制了一种聚乳酸材质的可降解支架,并在犬类BBS动物模型上证实该支架具有防治BBS的作用[18]。在此基础上,本研究拟寻求抑制胆管成纤维细胞胶原等ECM生成的新药物,并将其作为涂层材料应用于该聚乳酸可降解支架,本研究有望成为BBS防治的新途径。
TGF-β作为TGF-β超家族的主要成员,在上皮-间充质转分化及胶原等ECM生成方面发挥重要作用[19]。TGF-β主要通过与受体结合,以Smad依赖/非依赖的方式调控目的基因转录,进而发挥其生理性或病理性生物学作用[20]。Smad3、CTGF作为BBS的致病因素广泛参与发病,而其是否通过介导TGF-β刺激的胆管成纤维细胞胶原I生成参与BBS的发生,目前尚不完全清楚[22]。本研究以原代大鼠胆管成纤维细胞为研究对象,采用Smad3 siRNA特异性阻抑Smad3的表达,可显著降低胶原I蛋白生成。提示TGF-β1通过活化Smad3信号通路刺激胆管成纤维细胞胶原I分泌。
最新研究发现CTGF作为促纤维化的主要分子介质,被证实广泛参与BBS的发病[23]。因此,抑制CTGF的表达有望成为BBS的潜在治疗靶点。TGF-β1可通过激活Smad3诱导猪膀胱上皮细胞CTGF表达[24]。本研究在细胞层面上证实:CTGF特异性介导了TGF-β1/ Smad3信号通路激活诱导的胆管成纤维细胞胶原I分泌。TGF-β1可刺激胆管成纤维细胞CTGF蛋白生成,Smad3 siRNA转染抑制Smad3表达,可抑制CTGF的合成。而CTGF siRNA转染特异性阻抑CTGF蛋白的表达,可同等程度地抑制TGF-β1诱导的胆管成纤维细胞胶原I分泌。
AMPK作为真核生物中重要的蛋白激酶,是由催化亚基α、调节亚基β及γ构成的异三聚体[26]。激活的AMPK已经被证实具有抗肾脏、气道等组织器官纤维化等作用[27-30]。然而,激活的AMPK能否抑制BBS的发病,何种分子信号机制介导了AMPK的作用目前尚不完全清楚。本研究首次揭示了二甲双胍激活的AMPK通过抑制Smad3磷酸化活化介导的CTGF蛋白表达,进而抑制TGF-β1刺激的胆管成纤维细胞胶原I分泌。提示激活的AMPK可能通过抑制胆管成纤维细胞胶原I合成,特异性阻抑BBS的发病。在后续的研究中,本课题组拟以二甲双胍作为药物涂层,在聚乳酸可降解支架材质中加入一定比例的二甲双胍制成药物涂层支架,以犬类BBS动物模型揭示该药物涂层支架与单纯的聚乳酸可降解支架相比,是否具有更好的防治BBS的作用。
综上所述,本研究揭示了TGF-β1诱导的胆管成纤维细胞胶原I生成的分子信号机制,并证实二甲双胍通过激活AMPK可显著抑制TGF-β1诱导的胆管成纤维细胞胶原I合成,提示该类药物具有潜在治疗BBS的作用。本研究有望为BBS的治疗提供新的靶点,同时也拓展了AMPK激活剂二甲双胍的药物治疗谱。
| [1] |
Nakai Y, Kogure H, Isayama H, et al. Endoscopic ultrasound-guided biliary drainage for benign biliary diseases[J]. Clin Endosc, 2019, 52(3): 212-9. |
| [2] |
Yi Z, Qian C, Liu MY, et al. Effects of benzophenones from mango leaves on lipid metabolism[J]. Chem Pharm Bull (Tokyo), 2019, 67(7): 634-9. DOI:10.1248/cpb.c18-00905 |
| [3] |
Choi J, Chung KJ, Choo SH, et al. Long-term outcomes of two types of metal stent for chronic benign ureteral strictures[J]. World J Gastroenterol, 2019, 19(1): 2061-72. |
| [4] |
Zhang XJ, Wang XD, Liang W, et al. Effect of covered selfexpanding metal stents compared with multiple plastic stents on benign biliary stricture[J]. Medicine (Baltimore), 2018, 97(36): e12039. DOI:10.1097/MD.0000000000012039 |
| [5] |
Bartel MJ, Higa JT, Tokar JL. The status of SEMS versus plastic stents for benign biliary strictures[J]. Curr Gastroenterol Rep, 2019, 21(7): 29-37. DOI:10.1007/s11894-019-0696-3 |
| [6] |
Yang H, Baker D, Dijke PT. TGF-β-mediated epithelial-mesenchymal transition and cancer metastasis[J]. Int J Mol Sci, 2019, 20(11): 2767. DOI:10.3390/ijms20112767 |
| [7] |
Li KY, Shi CX, Huang JZ, et al. Tetramethylpyrazine effects on the expression of scar-related genes in rabbit benign biliary stricture fibroblasts[J]. J Coll Physicians Surg Pak, 2016, 26(10): 813-7. |
| [8] |
Li K-, Shi C-, Huang J, et al. Dexamethasone effect on the expression of transforming growth factor-β1/smads signaling pathway in benign biliary stricture fibroblasts in rodent[J]. J Coll Physicians Surg Pak, 2017, 27(3): 131-4. |
| [9] |
Grafe I, Alexander S, Peterson JR, et al. TGF-β family signaling in mesenchymal differentiation[J]. Cold Spring Harb Perspect Biol, 2017, 10(5): 1-12. |
| [10] |
Geng ZM, Zheng JB, Zhang XX, et al. Role of transforming growth factor-beta signaling pathway in pathogenesis of benign biliary stricture[J]. World J Gastroenterol, 2008, 14(31): 4949. DOI:10.3748/wjg.14.4949 |
| [11] |
Wen Z, Jin K, Shen Y, et al. N-myristoyltransferase deficiency impairs activation of kinase AMPK and promotes synovial tissue inflammol/Lation[J]. Nat Immol/Lunol, 2019, 20(3): 313-25. DOI:10.1038/s41590-018-0296-7 |
| [12] |
Tamargo-Gómez I, Mariño G. AMPK: regulation of metabolic dynamics in the context of autophagy[J]. Int J Mol Sci, 2018, 19(12): 3812. DOI:10.3390/ijms19123812 |
| [13] |
Peng W, Xie ZD, Xie CN, et al. AMP-activated protein kinasedependent induction of autophagy by erythropoietin protects against spinal cord injury in rats[J]. CNS Neurosci Ther, 2018, 24(12): 1185-95. DOI:10.1111/cns.12856 |
| [14] |
Sithandiwe E, Mazibuko M, Phiwayinkosi V, et al. Aspalathinenriched green rooibos extract reduces hepatic insulin resistance by modulating PI3K/AKT and AMPK pathways[J]. Int J Mol Sci, 2019, 20(3): 633-41. DOI:10.3390/ijms20030633 |
| [15] |
Lu JM, Shi JH, Li MX, et al. Activation of AMPK by metformin inhibits TGF-β-induced collagen production in mouse renal fibroblasts[J]. Life Sci, 2015, 127(3): 59-65. |
| [16] |
Alampady Krishna Prasad Shanbhogue, Tirumani SH, Srinivasa RP, et al. Benign biliary strictures: a current comprehensive clinical and imaging review[J]. American J Roentgen, 2011, 197(2). |
| [17] |
Chang JH, Lee I, Choi MG, et al. Current diagnosis and treatment of benign biliary strictures after living donor liver transplantation[J]. World J Gastroenterol, 2016, 22(4): 1593-606. DOI:10.3748/wjg.v22.i4.1593 |
| [18] |
Shi JH, Yi L, Liang Y, et al. Interest of a new biodegradable stent coated with paclitaxel on anastomotic wound healing after biliary Reconstruction[J]. Eur J Gastroenterol Hepatol, 2013, 25(12): 1415-23. DOI:10.1097/MEG.0b013e328361eb51 |
| [19] |
Liu ZY, Pan HW, Yan C, et al. Downregulated microRNA-330 suppresses left ventricular remodeling via the TGF-β1/Smad3 signaling pathway by targeting SRY in mice with myocardial ischemia-reperfusion injury[J]. J Cell Physiol, 2019, 234(7): 11440-50. DOI:10.1002/jcp.27800 |
| [20] |
Bitnara L, Younseo O, Sungsin J, et al. A dual role of TGF-β in human osteoclast differentiation mediated by Smad1 versus Smad3 signaling[J]. Immol/Lunol Lett, 2019, 206(2): 33-40. |
| [21] |
Liu WJ, Cui YJ, Sun JX, et al. Transforming growth factor-β1 upregulates connexin43 expression in osteocytes via canonical Smaddependent signaling pathway[J]. Biosci Rep, 2018, 38(6): 1-14. |
| [22] |
Liu YD, Xin S, Yao Z, et al. Protocatechuic acid inhibits TGF-β1-induced proliferation and migration of human airway smooth muscle cells[J]. J Pharmacol Sci, 2019, 139(1): 9-14. |
| [23] |
Zhao X, An XL, Zhu XC, et al. Inhibiting transforming growth factor-β signaling regulates in vitro maintenance and differentiation of bovine bone marrow mesenchymal stem cells[J]. J Exp Zool B Mol Dev Evol, 2018, 330(8): 406-16. DOI:10.1002/jez.b.22836 |
| [24] |
Wang QX, Zhou C, Li XB, et al. TGF-β1 promotes gap junctions formation in chondrocytes via Smad3/Smad4 signalling[J]. Cell Prolif, 2019, 52(2). |
| [25] |
Gao HY, Bo Z, Qin W, et al. Salvanic acid B inhibits myocardial fibrosis through regulating TGF-β1/Smad signaling pathway[J]. Biomed Pharmacother, 2019, 110(2): 685-91. |
| [26] |
Ismail Hassan F, Didari T, Khan F, et al. A review on the protective effects of metformin in Sepsis-induced organ failure[J]. Cell J, 2020, 21(4): 363-70. |
| [27] |
Novita BD. Metformin: a review of its potential as enhancer for anti tuberculosis efficacy in diabetes mellitus-tuberculosis coinfection patients[J]. Indian J Tuberc, 2019, 66(2): 294-8. |
| [28] |
Guillaume V, Dominique D, Bruno G. Role of mitochondria in the mechanism(s) of action of metformin[J]. Front Endocrinol (Lausanne), 2019, 10(5): 294-301. |
| [29] |
Salminen A, Kauppinen A, Kaarniranta K. AMPK activation inhibits the functions of myeloid-derived suppressor cells (MDSC): impact on cancer and aging[J]. J Mol Med (Berl), 2019, 97(8): 1049-64. DOI:10.1007/s00109-019-01795-9 |
| [30] |
Saraei P, Asadi I, Kakar MA, et al. The beneficial effects of metformin on cancer prevention and therapy: a comprehensive review of recent advances[J]. Cancer Manag Res, 2019, 11(4): 3295-313. |
 2020, Vol. 40
2020, Vol. 40

