2. 北京中医药大学东方医院,北京 100078
2. Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100078, China
冠心病合并焦虑状态流行趋势日益严峻,相关报告显示,焦虑在心血管疾病的发病率约27.8%,增加30%的冠脉事件风险[1-2]。焦虑是影响冠心病发生发展的独立危险因素,严重影响疾病的远期预后[3],因此亟需阐明其共病病理机制。
目前主流的冠心病与焦虑共病假说主要包括神经内分泌、心脏自主神经紊乱,血小板活化以及炎症假说等,其中炎症因子假说已被大量研究证实与冠心病患者焦虑状态水平具有高度的相关性[4]。全基因组关联研究(GWAS)揭示编码CXCL12基因与冠心病主要基因强位点染色体10q11接近,CXCL12与心肌梗死的发生有着密切关系,但其作用机制尚不清楚[5-6]。CXCL12即基质细胞衍生因子-1(SDF-1,CXCL12),CXCR4为CXCL12特异性受体,表达于心脏、骨髓、大脑等区域[7],CXCL12/CXCR4信号轴能诱导炎性细胞因向组织损伤部位定向运动。
CXCL12/CXCR4信号轴在急性心梗早期表达失衡,趋化炎性细胞,激活炎性信号通路,造成严重的炎性级联反应,加重心肌细胞凋亡、坏死,导致梗死面积增加、心功能恶化[8-9]。AMD3100 (Plerixafor)是CXCR4的非肽类阻断剂[10],能特异性与CXCR4结合, 阻断CXCL12/CXCR4轴参与的细胞迁移、炎性反应和免疫应答等的生理过程[11]。前期研究已证明,慢性情绪刺激能加剧炎症反应,但微观病理机制尚不明确[12]。本研究从CXCL12/CXCR4生物轴角度,进一步探析慢性情绪应激刺激对心梗后大鼠的影响,揭示急性心梗合并焦虑疾病的部分病理机制。
1 材料和方法 1.1 材料及设备选用SPF级雄性SD大鼠,体质量190~220 g,购于北京维通利华实验动物技术有限公司,饲养于北京中医药大学SPF级动物房。考虑心梗造模成功率为75%~ 90%,购进40只大鼠。实验试剂及设备:大鼠趋化因子C-X-C-基元配体12(CXCL-12)酶联免疫试剂盒、大鼠趋化因子CXC基元受体4(CXCR4)酶联免疫试剂盒、大鼠白细胞间介素1β(IL-1β)酶联免疫试剂盒、大鼠白细胞间介素18(IL-18)酶联免疫试剂盒,大鼠中性粒细胞弹性蛋白酶(NE)酶联免疫试剂盒(BlueGene);CXCL12/SDF-1抗体及CXCR4抗体、AMD3100(Octahydrochloride)(abcam)。小动物呼吸机,小动物超声影像系统,全自动三导联心电图机。
1.2 模型制备本研究采用不确定性空瓶刺激建立焦虑模型,结扎冠脉左前降支建立心梗模型[13],于焦虑造模第15天进行心梗手术,建立心梗合并焦虑模型。
1.2.1 急性心梗模型建立采用冠状动脉左前降支结扎建立急性心肌梗死模型[14]。大鼠经1%戊巴比妥(40 mg/kg)腹腔注射麻醉,经口连接气管插管后,连接小动物呼吸机,呼吸机模式为心率80次/min,潮气量2 mL/100g,吸呼比1:2。于左侧第3、4肋骨间打开胸腔,暴露左心耳边缘区域,用5-0带线缝合针于左心耳前下方2 mm部位进行结扎。术后腹腔注射0.2 mL利多卡因防止心律失常,40万U青霉素预防术后感染,术后进行有效保暖措施。以术后第2天心电图I、AVL、V1~16导联中6个以上导联出现病理性Q波为心肌梗死成功标志。假手术组穿线后不打结,其余步骤同心梗造模。
1.2.2 焦虑模型建立采用空瓶刺激方法对大鼠进行焦虑造模。该方法为经典焦虑造模方法,简单易行,经多篇文献报道及本课题前期研究证明,可成功诱导大鼠产生焦虑[15]。造模周期共21 d,造模期间大鼠自由饮食。第1~7天每日9:00~9:10和21:00~21:10早晚分两次给予饮水,其余时间禁水。第8~21天每日早晚随机一个时间段给予空瓶,另一时间段喂水。
1.2.3 复合模型建立于焦虑造模第15天进行心梗造模,继续给予空瓶刺激,至第22天进行行为学评价。经前期研究验证,该方法能最大程度降低大鼠死亡率,提高造模成功率[16]。
1.3 给药方式及分组将造模后成活的大鼠根据心电图Q波导联数量及随机数字表法,分为假手术组、心梗组、心梗合并焦虑组、抑制剂组,其中抑制剂组为复合模型基础上经腹腔注射AMD3100(1 mg·kg-1·d-1)[10, 17],持续给药6 d。
1.4 检测手段及方法 1.4.1 心电图检测于心梗造模后的第2天进行,经1%戊巴比妥(40 mg/kg)0.6倍剂量进行麻醉后,仰卧固定于鼠板上,安置胸、肢导联,待心电图基线稳定,出现稳定心电图波后进行记录。
1.4.2 高架十字迷宫(EPM)评价EPM设置由4个高于地面50 cm的十字交叉架窄壁组成,包括两条开放臂(长宽高:50 cm×10 cm×1 cm),两条封闭臂(长宽高:50 cm×10 cm×30 cm),四臂之间的中央区(长宽:10 cm× 10 cm)及顶端摄像仪器。经15 min环境适应后,将大鼠面向开臂放入中央区,记录5 min内的活动情况,内容包括:开放臂进入次数(OT)及时间(OE),闭合臂的进入次数(CT)及时间(CE),评价动物焦虑程度,计算OE/(OE+ CE)及OT/(OT+CT)的比值。
1.4.3 旷场试验(OFT)评价OFT设置为100 cm×100 cm×40 cm的灰色旷场箱,底面有25个方格,正上方有专用记录摄像仪。将大鼠经过10 min环境适应后放入中央格,开始3 min计时记录。记录内容包括:大鼠在旷场内水平运动得分(后腿离开一格记1分)评价水平运动能力,垂直运动得分(前爪离地直立记1分)评价大鼠垂直运动能力。
1.4.4 超声心动图检测大鼠经1%戊巴比妥(40 mg/kg)麻醉后,仰卧固定。左前胸备皮,取左心室短轴切面,探测M型曲线,记录大鼠的左室射血分数(LVEF)、左心室缩短分数(LVFS)、左心室收缩末期容积(LVESV)和左心室舒张末期容积(LVEDV)。
1.4.5 心脏HE染色、Masson染色及大脑尼氏染色大鼠麻醉后,打开胸腔暴露心脏,将灌流针由心尖插入左心室,固定灌流针,先用生理盐水快速灌注后采用10%福尔马林溶液常速灌注固定,摘取心脏及大脑浸泡于4%的组织固定液中。制备石蜡切片,采用Masson染色、苏木精-伊红(HE)染色及大脑尼氏染色。组织切片扫描后采用Image-Pro Plus 6.0进行计算机化分析。HE、Masson染色分析,每组内每张切片挑选合适倍数进行截图,截取整个组织,分别测量区域蓝色胶原纤维像素面积及胶原纤维的面积百分比,并进行梗死面积(纤维化面积/左心室总面积×100%)的百分比表示。
1.4.6 ELISA检测大鼠麻醉后固定暴露腹腔,行腹主动脉采血,经3000 r/min,10 min,离心后取血清,根据相应ELISA试剂盒说明书步骤进行指标检测。
1.4.7 免疫组化检测取制备的石蜡切片,按照试剂盒说明书进行操作。图像分析采用Image-Pro Plus 6.0进行计算机化分析,每张切片采样测量3处,计算单位面积下阳性染色区域面积。
1.5 统计学方法采用SPSS22.0统计软件进行统计分析。各组数据经正态性检验和方差齐性检验,若符合正态分布,计量资料以均数±标准差表示,若方差齐采用单因素方差分析,方差不齐采用Welchi检验。不符合正态分布,计量资料采用中位数(四分位数间距)表示,组间比较采用非参数检验,P < 0.05为差异有统计学意义。
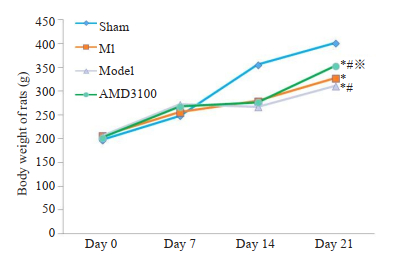
2 结果 2.1 各组大鼠体质量变化情况各组大鼠在第2周开始出现差异性增长。造模第4周,复合模型组体质量明显低于心梗组、假手术组;抑制剂组体质量高于心梗组、复合模型组,差异均具有统计学意义(P < 0.05,图 1)。
|
图 1 各组大鼠体质量变化情况 Fig.1 Changes of body weight of the rats in each group. MI group: Myocardial infarction. Model group: Myocardial infarcted rats with uncertain empty bottle stimulation. AMD3100 group: Compound model group treated with AMD3100. *P < 0.05 vs the sham group; #P < 0.05 vs the MI group; ※P < 0.05 vs the model group. |
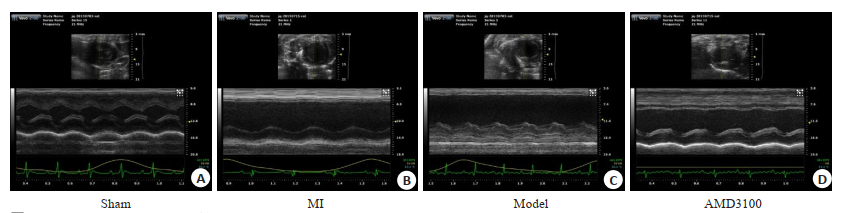
结果显示,复合模型组LVEF、LVFS均低于假手术组、心梗组,LVID;d、LVID;s均高于假手术组、心梗组,差异均具有统计学意义(P < 0.05);抑制剂组LVEF、LVFS均高于复合模型组,LVID;d、LVID;s低于复合模型组,差异均具有统计学意义(P < 0.05,表 1、图 2)。
| 表 1 各组大鼠心脏超声LVEF、LVFS、LVID; d、LVID; s指标比较情况 Tab.1 Comparison of echocardiographic indexes of LVEF, LVFS, LVID; d and LVID; s among the groups |
|
图 2 各组大鼠心脏超声图像情况 Fig.2 Echocardiographic images of the rats in each group. A: Sham group (n=6); B: MI group (n=6); C: Model group (n=6); D: AMD3100 group (n=7). Sham group: Rats with sham surgery; MI group: Myocardial infarction; Model group: Myocardial infarcted rats with uncertain empty bottle stimulation; AMD3100 group: Model group rats with administration ofAMD3100. |
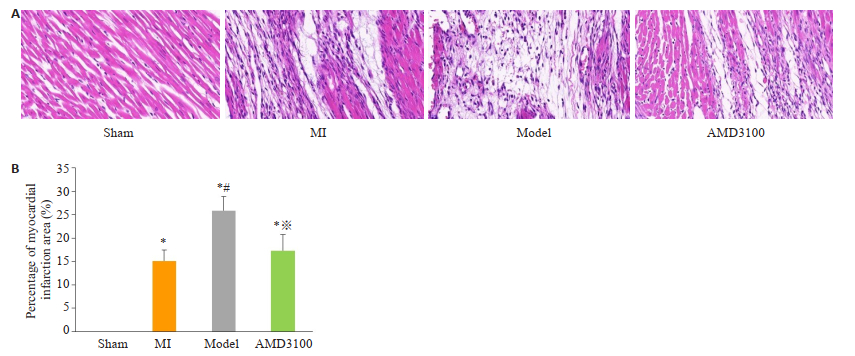
假手术组心肌组织染色均匀,未见明显炎性浸润;心肌细胞结构大致正常,肌纤维排列整齐,未见明显病理表现。心梗组出现较多心肌细胞坏死消失;局部被结缔组织取代修复;局部可见大量成纤维细胞和血管,血管多见淤血;较多炎性细胞浸润;心肌间质水肿变宽。复合模型组比心梗组严重。抑制剂组可见大血管代偿性增生,血管扩张;心肌细胞部分坏死消失;局部被结缔组织取代修复;部分炎症细胞浸润(图 3A)。
|
图 3 各组大鼠心脏心肌梗死病理结果(A, HE染色, ×400)和面积所占百分比(B, %) Fig.3 Pathological results of myocardial infarction (A, HE staining, original magnification: ×400) and the percentage of myocardial infarction area (B, %). Sham group: Rats with sham surgery. MI group: Myocardial infarction. Model group: Myocardial infarcted rats with uncertain empty bottle stimulation. AMD3100 group: Model group rats with administration of AMD3100. *P < 0.05 vs the sham group; #P < 0.05 vs the MI group; ※P < 0.05 vs the model group |
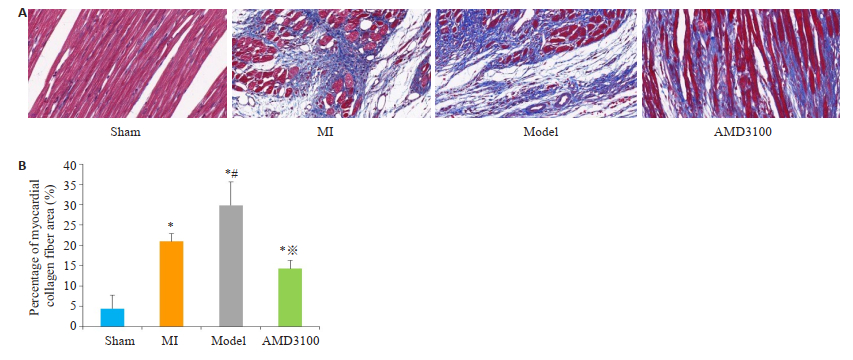
假手术组心肌红染,肌纤维清晰、排列整规则,心肌细胞结构大致正常。心梗组心肌细胞大量坏死消失,局部组织被胶原纤维取代,心肌细胞排列紊乱,组织间质可见大量炎性浸润。复合模型组比心梗组严重。抑制剂组心肌细胞红染,部分心肌细胞坏死,坏死区肌纤维排列紊乱,组织间质可见胶原纤维散在性分布(图 4A)。
|
图 4 各组大鼠心脏心肌胶原纤维病理结果(A, Masson染色, ×400)和面积所占百分比(B, %) Fig.4 Pathological results of myocardial collagen fibers in rats of each group (A, Massion staining, original magnification: × 400) and the Percentage of myocardial collagen fiber area (B, %). Sham group: Rats with sham surgery. MI group: Myocardial infarction. Model group: Myocardial infarcted rats with uncertain empty bottle stimulation. AMD3100 group: Model group rats treated with AMD3100. *P < 0.05 vs the sham group; #P < 0.05 vs the MI group; ※P < 0.05 vs the model group. |
心肌梗死面积及胶原纤维阳性面积比较,复合模型组均高于其他3组,提示复合模型组发生了更严重的心肌梗死;与复合模型相比,抑制剂组梗死面积及胶原纤维阳性面积减小,差异具有统计学意义(P < 0.05);但与心梗组比较,其差异无统计学意义(图 3B、4B)。
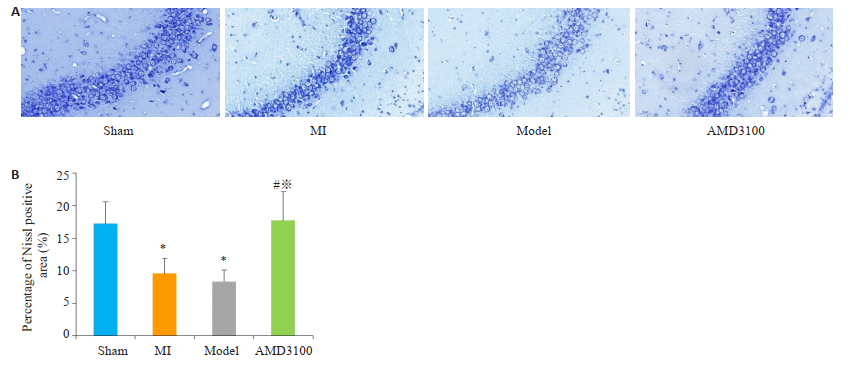
2.4 各组大鼠行为学评价比较及海马尼氏染色情况尼氏染色图像分析显示,与假手术组相比,心梗组、复合模型组尼氏体的数量减少,差异具有明显统计学意义(P < 0.01);抑制剂组与假手术组之间无明显差异,反映神经细胞合成蛋白质的功能较强,在神经元受损较轻(图 5)。
|
图 5 各组大鼠海马区尼氏染色病理结果(A, 尼氏染色, ×200)和尼氏阳性面积所占百分比(B, %) Fig.5 Pathological results of Nissl staining in the hippocampus of rats in each group (A, Nissl staining, original magnification: × 200) and the percentage of Nissl positive area (B, %). Sham group: Rats with sham surgery. MI group: Myocardial infarction. Model group: Myocardial infarcted rats with uncertain empty bottle stimulation. AMD3100 group: Model group rats treated with administration of AMD3100. *P < 0.05 vs the sham group; #P < 0.05 vs the MI group; ※P < 0.05 vs the model group. |
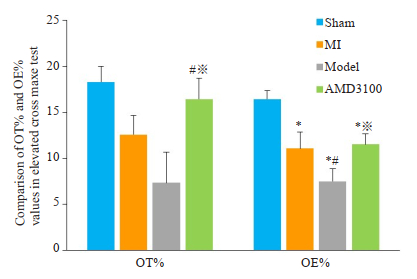
在高架十字迷宫试验中,复合模型组大鼠停留在开臂时间及进入开臂的次数均明显低于假手术组及心梗组(P < 0.05)。与复合模型组相比,抑制剂组大鼠在开臂上的时间及进入开臂的次数明显增加(P < 0.05,图 6)。
|
图 6 各组大鼠高架十字迷宫实验OT%、OE%值比较 Fig.6 Comparison of OT% and OE% values in Elevated Cross Maze test of rats in different groups. *P < 0.05 vs the sham group; #P < 0.05 vs the MI group; ※P < 0.05 vs the model group. |
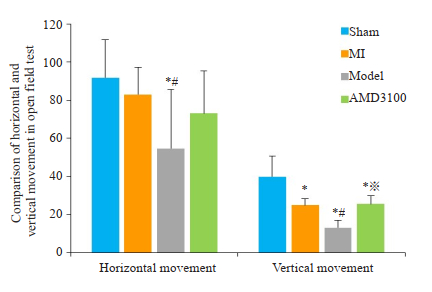
在旷场试验中,复合模型组大鼠的水平运动和垂直运动较假手术组与心梗组减少(P < 0.05),而抑制剂组大鼠的水平运动,与各组间比较均无差异;抑制剂组大鼠垂直运动较复合模型组增加,组间差异有意义(P < 0.05,图 7)。
|
图 7 各组大鼠旷场实验水平及垂直运动情况比较 Fig.7 Comparison of horizontal and vertical movement in Open Field test of rats in different groups, *P < 0.05 vs the sham group; #P < 0.05 vs the MI group; ※P < 0.05 vs the model group. |
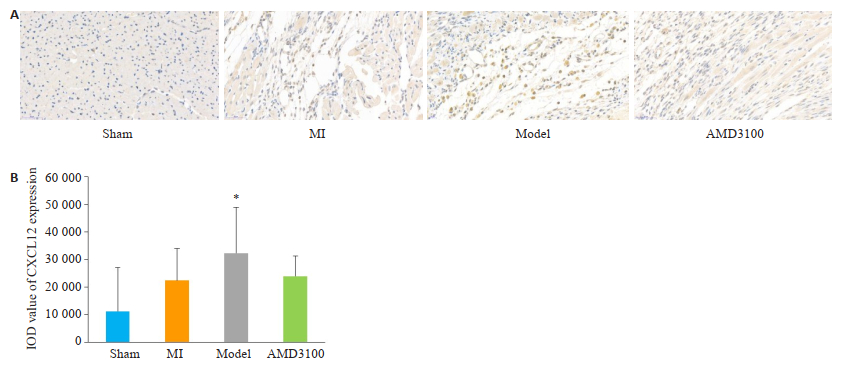
运用Image-Pro Plus 6.0对各组的免疫组化截取图片进行半定量统计分析,复合模型组大鼠心梗边缘区CXCL12表达IOD值高于假手术组(P < 0.05),余组间比较差异无统计学意义。复合模型组大鼠血液中CXCR4表达IOD值均高于假手术组、心梗组和抑制剂组,差异具有统计学意义(P < 0.05),提示空瓶刺激诱导的情绪应激可能激活心梗后大鼠体内CXCR4的表达,导致CXCL12/CXCR4信号轴失衡。抑制剂组CXCR4表达量低于复合模型组(P < 0.05,图 8、9)。
|
图 8 各组大鼠心梗边缘区CXCL12表达情况(A, 免疫组化染色, ×200)和表达IOD值(B) Fig.8 The expression of CXCL12 in the marginal zone of myocardial infarction (A, Immunohistochemical staining, × 200) and IOD values (B) in different groups. Sham group: Rats with sham surgery. MI group: Myocardial infarction. Model group: Myocardial infarcted rats with uncertain empty bottle stimulation. AMD3100 group: Model group rats with administration of AMD3100. *P < 0.05 vs the sham group; #P < 0.05 vs the MI group; ※P < 0.05 vs the model group. |
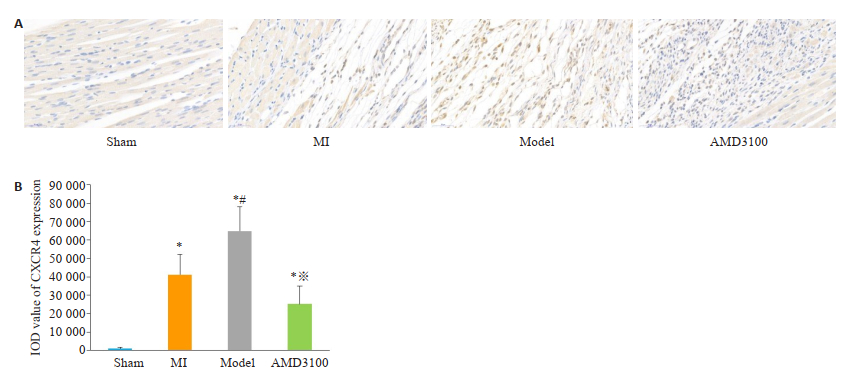
|
图 9 各组大鼠心梗边缘区CXCR4表达情况(A, 免疫组化染色, ×200)和表达IOD值(B) Fig.9 The expression of CXCR4 in the marginal zone of myocardial infarction (A, Immunohistochemical staining, ×200) and IOD values (B) in different groups. *P < 0.05 vs the sham group; #P < 0.05 compared with the MI group; ※P < 0.05 vs the model group. |
ELISA结果显示,心梗组、复合模型组、抑制剂组CXCL12表达均低于假手术组,组间比较差异无统计学意义。复合模型组大鼠血液中CXCR4表达均高于假手术组、心梗组,差异具有统计学意义(P < 0.05),提示空瓶刺激诱导的情绪应激可能激活心梗后大鼠体内CXCR4的表达,使CXCL12/CXCR4信号轴失衡。抑制剂组CXCR4表达量低于复合模型组(P < 0.05)。
抑制剂组心梗相关炎性因子IL-1β、IL-18、中性粒细胞活性蛋白酶(NE)的表达均低于复合模型组,差异具有统计学意义(P < 0.05)。AMD3100能够抑制过度激活CXCR4的表达,抑制部分炎性因子表达,但对CXCL12表达无影响(表 2)。
| 表 2 各组大鼠血CXCL12、CXCR4、IL-1β、IL-18、NE表达水平比较情况 Tab.2 Comparison of the expression levels of CXCL12, CXCR4, IL-1β, IL-18 and NE in blood of rats in different groups groups (Mean±SD) |
本研究采用21 d不确定空瓶刺激诱发大鼠焦虑行为,是传统焦虑建模方式[18]。造模期间记录各组实验大鼠体质量、毛发状态、行为反应,造模结束后采用高架十字迷宫、旷场试验进行行为学评测,脑部尼氏染色进行病理形态学观察。与假手术和单纯心梗大鼠相比,给予慢性应激刺激的心梗大鼠体质量增长趋势明显缓慢。其次,复合模型组大鼠进入开臂的次数、停留开臂的时间、穿越格子数、垂直站立次数明显下降,大鼠出现探究行为、活动度下降,脑部海马尼氏阳性面积减少,表明脑部神经元受损严重,提示复合模型组大鼠处在严重焦虑情绪状态中。
CXCL12/CXCR4轴在急性心梗中发挥双刃剑作用[19]。趋化因子(CKs)是一种8~12kda蛋白质,与G蛋白偶联受体的相互作用在细胞增殖、免疫系统、迁移、侵袭、血管生成、免疫应答的逃避、炎症微环境等方面具有重要作用[20-21],例如免疫细胞向炎症和损伤部位的招募[22]。趋化因子根据其功能分为两个亚组:炎性趋化因子和稳态趋化因子。炎症性趋化因子在炎症条件下上调,介导免疫细胞向感染、组织损伤和炎症部位的募集等功能;稳态趋化因子控制各种细胞的稳态迁移和归巢[23]。研究表明CXCL12与CXCR4结合后,CXCR4被泛素化、内吞,然后被溶酶体降解[24]。在一些病理情况下趋化因子CXCR4的表达过度上调,CXCR4可直接或间接激活PI3K/AKT、NF-κB通路,调控下游炎症效应,导致IL-1β、IL-18等表达增加[25]。该信号轴在急性心梗超早期被激活,能动员诱导骨髓间充质干细胞归巢至心梗区及梗死边缘区,发挥修复坏死心肌细胞的作用[26],但CXCL12表达在急性心梗后3~7 d急剧下降至正常或更低水平,而激活的CXCR4在心梗后3~4 d后表达迅速上升并维持高水平状态[6],CXCR4过度激活,能诱发多种炎性信号通路,导致炎性因子的大量释放,加重心肌细胞坏死,恶化心功能。
本研究通过检测各组别大鼠心梗边缘区CXCL12、CXCR4的表达,观察到CXCR4在慢性情绪应激刺激的心梗大鼠中呈现高表达状态,相比于单纯心梗大鼠,其表达明显上调,而两组间CXCL12的表达量并无差异,因此,慢性情绪应激刺激可能通过使CXCL12/CXCR4轴表达失调,CXCR4过度激活,造成梗死边缘区炎性微环境稳态失衡,IL-1β、IL-18、中性粒细胞活性蛋白酶等大量释放。复合模型组与心梗组相比,大鼠心脏LVEF%、LVFS%降低,心肌梗死面积增加,说明CXCR4过度激活诱导炎性因子释放,恶化心梗后心功能,可能是焦虑影响心梗预后的潜在病理机制。
慢性情绪应激严重威胁人们身心健康,是导致心梗后长期死亡率增加的重要危险因素[27-28]。目前研究认为炎性反应、内皮损伤、HPA轴激活和交感神经系统过度兴奋等是焦虑心理障碍诱发并恶化心血管疾病的病理机制[29-30]。
抑制剂AMD3100(Plerixafor),是美国食品和药物管理局(FDA)批准用于治疗非霍奇金淋巴瘤(NHL)或多发性骨髓瘤(MM),能阻断和抑制CXCR4的功能作用[31-32],降低炎性因子表达,减轻急性心梗后心肌细胞的坏死程度。
本研究结果显示,相比于复合模型组,接受AMD3100腹腔注射组大鼠的CXCR4表达减少,炎性因子水平降低,心脏超声LVEF%、LVFS%有不同程度的改善,说明过度激活CXCR4诱导的炎性反应可在一定程度上被AMD3100所逆转,有益于心梗后心脏的恢复。
本研究揭示了慢性情绪应激刺激可导致CXCL12/CXCR4信号轴失调,加重心梗后的炎性反应,造成心肌细胞大量坏死,恶化心功能。AMD3100可抑制心梗后CXCR4的高表达状态,减少炎性因子释放,降低焦虑情绪对心梗后大鼠的负面影响。该机制可能是焦虑影响心梗预后的潜在病理环节,但仍需通过进一步的细胞分子实验对本研究结论进行深入论证和完善。
| [1] |
Carroll AJ, Huffman MD, Zhao LH, et al. Associations between depressive symptoms, cigarette smoking, and cardiovascular health: Longitudinal results from CARDIA[J]. J Affect Disord, 2020, 260: 583-91. DOI:10.1016/j.jad.2019.09.049 |
| [2] |
Zhou MG, Wang HD, Zeng XY, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the global burden of disease study 2017[J]. Lancet, 2019, 394(10204): 1145-58. DOI:10.1016/S0140-6736(19)30427-1 |
| [3] |
Otto MW, Fitzgerald HE, Meyer-Pot MJ. The potential role of anxiety sensitivity in the risk for and recovery from heart attacks: comment on edmondson et al. (2018)[J]. Am Psychol, 2019, 74(5): 622-3. DOI:10.1037/amp0000479 |
| [4] |
Roest AM, Martens EJ, de Jonge P, et al. Anxiety and risk of incident coronary heart disease: a meta-analysis[J]. J Am Coll Cardiol, 2010, 56(1): 38-46. DOI:10.1016/j.jacc.2010.03.034 |
| [5] |
Döring Y, Pawig L, Weber C, et al. The CXCL12/CXCR4 chemokine ligand/receptor Axis in cardiovascular disease[J]. Front Physiol, 2014, 5: 212. |
| [6] |
Penn MS. Importance of the SDF-1: CXCR4 Axis in myocardial repair[J]. Circ Res, 2009, 104(10): 1133-5. DOI:10.1161/CIRCRESAHA.109.198929 |
| [7] |
王昊, 卢明. CXCL12/CXCR4轴的表达和功能研究进展[J]. 激光生物学报, 2018, 27(2). |
| [8] |
Isles HM, Herman KD, Robertson AL, et al. The CXCL12/CXCR4 signaling Axis retains neutrophils at inflammatory sites in zebrafish[J]. Front Immunol, 2019, 10: 1784. DOI:10.3389/fimmu.2019.01784 |
| [9] |
Jarrah AA, Schwarskopf M, Wang ER, et al. SDF-1 induces TNFmediated apoptosis in cardiac myocytes[J]. Apoptosis, 2018, 23(1): 79-91. DOI:10.1007/s10495-017-1438-3 |
| [10] |
Dai SJ, Yuan FP, Mu JY, et al. Chronic AMD3100 antagonism of SDF-1alpha-CXCR4 exacerbates cardiac dysfunction and remodeling after myocardial infarction[J]. J Mol Cell Cardiol, 2010, 49(4): 587-97. DOI:10.1016/j.yjmcc.2010.07.010 |
| [11] |
周瑞明, 曾荣. SDF-1/CXCR4拮抗剂AMD3100应用方面的研究进展[J]. 广东医学院学报, 2010, 28(2): 205-7. DOI:10.3969/j.issn.1005-4057.2010.02.043 |
| [12] |
王超, 杜泓森, 侯季秋, 等. 慢性情绪应激对急性心肌梗死后骨髓ckit~+干细胞动员的影响[J]. 中国循环杂志, 2018, 33(7): 709-13. DOI:10.3969/j.issn.1000-3614.2018.07.019 |
| [13] |
Bøtker HE, Hausenloy D, Andreadou I, et al. Practical guidelines for rigor and reproducibility in preclinical and clinical studies on cardioprotection[J]. Basic Res Cardiol, 2018, 113(5): 39. DOI:10.1007/s00395-018-0696-8 |
| [14] |
王蕾, 赵明镜, 杨涛, 等. 从心电图和超声心动图相关性分析研究心肌梗死后心衰模型的早期评价和筛选方法[J]. 中西医结合心脑血管病杂志, 2017, 15(22): 2816-20. DOI:10.3969/j.issn.1672-1349.2017.22.006 |
| [15] |
Shao F, Lin WJ, Wang WW, et al. The effect of emotional stress on the primary humoral immunity of rats[J]. J Psychopharmacol (Oxford), 2003, 17(2): 179-83. DOI:10.1177/0269881103017002005 |
| [16] |
Wang C, Du HS, Hou JQ, et al. Chaihulonggumulitang shows psycho-cardiology therapeutic effects on acute myocardial infarction by enhancing bone marrow mesenchymal stem cells mobilization[J]. Sci Rep, 2018, 8(1): 3724. DOI:10.1038/s41598-018-21789-w |
| [17] |
赵晓宁. CXCR4拮抗剂AMD3100促进心肌梗死后组织修复过程的实验研究[D].天津: 天津医科大学, 2009. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y1553055
|
| [18] |
朱明好, 蒋宁, 周文霞. 不确定性空瓶饮水刺激法和束缚应激法建立小鼠焦虑模型及比较[J]. 中国药理学与毒理学杂志, 2019, 33(2): 102-8. DOI:10.3867/j.issn.1000-3002.2019.02.003 |
| [19] |
Liehn EA, Tuchscheerer N, Kanzler I, et al. Double-edged role of the CXCL12/CXCR4 Axis in experimental myocardial infarction[J]. J Am Coll Cardiol, 2011, 58(23): 2415-23. DOI:10.1016/j.jacc.2011.08.033 |
| [20] |
Blanchet X, Langer M, Weber C, et al. Touch of chemokines[J]. Front Immunol, 2012, 3: 175. |
| [21] |
Vinader V, Afarinkia K. The emerging role of CXC chemokines and their receptors in cancer[J]. Future Med Chem, 2012, 4(7): 853-67. DOI:10.4155/fmc.12.48 |
| [22] |
García-Cuesta EM, Santiago CA, Vallejo-Díaz J, et al. The role of the CXCL12/CXCR4/ACKR3 Axis in autoimmune diseases[J]. Front Endocrinol (Lausanne), 2019, 10: 585. DOI:10.3389/fendo.2019.00585 |
| [23] |
Mousavi A. CXCL12/CXCR4 signal transduction in diseases and its molecular approaches in targeted-therapy[J]. Immunol Lett, 2020, 217: 91-115. DOI:10.1016/j.imlet.2019.11.007 |
| [24] |
Marchese A, Benovic JL. Agonist-promoted ubiquitination of the G protein-coupled receptor CXCR4 mediates lysosomal sorting[J]. J Biol Chem, 2001, 276(49): 45509-12. DOI:10.1074/jbc.C100527200 |
| [25] |
Busillo JM, Armando S, Sengupta R, et al. Site-specific phosphorylation of CXCR4 is dynamically regulated by multiple kinases and results in differential modulation of CXCR4 signaling[J]. J Biol Chem, 2010, 285(10): 7805-17. DOI:10.1074/jbc.M109.091173 |
| [26] |
Lu DH, Liao Y, Zhu SH, et al. Bone-derived Nestin-positive mesenchymal stem cells improve cardiac function via recruiting cardiac endothelial cells after myocardial infarction[J]. Stem Cell Res Ther, 2019, 10(1): 127. DOI:10.1186/s13287-019-1217-x |
| [27] |
Emdin CA, Odutayo A, Wong CX, et al. Meta-analysis of anxiety as a risk factor for cardiovascular disease[J]. Am J Cardiol, 2016, 118(4): 511-9. DOI:10.1016/j.amjcard.2016.05.041 |
| [28] |
Smeijers L, Mostofsky E, Tofler GH, et al. Anxiety and anger immediately prior to myocardial infarction and long-term mortality: Characteristics of high-risk patients[J]. J Psychosom Res, 2017, 93: 19-27. DOI:10.1016/j.jpsychores.2016.12.001 |
| [29] |
Muller JE, Koen L, Stein DJ. Anxiety and medical disorders[J]. Curr Psychiatry Rep, 2005, 7(4): 245. DOI:10.1007/s11920-005-0077-5 |
| [30] |
Cohen BE, Edmondson D, Kronish IM. State of the Art Review: Depression, Stress, Anxiety, and cardiovascular disease[J]. Am J Hypertens, 2015, 28(11): 1295-302. DOI:10.1093/ajh/hpv047 |
| [31] |
Debnath B, Xu S, Grande F, et al. Small molecule inhibitors of CXCR4[J]. Theranostics, 2013, 3(1): 47-75. DOI:10.7150/thno.5376 |
| [32] |
De Clercq E. Mozobil(R) (Plerixafor, AMD3100), 10 years after its approval by the US Food and Drug Administration[J]. Antivir Chem Chemother, 2019, 27: 1630018426. |
 2020, Vol. 40
2020, Vol. 40

