国家卫生健康委员会2020年2月18日发布《新型冠状病毒肺炎诊疗方案(试行第六版)》,增加磷酸氯喹(Chloroquine phosphate)作为抗病毒试用药物[1]。次日,广东省科技厅及广东省卫生健康委磷酸氯喹治疗新冠状病毒肺炎多中心协作组发布了《磷酸氯喹治疗新型冠状病毒肺炎的专家共识》,对确诊为新型冠状病毒肺炎(COVID-19)轻型、普通型和重型患者,排除氯喹禁忌证后,可以使用磷酸氯喹片每次500 mg,2次/d,疗程10 d[2]。2月28日,国家卫健委再次发文,国卫办医函[2020]165号《关于调整试用磷酸氯喹治疗新冠肺炎用法用量的通知》,将适用人群和用法用量调整为:新冠肺炎18岁~65岁成人。体质量50 kg以上者每次500 mg、2次/d,疗程7 d;体质量50 kg及以下者第1、2天每次500 mg、2次/d,第3~7天每次500 mg、1次/d,疗程7 d。《新型冠状病毒肺炎诊疗方案(试行第七版)》继续推荐该用法用量。因氯喹使用剂量较大,其安全性引起了广大医务工作者的担忧与警惕。因此,本文就氯喹临床应用的进展,药代动力学特点,抗病毒机制,以及安全性等作一综述。
1 磷酸氯喹治疗COVID-19的现状 1.1 体外抗病毒研究COVID-19疫情发生后,中国的科学家为寻找有效的抗病毒药物,做了大量的体外细胞筛选试验。2020年2月4日,武汉病毒所联合国家应急防控药物工程技术研究中心首次发表了磷酸氯喹体外抑制新冠病毒的体外研究结果[3],通过病毒感染Vero E6细胞后,加用磷酸氯喹作用于感染的细胞,发现氯喹的半数有效浓度(EC50)为1.13 μmol/L(0.36 mg/L),EC90为6.90 μmol/L(2.21 mg/L),半数细胞毒性浓度(CC50) > 100 μmol/L,选择指数(SI) > 88.5,在病毒进入阶段和进入后阶段,均有抗病毒作用,体外试验证明磷酸氯喹在较低浓度就能阻断病毒感染。但根据已有报道,500 mg/d的剂量血浆药物浓度即可超过EC90(6.90 μmol/L)[4]。因此,其安全性值得进一步探讨
1.2 临床研究目前,国内有13项磷酸氯喹治疗COVID-19的临床研究正在开展(表 1)。同时,11项针对硫酸羟氯喹(Hydroxychloroquine Sulphate)的临床研究也在进行(http://www.chictr.org.cn/)。根据已发表的简报[5],来自100多名患者的临床治疗观察表明,在抑制肺炎恶化、改善肺部影像结果、促进病毒转阴和缩短病程方面,磷酸氯喹优于对照治疗,并且上述患者未见严重的磷酸氯喹不良反应。
| 表 1 磷酸氯喹治疗COVID-19的临床研究项目 Tab.1 Clinical research projecs of chloroquine chlorate for COVID-19 |
日前,由中山大学附属第五医院领衔完成的磷酸氯喹的临床研究,报道了初步的研究结果[6]。共纳入22例COVID患者,以洛匹那韦/利托那韦片(400/100 mg,2次/d)为对照组(n=12),磷酸氯喹(500 mg,2次/d)为试验组(n=10),共治疗10 d。在治疗第7、10、14天,磷酸氯喹的病毒转阴率均轻度高于对照组。在肺部CT评价中,洛匹那韦/利托那韦组第一例病毒转阴在第3天,而肺部影像学清楚则出现在第6天,氯喹病毒转阴出现在第6天,而肺部影像清除在第7天。这些数据表明,病毒清除不会立即转化为肺部的病理改善。在第9天,氯喹组60%肺部清除,而对照组是25%,到第14天,氯喹组肺部影像的改善率是洛匹那韦/利托那韦组的2倍余(RR=2.21, 95% CI 0.81-6.62)。在出院时间上,氯喹第14天出院率为100%,洛匹那韦/利托那韦组为50%。这些结果表明,氯喹治疗的患者比洛匹那韦/利托那韦组治疗的患者恢复得更好,肺功能恢复得更快。而在此之前,从已发表的文献中得出的初步结论是,目前没有足够证据表明氯喹在治疗COVID-19中的有效性和安全性[7-9]。应严格警惕临床试验中使用的限制,并进行随访,进一步明确其作用。到目前为止,国内外共有30余项临床试验正在进行中,只有在这些高质量、大样本临床试验的结果出来之后,才能确定氯喹在COVID-19治疗中的作用。
2 磷酸氯喹的临床应用进展 2.1 氯喹的来源印地安人最早使用金鸡纳树皮泡水来治疗发热高烧,也就是现在的疟疾。直到1817年,法国药剂师Caventou和Pelletier合作,首先从金鸡纳树皮中分离得到了奎宁(Quinine)单体(俗称金鸡纳碱),并尝试对疟疾进行治疗,后来奎宁被证实就是存在于金鸡纳树皮中的抗疟疾有效成分,奎宁也因此成为当时治疗发热性疾病的首选药物[10]。奎宁能杀灭各种疟原虫红内期裂殖体,对间日疟疗效较好,但毒性较大,表现为恶心、呕吐、耳鸣、头痛、视力和听力减退等,俗称为“金鸡纳反应”。在后来的一百多年里,全世界科学家们不断尝试人工合成奎宁,并对其结构进行改造。
1934年德国人Andersay首先合成氯喹[11],命名为Resochin(雷索欣),认为毒性太大而停止研究,这一结论以后称之为“雷索欣错误”。1944年经联合国疟疾研究协调组织对氯喹的药物学和抗疟活性进行审慎研究和评价,才重新引起关注,它是人类生产的最成功的抗疟药物之一[12]。同年,科学家为了寻找疗效更好、毒性更低的药物,对氯喹的结构进行改造,在氯喹中加了一个羟基,研究出一种新型抗疟疾药——羟氯喹,使其在人体胃肠道吸收更快,体内分布更广,毒性更低(结构式见图 1)。后来,一部分恶性疟疾原虫对氯喹和羟氯喹产生了抗药性。于是,就有了现在国人熟知的屠呦呦发现抗疟疾药物青蒿素。
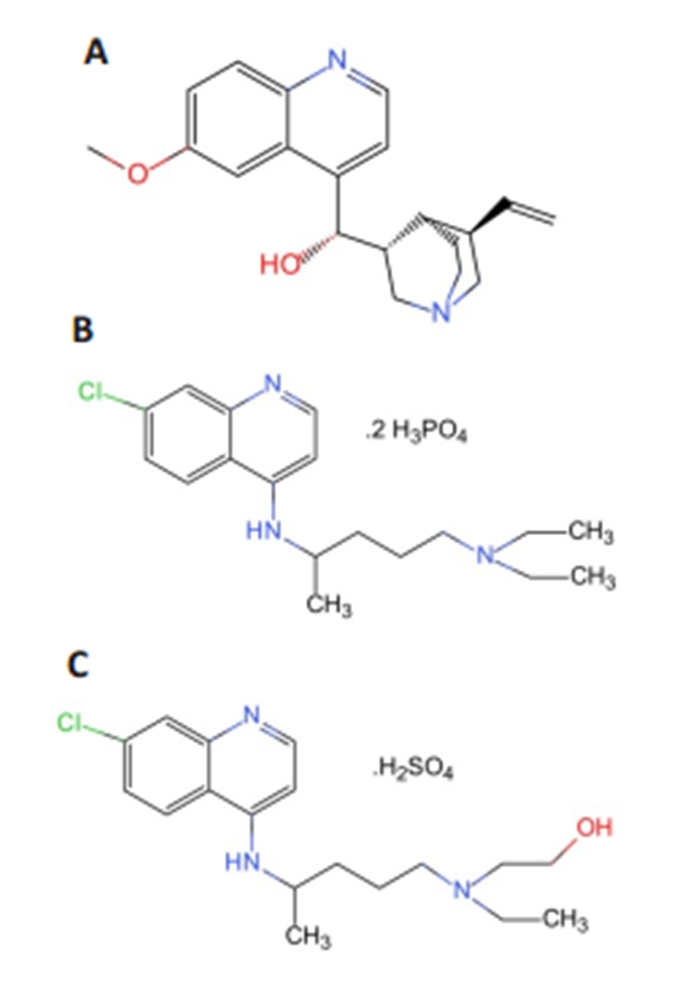
|
图 1 奎宁(A)、磷酸氯喹(B)和硫酸羟氯喹(C)结构式 Fig.1 Structures of quinine (A), chloroquine phosphate (B) and hydroxychloroquine sulfate (C) |
氯喹最初用于疟疾,在80余年的不断研究发展中,它在皮肤病、免疫学、风湿病及严重传染性疾病等方面均有获益。研究发现,氯喹和羟氯喹已被证明具有免疫调节作用,目前已在风湿病、不同类型红斑狼疮和皮肤病的治疗中确立了作用。最近,氯喹也被发现具有代谢、心血管、抗血栓和抗肿瘤等作用(表 2)。
| 表 2 氯喹的临床应用进展 Tab.2 Progress in the clinical application of chloroquine |
Murray等[18]的RCT研究表明,氯喹250 mg/d或500 mg/d治疗2个月,可降低HIV感染慢性阶段的T细胞免疫激活,氯喹可能对某些HIV感染人群有益。相反,Routy等[19]的一项单臂概念验证性探索性研究发现,氯喹250 mg/d联合抗病毒治疗24周,并不能减少HIV病毒诱导的免疫激活或提高CD4+T细胞计数。氯喹是否能调节免疫激活仍然存在一些争议。最近的一些综述文章也着重讨论了氯喹启动治疗的时机与剂量的选择,以达到最大的疗效[20-21]。
目前,尚无用于治疗冠状病毒感染的已注册有效的预防或暴露后疗法。据报道,氯喹在体外对SARS冠状病毒感染(SARS-CoV)和传播具有很强的抗病毒活性[14, 22]。氯喹体外抑制SARS-CoV的IC50为(8.8±1.2)µmol/L(EC50=261 µmol/L,SI=30),显着低于其抑制细胞活性的浓度,且接近在急性疟疾治疗期间达到的血浆氯喹浓度[23]。相比之下,氯喹似乎对COVID-19显示出了更低的有效浓度和更高的选择指数。当在暴露于病毒之前或之后用氯喹处理细胞时,同样观察到了明显的抑制作用,这表明了氯喹预防和治疗方面均有作用[14, 23]。而这种预防作用,可能是氯喹改变ACE2受体糖基化修饰,导致SARS-CoV的刺突蛋白与ACE2受体结合的亲和力降低,影响了病毒感染的启动。
2012年出现的中东呼吸综合征冠状病毒(MERSCoV),死亡率高达30%。de Wilde等[22]筛选了348种FDA批准的用于细胞培养中抗MERS-CoV活性的药物文库,鉴定了四种化合物(氯喹,氯丙嗪,洛哌丁胺和洛匹那韦)在低摩尔浓度范围(EC50=3~8 µmol/L)即能抑制MERS-CoV复制,其中氯喹EC50=3.0 µmol/L,EC50= 58.1 µmol/L,SI=19.4。因此,氯喹也成为最具价值的抗MERS-CoV候选药物,可以在动物模型中进一步测试或直接超说明书使用。
在抗埃博拉病毒(Ebola Virus)的体外实验中,氯喹抑制病毒复制的EC50为16 µmol/L,抑制病毒进入的EC50=4.7 µmol/L,EC50 > 50 µmol/L,SI > 3.1。在病毒感染的小鼠模型中,氯喹90 mg/kg腹腔给药2次/d,能显著增加感染小鼠生存率。但在豚鼠模型中,却没有任何剂量的氯喹能增加生存率,且在低剂量时就观察到毒副作用[15]。因此,氯喹的抗病毒作用需谨慎评估,简单体外试验并不能代表体内有效或对人体有效。
2.3.2 氯喹抗病毒作用机制氯喹的抗疟疾作用机理尚未完全阐明,但主要机制理论集中在:(1)氯喹通过在寄生虫食物泡内和溶酶体积聚,提高了寄生虫食物泡内的pH值,使消化血红蛋白的血红蛋白酶受损,疟原虫不能消化所摄取的血红蛋白,导致疟原虫生长发育所必需的氨基酸缺乏,并引起核糖核酸崩解。(2)与高铁血红素结合形成复合物或抑制血红素聚合酶,使血红素游离,干扰了寄生虫的解毒过程,使疟原虫的膜被脂质过氧化反应而损伤。在抗病毒作用的体外研究中,氯喹主要以pH依赖性的抑制病毒复制,同时还能抑制病毒感染的过程[24]。氯喹可通过下调细胞因子(IFN-γ和TNF-α)的表达以及TNF-α受体的表达,从而增加核内体-溶酶体和高尔基体囊泡的pH。因此,氯喹能直接抑制核内体-溶酶体中酸依赖性的病毒,也能缓和因病毒感染而导致的免疫激活带来的损伤作用[25-26]。而在一些非pH依赖性的途径中,氯喹还可能抑制多聚合谷氨酸转移酶发挥作用。
在COVID-19中,SARS-CoV-2表面的S蛋白使用与SARS-CoV-1相同的细胞表面受体ACE2进入宿主细胞[27-28]。Fantini等[29]运用结构和分子模拟结合的方法,发现氯喹与唾液酸和神经节苷脂有高度的亲和力。在SARS-CoV-2 S蛋白的N末端发现了一种新型的神经节苷脂结合结构域,此结构域在全球分离的病毒中完全保守,它能改善病毒对脂质筏的附着,促进其与ACE2的结合。而氯喹与其高亲和力,可阻断病毒与ACE2的结合而抑制其进入细胞。
3 氯喹的药代动力学特点 3.1 氯喹一般药代动力学根据SFDA和FDA已批准上市的药品说明书,氯喹口服后,肠道吸收快而充分。健康成人口服片剂相当于300 mg氯喹基质后,平均3.6 h达到血浆浓度为76 ng/mL(0.24 µmol/L)[30]。血浆蛋白结合率约55%,血药浓度维持较久。氯喹的吸收分布呈二室模型,1个转运吸收室和1个中央室,而其代谢物去乙基氯喹还存在1个周边室[31]。氯喹在红细胞中的浓度为血浆内浓度的10~20倍,且氯喹也与血小板和粒细胞相结合,使全血浓度为血浆浓度的5~10倍[32]。血液凝固时,血小板中的氯喹释放,使血清浓度又显著高于血浆浓度[30]。氯喹与组织蛋白结合更多,表观分布容积十分巨大,在肝、脾、肾、肺中的浓度高于血浆浓度达200~700倍。但在脑组织及脊髓组织中的浓度为血浆浓度的10~30倍。Parson等[33]人运用LESA-MS/MS组织切片药物成分直接定量化学成像技术,分析了氯喹10 mg/kg灌胃大鼠2 h后的组织分布,更直观呈现其主要在肝、肺、肾、脾等组织的分布(图 2)。
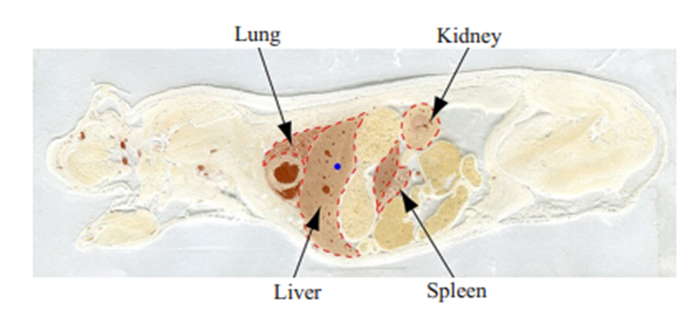
|
图 2 氯喹10 mg/kg灌胃2 h后的组织分布[33] Fig.2 Tissue distribution of chloroquine 2 h after gavage at a dose of 10 mg/kg |
氯喹的t1/2为2.5~10 d,其终末消除半衰期随剂量增加而增加。单次口服250 mg后的t1/2为3.1 h,500 mg的t1/2为42.9 h,单次口服1 g后的t1/2为312 h。氯喹在体内的代谢转化是在肝脏进行的,其主要代谢产物是去乙基氯喹,此物仍有抗疟作用。高达70%的剂量以不变的形式随尿液排出,25%的剂量以去乙基氯喹的形式随尿液排出。少量氯喹可能存在于停药后的几周、几个月甚至几年的尿液中(https://www.drugs.com/monograph/chloroquine-phosphate.html)。其排泄速度可因尿液酸化而加快,碱化而降低。约8%随粪便排泄,氯喹也可由乳汁中排出。值得注意的是,不同种族人群,氯喹的药代动力学差异明显[32]。
3.2 氯喹异构体药代动力学差异氯喹为手性药物,是由(S)-异构体和(R)-异构体1:1组成的外消旋体。关于对映体与疗效间的关系,目前研究较少。Augustijns等[34]通过交叉试验设计研究纳入6名健康志愿者,分别前后给予150 mg基质的氯喹对映体单体,发现R:S的全血浓度稳定在1:0.7,两者药代动力学存在较大差异(表 3)。由于氯喹立体异构体的立体选择活性和毒性的研究不足,阻碍了对这些药代动力学差异的临床后果的进一步结论。有体外研究表明,(R)-异构体抗恶性虐活性比(S)-异构体降低2~15倍[35]。因此,可以推测个体间氯喹立体选择性的差异,可能导致反应的差异。
3.3 氯喹血药浓度-时间曲线 3.3.1 氯喹单次给药后的药时曲线WALKER等[36]通过高效液相色谱法(HPLC),分析了8个健康的尼日利亚志愿者口服600 mg氯喹(基质)后的药动学参数。发现氯喹血浆的峰浓度Cmax为374±56 ng/mL(1.17 µmol/L),达峰时间Tmax为5±3 h,t1/2为192±28 h,CLR为378±45 mL/min,AUC为18609±4254 ng/(mL· h)。其代谢物去乙基氯喹的Cmax=113±31 ng/mL,Tmax=7±2 h。运用不同的检测方法和临床研究,也得到了相似的结果[37-39]。由于氯喹在全血、血浆和血清中浓度存在较大的差异,Frisk-Holmberg等在健康意愿者中建立了全血(X)与血浆(Y)药物浓度之间的线性关系:y=0.09x+0.164(r=0.923)[39]。但不同个体间的血药浓度也同样存在较大差异,在接受氯喹250 mg/d治疗的风湿病患者中,其全血浓度跨度较大,处于36.6 µg/L~3895 µg/L(平均815±743 µg/L)[40],该研究人员建议对氯喹进行血药浓度监测,并采用全血浓度作为监测指标,以避免红细胞或者血小板释放氯喹的影响,并鼓励开展更多临床试验来论证剂量-效应关系和剂量-毒性关系。
3.3.2 氯喹连续给药的药时曲线连续给药模型主要来源于抗疟3日方案和风湿病的长期用药。Olafuyi等[41]总结了以往不同研究中,氯喹抗疟短期疗程的药时曲线,在3 d总剂量1500 mg氯喹,血浆药物浓度大约维持在100 µg/L~600 µg/L(0.31~1.8 µmol/L),30 d后仍可维持在10 µg/L~30 µg/L(0.03~0.1 µmol/L)以上。而全血浓度前3 d约在500~1000 µg/L(1.56~3.13 µmol/L)(图 3、表 4)。
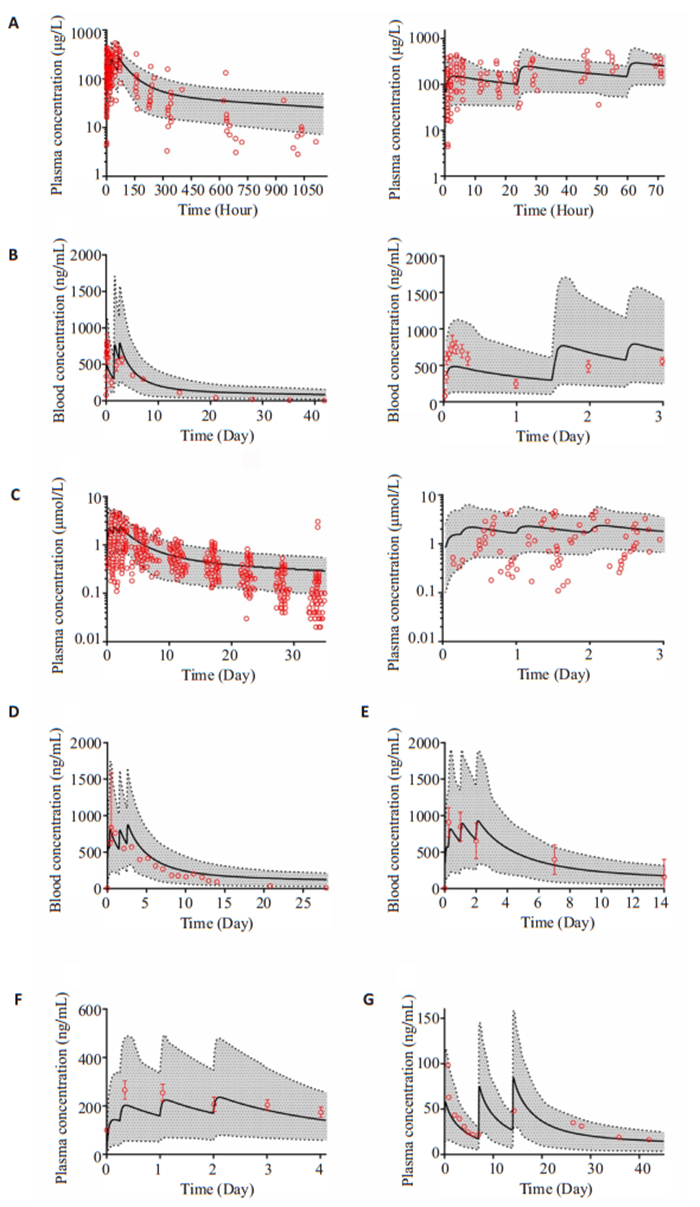
|
图 3 多剂量氯喹的血液或血浆浓度-时间曲线 Fig.3 Blood or plasma concentration-time curves for multiple doses of chloroquine. The solid line represents the average predicted concentration-time curve, and the dotted line represents the 5th and 95th percentile ranges. Red open circles represent clinical data observed in each study. The research overview of A-G is shown in Table 4[41] |
| 表 4 氯喹药代动力学验证中使用的单次和多次剂量研究摘要 Tab.4 Summary of single and multiple dose studies used in chloroquine pharmacokinetic validation[41] |
氯喹长期使用的药动学研究较少,MACKENZIE[4]总结了氯喹在风湿病治疗和疟疾预防长期使用中的药时曲线,250 mg/周的剂量,需7周才能达到血浆浓度稳态(约0.01 µmol/L),而在250 mg/d的风湿病治疗剂量中,需1个月达到稳态(约1 µmol/L),而500 mg/d血浆稳态浓度则超过了10 µmol/L,这已经超过了引起眼睛毒性浓度的阈值。有研究表明,氯喹250 mg/d所达到的稳态血浆浓度(0.8~2 µmol/L),为治疗风湿病的有效治疗范围。关于氯喹稳态血药浓度范围与疗效间的关系,目前研究相对较少,需要更多严格的临床试验来证明。
4 氯喹的安全性氯喹毒性主要与超剂量使用相关,而且治疗剂量与毒性剂量和致死剂量,十分接近。值得注意的是,新冠肺炎诊疗指南推荐的磷酸氯喹剂量是500 mg,2次/d。其中500 mg是磷酸氯喹片的标示含量,为氯喹和磷酸的总量,而其中氯喹基质含量是300 mg左右。250 mg规格片剂相当于氯喹基质约150 mg。因此,指南推荐的剂量相当于每天实际摄入氯喹是600 mg,我们讨论其剂量安全性,也主要是基于氯喹基质的含量。
根据已批准药品说明书内容,磷酸氯喹治不良反应相对较少,口服一般可能出现的反应有:头晕、头痛、眼花、食欲减退、恶心、呕吐、腹痛、腹泻、皮肤瘙痒等。反应大多较轻,停药后可自行消失。总体来说,50%的不良反应为轻度,36%~40%为中度,10%~14%为严重,而恶心是所有剂量方案中最常见的(10.8%~18.8%)[42]。当用药量大,疗程长时,组织内蓄积可导致不可逆的眼毒性和心脏毒性。一般认为,氯喹单次剂量(基质)超过20 mg/kg就会有毒性,而超过30 mg/kg就能致死[42-43]。
在纳入COVID-19治疗的10名患者中,5例患者共发生9种不良反应,包括呕吐、腹痛、恶心、腹泻、皮疹或发痒、咳嗽和气短,其中呕吐最常发生。没有严重不良反应的发生,也没有因不良反应而终止治疗的患者。其中3名患者在完成氯喹治疗后14 d后检测了血清药物浓度,为0.26~0.61 μmol/L,被认为对患者是相对安全的[6]。
4.1 氯喹的心脏毒性氯喹过量使用导致的心脏急性毒性,曾被当作自杀药物使用[44]。法国出版的“Suicide: mode d'emploi”(Suicide: a how-to guide)更是将其纳入自杀的常用手段之一[45]。1988年新英格兰医学杂志发表了Riou等[46]的回顾性研究,发现氯喹5 g剂量(单次剂量,而非累积剂量)是预测死亡结局的准确指标,在没有采取准确抢救措施的对照组中,11例摄入5 g以上氯喹中毒的患者中,有10例死亡。而通过给予机械通气、地西泮和肾上腺素抢救的11名患者中,只有1例死亡。他们的氯喹全血浓度为40~80 µmol/L。而此前研究报道,全血浓度高于25 µmol/L没有病例能存活。Frisk-Holmberg等[39]也得到了相似的结果,当氯喹血浆浓度超过800 µg/L(2.5 µmol/L),80%患者出现不良反应,当浓度小于400 µg/L(1.25 µmol/L)时则没有不良反应发生。Mégarbane等[47]通过一项前瞻性研究发现,氯喹中毒患者平均全血浓度为6700 µg/L(21 µmol/L),血浆浓度为1500 µg/L(4.7 µmol/L),在有无心脏停搏患者间存在显著差异。而即时或者连续测定全血浓度,比血浆浓度更能预测氯喹的心血管毒性。Looareesuwan等[48]研究了氯喹静脉给药的药动学分布与心脏毒性间的关系。12个健康成年男性接受3 mg/kg氯喹基质静脉注射10 min,血浆峰浓度为784~6649 µg/L(2.5~20.8 µmol/L),随着体内的快速分布,氯喹浓度也呈指数下降。没有观察到严重的毒性反应,但都出现了一些不良反应。平均血压从(110±9.5)mm Hg降到101±12.5 mm Hg,心率的上升与血浆氯喹浓度平行。QRS间期从(81±15)ms延长到(92±13)ms,但QTc间期没有改变。该研究认为,氯喹的心血管毒性与其静脉给药造成的早期分布相短暂的高血浆浓度有关,静脉给药速度是其毒性的关键因素。因此,氯喹引起的心脏毒性,与其短时高剂量摄入导致的高血药浓度密切相关。
4.2 氯喹的眼睛毒性有报道称,氯喹的眼毒性与累积剂量有关,当总的累积剂量超过50~100 g或者1 g/kg,眼毒性的风险显著增加[42]。但也有研究表明,每日剂量才是眼毒性风险更重要的决定因素,当日剂量为500 mg或超过4 mg/kg,眼毒性风险显著增加,而当日剂量为250 mg或低于3.5 mg/kg时,即使用药多年,都不会发生眼毒性,且可以耐受超过1000 g的累积剂量[49]。而MACKENZIE[4]研究认为,每天5.1 mg/kg为眼睛毒性的阈值,其安全的日剂量上限为3.5~4 mg/kg,为了防止过量使用,应该使用理想体质量计算氯喹剂量,这样就不会超过毒性剂量阈值,而目前《新型冠状病毒肺炎诊疗方案(试行第七版)》是以实际体质量50 kg作为剂量调整的阈值。
4.3 氯喹中毒的抢救急性的氯喹过量是能迅速致死,毒性表现常发生在服药后1~3 h,而死亡常发生在2~3 h内。其主要临床症状是神经系统、呼吸系统及心血管系统的毒性作用,死亡常由于与氯喹直接作用于心肌有关的心脏骤停。立即强化的对症性支持治疗,第一步必须维持充分的呼吸及纠正任何心血管系统的紊乱。口服活性炭并滞留在胃中可限制氯喹的进一步吸收。早期采用机械通气,静脉输入肾上腺素,剂量为每分钟250 ng/kg,并以每分钟250 ng/kg的增量直到恢复恰当的收缩压,并静脉输入地西泮,剂量为2 mg/kg,历时30 min作为负荷剂量,继之以每日1~2 mg/kg,达2~4 d。而增加氯喹排出的方法(如透析)可能很少有用[30, 46]。
5 总结氯喹作为抗疟药在临床已应用近80余年,目前仍然是抗击疟疾的首选药物。经过几十年的不断研究与开发,其临床应用也越来越广泛。COVID-19又将氯喹的抗病毒作用推向热潮,其500 mg(300 mg基质),2次/d的7 d疗程,也引起不少医药工作者对安全性的担忧。通过上文的资料总结,作者认为:该给药方案氯喹血浆浓度在绝大多数患者中必然达到体外试验的EC50(1.13 μmol/L),甚至超过EC90(6.90 μmol/L),而已有临床研究报道氯喹中毒的平均血浆浓度为4.7 µmol/L,且氯喹血药浓度在个体间又存在较为显著的差异。因此,在医疗条件允许时,我们建议在新冠肺炎的治疗中,应该监测氯喹的全血浓度,根据血药浓度调整磷酸氯喹的剂量,制定更加精准的个体化治疗方案,并密切做好心电监护,预防不良反应的发生。
| [1] |
国家卫生健康委员会, 国家中医药管理局. 新型冠状病毒肺炎诊疗方案(试行第六版)[J]. 中国病毒病杂志, 2020, 10(2): 88-92. |
| [2] |
广东省科技厅及广东省卫生健康委磷酸氯喹治疗新冠状病毒肺炎多中心协作组. 磷酸氯喹治疗新型冠状病毒肺炎的专家共识[J]. 中华结核和呼吸杂志, 2020. DOI:10.3760/cma.j.issn.1001-0939.2020.0019 |
| [3] |
Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro[J]. Cell Res, 2020, 30(3): 269-71. DOI:10.1038/s41422-020-0282-0 |
| [4] |
Mackenzie AH. Dose refinements in long-term therapy of rheumatoid arthritis with antimalarials[J]. Am J Med, 1983, 75(1A): 40-5. |
| [5] |
Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies[J]. Bio Sci Trends, 2020, 14(1): 72-3. DOI:10.5582/bst.2020.01047 |
| [6] |
Huang M, Tang T, Pang P, et al. Treating COVID-19 with Chloroquine[J]. J Mol Cell Biol, 2020 Apr 1, doi: 10.1093/jmcb/mjaa014.
|
| [7] |
Gupta N, Agrawal S, Ish P. Chloroquine in COVID-19: the evidence [J]. Monaldi Arch Chest Dis, 2020 Mar 31, 90(1). doi: 10.4081/monaldi.2020.1290.
|
| [8] |
Gbinigie K, Frie K. Should chloroquine and hydroxychloroquine be used to treat COVID-19? A rapid review[J]. BJGP Open, 2020 Apr 7. doi: 10.3399/bjgpopen20X101069.
|
| [9] |
Cortegiani A, Ingoglia G, Ippolito M, et al. A systematic review on the efficacy and safety of chloroquine for the treatment of COVID- 19[J]. J Crit Care, 2020. DOI:10.1016/j.jcrc.2020.03.005 |
| [10] |
郭瑞霞, 李力更, 付炎, 等. 天然药物化学史话:奎宁的发现、化学结构以及全合成[J]. 中草药, 2014, 45(19): 2737-41. |
| [11] |
Tang YQ, Ye Q, Huang H, et al. An Overview of Available Antimalarials: Discovery, Mode of Action and Drug Resistance[J]. Curr Mol Med, 2020. DOI:10.2174/1566524020666200207123253 |
| [12] |
梁晓竟, 谢贤桂. 氯喹抗疟研究概况[J]. 预防医学情报杂志, 2002, 18(3): 219. DOI:10.3969/j.issn.1006-4028.2002.03.012 |
| [13] |
中华人民共和国国家卫生与计划生育委员会.抗疟药使用规范: WS/ T485-2016[S].北京: 国家卫生和计划生育委员会. 2016.
|
| [14] |
Vincent M J, Bergeron E, Benjannet S, et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread[J]. J Virol, 2005, 2(69): 1-10. |
| [15] |
Madrid PB, Panchal RG, Warren TK, et al. Evaluation of Ebola Virus Inhibitors for Drug Repurposing[J]. ACS Infect Dis, 2015, 1(7): 317-26. DOI:10.1021/acsinfecdis.5b00030 |
| [16] |
Ooi EE, Chew JS, Loh JP, et al. In vitro inhibition of human influenza A virus replication by chloroquine[J]. J Virol, 2006, 3(39): 1-3. |
| [17] |
Al-Bari MAA. Chloroquine analogues in drug discovery: new directions of uses, mechanisms of actions and toxic manifestations from malaria to multifarious diseases[J]. J Antimicrob Chemoth, 2015, 70(6): 1608-21. DOI:10.1093/jac/dkv018 |
| [18] |
Murray SM, Down CM, Boulware DR, et al. Reduction of Immune Activation with Chloroquine Therapy during Chronic HIV Infection[J]. JVirol, 2010, 84(22): 12082-6. DOI:10.1128/JVI.01466-10 |
| [19] |
Routy J, Angel J B, Patel M, et al. Assessment of chloroquine as a modulator of immune activation to improve CD4 recovery in immune nonresponding HIV-infected patients receiving antiretroviral therapy[J]. HIV Med, 2015, 16(1): 48-56. DOI:10.1111/hiv.12171 |
| [20] |
Al-Bari M. Targeting endosomal acidification by chloroquine analogs as a promising strategy for the treatment of emerging viral diseases[J]. Pharmacol Res Perspect, 2017, 5(1): e293. |
| [21] |
Savarino A, Shytaj IL. Chloroquine and beyond: exploring antirheumatic drugs to reduce immune hyperactivation in HIV/AIDS[J]. Retrovirology, 2015, 12(51): 1-10. |
| [22] |
de Wilde AH, Jochmans D, Posthuma CC, et al. Screening of an FDA-Approved Compound Library Identifies Four Small-Molecule Inhibitors of Middle East Respiratory Syndrome Coronavirus Replication in Cell Culture[J]. Antimicrob Agents Chem, 2014, 58(8): 4875-84. DOI:10.1128/AAC.03011-14 |
| [23] |
Keyaerts E, Vijgen L, Maes P, et al. In vitro inhibition of severe acute respiratory syndrome coronavirus by chloroquine[J]. Biochem Biophys Res Commun, 2004, 323(1): 264-8. DOI:10.1016/j.bbrc.2004.08.085 |
| [24] |
Thomé R, Lopes SCP, Costa F TM, et al. Chloroquine: Modes of action of an undervalued drug[J]. Immunol Lett, 2013, 153(1-2): 50-7. DOI:10.1016/j.imlet.2013.07.004 |
| [25] |
Salata C, Calistri A, Parolin C, et al. Antiviral activity of cationic amphiphilic drugs[J]. Expert Rev Anti-infe, 2017, 15(5): 483-92. DOI:10.1080/14787210.2017.1305888 |
| [26] |
Schrezenmeier E, Dörner T. Mechanisms of action of hydroxychloroquine and chloroquine: implications for rheumatology[J]. Nat Rev Rheumatol, 2020, 16(3): 155-66. DOI:10.1038/s41584-020-0372-x |
| [27] |
Pei-Hui Wang, Yun Cheng. Increasing Host Cellular Receptor— Angiotensin-Converting Enzyme 2 (ACE2) Expression by Coronavirus may Facilitate 2019-nCoV Infection[J]. bioRxiv 2020 Feb 27. doi: 10.1101/2020.02.24.963348.
|
| [28] |
Li R, Qiao S, Zhang G. Analysis of angiotensin-converting enzyme 2 (ACE2) from different species sheds some light on cross-species receptor usage of a novel coronavirus 2019-nCoV[J]. J Infect, 2020 Feb 21. doi: 10.1016/j.jinf.2020.02.013.
|
| [29] |
Fantini J, Scala CD, Chahinian H, et al. Structural and molecular modeling studies reveal a new mechanism of action of chloroquine and hydroxychloroquine against SARS-CoV-2 infection[J]. Int J Antimicrob Agents, 2020 Apr 3. doi: 10.1016/j.ijantimicag
|
| [30] |
Sweetman Sean C. 希恩.C斯威曼.马丁代尔药物大典(原著第37版)[M]. 北京: 化学工业出版社, 2013.
|
| [31] |
Höglund R, Moussavi Y, Ruengweerayut R, et al. Population pharmacokinetics of a three-day chloroquine treatment in patients with Plasmodium vivax infection on the Thai-Myanmar border[J]. J Mal, 2016, 15(129): 1-9. |
| [32] |
Ducharme J, Farinotti R. Clinical pharmacokinetics and metabolism of chloroquine. Focus on recent advancements[[J]. Clin Pharmacokinet, 1996, 31(4): 257-74. DOI:10.2165/00003088-199631040-00003 |
| [33] |
Parson WB, Koeniger SL, Johnson RW, et al. Analysis of chloroquine and metabolites directly from whole-body animal tissue sections by liquid extraction surface analysis (LESA) and tandem mass spectrometry[J]. J Mass Spectrom, 2012, 47(11): 1420-8. DOI:10.1002/jms.3068 |
| [34] |
Augustijns P, Verbeke N. Stereos elective Pharmacokinetic Properties of Chloroquine and De-Ethyl-Chloroquine in Humans[J]. clin pharmacokinet, 1993, 24(3): 259-69. DOI:10.2165/00003088-199324030-00007 |
| [35] |
Mullié C, Jonet A, Desgrouas C, et al. Differences in anti-malarial activity of 4-aminoalcohol quinoline enantiomers and investigation of the presumed underlying mechanism of action[J]. Malaria J, 2012, 11(65): 1-7. |
| [36] |
Walker O, Salako LA, Alvan G, et al. The disposition of chloroquine in healthy Nigerians after single intravenous and oral doses[J]. Brit J Clin Pharmaco, 1987, 23(3): 295-301. DOI:10.1111/j.1365-2125.1987.tb03048.x |
| [37] |
Kaewkhao K, Chotivanich K, Winterberg M, et al. High sensitivity methods to quantify chloroquine and its metabolite in human blood samples using LC–MS/MS[J]. Bioanalysis, 2019, 11(5): 333-47. DOI:10.4155/bio-2018-0202 |
| [38] |
Mzayek F, Deng H, Mather FJ, et al. Randomized dose-ranging controlled trial of AQ-13, a candidate antimalarial, and chloroquine in healthy volunteers[J]. PLoS Clin Trials, 2007, 2(1): e6. DOI:10.1371/journal.pctr.0020006 |
| [39] |
Frisk-Holmberg M, Bergqvist Y, Termond E, et al. The single dose kinetics of chloroquine and its major metabolite desethylchloroquine in healthy subjects[J]. Eur J Clin Pharmacol, 1984, 26(4): 521-30. DOI:10.1007/BF00542151 |
| [40] |
Augustijns P, Geusens P, Verbeke N. Chloroquine levels in blood during chronic treatment of patients with rheumatoid arthritis[J]. Eur J Clin Pharmacol, 1992, 42(4): 429-33. |
| [41] |
Olafuyi O, Badhan R K S. Dose Optimization of Chloroquine by Pharmacokinetic Modeling During Pregnancy for the Treatment of Zika Virus Infection[J]. J Pharm Sci, 2019, 108(1): 661-73. DOI:10.1016/j.xphs.2018.10.056 |
| [42] |
Taylor WR, White NJ. Antimalarial drug toxicity: a review[J]. Drug Safety, 2004, 27(1): 25-61. |
| [43] |
Chattopadhyay R, Mahajan B, Kumar S. Assessment of safety of the major antimalarial drugs[J]. Expert Opin Drug Saf, 2007, 6(5): 505-21. DOI:10.1517/14740338.6.5.505 |
| [44] |
Kiel FW. Chloroquine Suicide[J]. JAMA, 1964, 190(4): 398-400. |
| [45] |
Clemessy JL, Angel G, Borron SW, et al. Therapeutic trial of diazepam versus placebo in acute chloroquine intoxications of moderate gravity[J]. Intensive Care Med, 1996, 22(12): 1400-5. DOI:10.1007/BF01709558 |
| [46] |
Riou B, Barriot P, Rimailho A, et al. Treatment of Severe Chloroquine Poisoning[J]. New Engl J Med, 1988, 319(0): 49-51. |
| [47] |
Mégarbane B, Bloch V, Hirt D, et al. Blood concentrations are better predictors of chioroquine poisoning severity than plasma concentrations: a prospective study with modeling of the concentration/effect relationships[J]. Clin Toxicol, 2010, 48(9): 904-15. DOI:10.3109/15563650.2010.518969 |
| [48] |
Looareesuwan S, White N J, Chanthavanich P, et al. Cardiovascular toxicity and distribution kinetics of intravenous chloroquine[J]. Br J Clin Pharmacol, 1986, 22(1): 31-6. DOI:10.1111/j.1365-2125.1986.tb02876.x |
| [49] |
Luzzi GA, Peto TEA. Adverse Effects of Antimalarials[J]. Drug Safety, 1993, 8(4): 295-311. DOI:10.2165/00002018-199308040-00004 |
 2020, Vol. 40
2020, Vol. 40

