2. 口腔疾病与生物医学重庆市重点实验室,重庆 401145;
3. 重庆市高校市级口腔生物医学工程重点实验室,重庆 401145
2. Chongqing Key Laboratory of Oral Diseases and Biomedicine Science, Chongqing 401145, China;
3. Chongqing Municipal Key Laboratory of Oral Biomedical Engineering of Higher Education, Chongqing 401145, China
糖尿病主要特征为机体高血糖,主要由胰岛素分泌不足或抵抗所致[1]。正常稳定的骨代谢源于骨质形成和骨质吸收的动态平衡,该过程主要由破骨细胞和成骨细胞发挥功能所介导[2],而血液中葡萄糖浓度的改变可影响骨代谢,若糖尿病患者的血糖控制不佳,可能伴随高钙尿症或骨质疏松[3-4]。国内外学者针对糖尿病性骨质疏松的研究大多模拟体内外高糖环境,且高糖对破骨细胞的作用尚存在一定争议[5-6]。相关研究较少考虑到糖尿病状态下,机体代谢产物的异常堆积可能对骨代谢产生的不良影响。晚期糖基化终末产物(AGEs)是蛋白质等大分子物质通过非酶促糖基化反应所生成的稳定共价加成物,对糖尿病等慢性疾病有致病意义[7]。糖尿病患者血糖控制不佳时,AGEs生成速率加快,可能直接或间接影响骨代谢平衡[8]。
近年来,AGEs对骨吸收过程的影响存在较大争议。一些研究表明,AGEs对破骨细胞的功能起到明显的促进作用,进而影响骨代谢[9-10]。而另有学者认为AGEs对破骨细胞的骨质吸收过程产生显著的抑制作用[11-13]。既往研究中,细胞培养及破骨细胞诱导的方法和条件基本一致,即按照实验分组向细胞培养基中加入不同浓度的诱导因子及AGEs,更换培养基至破骨细胞成熟,进行相关检测。但研究忽视了破骨细胞的分化是一个从细胞融合阶段到细胞成熟阶段的动态过程[14-15],研究结果可能不够全面。
目前国内外就AGEs对骨吸收过程的作用的研究尚无明确结论。因此,本实验就AGEs对RANKL诱导的破骨细胞分化的影响进行研究,探究AGEs对破骨细胞分化不同阶段的影响,以期为糖尿病性骨质疏松患者的预防和治疗提供新思路。
1 材料和方法 1.1 主要试剂小鼠巨噬细胞系Raw 264.7,AGEs(博奥森,中国),胎牛血清(Natocor,阿根廷),α-MEM普通糖/高糖培养基(Hyclone,美国);重组小鼠核因子κB受体活化因子配体(RANKL)(Novoprotein,中国),Trizol Regent(Invitrogen,美国),RT-PCR试剂盒(Promega,美国),CCK-8试剂盒(碧云天,中国),抗酒石酸酸性磷酸酶染色试剂盒(Sigma,美国),SDS-PAGE凝胶试剂盒、Beyo ECL Plus超敏ECL化学发光试剂盒(碧云天,中国),抗组织蛋白酶K(CTSK)抗体(Abcam,美国),抗核因子κB受体活化因子(RANK)抗体(Abcam,美国),抗GAPDH抗体(CST,美国)。
1.2 破骨细胞的诱导及实验分组本实验已经通过重庆医科大学附属口腔医院动物实验伦理审查。将Raw 264.7细胞以1×106/mL的浓度接种于10 cm培养皿中,在α-MEM培养基中加入10%胎牛血清、100 U/mL青霉素以及100 μg/mL链霉素。将培养皿置于37 ℃、5% CO2的细胞孵箱中培养。观察细胞贴壁24 h后,向培养基中加入终浓度为50 μg/L的RANKL,培养基每日更换。
本实验将细胞随机分成3组:对照组,即单纯诱导破骨细胞向分化:仅利用含终浓度为50 μg/L RANKL的α-MEM培养基诱导Raw264.7细胞;分化早期阶段干预组:在Raw264.7细胞进行破骨细胞向诱导的分化早期阶段的培养基中加入AGEs,分化晚期阶段更换为仅含终浓度为50 μg/L RANKL的α-MEM培养基;分化晚期阶段干预组:在Raw264.7细胞进行破骨细胞向诱导的分化早期阶段加入仅含终浓度为50 μg/L RANKL的α-MEM培养基,于分化晚期阶段加入AGEs。
1.3 抗酒石酸酸性磷酸酶(TRAP)染色根据抗TRAP染色试剂盒的操作流程,吸尽培养皿内原有培养基,用37 ℃ PBS洗涤3次,之后用4%多聚甲醛于室温下固定20 min,吸尽培养皿内的多聚甲醛,再次用37 ℃ PBS洗涤3次,随即加入根据说明书制备好的染色液进行染色,于37 ℃避光条件下染色1 h,去离子水洗涤3次。将培养皿自然风干后置于倒置光学显微镜下进行TRAP染色阳性细胞观察并计数。
1.4 CCK-8法检测AGEs对RAW 264.7活性的影响以5×103/孔的密度将Raw 264.7细胞接种于96孔板,在细胞贴壁24 h后,吸尽原培养基,并利用37 ℃ PBS洗涤3次,而后于各孔依次加入含牛血清白蛋白(BSA)浓度100 mg/L以及含AGEs浓度分别为0、100、200、400 mg/L的α-MEM培养基100 μL,各孔于加药后12、24、36、48、60、72 h分别行CCK-8检测,每组设置3个副孔。100 mg/L的BSA以及不同浓度的AGEs用α-MEM培养基进行配制。根据CCK-8试剂盒的操作流程,每孔加入10 μL CCK-8液体。而后将96孔板置于37 ℃孵箱中,进行避光孵育3 h,利用酶标仪测定450 nm处的吸光度A450 nm,绘制生长曲线图。
1.5 Real time PCR技术Raw264.7细胞以5×105/孔的密度接种于6孔板,破骨细胞向诱导完成后,提取细胞总RNA并合成cDNA。制备20 μL的PCR反应体系并进行聚合酶链式反应。该反应以GAPDH为内参,每组设置3个复孔,利用2-∆∆CT法计算各相关基因的表达水平。RANK、活化T细胞核因子c1、肿瘤坏死因子受体相关因子6(TRAF-6)、TRAP、CTSK、GAPDH基因序列参照GenBank数据库,引物设计利用Primer primer 5.0软件,引物由生工生物工程(上海)股份有限公司合成。
1.6 Western blot分析破骨细胞向诱导完成后,检测CTSK,RANK及GAPDH的蛋白表达。根据Western blot试剂盒操作流程,首先利用裂解缓冲液进行细胞裂解,并将裂解液收集于EP管中,离心后进行蛋白质浓度测定。将蛋白置于100 ℃高温下变性5 min后进行聚丙烯酰胺凝胶电泳,而后转移至硝酸纤维素膜上。使用抗CTSK抗体,抗RANK抗体和抗GAPDH抗体进行免疫印迹分析。利用增强型化学发光液进行蛋白条带的显影,最后分析条带灰度值。
1.7 统计学方法全部实验均重复3次,所有数据采用SPSS 19.0软件完成统计并分析,以均数±标准差的形式表示。两组间差异比较利用两独立样本t检验,P < 0.05认为差异有统计学意义。
| 表 1 Real time PCR引物序列表 Tab.1 Primers used for real-time PCR |
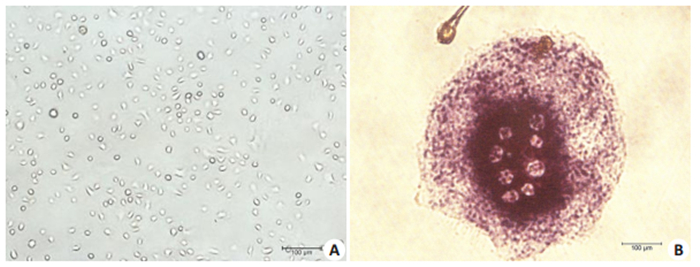
Raw264.7细胞胞体较小,呈圆形(图 1A),在培养的过程中增殖速度较快,当加入RANKL进行破骨细胞向诱导后,细胞逐渐分化并相互融合成为多核的巨细胞(图 2)。成熟的破骨细胞判断标准为:细胞胞体大;TRAP染色阳性,即TRAP染色后细胞胞浆被染成深红色;细胞核数目≥ 3(图 1B)。
|
图 1 Raw264.7细胞(A)与诱导成熟的破骨细胞的形态特征(B) Fig.1 Morphology of primary cultured Raw264.7 cells (A, original magnification: ×200) and mature osteoclasts after induction (B, ×800) |
|
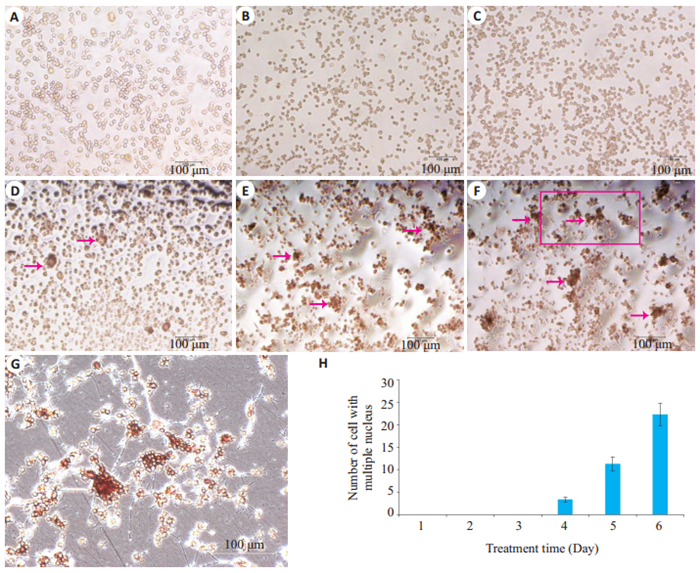
图 2 RANKL诱导Raw264.7破骨细胞 Fig.2 Osteoclastogenesis of Raw264.7 cells induced by RANKL. A-F: TRAP staining for osteoclastogenesis of Raw264.7 cells induced by RANKL from Day 1 to Day 6 (×200); G: TRAP staining for osteoclastogenesis of Raw264.7 after 6 days of induction by RANKL in high power field (the part of the red box in Figure F, ×400); H: The number of cells with multiple nuclei from Day1 to Day 6 (each view) |
通过TRAP染色观察,从开始进行破骨细胞向诱导至镜下尚未出现多核细胞(细胞核≥ 2个)的阶段为分化早期阶段(图 2A~C);从开始出现多核细胞之后定为分化晚期阶段(图 2D~F)。结果显示,破骨细胞向诱导的前3 d尚未出现多核细胞,3 d后开始出现多核细胞,即将RANKL诱导Raw264.7细胞破骨细胞向分化的前3 d划分为细胞分化早期阶段,之后为细胞分化晚期阶段。
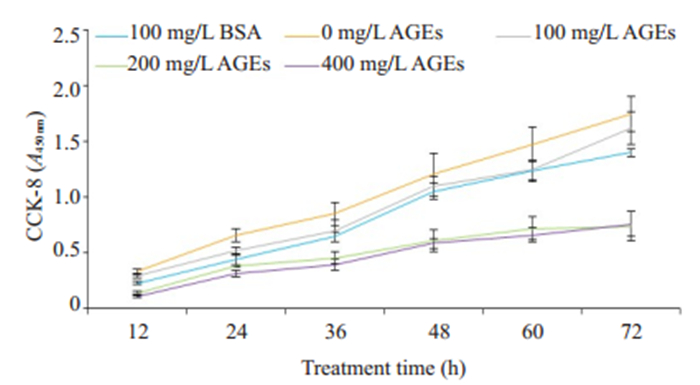
2.2 AGEs对Raw264.7细胞活性的影响CCK-8检测结果显示,100 mg/L的BSA以及浓度为100 mg/L的AGEs对Raw264.7细胞的生长无明显影响,而当AGEs的浓度≥ 100 mg/L时,Raw264.7细胞的增殖活力下降(图 3)。后续实验选取AGEs的浓度为100 mg/L。
|
图 3 不同浓度AGEs对Raw264.7细胞活性的影响 Fig.3 Viability of Raw264.7 cells treated with different concentrations of AGEs |
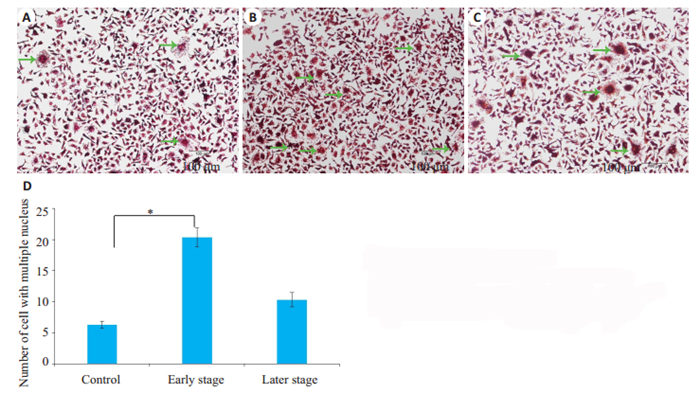
Raw264.7细胞进行破骨细胞向诱导6 d后,分别对3组细胞进行TRAP染色,自然风干后置于倒置相差显微镜下观察。各组细胞随机取3个视野进行观察,根据前文所述成熟破骨细胞的标准,结果显示分化早期阶段干预组(图 4B)、分化晚期阶段干预组(图 4C)细胞的成熟破骨细胞数均多于对照组(图 4A),分化早期阶段干预组与对照组差异具有统计学意义(图 4D,P < 0.05)。
|
图 4 TRAP染色结果 Fig.4 TRAP staining results. A-C: The results of TRAP staining (A-C, ×200); D: The number of mature osteoclasts (each view, *P < 0.05) |
RANKL与RANK结合后,Raw264.7细胞募集TRAF-6,激活多条信号通路,使得NFATC-1等多种转录因子入核,进而TRAP,CTSK等破骨细胞相关基因和特异性标记物表达。在破骨向诱导6 d后,分别对3组细胞进行Real time PCR检测,结果显示(图 5),分化早期阶段干预组及分化晚期阶段干预组的NFATC-1、TRAF-6、RANK、TRAP、CTSK的mRNA表达均较对照组高,分化早期阶段干预组与对照组差异具有统计学意义(P < 0.05)。
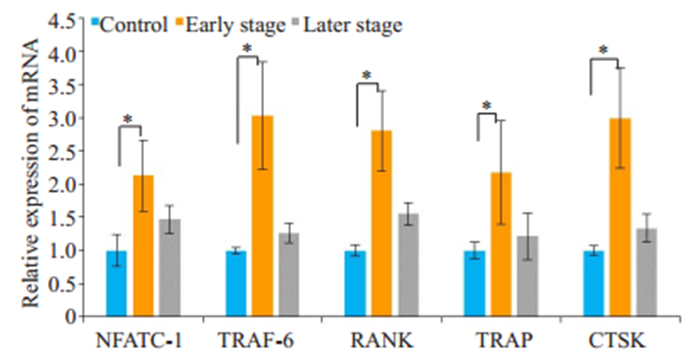
|
图 5 Real-time PCR检测NFATC-1、TRAF-6、RANK、CTSK、TRAP的mRNA表达 Fig.5 Gene expression levels of NFATC- 1, TRAF- 6, RANK, CTSK and TRAP detected by RT-PCR (*P < 0.05) |
结果显示,分化早期阶段干预组及分化晚期阶段干预组的CTSK及RANK蛋白表达水平均高于对照组,分化早期阶段干预组与对照组差异具有统计学意义(P < 0.05,图 6),其结果与相关mRNA表达变化趋势一致。
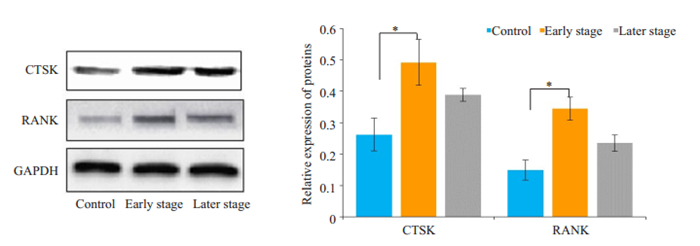
|
图 6 Western blot检测CTSK及RANK的蛋白表达 Fig.6 Protein expression of CTSK and RANK detected by Western blot (*P < 0.05) |
糖代谢紊乱可能影响成骨细胞和破骨细胞的活性和功能,引起骨形成和骨吸收的失衡,导致糖尿病性骨质疏松等骨代谢疾病[16-17]。长期的糖尿病高血糖状态可能导致AGEs在体内蓄积,从而引发骨代谢失衡及一系列生理病理改变[18-20]。本实验通过TRAP染色观察RANKL诱导的Raw264.7细胞破骨细胞向分化的过程,研究结果显示,破骨细胞向诱导的前3 d尚未出现多核细胞,3 d后开始出现多核细胞。本实验将RANKL诱导Raw264.7细胞破骨细胞向分化的前3 d划分为细胞分化早期阶段,之后为细胞分化晚期阶段。有研究表明,以Raw264.7细胞作为前体细胞进行破骨细胞向诱导3 d后,其生理功能发生较大变化[21],本实验结果与该研究结论相符。本实验就AGEs对RANKL诱导的破骨细胞分化和活性的影响进行探究,对照组细胞单纯破骨细胞向诱导;分化早期阶段干预组在破骨细胞向诱导的分化早期阶段加入AGEs;分化晚期阶段干预组在破骨细胞向诱导的分化晚期阶段加入AGEs。分别诱导完成后,通过TRAP染色、Real-time PCR、Western blot,结果提示在破骨细胞分化早期阶段及在分化晚期阶段加入AGEs均会促进破骨细胞的分化,仅在分化早期阶段加入具有统计学差异(P < 0.05)。
本实验与Miyata等[9]早期进行的相关研究结果均支持AGEs对骨吸收活动起到明显的促进作用,但该研究认为AGEs会增加破骨细胞的骨吸收效能但不会增加破骨细胞的数量,而本实验通过TRAP染色和细胞计数,认为AGEs干预会增加实验组的破骨细胞数量。国内外就AGEs在骨吸收方面的研究尚存在较大争议,有研究认为AGEs可能改变骨基质蛋白的结构完整性并且抑制破骨细胞分化过程,进而对骨吸收的功能产生抑制作用[11-13]。既往体外研究中,破骨细胞诱导方法及AGEs干预方式相似,即按照实验分组向细胞培养基中加入相关诱导因子及AGEs,更换培养基至破骨细胞成熟,进行相关指标的检测。而破骨细胞源自造血干细胞,在体内的分化受RANKL和巨噬细胞集落刺激因子等多种因子的调控[15]。巨噬细胞作为一种破骨前体细胞[22],从开始破骨细胞向分化至分化成熟是一个动态且复杂的过程,包括RANKL与破骨前体细胞表面受体RANK结合,细胞募集TRAF-6,激活下游核因子NF-κB等多条信号通路,使得NFATC-1等多种转录因子入核,进而TRAP,CTSK等破骨细胞相关基因和特异性标记物表达等多个过程[14, 23]。由此可知,仅于破骨细胞向诱导初始阶段进行AGEs干预,而未充分考虑破骨细胞分化的动态过程,研究结果可能是片面的。本实验充分考虑破骨细胞的分化的动态过程,提出AGEs在破骨细胞分化的不同阶段可能对其产生不同影响。
AGEs在体内蓄积可能导致炎性因子表达增加,例如IL-1,TNF-α,进而通过直接或间接的途径刺激破骨细胞的分化和成熟,提高骨吸收活性[24-25]。AGEs与其受体RAGE结合后,会激活NF-κB通路的表达,且该通路的激活会形成正反馈,进一步刺激AGEs与RAGE结合[26-27]。NF-κB通路是破骨细胞分化成熟的主要通路之一,本课题组猜想,AGEs是否通过激活NF-κB通路而影响破骨细胞的表达,相关后续试验将对本研究所涉及的相关机制进行深入探究。
本结果提示,AGEs在破骨细胞分化的不同阶段可能对其产生不同影响。在破骨细胞分化早期阶段加入AGEs对破骨细胞分化的促进作用比在细胞分化晚期阶段加入更明显。本结果为糖尿病性骨质疏松患者的治疗提供了新的思路。
| [1] |
Polidori D, Iijima H, Goda M, et al. Intra-and inter-subject variability for increases in serum ketone bodies in patients with type 2 diabetes treated with the Sodium glucose co-transporter 2 inhibitor canagliflozin[J]. Diabetes Obes Metab, 2018, 20(5): 1321-6. DOI:10.1111/dom.13224 |
| [2] |
Walsh NC, Crotti TN, Goldring SR, et al. Rheumatic diseases: the effects of inflammation on bone[J]. Immunol Rev, 2005, 208(1): 228-51. |
| [3] |
Xu H, Wang Z, Li X, et al. Osteoporosis and osteopenia among patients with type 2 diabetes aged ≥ 50: role of sex and clinical characteristics[J]. J Clin Densitom, 2019, 22(6): 905-16. |
| [4] |
Qi S, He J, Zheng H, et al. Icariin prevents diabetes-induced bone loss in rats by reducing blood glucose and suppressing bone turnover[J]. Molecules, 2019, 24(10): 1215-23. |
| [5] |
Williams JP, Blair HC, Mcdonald JM, et al. Regulation of osteoclastic bone resorption by glucose[J]. Biochem Biophys Res Commun, 1997, 235(3): 646-51. DOI:10.1006/bbrc.1997.6795 |
| [6] |
Xu J, Yue F, Wang J, et al. High glucose inhibits receptor activator of nuclear factor-κB ligand-induced osteoclast differentiation via downregulation of v-ATPase V0 subunit d2 and dendritic cell-specific transmembrane protein[J]. Mol Med Rep, 2015, 11(2): 865-70. |
| [7] |
Maruf MH, Suzuki A, Hayashi K, et al. Increased advanced glycation end products in hypertrophied ligamentum flavum of diabetes mellitus patients[J]. Spine J, 2019, 19(10): 1739-45. DOI:10.1016/j.spinee.2019.06.001 |
| [8] |
Yamagishi S, Matsui T. Role of hyperglycemia-induced advanced glycation end product(AGE) accumulation in atherosclerosis[J]. Ann Vasc Dis, 2018, 11(3): 253-8. DOI:10.3400/avd.ra.18-00070 |
| [9] |
Miyata T, Notoya K, Yoshida K, et al. Advanced glycation end products enhance osteoclast-induced bone resorption in cultured mouse unfractionated bone cells and in rats implanted subcutaneously with devitalized bone particles[J]. J Am Soc Nephrol, 1997, 8(2): 260-11. |
| [10] |
蔡德鸿, 陈宏, 张桦, 等. 糖基化终末产物对破骨细胞骨吸收功能的影响[J]. 中华内分泌代谢杂志, 2003, 19(1): 61-3. |
| [11] |
Valcourt U, Merle B, Stan E, et al. Non-enzymatic glycation of bone collagen modifies osteoclastic activity and differentiation[J]. J Biol Chem, 2007, 282(8): 5691-703. DOI:10.1074/jbc.M610536200 |
| [12] |
李子卿, 王海兴, 何沛恒, 等. 晚期糖基化终末产物可影响破骨细胞的骨吸收功能[J]. 中国组织工程研究, 2016, 20(20): 2907-14. DOI:10.3969/j.issn.2095-4344.2016.20.003 |
| [13] |
王海兴, 李子卿, 肖胤勃, 等. 晚期糖基化终末产物可通过调节VATPase a3与ClC-7影响破骨细胞的泌酸功能[J]. 中国组织工程研究, 2017, 21(12): 1826-32. DOI:10.3969/j.issn.2095-4344.2017.12.004 |
| [14] |
Väänänen K. Mechanism of osteoclast mediated bone resorption-- rationale for the design of new therapeutics[J]. Adv Drug Deliv Rev, 2005, 57(7): 959-71. DOI:10.1016/j.addr.2004.12.018 |
| [15] |
Boyle WJ, Simonet WS, Lacey DL. Osteoclast differentiation and activation[J]. Nature, 2003, 423(6937): 337-42. DOI:10.1038/nature01658 |
| [16] |
Liu JM, Zhu DL, Mu YM, et al. Management of fracture risk in patients with diabetes-Chinese expert consensus[J]. J Diabetes, 2019, 11(11): 837-920. DOI:10.1111/1753-0407.12811 |
| [17] |
Xiu S, Chhetri JK, Sun L, et al. Association of serum prealbumin with risk of osteoporosis in older adults with type 2 diabetes mellitus: a cross-sectional study[J]. Ther Adv Chronic Dis, 2019, 10(7): 1023-33. |
| [18] |
Sakamoto E, Kido J, Takagi R, et al. Advanced glycation endproduct 2 and Porphyromonas gingivalis lipopolysaccharide increase sclerostin expression in mouse osteocyte-like cells[J]. Bone, 2019, 122(1): 22-30. |
| [19] |
Lamb LS, Alfonso H, Norman PE, et al. Advanced glycation end products and esRAGE are associated with bone turnover and incidence of hip fracture in older men[J]. J Clin Endocrinol Metab, 2018, 103(11): 4224-31. DOI:10.1210/jc.2018-00674 |
| [20] |
Aikawa E, Fujita R, Asai M, et al. Receptor for advanced glycation end products-mediated signaling impairs the maintenance of bone marrow mesenchymal stromal cells in diabetic model mice[J]. Stem Cells Dev, 2016, 25(22): 1721-32. DOI:10.1089/scd.2016.0067 |
| [21] |
Li Z, Li C, Zhou Y, et al. Advanced glycation end products biphasically modulate bone resorption in osteoclast-like cells[J]. Am J Physiol Endocrinol Metab, 2016, 310(5): E355-66. DOI:10.1152/ajpendo.00309.2015 |
| [22] |
Zhang Y, Yan M, Yu QF, et al. Puerarin prevents LPS-Induced osteoclast formation and bone loss via inhibition of Akt activation[J]. Biol Pharm Bull, 2016, 39(12): 2028-35. DOI:10.1248/bpb.b16-00522 |
| [23] |
Mellis DJ, Itzstein C, Helfrich MH, et al. The skeleton: a multifunctional complex organ: the role of key signalling pathways in osteoclast differentiation and in bone resorption[J]. J Endocrinol, 2011, 211(2): 131-43. |
| [24] |
王美霞, 刘雪平, 徐松, 等. 糖基化终产物对小胶质细胞分泌IL-1β和TNF-α的影响[J]. 山东大学学报:医学版, 2011, 55(2): 34-8. |
| [25] |
Yan SD, Chen X, Fu J, et al. RAGE and amyloid-beta peptide neurotoxicity in Alzheimer's disease[J]. Nature, 1996, 382(6593): 685-91. DOI:10.1038/382685a0 |
| [26] |
Alves M, Da CH, Calegari VC, et al. Nuclear factor-kappaB and advanced glycation end-products expression in lacrimal glands of aging rats[J]. J Endocrinol, 2005, 187(1): 159-66. |
| [27] |
胡剑, 俞敏, 唐云, 等. 糖皮质激素对高氧诱导新生大鼠肺组织RAGE-NF-κB通路的影响[J]. 中国当代儿科杂志, 2015, 14(1): 81-5. |
 2020, Vol. 40
2020, Vol. 40

