原发性肝细胞癌(HCC)是世界上最常见的恶性肿瘤之一,每年约有70万新患者被确诊[1]。我国是乙肝大国,同时也是肝细胞癌发生大国,肝细胞癌严重危害我国人民的身体健康,也给社会及人们带来巨大的损失[2]。而当前,作为肝细胞癌最主要治疗方式,手术切除仍是众多肝癌早期及部分中晚期患者的首选[3-4]。但是,肝癌切除术后缺少较为可靠的预后指标,很难在切除术后做出科学、合理的判断,从而进行针对性的辅助治疗[5]。
m6A甲基化广泛存在于RNA中,参与细胞多种生命活动,在肿瘤的发生、发展中也被报道发挥着重要的作用[6-8]。m6A甲基化过程中存在3种甲基化酶:METTL3、METTL14及WTAP,2种去甲基化酶:FTO与ALKBH5[9]。m6A水平在不同肿瘤或不同细胞系中显著不同,在肝脏、肾脏及脑组织中较高存在[10]。
METTL14是一种十分重要的m6A甲基化酶,在RNA的m6A甲基化过程中扮演到关键的角色,同时也被发现可能在多种肿瘤的发生或发展过程中起到作用[11]。Wang等报道,敲低METTL3和METTL14可导致m6A水平的降低,进而抑制小鼠胚胎干细胞的自我更新[12]。研究报道,METTL14通过调节依赖m6A甲基化的MicroRNA进程,抑制肝细胞癌的潜在转移能力[13]。Lin等[14]发现了METTL14在肺癌组织中表达降低,而其在肺癌中的功能未研究清楚。METTL14与肝癌患者术后生存预后的关系,以及其是否可作为肝癌患者生存的独立预后危险因素,目前报道较少[12-14],这对于METTL14在肝癌研究中的临床转化至关重要。本研究致力于解决以上问题,通过在大量肝癌临床样本中研究其对临床预后的指导意义,为肝癌临床预后寻找有效的生存标志物。
本研究拟采用组织化学有染色的方法,检测METTL14在147例HCC及癌旁组织中的表达水平,通过卡方检验分析其表达量与临床病理指标的相关性,并应用与Kaplan-Meier分析METTL14表达水平与肝癌患者术后预后的关系,利用COX回归模型判断其是否可作为总生存期及无瘤生存期的一个独立预后因素。
1 资料和方法 1.1 研究对象选取2007年1月~2011年1月在某院肝胆外科行根治性肝癌切除术的HCC患者147例,纳入标准:临床资料完整;术前均无其他治疗,如TACE、免疫治疗等;术后病理学诊断为原发性肝细胞癌;蜡块包埋组织保存完整;术后随访5年的生存资料。
1.2 术后随访所有患者术后定期通过电话随访以及门诊复诊的形式进行随访。随访内容包括:术后健康情况(疾病进展、复发及死亡)、血清及影像学检查变化情况。总生存期(OS)被定义为手术日期与死亡日期之间的间隔。无瘤生存期(DFS)被定义为手术日期与复发之间的间隔无病生存率。如果复发未被诊断,在最后一次随访之日对病例进行删除。
1.3 免疫组织化学染色石蜡切片由4 ℃冰箱中取出,先放置于室温2 h复温,再将其放入60 ℃烤箱中烘烤1 h。二甲苯中脱蜡3次(10 min/次),依次放入100%、95%、85%、75%乙醇和ddH2O中,5~10 min/次。然后,放入3%的甲醇过氧化氢液中,室温静置20 min。取出后ddH2O清洗3次,高压修复,冷却至室温。再次取出后用ddH2O清洗2次,PBS清洗1次5 min,覆盖50 μL封闭液(1%BSA),37 ℃封闭30 min后,去除封闭液,覆盖一抗4 ℃过夜。第2天取出后,室温复温15 min,PBS清洗4次(5 min/次),加对应二抗,37 ℃孵箱孵育30 min,再用PBS清洗4次(5 min/次),滴加现配的DAB显色液,ddH2O清洗2次,苏木素染液10 min,盐酸乙醇中分化1~2 s,水流中反蓝20~30 min。再依次放入双蒸水(5 min)、75%(5 min)、85%(5 min)、95%(10 min),100%(10 min)、100%乙醇(10 min)、石碳酸(5 min)、二甲苯(15 min),取出切片晾干后,用中性树脂封片[15]。
1.4 免疫组化分析方法将所有封片的组织芯片烤干,然后采用Image Scope(Aperio)软件对整张组织组化芯片进行扫描,扫描后由病理学家进行打分,评分标准如下:评分为“0-0.5分”(阳性率≤20%),“1~1.5分”(20% < 阳性率≤50%),“2~2.5分”(50% < 阳性率≤80%)“,3~3.5分”(80% < 阳性率≤100%)。染色评分 < 2分的切片定义为低表达,其他切片定义为高表达[16]。
1.5 统计学方法本研究结果数据采用SPSS 20.0统计软件进行分析。所有配对的四格表资料采用卡方检验分析,临床预后信息OS与DFS用Kaplan-Meier法分析并绘制生存曲线,同时采用了Log-Rank检验进行比较分析,利用COX回归模型对单因素及多因素进行分析,P < 0.05为差异具有统计学意义[17-18]。
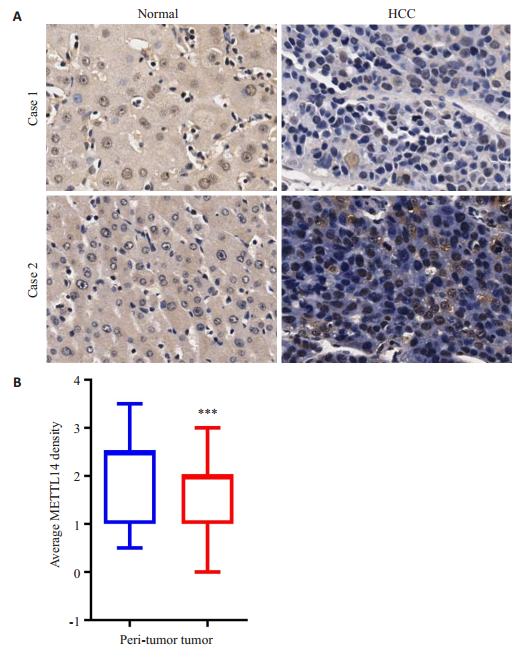
2 结果 2.1 METTL14在肝癌组织中的表达水平免疫组织化学染色发现,HCC癌组织中METTL14的表达低于癌旁组织的患者约占62%(图 1)。以METTL14在147例HCC组织中的相对表达量,将所有患者分为两组,即低表达组(n=67)、高表达组(n=80)两组,并将患者的基本临床病理学参数构建四格表,做卡方分析得出HCC组织中METTL14表达与HCC患者肿瘤大小(P=0.044)及TNM分期(P=0.046)显著相关,与性别、年龄、AFP等其他因素不相关(表 1)。
|
图 1 HCC患者癌组织和癌旁组织中METTL14的表达 Fig.1 Expression of METTL14 in cancer and adjacent tissues of HCC patients (A, original magnification: ×40) and statistical analysis (B). ***P < 0.01 vs control group. |
| 表 1 147例肝癌病人的基本病理学信息 Tab.1 Clinicopathological features of 147 HCC specimens in cohort 1 |
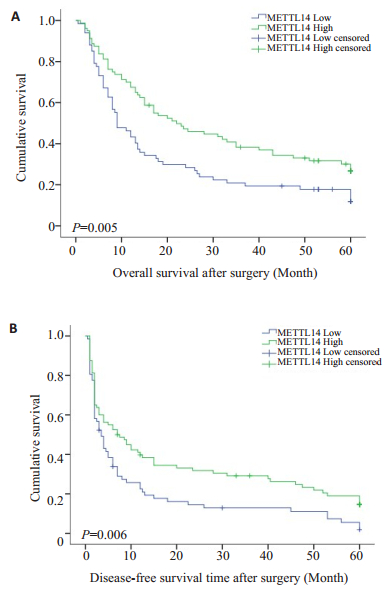
通过Kaplan-Meier生存分析,我们发现HCC组织中METTL14的低表达与患者的不良预后显著相关,其术后总生存期及无瘤生存期明显缩短(P < 0.05,图 2)。
|
图 2 HCC患者癌组织METTL14的表达与患者预后的关系 Fig.2 Relationship between the expression of METTL14 and the prognosis of HCC patients. A: Overall survival time; B: Disease free survival time. |
我们对临床病理参数与患者术后总生存或无瘤生存时间的关系,进行COX单因素回归分析,将单因素分析中有统计学意义的指标纳入COX多因素回归分析。
术后总生存期分析结果显示:单因素分析发现,微卫星灶(P=0.003)、微血管侵犯(P=0.002)、PVTT(P=0.000)、肿瘤大小(P=0.045)、BCLC(P=0.000)、TNM(P=0.000)及METTL14表达水平(P=0.001)等与患者总生存时间长短显著相关(表 2);多因素分析发现,微卫星灶(P=0.018)、PVTT(P=0.000)及METTL14表达水平(P=0.003)为患者总生存期的独立预后因素(表 2)。
| 表 2 队列1中肝癌病人总生存期的单因素与多因素分析 Tab.2 Univariate and multivariate analysis of overall survival of patients in Cohort 1 |
术后无瘤生存期分析结果显示:单因素分析发现,微卫星灶(P=0.002)、微血管侵犯(P=0.001)、PVTT(P= 0.000)、肿瘤大小(P=0.000)、BCLC(P=0.000)、TNM(P= 0.000)及METTL14表达水平(P=0.006)等与患者无瘤生存时间长短显著相关(表 3);多因素分析发现,微卫星灶(P=0.027)、肿瘤大小(P=0.013)、BCLC(P=0.003)及METTL14表达水平(P=0.003)为患者无瘤生存期的独立预后因素(表 3)。
| 表 3 队列1中肝癌病人无瘤生存期的单因素与多因素分析 Tab.3 Univariate and multivariate analysis of disease-free survival of patients in Cohort 1 |
近些年来,国内外多项研究发现RNA的m6A甲基化在肿瘤的发生、发展、转移及复发的过程中,起到比较重要的作用[19-20]。作为m6A甲基化其中主要甲基化酶之一,METTL14也逐渐被发现其在多种肿瘤中表达异常,且参与多种肿瘤的恶性表型调控[21-22]。Weng等发现METTL14通过mRNA m6A修饰抑制造血干/祖细胞分化,促进白血病发生[23]。Ma等提出了METTL14与HCC的转移相关,且与预后相关,但并未作出很好的总生存期及无瘤生存期的单因素与多因素分析[13]。
在本次研究中,我们首先检测了METTL14在HCC与癌旁组织中的免疫组化表达水平,发现METTL14在HCC组织中表达显著降低(图 1);同时通过卡方分析,发现METTL14的相对表达水平与患者肿瘤大小及TNM分期等显著相关(表 1);采用Kaplan-Meier生存分析,发现HCC组织中METTL14的低表达与患者的不良预后显著相关,其术后总生存期及无瘤生存期明显缩短(图 2),而且COX回归分析显示,HCC组织中METTL14的表达量是是影响HCC患者术后总生存期及无瘤生存期的一个独立预后因素(表 2、3)。
我们的研究通过对大样本肝癌组织与癌旁组织进行分析,首次发现METTL14在大多数肝癌中低表达(62%),并且首次提出肝癌组织中METTL14的蛋白低表达,即免疫组织化学染色水平,确实能作为肝癌患者总生存期与无瘤生存期的一个独立预后危险因素,之前研究并未有报道[13]。这些研究结果显示,肝癌患者METTL14的表达能对肝癌患者肝癌切除术后的预后做出一个很好的评价,并且其低表达预示着患者的预后可能较差,是一个很好的肝癌预后判定靶标。
这些结果都提示我们,METTL14可能在肝癌的进展中起到重要作用,且与之前报道的METTL14抑制肝癌转移能力的结果相一致[12]。而与上文所说的METTL14在通过mRNA m6A修饰促进白血病发生这个过程中的机制可能会不同[23]。也有研究报道,METL3-METL14甲基转移酶复合物调节成人造血干细胞的沉默状态[24]。另有学者发现,敲除HeLa细胞中的METTL3和METTL14能显著抑制细胞的活性[25]。同时也有学者发现m6A去甲基化酶FTO在急性髓性白血病中起到了促癌作用[26],m6A去甲基化酶ALKBH5维持恶性神经胶质瘤的恶性表型[27]。还有其他许多研究证明了m6A甲基化修饰在肿瘤的发生、进展及转移中起到非常重要的作用[28-29]。这些研究无疑表明RNA的m6A修饰在不同组织、细胞中起到不同的、复杂的功能,为肿瘤的预防及治疗提供新的理论支持。
在我们的研究中,与癌旁组织相比,METTL14在肝癌中较为显著地表达降低,这符合前人在肝癌中m6A的研究,尤其是肝癌中的m6A水平较癌旁有所降低[13]。而至于METTL14的表达与肝癌预后相关的机制,已有研究者报道METTL14在肝癌中的分子生物学功能,且其具有一定的抑制肝癌转移的能力。经过后期研究,发现METTL14可能通过增加m6A的水平,进而增强部分具有抑癌作用相关基因的表达与稳定性,具体涉及机制可能是通过IGF2BPs这个家族来识别m6A信息,进而传递增强相应mRNA稳定性的信息[30]。
综上所述,患者HCC组织中METTL14的低表达,预示着其HCC切除术后不良的总生存期与无瘤生存期,作为HCC的总生存期及无瘤生存期的一个独立预后因素,可能为临床治疗提供了新的指导与依据,并且可能作为一个新的术后预后指标。METTL14可能在HCC的发生、发展中也发挥着重要作用,其在HCC中的调控机制仍需更加深入地研究。
| [1] |
Forner A, Reig M, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2018, 391: 1301-14. DOI:10.1016/S0140-6736(18)30010-2 |
| [2] |
Li ZL, Yan WT, Zhang J, et al. Identification of Actual 10-Year Survival After Hepatectomy of HBV-Related Hepatocellular Carcinoma: a Multicenter Study[J]. J Gastrointest Surg, 2019, 23(2): 288-96. |
| [3] |
Ji F, Liang Y, Fu S, et al. Prognostic value of combined preoperative prognostic nutritional index and body mass index in HCC after hepatectomy[J]. HPB, 2017, 19(8): 695-705. DOI:10.1016/j.hpb.2017.04.008 |
| [4] |
Lim C, Shinkawa H, Hasegawa K, et al. Salvage liver transplantation or repeat hepatectomy for recurrent hepatocellular carcinoma: an intent-to-treat analysis[J]. Liver Transpl, 2017, 23(12): 1553-63. DOI:10.1002/lt.24952 |
| [5] |
Long J, Zhang L, Wan X, et al. A four-gene-based prognostic model predicts overall survival in patients with hepatocellular carcinoma[J]. J Cell Mol Med, 2018, 22(12): 5928-38. DOI:10.1111/jcmm.13863 |
| [6] |
Chen MN, Wei L, Law CT, et al. RNA N6-methyladenosine methyltransferase-like 3 promotes liver cancer progression through YTHDF2-dependent posttranscriptional silencing of SOCS2[J]. Hepatology, 2018, 67(6): 2254-70. |
| [7] |
Liu JQ, Ren DL, Du ZH, et al. m6A demethylase FTO facilitates tumor progression in lung squamous cell carcinoma by regulating MZF1 expression[J]. Biochem Biophys Res Commun, 2018, 502(4): 456-64. DOI:10.1016/j.bbrc.2018.05.175 |
| [8] |
Liang D, Wang H, Song W, et al. The decreased N6-methyladenine DNA modification in cancer cells[J]. Biochem Biophys Res Commun, 2016, 480(1): 120-5. DOI:10.1016/j.bbrc.2016.09.136 |
| [9] |
Deng XL, Su R, Weng HY, et al. RNA N6-methyladenosine modification in cancers: current status and perspectives[J]. Cell Res, 2018, 28(5): 507-17. DOI:10.1038/s41422-018-0034-6 |
| [10] |
Meyer KD, Saletore Y, Zumbo P, et al. Comprehensive analysis of mRNA methylation reveals enrichment in 3' UTRs and near stop codons[J]. Cell, 2012, 149(7): 1635-46. |
| [11] |
Deng XL, Su R, Weng HY, et al. RNA N6-methyladenosine modification in cancers: current status and perspectives[J]. Cell Res, 2018, 28(5): 507-17. |
| [12] |
Wang Y, Li Y, Toth JI, et al. N6-methyladenosine modification destabilizes developmental regulators in embryonic stem cells[J]. Nat Cell Biol, 2014, 16(2): 191-8. DOI:10.1038/ncb2902 |
| [13] |
Ma JZ, Yang F, Zhou CC, et al. METTL14 suppresses the metastatic potential of hepatocellular carcinoma by modulating N6-methyladenosinedependent primary MicroRNA processing[J]. Hepatology, 2017, 65(2): 529-43. DOI:10.1002/hep.28885 |
| [14] |
Lin SB, Choe J, Du P, et al. The m(6)A methyltransferase METTL3 promotes translation in human cancer cells[J]. Mol Cell, 2016, 62(3): 335-45. DOI:10.1016/j.molcel.2016.03.021 |
| [15] |
Adam J, Stang N L, Rouquette I, et al. Multicenter french harmonization study for PD-L1 IHC testing in non-small cell lung cancer[J]. Ann Oncol, 2018, 29(4): 953-8. DOI:10.1093/annonc/mdy014 |
| [16] |
Xiang DM, Sun W, Ning BF, et al. The HLF/IL-6/STAT3 feedforward circuit drives hepatic stellate cell activation to promote liver fibrosis[J]. Gut, 2018, 67(9): 1704-15. DOI:10.1136/gutjnl-2016-313392 |
| [17] |
Li Z, Wang Y. miR-96 targets SOX6 and promotes proliferation, migration, and invasion of hepatocellular carcinoma[J]. Biochem Cell Biol, 2018, 96(3): 365. |
| [18] |
Qu MX, Velker V, Leung E, et al. PV-0548: The role of adjuvant therapy in stage IA serous and clear cell uterine cancer: a pooled analysis[J]. Gynecol Oncol, 2018, 123: S292. |
| [19] |
Pan Y, Ma P, Liu Y, et al. Multiple functions of m6A RNA methylation in cancer[J]. J Hematol Oncol, 2018, 11(1): 48-50. DOI:10.1186/s13045-018-0590-8 |
| [20] |
Wang S, Sun C, Li J, et al. Roles of RNA methylation by means of N6-methyladenosine (m6A) in human cancers[J]. Cancer Lett, 2017, 408: 112-20. DOI:10.1016/j.canlet.2017.08.030 |
| [21] |
Cui Q, Shi H, Ye P, et al. m6A RNA methylation regulates the self-renewal and tumorigenesis of glioblastoma stem cells[J]. Cell Rep, 2017, 18(11): 2622-34. DOI:10.1016/j.celrep.2017.02.059 |
| [22] |
Panneerdoss S, Eedunuri VK, Yadav P, et al. Cross-talk among writers, readers, and erasers of m6A regulates cancer growth and progression[J]. Sci Adv, 2018, 4(10): eaar8263. |
| [23] |
Weng H, Huang H, Wu H, et al. METTL14 inhibits hematopoietic stem/progenitor differentiation and promotes leukemogenesis via mRNA m6A modification[J]. Cell Stem Cell, 2018, 22(2): 191-205. |
| [24] |
Yao QJ, Sang L, Lin M, et al. Mettl3-Mettl14 methyltransferase complex regulates the quiescence of adult hematopoietic stem cells[J]. Cell Res, 2018, 28(9): 952-4. DOI:10.1038/s41422-018-0062-2 |
| [25] |
Liu J, Yue Y, Han D, Wang X, et al. A METTL3-METTL14 complex mediates mammalian nuclear RNA N6-adenosine methylation[J]. Nat Chem Biol, 2014, 10: 93-5. DOI:10.1038/nchembio.1432 |
| [26] |
Li Z, Weng HY, Su R, et al. FTO plays an oncogenic role in acute myeloid leukemia as a N6-methyladenosine RNA demethylase[J]. Cancer Cell, 2016, 31(1): 127-41. |
| [27] |
Zhang S, Zhao BX, Zhou A, et al. m6A Demethylase ALKBH5 maintains tumorigenicity of glioblastoma stem-like cells by sustaining FOXM1 expression and cell proliferation program[J]. Cancer Cell, 2017, 31(4): 591. |
| [28] |
Taketo K, Konno M, Asai A, et al. The epitranscriptome m6A writer METTL3 promotes chemo- and radioresistance in pancreatic cancer cells[J]. Int J Oncol, 2017, 52(2): 621-9. DOI:10.3892/ijo.2017.4219 |
| [29] |
Deng X, Su R, Weng HY, et al. RNA N6-methyladenosine modification in cancers: current status and perspectives[J]. Cell Res, 2018, 28(5): 507-17. |
| [30] |
Huang H, Weng H, Sun W, et al. Author correction: recognition of RNA N6-methyladenosine by IGF2BP proteins enhances mRNA stability and translation[J]. Nat Cell Biol, 2018, 20(3): 285. DOI:10.1038/s41556-018-0045-z |
 2020, Vol. 40
2020, Vol. 40

