2. 湖南师范大学附属第一医院//湖南省人民医院手术室,湖南 长沙 410005
2. Operating Room, First Affiliated Hospital of Hunan Normal University/Hunan Provincial People's Hospital, Changsha 410005, China
慢性肾脏病(CKD)患者通常存在凝血功能障碍,具有较高的脑卒中或系统性血栓栓塞、心血管疾病以及出血风险[1-3]。血栓并发症已成为CKD患者死亡的最常见原因和肾脏替代治疗的难点之一[4]。血栓弹力图(TEG)是一种分析凝血和纤维蛋白溶解的实验室方法,TEG使用全血样本,与基于血浆的常规凝血试验相比,可更好地评估整体凝血功能[5]。有研究应用TEG发现血液透析与非透析CKD患者与健康对照相比出现血凝块形成延迟、血栓强度增加和血凝块分解减少[6]。最大振幅(MA)代表最大凝块强度,是血小板和纤维蛋白原/纤维蛋白交联的综合结果[7]。有研究发现术后MA值的升高与较高的术后血栓并发症风险相关[8]。因此测定MA值对评估CKD患者凝血状态具有重要意义,多种因素影响患者高凝状态,但国内外尚未见其MA值与血常规、肝肾功能等实验室指标的分析。因此,本研究根据MA值将CKD患者分组,评估其凝血功能的特征,并对患者基本情况、实验室指标等进行分析,探讨CKD患者凝血功能的相关影响因素。
1 资料和方法 1.1 研究对象选取2018年8月~2019年3月就诊于本院肾内科的CKD患者128例作为观察组,同期在本院体检的未患肾脏疾病的21名健康成年人作为对照组。所有患者均符合KDIGO指南的诊断标准[9]。排除标准:患急性肾损伤、肾病综合征、狼疮性肾炎或抗中性粒细胞胞浆自身抗体相关性血管炎的患者;合并急性感染、肝功能衰竭、手术、创伤、癌症、妊娠或血液系统恶性疾病的患者;近1月内使用抗凝药物、糖皮质激素或免疫抑制剂治疗的患者;过去12月内有血栓栓塞或出血性疾病史的患者。本研究获得了湖南省人民医院伦理委员会的批准,所有受试者均签署知情同意书。
1.2 研究方法 1.2.1 标本采集及临床数据收集患者入院后采集清晨空腹静脉血:枸橼酸钠抗凝血2管,3 mL/管,分别用于血栓弹力图和常规凝血功能检测,均在2 h内完成;EDTA-K2抗凝血1管,2 mL/管,用于血常规分析;促凝剂全血1管,3 mL/管,用于生化检测。收集并记录受试者的一般状况(年龄、性别和病因)、既往病史(冠心病、高血压、糖尿病和脑卒中)、用药史等信息。
1.2.2 血常规及生化指标检测血常规采用日本希森美康自动血细胞分析仪(XN9000)及配套试剂进行检测,记录白细胞、中性粒细胞计数(N)、淋巴细胞计数(L)、血小板、红细胞及血红蛋白水平,计算中性粒细胞百分比(N%=N/WBC×100%)及中性粒细胞淋巴细胞比值(NLR=N/L×100%)。采用美国贝克曼生化分析仪(AU5821/AU2700)及配套试剂进行生化指标检测,记录血清白蛋白、血清肌酐、尿酸、血清胱抑素-C、总血清胆固醇、甘油三酯、脂蛋白Lp(a)和血钙水平。使用CKD-EPI-Cr方程[10]估算肾小球滤过率(eGFR)。
1.2.3 常规凝血试验使用日本希森美康全自动血凝仪(CS5100/CA7000)及配套试剂进行常规凝血功能检测,检测指标有凝血酶原时间、国际标准化比值、纤维蛋白原(Fib)、活化部分凝血酶原时间(APTT)、D-二聚体和抗凝血酶Ⅲ(AT-Ⅲ)。
1.2.4 血栓弹力图用西芬斯血栓弹力图分析仪(LEPU-8800)进行检测。将1 mL柠檬酸钠抗凝全血转移到含有高岭土的小瓶中,充分颠倒混匀。37℃预热含有20 μL 0.2 mol/L CaCl2的反应杯,然后将340 μL高岭土活化的样本加入到该反应杯中。启动TEG测定,分析仪电脑记录血栓弹力图曲线。所有检测均由同一人员操作,并严格按照说明书进行。记录检测指标:反应时间(R),凝血启动到第一块纤维蛋白凝块形成所用的时间;K时间(K),从R值终点到血凝块强度达到振幅20 mm时所需的时间;α角,通过纤维蛋白原的聚合加强凝块的速度;MA,血小板通过与纤维蛋白原/纤维蛋白的相互作用产生的血凝块最大强度;凝血指数(CI),综合凝血状态。
1.3 实验分组根据eGFR[9]及是否进行血液透析将CKD患者分为4组:CKD 1~2期组[60≤eGFR < 90 mL(min·1.73 m2),n=25],CKD 3~4期组[eGFR≥15 mL(min·1.73 m2),n=29],CKD 5期非血液透析组[eGFR < 15 mL(min· 1.73 m2),n=43]和CKD 5期血液透析组[eGFR < 15 mL(min·1.73 m2),n=31]。根据MA值将CKD患者分为高凝集组(MA > 68 mm)和非高凝集组(MA≤68 mm)[8]。
1.4 统计分析使用SPSS 23.0进行数据处理。符合正态分布的计量资料以均数±标准差表示,非正态分布的计量资料以中值(四分位数)表示。两组之间的连续变量的比较使用t检验或Mann-Whitney'U检验。多组间比较采用单因素ANOVA分析或Kruskal-Wallis检验。定性资料的比较采用卡方检验。使用二元logistic回归分析进行影响因子分析。采用Spearman检验进行相关性分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 CKD患者与对照组基线资料CKD不同组与对照组间年龄、性别差异无统计学意义(P > 0.05),不同CKD分期的患者合并高血压、糖尿病或冠心病的比例均高于对照组(P < 0.05),CKD不同分期组与对照组的脑卒中发生率总体分布差异有统计学意义(P < 0.05),虽然脑卒中的发病率随着CKD的发展而增加,但两组差异无统计学意义(P > 0.05,表 1)。
| 表 1 CKD患者与对照组基线资料比较 Tab.1 Comparison of baseline characteristics between CKD subgroups and control group |
与对照组相比,CKD不同分期组患者的Fib和D-二聚体水平升高(P < 0.05),同时,CKD 5期非血液透析患者的Fib水平高于CKD 1-2期患者(P < 0.05),D-二聚体水平高于CKD 1~2期和CKD 3~4期患者(P < 0.05)。CKD 5期非血液透析组患者APTT较对照组明显延长(P < 0.05)。CKD 5期血液透析患者的AT-Ⅲ低于对照组(P < 0.05)。而凝血酶原时间和国际标准化比值在4个CKD亚组与对照组之间差异无统计学意义(P > 0.05)。CKD不同分期组与对照组血栓弹力图结果比较显示CKD 3-4期、CKD 5期非血液透析和CKD 5期血液透析组的患者的α-角和凝血指数水平高于CKD 1-2组和对照组(P < 0.05),而反应时间和K时间水平低于对照组(P < 0.05)。不同CKD分期组患者的MA值较对照析患者的MA值高于CKD1-2期患者(P < 0.05,表 2)。组有升高趋势(P < 0.05),CKD 5期血液透析或非血液透析患者的MA值高于CKD1-2期患者(P < 0.05,表 2)。
| 表 2 CKD患者与对照组凝血功能比较 Tab.2 Comparison of coagulation function between CKD subgroups and control group |
常规凝血试验的比较显示,两组间凝血酶原时间、国际标准化比值、APTT和AT-Ⅲ水平差异无统计学意义(P > 0.05),高凝组患者的Fib和D-二聚体水平较非高凝组升高(P < 0.01)。TEG指标分析显示,高凝组中α-角、MA和凝血指数水平升高(P < 0.01),而反应时间和K时间水平均低于非高凝组(P < 0.01,表 3)。
| 表 3 高凝组与非高凝组凝血功能比较 Tab.3 Comparison of coagulation function between hypercoagulable group and non-hypercoagulable group |
高凝血组CKD患者的eGFR、红细胞、血红蛋白和血清白蛋白水平均低于非高凝组(P < 0.05)。高凝组中合并糖尿病或脑卒中史的患者比例以及N%、NLR、血小板、血清肌酐、血清胱抑素-C、Lp(a)水平均高于非高凝组(P < 0.05)。两组间性别、年龄、合并高血压或冠心病的患者比例、尿酸、总血清胆固醇、甘油三酯、血钙水平的差异无统计学意义(P > 0.05,表 4)。
| 表 4 CKD患者高凝状态相关指标单因素分析 Tab.4 Univariate analysis of related indexes of hypercoagulable state in patients with CKD |
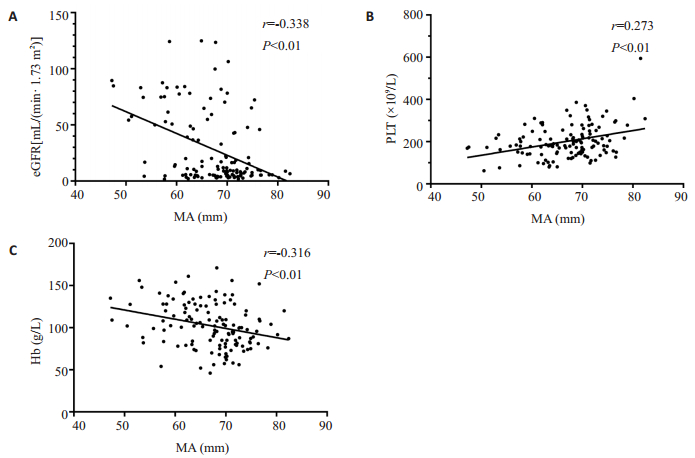
eGFR、血小板和血红蛋白是CKD患者高凝状态的独立影响因素(表 5)。MA值与eGFR、血红蛋白呈负相关(P < 0.01),与血小板呈正相关(P < 0.01,图 1)。
| 表 5 CKD患者高凝状态的多因素分析 Tab.5 Multivariate analysis of hypercoagulable state in patients with CKD |
|
图 1 MA与eGFR、血小板及血红蛋白相关性分析 Fig.1 Correlation analyze of eGFR, PLT or Hb with MA. A: Correlation of eGFR with MA. B: Correlation of PLT with MA. C: Correlation of Hb with MA. eGFR:estimated glomerular filtration rate; MA: Maximal amplitude; PLT: Platelet count; Hb: Hemoglobin. |
慢性肾脏病患者在疾病早期阶段即可发生凝血异常,且CKD患者通常具有较高水平的血栓栓塞事件的传统危险因素,如高血压、糖尿病、血脂异常、白蛋白尿和低蛋白血症等[11-13]。有研究观察到慢性肾功能不全合并脑出血患者较肾功能正常的脑出血患者凝血速度更快,凝块强度增加,提示肾功能不全患者处在相对高凝状态[7]。在本研究中,随着CKD的进展,合并高血压、糖尿病、冠心病或有脑卒中病史的患者比例逐渐增加;与非高凝组相比,高凝组人群中合并糖尿病或脑卒中史的患者及Lp(a)水平均升高,而血清白蛋白浓度显著降低,与上述研究结果相符。因此,早期发现CKD患者,尤其是合并基础疾病的CKD患者的凝血异常,及时进行治疗干预是十分重要的。
常规凝血功能仅检测凝血过程中凝血因子的阶段性作用,但TEG可动态显示血凝块形成的过程。本研究比较了不同CKD分期组和正常对照组间常规凝血试验和TEG的指标,发现不同CKD分期组与对照组间比较,仅CKD 5期非血液透析患者的APTT较对照组显著延长,而凝血酶原时间和国际标准化比值的比较差异无统计学意义。作为传统的凝血指标,ATPP,凝血酶原时间和国际标准化比值仅反映凝血功能,并不适合评估凝血的真实状态[4]。在CKD不同组人群中检测到纤维蛋白原和D-二聚体水平的增加、纤维蛋白形成所需时间缩短(R)、血凝块的加速形成(K/a角)和凝块强度增加(MA),表明CKD患者处于高凝状态。为了进一步研究与CKD患者高凝状态的影响因素,我们根据MA值将CKD患者分为高凝组和非高凝组,发现eGFR、糖尿病或脑卒中史、N%、NLR、血小板、红细胞、血红蛋白、血清肌酐、血清胱抑素-C、血清白蛋白和Lp(a)均是潜在的影响因素,Logistic回归模型分析显示eGFR、血小板和血红蛋白是CKD患者高凝状态的危险因素。
MA是纤维蛋白和血小板通过GPIIb/Ⅲa结合的结果,代表纤维蛋白凝块的最大强度,被认为是TEG中最能代表血小板功能的参数[7-8]。本研究显示,高凝组血小板计数明显高于非高凝组,血小板与MA呈正相关,说明MA还可反应血小板数量。但先前也有报道CKD患者存在血小板功能障碍[14],因此当患者血小板计数与临床表现不符时,可进行TEG检测辅助诊断。同时高凝组Fib水平显著高于非高凝组,且Fib水平随着CKD的进展而增加,这与文献报道的CKD患者纤维蛋白原水平升高,可调节凝块强度增加的结果相一致[6]。
相关性分析提示eGFR与MA值呈负相关,表明随着CKD病程的进展,凝块强度逐渐增加,患者高凝状态加剧。本研究分析考虑:(1)CKD患者存在纤维蛋白原和D-二聚体的代谢和消除减少[6, 15-16],随着疾病的进展,肾功能受损加剧,导致促凝血物质的去除减少,其水平逐渐升高,而抗凝因子水平逐渐降低[17];(2)其他因素如内皮细胞损伤和CKD引起的炎症介质激活,也可导致肾损害患者处于高凝状态[14, 18]。在本研究中,高凝组CKD患者的N%和NLR均较非高凝组升高。外周血白细胞的测定是评估炎症的廉价且简单的方法,据报道,CKD患者的NLR与炎症标志物如IL-6或高敏CRP[19]以及内皮功能障碍、心血管风险是呈正相关的[20];(3)由于促红细胞生成素减少,CKD患者通常患有贫血。本研究数据显示,与非高凝组相比,高凝组患者的红细胞和血红蛋白显著降低,血红蛋白作为CKD患者高凝状态危险因素,与MA值呈负相关。有实验表明在测试所需的全血量恒定的条件下,随着红细胞计数减少,相应的血浆蛋白增加,血浆中的纤维蛋白含量增加,可导致血液凝块强度增加[21]。
综上所述,TEG较常规凝血功能检测能更早的发现CKD患者的凝血异常,CKD患者存在血凝块形成速度加快及强度增加,表现出高凝状态。多种因素可影响CKD患者凝血功能,其中eGFR、血小板和血红蛋白是影响CKD患者高凝状态的危险因素。本研究的不足之处在于作为单中心小样本研究,可能使结果产生偏差,后期将扩大研究样本并长期随访,探讨TEG参数在临床中的应用。应密切监测CKD患者凝血功能变化,积极治疗并发症,预防血栓栓塞等风险。
| [1] |
Olesen JB, Lip GY, Kamper AL, et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease[J]. N Engl J Med, 2012, 367(7): 625-35. DOI:10.1056/NEJMoa1105594 |
| [2] |
Gansevoort RT, Correa-Rotter R, Hemmelgarn BR, et al. Chronic kidney disease and cardiovascular risk: Epidemiology, mechanisms, and prevention[J]. Lancet, 2013, 382(9889): 339-52. DOI:10.1016/S0140-6736(13)60595-4 |
| [3] |
Folsom AR, Lutsey PL, Astor BC, et al. Chronic kidney disease and venous thromboembolism: A prospective study[J]. Nephrol Dial Transplant, 2010, 25(10): 3296-301. DOI:10.1093/ndt/gfq179 |
| [4] |
Min H, Rob W, Yan W, et al. Blood coagulation system in patients with chronic kidney disease: a prospective observational study[J]. Bmj Open, 2017, 7(5): e014294-305. DOI:10.1136/bmjopen-2016-014294 |
| [5] |
Othman M, Kaur H. Thromboelastography (TEG)[J]. Methods Mol Biol, 2017, 1646(10): 533-43. |
| [6] |
Gred N, Elin M, Mapin C, et al. The hypercoagulability paradox of chronic kidney disease: the role of fibrinogen[J]. Am J Surg, 2017, 214(6): 1215-8. DOI:10.1016/j.amjsurg.2017.08.039 |
| [7] |
Kim M, Deny S, Glin T, et al. Thrombelastography suggests hypercoagulability in patients with renal dysfunction and intracerebral hemorrhage[J]. J Stroke Cerebrovasc, 2018, 27(5): 1350-6. DOI:10.1016/j.jstrokecerebrovasdis.2017.12.026 |
| [8] |
Mccrath DJ, Cerboni E, Frumento RJ, et al. Thromboelastography maximum amplitude predicts postoperative thrombotic complications including myocardial infarction[J]. Anesthesia & Analgesia, 2005, 100(6): 1576-83. |
| [9] |
Andrassy KM. Comments on 'KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease'[J]. Kidney Int, 2013, 84(3): 622-3. |
| [10] |
Yan C, Wu B, Zeng M, et al. Comparison of different equations for estimated glomerular filtration rate in Han Chinese patients with chronic kidney disease[J]. Clin Nephrol, 2019, 91(5): 301-10. DOI:10.5414/CN109420 |
| [11] |
Tonelli M, Wiebe N, Richard JF, et al. Characteristics of adults with type 2 diabetes mellitus by category of chronic kidney disease and presence of cardiovascular disease in Alberta Canada: a cross-sectional study[J]. Can J Kidney Health Dis, 2019, 6(5): 1-13. |
| [12] |
Go AS. Cardiovascular disease consequences of CKD[J]. Semin Nephrol, 2016, 36(4): 293-304. DOI:10.1016/j.semnephrol.2016.05.006 |
| [13] |
Aggarwal HK, Jain D, Lathar M, et al. Lipoprotein-a and carotid intima media thickness as cardiovascular risk factors in patients of chronic kidney disease[J]. Ren Fail, 2010, 32(6): 647-52. DOI:10.3109/0886022X.2010.486097 |
| [14] |
Lutz J, Menke J, Sollinger D, et al. Haemostasis in chronic kidney disease[J]. Nephrol Dial Transplant, 2014, 29(1): 29-40. DOI:10.1093/ndt/gft209 |
| [15] |
Lane DA, Ireland H, Knight I, et al. The significance of fibrinogen derivatives in plasma in human renal failure[J]. Br J Haematol, 1984, 56(2): 251-60. DOI:10.1111/j.1365-2141.1984.tb03953.x |
| [16] |
Mörtberg J, Blombäck M, Wallén H, et al. Increased fibrin formation and impaired fibrinolytic capacity in severe chronic kidney disease[J]. Blood Coagul Fibrinolysis, 2016, 27(4): 401-7. DOI:10.1097/MBC.0000000000000462 |
| [17] |
Dubin R, Cushman M, Folsom AR, et al. Kidney function and multiple hemostatic markers: cross sectional associations in the multi-ethnic study of atherosclerosis[J]. BMC Nephrol, 2011, 12(1): 3-15. DOI:10.1186/1471-2369-12-3 |
| [18] |
McMillan R, Skiadopoulos L, Hoppensteadt D, et al. Biomarkers of endothelial, renal, and platelet dysfunction in stage 5 chronic kidney disease hemodialysis patients with heart failure[J]. Clin Appl Thromb Hemost, 2018, 24(2): 235-40. DOI:10.1177/1076029617729216 |
| [19] |
Ahbap E, Sakaci T, Kara E, et al. Neutrophil-to-lymphocyte ratio and platelet-tolymphocyte ratio in evaluation of inflammation in end-stage renal disease[J]. Clin Nephrol, 2016, 85(4): 199-208. |
| [20] |
Martínez D, Beltrán A, Huerta OA, et al. The neutrophil-to-lymphocyte ratio as a marker of systemic endothelial dysfunction in asymptomatic subjects[J]. Nefrologia, 2016, 36(4): 397-403. |
| [21] |
Noorman F, Hess JR. The contribution of the individual blood elements to the variability of thromboelastographic measures[J]. Transfusion, 2018, 58(10): 2430-6. DOI:10.1111/trf.14884 |
 2020, Vol. 40
2020, Vol. 40

