2. 内蒙古医科大学附属人民医院医务科,内蒙古 呼和浩特 010010;
3. 内蒙古医科大学基础医学院药理学院,内蒙古 呼和浩特 010110;
4. 内蒙古医科大学附属人民医院介入科,内蒙古 呼和浩特 010010;
5. 内蒙古医科大学附属医院放疗科,内蒙古 呼和浩特 010050
2. Medical Departmentn, Affiliated People's Hospital of Inner Mongolia Medical University, Hohhot, 010010, China;
3. Department of Basic Medicine, School of Pharmacology of Inner Mongolia Medical University, Hohhot 010110, China;
4. Department of Interventional Riadiology, Affiliated People's Hospital of Inner Mongolia Medical University, Hohhot 010010, China;
5. Department of Radiotherapy, Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010050, China
乳腺癌是女性最常见的恶性肿瘤。全球每年新发病例可达170万以上,并以每年3%~4%的速度递增[1-2]。其发病率在我国虽低于欧美水平,而地域差异明显,发病年龄逐渐年轻化[3]。因此,开展乳腺癌的研究具有重要的现实意义。近年来,抑癌基因的甲基化失活对乳腺癌的影响日益受到关注[4]。OPCML是广泛的存在于正常组织的一类免疫球蛋白超家族,其功能主要是参与细胞之间的识别与黏附,也可以激活相关的转导通路,发挥抑癌基因的作用[5-6]。研究发现,在人的乳腺癌细胞中OPCML呈低水平表达或缺失,且其表达水平与OPCML基因启动子的甲基化状态密切相关[7],用甲基转移酶抑制剂处理使其去甲基化后可恢复其表达及原有功能[8]。表明抑癌基因的去甲基化是防治肿瘤的重要策略[9]。木犀草素是一类天然的黄酮类化合物,药理学研究表明,其不仅能抑制肿瘤细胞增殖,还具有抗氧化、抗炎症等多重功效[10-11],还可通过多种机制抑制肿瘤细胞生长[12],但迄今为止有关OPCML在乳腺癌癌中的作用仍不明确。因此本研究旨在研究OPCML对MDA-MB-231乳腺癌细胞生长增殖中的影响,并初步探讨其机制。
1 材料和方法 1.1 主要实验材料乳腺癌细胞株MDA-MB-231(中科院细胞库);木犀草素(Sigma-Adrich);MTT试剂(北京索莱宝科技有限公司);Annexin-V/PI细胞凋亡检测试剂盒(北京碧云天公司);鼠抗人OPCML、DNMT1以及GAPDH抗体(Santa Cruz);DMNT甲基化试剂盒(Epigentek)。RPMI 1640、胎牛血清等细胞培养试剂(上海生物工程股份有限公司)。
1.2 细胞培养与处理MDA-MB-231细胞均培养于含10%胎牛血清的RPMI 1640培养基中,且在培养基中加入1%的青霉素-链霉素。加入培养基后细胞于37 ℃、5% CO2条件下培养。当细胞密度达到80%左右时,更换新的RPMI 1640培养基。随后用5、10以及20 μmol/L的木犀草素处理细胞24 h。
1.3 细胞增殖实验待MDA-MB-231细胞生长至80%左右时,以3× 104/mL的细胞密度加入至96孔板中,每孔150 μL。在各个细胞孔中加入不同浓度的木犀草素,每组均设3个复孔,并在细胞培养箱中继续培养24 h。随后在各孔中分别加入15 μL的MTT试剂,继续培养4 h后加入150 μL DMSO,振荡10 min,使结晶物充分融解。最后于酶标仪上测定各孔的吸光度值(A490 nm),并计算细胞活性。
1.4 流式细胞术检测细胞凋亡收集处理后的MDA-MB-231细胞。用含1%牛血清白蛋白的PBS缓冲液冲洗固定细胞,并于1000 r/min条件下离心10 min。随后用100 μL Binding缓冲液重悬细胞,并充分振荡混匀。混匀后加入10 μL Annexin V-FITC和10 μL的PI溶液,37 ℃避光反应15 min后加入50 μg/mL的碘化丙啶进行染色。最后于流式细胞仪上进行检测。
1.5 甲基化特异性PCR建立甲基化特异性PCR(MSP)的反应体系10 μL,其中含有5 μL PCR Mix、2 μL引物(2 μmol/L)、2 μL DNA(2 μg)、1 μL ddH2O。MSP反应条件:95 ℃下预变性10 min,随后进入40个以下循环:95 ℃变性30 s,56 ℃下退火22 s,在58 ℃ 32 s,然后72 ℃延伸30 s。将PCR产物在2%琼脂糖凝胶上电泳,用溴化乙锭染色,用凝胶记录拍照(Bio-Rad)。
1.6 甲基化活性分析使用Epigentek提供的试剂盒从MDA-MB-231细胞提取总蛋白,并采用Bradford法测定蛋白浓度后将其储存于-80 ℃备用。使用Epiquik DNMT活性分析试剂盒测定细胞内DNMT1的活性(Epigentek),即,将10 μg总蛋白添加到包被有富含胞嘧啶DNA的样品孔中,根据试剂盒的说明依次加入捕获抗体与显色剂,最后使用酶标仪(Thermo-Scientific)获取A490 nm值,结果以相对活性表示(相对活性=处理组活性/对照组活性×100%)。
1.7 Western blot检测蛋白表达收集上述处理后的细胞提取细胞总蛋白,并用BCA法检测蛋白浓度。在蛋白样本中加入上样缓冲液后进行SDS-PAGE电泳。随后进行转膜,并将膜于5%脱脂奶粉中封闭2 h。一抗4 ℃孵育过夜后再加二抗室温孵育2 h。最后在膜上滴加ECL发光液后置于显影仪中避光显影。
1.8 异种移植瘤动物模型的建立及处理获取对数生长期的MDA-MB-231细胞,在每只裸鼠右腋皮下接种0.2 mL细胞悬液(细胞量约5×106),接种后置于SPF环境饲养。每2~3 d测量皮下肿瘤直径,待肿瘤直径为0.5~0.6 cm时,按每克体质量每2 d灌胃给予10、20和30 mg/kg木犀草素,共7次。灌胃后的小鼠自由进食、饮水。最后1次灌胃20 d后处死小鼠,获取瘤组织用于Western blot分析。
1.9 Sp1过表达实验采用转染试剂将构建好的PL- Sp1质粒转染至MDA-MB-231细胞中,并以空白PL质粒作为对照。转染结束后加入木犀草素处理48 h,随后在上述细胞中加入裂解液,获取总蛋白用于Western blot分析。
1.10 统计学分析使用graphpad prism 6.0软件进行统计分析。单因素方差分析和t检验用于多重比较。P < 0.05为差异具有统计学意义。
2 结果 2.1 木犀草素对MDA-MB-231细胞增殖的影响MTT结果显示,MDA-MB-231细胞经5、10、20 μmol/L木犀草素孵育72 h后,随着浓度的递增,细胞活性分别降至对照组的(93±2.5)%、(76±3.4)%和(54±6.2)%(P < 0.05,图 1)。
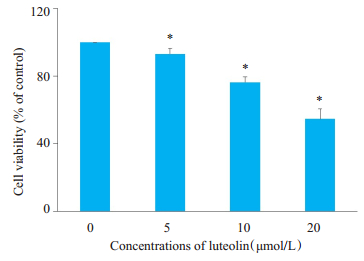
|
图 1 不同浓度木犀草素对MDA-MB-231细胞增殖的影响 Fig.1 Effects of different concentrations of luteolin on the proliferation of MDA-MB-231 cells. *P < 0.05vs control group (0 μmol/L). |
流式细胞术结果也显示,未处理组细胞凋亡率为2.67%,5、10、20 μmol/L木犀草素处理后,凋亡率分别为8.34%,14.46%和22.07%,与对照组相比,差异有统计学意义(P < 0.05,图 2)。
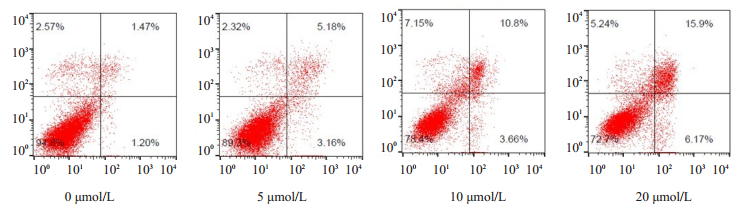
|
图 2 不同浓度木犀草素对MDA-MB-231细胞凋亡的影响 Fig.2 Effects of different concentrations of luteolin on apoptosis of MDA-MB-231 cells. |
实时定量PCR结果显示,OPCML mRNA在对照组中表达水平很低,给予木犀草素处理24 h后,随着其剂量的增加,细胞内OPCML的mRNA水平逐渐增多,其中20 μmol/L木犀草素处理后,mRNA相对表达量的水平是对照组的2.33倍(P < 0.05,图 3A)。OPCML蛋白表达变化趋势与mRNA一致(图 3B)。
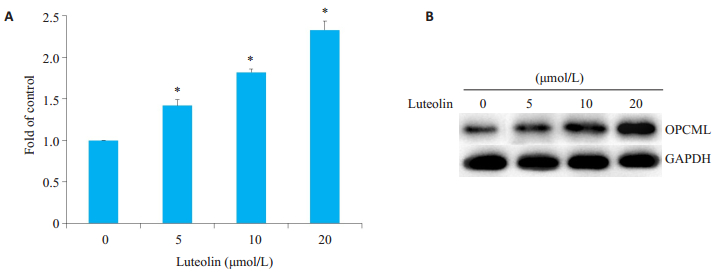
|
图 3 木犀草素上调MDA-MB-231细胞OPCML mRNA和蛋白表达 Fig.3 Luteolin upregulates OPCML mRNA and protein expressions in MDA-MB-231 cells, *P < 0.05vs control group (0 μmol/L); A: Fold change of expression of OPCML mRNA; B: Expressions of OPCML proteins after luteolin treatment. |
不同浓度木犀草素处理后,能有效降低甲基化OPCML(M)水平,而非甲基化OPCML(U)逐渐增多(图 4)。
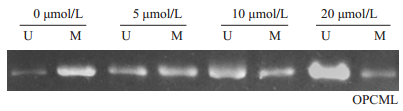
|
图 4 木犀草素对OPCML启动子甲基化的影响 Fig.4 Effect of luteolin on methylation of OPCML promoter. |
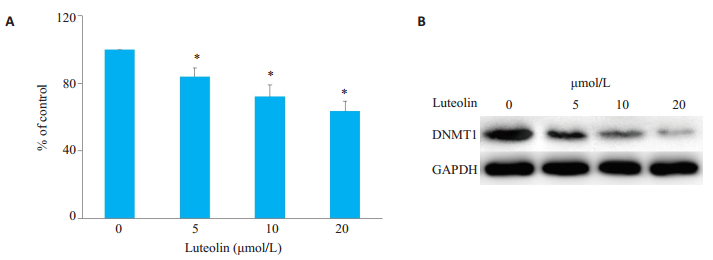
不同浓度木犀草素处理后,胞内甲基化酶的活性均有所降低。其中5、10、20 μmol/L木犀草素处理后,甲基化酶活性与对照组相比分别降低了16%、28%和37%(图 5A)。此外,Western blot结果也显示,采用不同浓度木犀草素处理后,细胞内甲基化转移酶DNMT1的表达水平也明显降低(图 5B)。
|
图 5 不同浓度木犀草素对胞内甲基化的影响 Fig.5 Effects different concentrations of luteolin on the intracellular methylation of the cells. A: Activity of methylation after luteolin treatment. *P < 0.05vs control group (0 μmol/L); B: Changes in expression of DNMT1 protein in luteolin-treated cells. |
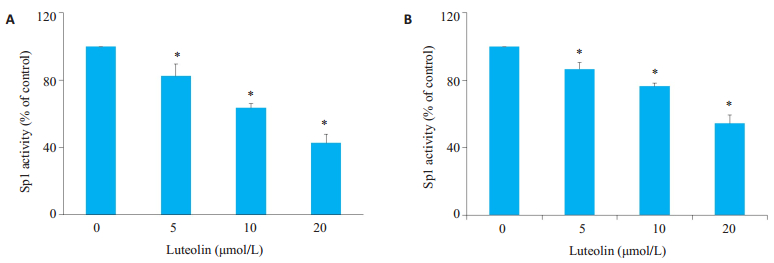
木犀草素处理后,细胞中Sp1的活性显著降低(图 6A)。此外,通过MDA-MB-231细胞建立的小鼠异种移植瘤组织中Sp1活性也随木犀草素浓度增加而降低(图 6B)。
|
图 6 木犀草素对体内外Sp1活性的影响 Fig.6 Effect of luteolin on Sp1 activity in vitro and in vivo. A: Sp1 activity in MDA-MB-231 cells; B: Sp1 activity in xenografted tumors after luteolin treatment. *P < 0.05 vs control group. |
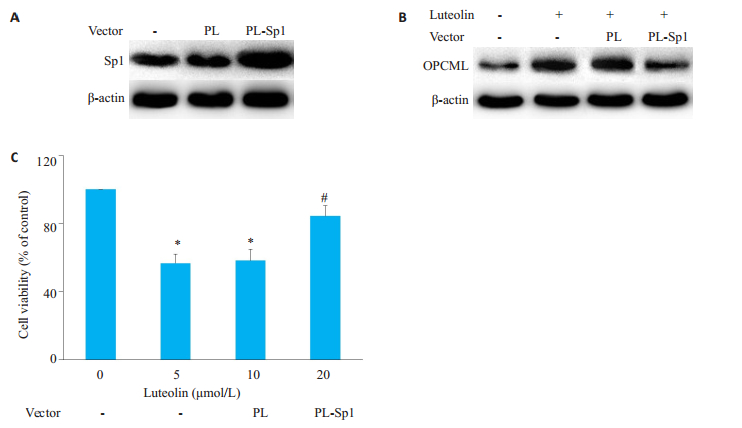
将MDA-MB-231细胞转染PL-Sp1载体使其胞内过表达Sp1(图 7A),随后用20 μmol /L木犀草素处理72 h后,Western blot结果显示,OPCML蛋白表达水平明显降低(图 7B),MDA-MB-231细胞增殖水平也明显削弱(图 7C)。
|
图 7 过表达Sp1对OPCML表达及细胞活性的影响 Fig.7 Effect of over-expression of Sp1 on OPCML expression and cell viability. A: Over-expression of Sp1 in MDA-MB-231 cells. B: Effect of Sp1 over-expression on luteolin-induced OPCML expression; C: Effect of Sp1 over-expression on luteolin-induced inhibition of cell viability.*P < 0.05 vs control group; #P < 0.05 vs PL vector group. |
木犀草素本名为3',4',5,7-四羟基黄酮,含有C6-C3-C6、苯环,有含氧碳环及C2-C3碳双键。是其发挥生物学作用的重要结构[13-15]。研究表明,木犀草素对结直肠癌细胞、乳腺癌细胞、前列腺癌细胞、胃癌细胞以及肝癌细胞的生长增殖具有抑制作用,并能影响细胞内与生长增殖相关的多条信号通路的激活[16-18]。在本研究结果证实木犀草素能抑制乳腺癌细胞MDA-MB-231的增殖,且随着浓度增大、培养时间延长,对细胞抑制效果越明显[5],同时也发现木犀草素能诱导MDA-MB-231细胞凋亡。由于原癌基因、抑癌基因的异常均参与了乳腺癌的发生和发展过程[19],因此我们对木犀草素能否影响抑癌基因的表达进行了研究。OPCML是持细胞正常功能、分化发育,改变细胞表达的重要基因,在多种肿瘤细胞中,OPCML表达往往异常,包括卵巢癌、膀胱癌、肺癌和胃癌等[7, 20-21]。2003年,Sellar首次于卵巢癌的细胞株A2780及正常卵巢的上皮细胞中发现OPCML基因的表达水平异常,主要表现为表达水平下调、细胞出现失控性生长[22];而正常机体内,OPCML基因呈一定水平表达,并参与增加细胞间的识别及粘附,并对肿瘤的发生具有抑制作用[23],进一步研究表明,OPCML基因在多种呼吸系统肿瘤、消化系统肿瘤、泌尿生殖系统肿瘤中均表达缺失[24-26],OPCML缺失后细胞可出现失控性生长,通过基因手段上调其表达后可以增加细胞间的识别及粘附能力,并能抑制细胞的增殖[8, 27]。本研究用不同浓度木犀草素培养MDA-MB-231细胞72 h,以实时定量PCR和Western blot方法检测细胞中OPCML mRNA和蛋白表达水平的影响。结果发现,OPCML在MDA-MB-231乳腺癌细胞中呈现低表达状态,不同浓度的木犀草素可以剂量依赖性的方式增加OPCML基因mRNA及蛋白的表达水平。表明木犀草素能通过某种机制上调OPCML重新表达,从而减弱乳腺癌MDA-MB-231细胞的生物学活性。研究表明,抑癌基因的甲基化是其失活的重要机制[28-29]。为了分析MDA-MB-231细胞在木犀草素处理后对OPCML表达水平上调是否与OPCML启动子区域的甲基化水平相关,我们采用MSP方法对不同浓度木犀草素处理后的MDA-MB-231细胞启动子区域甲基化水平进行了检测[30],结果证实,木犀草素可有效降低OPCML启动子区域甲基化水平。此外,酶活性实验结果也证实20 μmol/L木犀草素处理组与未处理组相比,细胞内甲基化活性也明显降低),并与DNMT1蛋白的表达水平成一定的正相关。结合以上结果均表明木犀草素可影响MDA-MB-231细胞内的甲基化活性,进而更一步的激活OPCML抑癌基因表达。
为了进一步明确木犀草素的作用机制,本研究随后探讨了核转录因子Sp1在木犀草素影响MDA-MB-231细胞增殖中的作用。首先,我们检测了木犀草素处理前后Sp1活性的变化,结果发现5、10、20 μmol/L木犀草素处理后Sp1与DNA的结合活性显著降低,动物实验中也得到了类似的结果。由于Sp1是引起抑癌基因甲基化的重要核转录因子,随后我们反向验证了Sp1对木犀草素抑制MDA-MB-231细胞增殖以及OPCML表达的影响。通过细胞内过表达Sp1后,Sp1对MDA-MB-231细胞增殖的抑制效应以及OPCML的表达明显削弱,表明木犀草素最终是影响Sp1的活性而上调OPCML的表达,最终影响细胞的增殖。
综上所述,木犀草素可以诱导乳腺癌细胞的生长抑制,并降低OPCML基因的甲基化水平,进而上调其表达水平密切相关。功能在一定程度上和5-Aza-CdR类似,而木犀草素是一种多甲氧基黄酮,由于其来源于自然界,其毒性相对较低,因此是一种潜在的安全的肿瘤辅助用药。
| [1] |
Goldberg MS, Villeneuve PJ, Crouse D, et al. Associations between incident breast cancer and ambient concentrations of nitrogen dioxide from a national land use regression model in the Canadian National Breast Screening Study[J]. Environ Int, 2019, 133(Pt B): 105182. |
| [2] |
Bach AC, Lo KS, Pathirana T, et al. Is the risk of cancer in Australia overstated? The importance of competing mortality for estimating lifetime risk[J]. Med J Aust, 2020, 212(1): 17-22. |
| [3] |
Blok CJM, Wiepjes CM, Nota NM, et al. Breast cancer risk in transgender people receiving hormone treatment: nationwide cohort study in the Netherlands[J]. BMJ, 2019, 365: 11652. |
| [4] |
Blondel A, Benberghout A, Pedeux R, et al. Exploiting ING2 epigenetic modulation as a therapeutic opportunity for non-small cell lung cancer[J]. Cancers (Basel), 2019, 11(10): E1601. DOI:10.3390/cancers11101601 |
| [5] |
Antony J, Zanini E, Kelly Z, et al. The tumour suppressor OPCML promotes AXL inactivation by the phosphatase PTPRG in ovarian cancer[J]. EMBO Rep, 2018, 19(8): 201745670. |
| [6] |
Wang LH, Chu FF, Ren DH, et al. Effect of OPCML gene on the biological behavior of gastric cancer cell line AGS[J]. J Biol Regul Homeost Agents, 2016, 30(2): 529-34. |
| [7] |
Xing XB, Cai WB, Ma SM, et al. Down-regulated expression of OPCML predicts an unfavorable prognosis and promotes disease progression in human gastric cancer[J]. BMC Cancer, 2017, 17(1): 268. DOI:10.1186/s12885-017-3203-y |
| [8] |
Caffrey A, Irwin RE, McNulty H, et al. Gene-specific DNA methylation in newborns in response to folic acid supplementation during the second and third trimesters of pregnancy: epigenetic analysis from a randomized controlled trial[J]. Am J Clin Nutr, 2018, 107(4): 566-75. DOI:10.1093/ajcn/nqx069 |
| [9] |
Oser MG, Sabet AH, Gao WH, et al. The KDM5A/RBP2 histone demethylase represses NOTCH signaling to sustain neuroendocrine differentiation and promote small cell lung cancer tumorigenesis[J]. Genes Dev, 2019, 33(23/24): 1718-38. |
| [10] |
Juszczak AM, Zovko-Končić M, Tomczyk M. Recent trends in the application of chromatographic techniques in the analysis of luteolin and its derivatives[J]. Biomolecules, 2019, 9(11): E731. DOI:10.3390/biom9110731 |
| [11] |
Attanzio A, D'Anneo A, Pappalardo F, et al. Phenolic composition of hydrophilic extract of Manna from Sicilian Fraxinus angustifolia vahl and its reducing, antioxidant and anti-inflammatory activity in vitro[J]. Antioxidants (Basel), 2019, 8(10): E494. DOI:10.3390/antiox8100494 |
| [12] |
Wang JF, Liu S, Liu BW, et al. Luteolin inhibits listeriolysin O translation by directly targeting the coding region of the hly mRNA[J]. Front Microbiol, 2019, 10: 1496. DOI:10.3389/fmicb.2019.01496 |
| [13] |
Olennikov DN, Gadimli AI, Isaev JI, et al. Caucasian Gentiana species: untargeted LC-MS metabolic profiling, antioxidant and digestive enzyme inhibiting activity of six plants[J]. Metabolites, 2019, 9(11): E271. DOI:10.3390/metabo9110271 |
| [14] |
Yamauchi K, Fujieda A, Mitsunaga T. Selective synthesis of 7-O-substituted luteolin derivatives and their melanonenesis and proliferation inhibitory activity in B16 melanoma cells[J]. Bioorg Med Chem Lett, 2018, 28(14): 2518-22. DOI:10.1016/j.bmcl.2018.05.051 |
| [15] |
de Oliveira DP, de Almeida L, Marques MJ, et al. Exploring the bioactivity potential of Leonotis nepetifolia: phytochemical composition, antimicrobial and antileishmanial activities of extracts from different anatomical parts[J]. Nat Prod Res, 2019, 1-6. |
| [16] |
Ibrahim M, Abdul Azziz SSS, Fah Wong C, et al. Interactions of flavone and steroid from A. subintegra as potential inhibitors for porcine pancreatic lipase[J]. Curr Comput Aided Drug Des, 2019. |
| [17] |
Gao GL, Ge RL, Li YZ, et al. Luteolin exhibits anti-breast cancer property through up-regulating miR-203[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 3265-71. DOI:10.1080/21691401.2019.1646749 |
| [18] |
Li DJ, Zhai SM, Song RM, et al. Determination of Cis-diol-containing flavonoids in real samples using boronate affinity quantum dots coated with imprinted silica based on controllable oriented surface imprinting approach[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2020, 227: 117542. DOI:10.1016/j.saa.2019.117542 |
| [19] |
Zhan SH, Li JM, Ge W. Multifaceted roles of asporin in cancer: current understanding[J]. Front Oncol, 2019, 9: 948. DOI:10.3389/fonc.2019.00948 |
| [20] |
Patai ÁV, Barták BK, Péterfia B, et al. Comprehensive DNA methylation and mutation analyses reveal a methylation signature in colorectal sessile serrated adenomas[J]. Pathol Oncol Res, 2017, 23(3): 589-94. DOI:10.1007/s12253-016-0154-6 |
| [21] |
Zanini E, Louis LS, Antony J, et al. The tumor-suppressor protein OPCML potentiates anti-EGFR- and anti-HER2-targeted therapy in HER2-positive ovarian and breast cancer[J]. Mol Cancer Ther, 2017, 16(10): 2246-56. DOI:10.1158/1535-7163.MCT-17-0081 |
| [22] |
Dong XM, Zhang J, Yang F, et al. Effect of luteolin on the methylation status of the OPCML gene and cell growth in breast cancer cells[J]. Exp Ther Med, 2018, 16(4): 3186-94. |
| [23] |
McKie AB, Vaughan S, Zanini E, et al. The OPCML tumor suppressor functions as a cell surface repressor-adaptor, negatively regulating receptor tyrosine kinases in epithelial ovarian cancer[J]. Cancer Discov, 2012, 2(2): 156-71. DOI:10.1158/2159-8290.CD-11-0256 |
| [24] |
Li BK, Liu WJ, Wang L, et al. CpG island methylator phenotype associated with tumor recurrence in tumor-node-metastasis stage Ⅰ hepatocellular carcinoma[J]. Ann Surg Oncol, 2010, 17(7): 1917-26. DOI:10.1245/s10434-010-0921-7 |
| [25] |
Li CH, Tang LP, Zhao LJ, et al. OPCML is frequently methylated in human colorectal cancer and its restored expression reverses EMT via downregulation of smad signaling[J]. Am J Cancer Res, 2015, 5(5): 1635-48. |
| [26] |
Amornpisutt R, Proungvitaya S, Jearanaikoon P, et al. DNA methylation level of OPCML and SFRP1: a potential diagnostic biomarker of cholangiocarcinoma[J]. Tumour Biol, 2015, 36(7): 4973-8. DOI:10.1007/s13277-015-3147-2 |
| [27] |
Jueliger S, Lyons J, Cannito S, et al. Efficacy and epigenetic interactions of novel DNA hypomethylating agent guadecitabine (SGI-110) in preclinical models of hepatocellular carcinoma[J]. Epigenetics, 2016, 11(10): 709-20. DOI:10.1080/15592294.2016.1214781 |
| [28] |
Zhang JY, Xing BL, Song JZ, et al. Associated analysis of DNA methylation for cancer detection using CCP-based FRET technique[J]. Anal Chem, 2014, 86(1): 346-50. DOI:10.1021/ac402720g |
| [29] |
Wang B, Yu L, Luo X, et al. Detection of OPCML methylation, a possible epigenetic marker, from free serum circulating DNA to improve the diagnosis of early-stage ovarian epithelial cancer[J]. Oncol Lett, 2017, 14(1): 217-23. DOI:10.3892/ol.2017.6111 |
| [30] |
Abdel-Rahman WM, Lotsari-Salomaa JE, Kaur S, et al. The role of chromosomal instability and epigenetics in colorectal cancers lacking β-catenin/TCF regulated transcription[J]. Gastroenterol Res Pract, 2016, 2016: 6089658. |
 2020, Vol. 40
2020, Vol. 40

