2. 南方医科大学南方医院器官移植科,广东 广州 510515
2. Department of Organ Transplantation, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
常染色体显性遗传性多囊肾病(ADPKD)是终末期肾病的第四大病因以及首要的遗传病因,通常在中年时期引起终末期肾病[1]。30%~50%的ADPKD患者会出现尿路感染(UTI),在肾移植受者中已达到57%[2]。既往研究表明UTI经常在免疫力低下的人群中出现,而在慢性肾病中与UTI最相关的是ADPKD和肾结石[3]。但目前没有明确的证据表明ADPKD患者的免疫力较其他肾脏病患者更低,且ADPKD患者移植术后免疫抑制剂血药浓度与其他肾移植受者的差异性也未见报道。
鉴于肾移植术后免疫抑制剂的使用与患者本身的免疫状态有关[4],因此本研究比较了ADPKD组和对照组、ADPKD中UTI组与非UTI组肾移植后不同时期免疫抑制剂血药浓度,以此推测ADPKD患者本身对于移植肾的耐受能力,探讨合理的免疫抑制剂血药浓度,这对于预防移植术后的急性排斥反应以及各种感染事件的发生具有重要意义。
1 资料和方法 1.1 研究对象本研究经过了南方医科大学南方医院伦理委员会批准。回顾性收集2000年3月~2018年1月年在南方医科大学南方医院诊断为ADPKD并在我院行首次肾移植术的患者资料。排除标准:移植前患有肿瘤、肾移植手术记录如术前透析时间缺失以及术后1年内使用以环孢素为主的免疫抑制方案的患者。总共纳入68例ADPKD患者作为研究组,同时在本院没有诊断为ADPKD的首次肾移植患者基本数据列表中选择年龄(相差5岁内)、性别和移植时间(1年内)相匹配的68例非ADPKD患者作为对照组。应用SPSS进行病例的匹配,执行最优操作。通过查阅病历和电话随访获得人口统计学资料、临床资料及随访资料。
ADPKD患者与对照组患者的年龄、术前透析时间、手术时间和冷缺血时间差异均无统计学意义(P > 0.05)。术前ADPKD组肾切除率为25%(17/68),对照组为3%(2/68)。ADPKD患者合并肝脏囊肿比例是72%(49/68),联合肝肾移植的比例是4%(3/68)。对照组终末期肾病的病因包括慢性肾小球肾炎(30/68)、高血压肾病(13/68)、IgA肾病(10/68)、糖尿病肾病(10/68)和不明病因(5/68)。
1.2 术后免疫抑制方案患者术中静滴甲基强的松龙1 g,术后第1~3天分别静滴甲基强的松龙0.5、0.25、0.25 g,同时术后静滴兔抗人胸腺细胞免疫球蛋白,即ATG(0.1 g/d,3~5 d)。术后给予钙调磷酸酶抑制剂(CNI)类药物为主的三联免疫抑制方案:他克莫司+霉酚酸酯或麦考酚钠肠溶片+强的松)。记录每例患者术后1、2~3、4~6、7~9、10~12月内不同时间段的免疫抑制剂浓度均值。
1.3 诊断标准常染色体显性遗传性多囊肾:年龄15~29岁,双侧至少存在3个囊肿;年龄30~39岁,双侧至少存在3个囊肿;40~59岁,每个肾脏至少存在2个囊肿,有阳性家族史,伴有肾功能不全[5]。
急性排斥反应:典型临床表现有尿量明显减少、体温升高、血压升高、移植肾区胀痛;辅助检查中72 h内血肌酐升高20%;移植肾区彩超提示移植肾动脉阻力指数升高;移植肾穿刺活检病理符合Banff标准[6]。
泌尿道感染:患者出现尿频、尿急、尿痛等尿路刺激症状;尿白细胞 > 5/高倍镜视野,血常规白细胞增多、中性粒细胞比例增多;尿细菌培养菌落计数 > 105/mL。
移植失败:以重新透析或切除移植肾为标准,因患者死亡造成的移植肾丢失也被认为是移植失败。
1.4 统计分析采用SPSS 22.0软件,符合正态分布计量资料用均数±标准差表示;非正态分布的计量资料以中位数(最小值-最大值)表示;计数资料以率表示;正态分布独立样本间比较用两独立样本t检验,非正态分布独立样本间比较用Mann-Whitney U检验;采用Kaplan-Meier法描绘生存曲线,Log-rank检验生存率差异;以P < 0.05为差异有统计学意义。
2 结果 2.1 术后并发症与移植受者、移植肾存活率ADPKD组与对照组的术后急性排斥反应发生率、肺部感染发生率、胃肠道反应包括恶心、呕吐、腹泻、胀气等发生率、心血管事件包括冠状动脉粥样硬化、动静脉血栓、心肌梗死以及心衰等发生率以及肿瘤发生率差异均无统计学意义(表 1)。ADPKD组术后有1例患者发生了宫颈癌,1例发生直肠癌;对照组术后有3例出现肿瘤,分别是前列腺癌、甲状腺肿瘤和结直肠癌。ADPKD组术后泌尿道感染发生率高于同期对照组(P < 0.05),UTI组与非UTI组的年龄、性别和肾切除率差异无统计学意义,4例双肾结石患者均发生在UTI组。
| 表 1 136例肾移植受者基本资料 Tab.1 Clinical characteristics of 136 kidney transplant recipients |
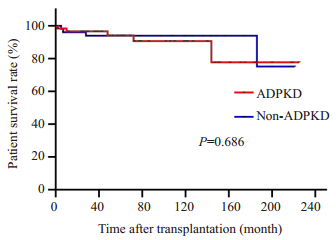
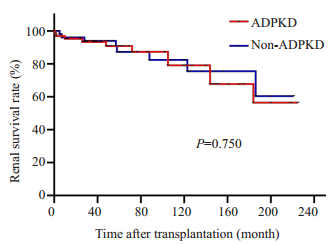
ADPKD组和对照组的术后中位随访时间分别是74.2(0.2~225.0)月和60.7(0.5~221.0)月。ADPKD组1、5、10年移植受者存活率为96.6%、94.1%、90.6%,肾脏存活率是95.2%、90.8%、79.0%;对照组1、5、10年移植受者存活率是96.0%、93.9%、93.9%,肾脏存活率是96.0%、87.2%、82.3%;两组的人、肾存活率相比较差异无统计学意义(图 1、2)。
|
图 1 ADPKD组与对照组移植受者存活率比较 Fig.1 Survival rate of transplant recipients in ADPKD group and control group. |
|
图 2 ADPKD组与对照组肾移植后肾脏存活率比较 Fig.2 Renal graft survival rate in ADPKD group and control group. |
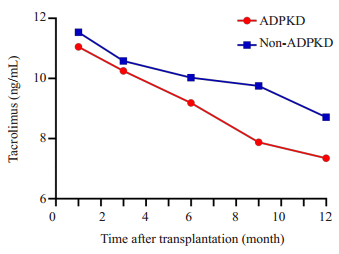
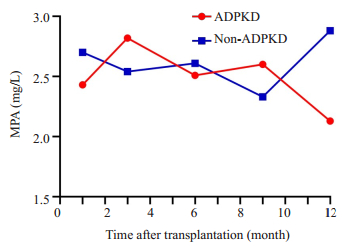
记录ADPKD和对照患者肾移植术后1月、2~3、4~ 6、7~9和10~12月5个时间段内免疫抑制剂他克莫司和MPA血药谷浓度均值。对照组他克莫司不同时期浓度均值均高于ADPKD组(图 3),而MPA则处于波动状态(图 4)。肾移植10月之后ADPKD组的他克莫司和MPA血药浓度水平都要低于对照组,差异具有统计学意义(P=0.037,0.022,图 5),其余时间段血药浓度水平差异无统计学意义(P > 0.05)。
|
图 3 术后1、2~3、4~6、7~9、10~12月内ADPKD组与对照组他克莫司血药谷浓度变化 Fig.3 Changes of tacrolimus plasma concentration in ADPKD group and non-ADPKD group at 1, 2-3, 4-6, 7-9, and 10-12 months after transplantation. |
|
图 4 术后1、2~3、4~6、7~9、10~12月内ADPKD组与对照组MPA血药谷浓度变化 Fig.4 Changes of MPA plasma concentration in ADPKD group and non-ADPKD group at 1, 2-3, 4-6, 7-9, and 10-12 months after transplantation. |
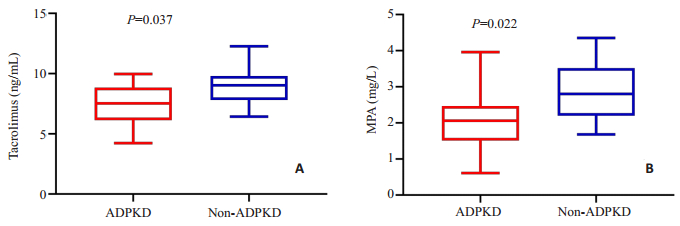
|
图 5 10~12月内ADPKD组与对照组免疫抑制剂血药谷浓度水平 Fig.5 Tacrolimus and MPA plasma concentrations in ADPKD group and non-ADPKD group at 10-12 months after the operation. A: Tacrolimus; B: MPA. |
术后不同时间段出现UTI的例数统计(图 6)。UTI组与非UTI组术后1年内的免疫抑制剂血药浓度分析发现,他克莫司浓度在两组之间差异无统计学意义(P > 0.05),非UTI组的MPA血药浓度在不同时间段均低于UTI组(P < 0.05),10月MPA血药谷浓度在两组之间差异有统计学意义(P < 0.05,图 7)。
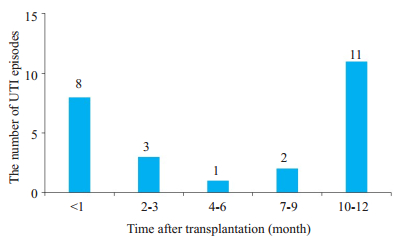
|
图 6 术后不同时间段ADPKD患者的UTI发生例数 Fig.6 Number of UTI episodes after transplantation in patients with ADPKD patients. |
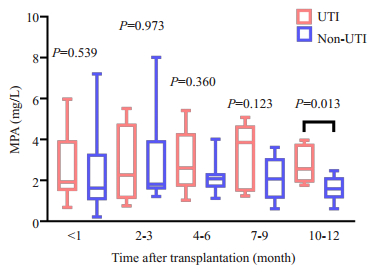
|
图 7 ADPKD患者中UTI组与非UTI组术后不同时间段MPA血药谷浓度变化 Fig.7 Changes of MPA plasma concentration in ADPKD patients with and without UTI after transplantation. |
研究表明ADPKD患者肾移植术后移植物存活率与对照组相似,而急性排斥反应在ADPKD患者中更为普遍,但差异并不总具有统计学意义[2]。肾移植受者肿瘤发生风险较一般人群高,本研究中ADPKD组术后发生的肿瘤为宫颈癌和直肠癌,对照组为前列腺癌、甲状腺肿瘤和结直肠癌。术后的感染在肾移植受者中非常常见,文献报道67.1%的肾移植患者至少有1次感染性并发症,UTI是最常见的感染,尤其是在ADPKD患者中[7-8]。本研究中ADPKD组UTI发生率为34%,高于对照组15%,差异具有统计学意义。原肾切除术常见的适应症是感染、血尿、囊性出血和恶性肿瘤,有研究显示约1/3的ADPKD受者在移植前进行了肾切除术[9],而本研究队列中移植前肾切除率是25%(17/68)。关于肾脏切除的时机,在反复的囊肿感染和出血,复杂性肾结石和疑似肾癌的情况下,应在肾移植之前切除ADPKD患者中一侧或两侧多囊肾[10]。但因患者肾功能不全,凝血功能欠佳,无论开放手术还是腹腔镜手术,风险均较大,切除多囊肾后出现的巨大的创面和创腔,在规律血液透析时会加重渗血,故在移植后或者肾移植手术同时切除单侧或双侧多囊肾通常更为稳妥,良好的肾功能和正常的凝血功能会使多囊肾切除术后创腔顺利愈合[11-12]。
哺乳动物雷帕霉素(mTOR)信号靶点在ADPKD囊肿发育中起到一定作用,而使用mTOR抑制剂可能可以减少ADPKD患者囊肿生长,有研究表明以mTOR抑制剂作为免疫抑制剂的ADPKD肾移植受者与接受钙调神经磷酸酶抑制剂者相比,肾囊肿和肝囊肿体积减少[10]。但目前依旧缺乏有效数据支持在具有ADPKD的移植受者中优先使用哺乳动物雷帕霉素抑制剂靶标作为免疫抑制剂[13]。目前采用的免疫抑制方案是以CNI类药物为主的三联免疫抑制方案,他克莫司作为CNI的一线药物,根据KIDGO指南,一般1月内浓度控制在10~15 ng/mL,2~3月为9~12 ng/mL,4~6月为7~ 10 ng/mL,6月以上为4~8 ng/mL。既往研究表明,移植后早期MPA水平为1.60 mg/L是区分急性排斥反应的最佳截点,2.75 mg/L是区分药物毒副反应发生的临界值[14-15]。但是实体器官移植后免疫抑制疗法和初始方案的确定应该根据个体患者的免疫风险状态而制定,相关危险因素有年龄、种族、输血致敏史以及既往移植物因免疫排斥丢失等。在明确患者免疫状态后,结合患者免疫抑制剂浓度监测及感染相关风险因素,及时调整免疫抑制剂方案,进行个体化治疗[4, 16]。
本研究显示,10~12月ADPKD患者的他克莫司和MPA血药浓度低于对照组肾移植患者,而急性排斥反应发生率无显著差异,这可能与ADPKD疾病本身对机体免疫环境造成的影响有关。研究表明ADPKD患者肾脏内T细胞分布的正常极性被打破,即皮质低T细胞分布和髓质高T细胞分布,但肾脏间质募集的T细胞并不能完全能够消除囊肿生长,因为同时还激活了免疫抑制途径[17-18]。CNIs类药物作用机制则是阻断细胞因子如IL-2的产生并抑制T细胞活化和增殖[19]。虽然前期他克莫司和MPA血药浓度在两组之间不存在显著性差异,原因可能是术后一段时间需要维持较高浓度免疫抑制剂避免急性排斥反应的发生,后期根据患者自身免疫状态调整了免疫抑制剂的剂量,因此ADPKD患者较对照组的他克莫司和MPA血药浓度更低。此外,在ADPKD晚期巨噬细胞大量浸润,囊壁上皮细胞建立的微环境诱导巨噬细胞分泌抗炎和免疫抑制因子,从而可能造成免疫抑制的微环境[20-21]。此外还有研究显示晚期肾脏囊肿大多起源于集合管系统,囊肿的形成破坏了集合管α-插入细胞(α-IC),而α-IC作为先天性免疫反应的屏障,可以调节尿液pH,在抵抗UTI中发挥着重要作用[22]。但多囊肾的免疫微环境对肾移植受者免疫状态的影响还有待进一步研究。当免疫抑制剂用量不足的时候,会增加排斥反应的发生率;而过度使用免疫抑制剂,又会增加患者的药物毒性反应、各系统感染和肿瘤的发生率,因此对于患者的个体化用药是提高移植成功率的关键。
UTI在ADPKD中更为常见,而肾移植发生感染的风险更高,可能的原因是患者的集合管系统经常被增大的囊肿压迫阻塞,这影响到微生物的有效清除并促进细菌生长。UTI通常由来自膀胱的革兰氏阴性杆菌引发,其他影响因素包括肾脏结石与输尿管返流等。ADPKD上尿道感染最常见的原因是急性肾盂肾炎和囊肿感染,在这两种情况下,患者会出现发热与肾区的疼痛。在怀疑有UTI时,根据病史和体格检查,结合血尿培养和药敏试验可以验证诊断开展治疗。对于因急性肾盂肾炎和囊肿感染引起如腰痛、高热、呕吐和恶心等全身症状患者,建议静脉注射喹诺酮类抗生素进行治疗[22]。与此同时,一个日益严重的问题是细菌耐药性的发展,因此预防ADPKD患者UTI的发生显得尤其重要。
尿量增加可能对预防ADPKD患者尿路感染有一定预防作用,这可能与液体对泌尿道的“冲刷”作用有关,而ADPKD患者肾移植受者每日喝大量的水是否可以减少UTI的发生还缺乏有效数据支持[23]。已经通过三期临床试验用于治疗ADPKD的血管加压素V2受体拮抗剂托伐普坦可以明显延缓肾脏体积增大以及肾功能恶化,这些也有利于预防UTI的发生[24]。
既往研究表明MPA的剂量与急性排斥反应和其他术后并发症之间存在相关性,且MPA在人体内的代谢需要经历肠-肝循环,这种循环易导致胃肠道的不耐受,而急性肾盂肾炎等上尿路感染以及肾脏囊肿感染多为血行感染,细菌来源可能是肠道的微生物;同时MPA浓度的增加也会降低机体自身的免疫力,因此MPA与ADPKD肾移植术后的泌尿道感染以及囊肿感染存在一定的联系[19, 25]。本研究发现,9月后UTI组较非UTI组MPA浓度存在显著差异,但是对于急性排斥反应与MPA浓度的关系以及泌尿系感染与MPA浓度的关系尚未有明确结论。既往文献表明在肾移植术后为预防急性排斥反应,尽量减少毒副事件的发生,MPA合适的治疗窗浓度在1.60~2.75 mg/L之间[15],而对于ADPKD患者术后免疫抑制剂浓度的合适的治疗窗还需要更多大样本、多中心的研究。
综上所述,本研究认为ADPKD患者移植术后长期维持需要的免疫抑制浓度可能要低于其他肾移植患者,应结合相关免疫抑制剂理想的治疗窗浓度,并对移植受者进行规律监测,以实现用药剂量个体化,减少各类感染事件的发生。
| [1] |
Bergmann C. ARPKD and early manifestations of ADPKD: the original polycystic kidney disease and phenocopies[J]. Pediatr Nephrol, 2015, 30(1): 15-30. DOI:10.1007/s00467-013-2706-2 |
| [2] |
Illesy L, Kovacs DA, Szabo RP, et al. Autosomal dominant polycystic kidney disease transplant recipients after kidney transplantation: a single-center experience[J]. Transplant Proc, 2017, 49(7): 1522-5. DOI:10.1016/j.transproceed.2017.06.014 |
| [3] |
Tandogdu Z, Cai T, Koves B, et al. Urinary tract infections in immunocompromised patients with diabetes, chronic kidney disease, and kidney transplant[J]. Eur Urol Focus, 2016, 2(4): 394-9. DOI:10.1016/j.euf.2016.08.006 |
| [4] |
Pratschke J, Dragun D, Hauser IA, et al. Immunological risk assessment: the key to individualized immunosuppression after kidney transplantation[J]. Transplant Rev (Orlando), 2016, 30(2): 77-84. DOI:10.1016/j.trre.2016.02.002 |
| [5] |
Chapman AB, Devuyst O, Eckardt KU, et al. Autosomal-dominant polycystic kidney disease (ADPKD): executive summary from a kidney disease: improving global outcomes (KDIGO) controversies conference[J]. Kidney Int, 2015, 88(1): 17-27. DOI:10.1038/ki.2015.59 |
| [6] |
Fu Q, Zhang H, Nie W, et al. Risk factors for acute rejection after deceased donor kidney transplantation in China[J]. Transplant Proc, 2018, 50(8): 2465-8. DOI:10.1016/j.transproceed.2018.03.063 |
| [7] |
Cornec GE, Alam A, Perrone RD. Autosomal dominant polycystic kidney disease[J]. Lancet, 2019, 393(10174): 919-35. DOI:10.1016/S0140-6736(18)32782-X |
| [8] |
Illesy L, Szabo-Pap M, Toth F, et al. Bacterial infections after kidney transplantation: a single-center experience[J]. Transplant Proc, 2016, 48(7): 2540-3. DOI:10.1016/j.transproceed.2016.07.011 |
| [9] |
Jacquet A, Pallet N, Kessler M, et al. Outcomes of renal transplantation in patients with autosomal dominant polycystic kidney disease: a nationwide longitudinal study[J]. Transpl Int, 2011, 24(6): 582-7. DOI:10.1111/j.1432-2277.2011.01237.x |
| [10] |
Kanaan N, Devuyst O, Pirson Y. Renal transplantation in autosomal dominant polycystic kidney disease[J]. Nat Rev Nephrol, 2014, 10(8): 455-65. DOI:10.1038/nrneph.2014.104 |
| [11] |
Asimakopoulos AD, Gaston R, Miano R, et al. Laparoscopic pretransplant nephrectomy with morcellation in autosomic-dominant polycystic kidney disease patients with end-stage renal disease[J]. Surg Endosc, 2015, 29(1): 236-44. |
| [12] |
Jean RA, Alexandre M, Yoo PS. Kidney Transplantation With and Without Native Nephrectomy for Polycystic Kidney Disease: Results of the National Inpatient Sample and the Rationale for a 2-Staged Procedure[J]. J Am Coll Surg, 2018, 226(6): 1079-84. DOI:10.1016/j.jamcollsurg.2017.11.021 |
| [13] |
Ma M, Yung S, Chan TM. mTOR Inhibition and Kidney Diseases[J]. Transplantation, 2018, 102(2S Suppl 1): S32-S40. |
| [14] |
Sara T. KDIGO clinical practice guideline for the care of kidney transplant recipients[J]. Am J Transplant, 2009, 9(3): S1-5. |
| [15] |
Borrows R, Chusney G, Loucaidou M, et al. Mycophenolic acid 12-h trough level monitoring in renal transplantation: association with acute rejection and toxicity[J]. Am J Transplant, 2006, 6(1): 121-8. |
| [16] |
Lebranchu Y, Baan C, Biancone L, et al. Pretransplant identification of acute rejection risk following kidney transplantation[J]. Transpl Int, 2014, 27(2): 129-38. DOI:10.1111/tri.12205 |
| [17] |
Zimmerman KA, Gonzalez NM, Chumley P, et al. Urinary T cells correlate with rate of renal function loss in autosomal dominant polycystic kidney disease[J]. Physiol Rep, 2019, 7(1): e13951-62. |
| [18] |
Kleczko EK, Marsh KH, Tyler LC, et al. CD8(+) T cells modulate autosomal dominant polycystic kidney disease progression[J]. Kidney Int, 2018, 94(6): 1127-40. DOI:10.1016/j.kint.2018.06.025 |
| [19] |
Taylor AL, Watson CJ, Bradley JA. Immunosuppressive agents in solid organ transplantation: mechanisms of action and therapeutic efficacy[J]. Crit Rev Oncol Hematol, 2005, 56(1): 23-46. DOI:10.1016/j.critrevonc.2005.03.012 |
| [20] |
Peda JD, Salah SM, Wallace DP, et al. Autocrine IL-10 activation of the STAT3 pathway is required for pathological macrophage differentiation in polycystic kidney disease[J]. Dis Model Mech, 2016, 9(9): 1051-61. DOI:10.1242/dmm.024745 |
| [21] |
Yang Y, Chen M, Zhou J, et al. Interactions between Macrophages and Cyst- Lining Epithelial Cells Promote Kidney Cyst Growth in Pkd1-Deficient Mice[J]. J Am Soc Nephrol, 2018, 29(9): 2310-25. DOI:10.1681/ASN.2018010074 |
| [22] |
Gao C, Zhang L, Zhang Y, et al. Insights into cellular and molecular basis for urinary tract infection in autosomal-dominant polycystic kidney disease[J]. Am J Physiol Renal Physiol, 2017, 313(5): F1077-83. DOI:10.1152/ajprenal.00279.2017 |
| [23] |
Lotan Y, Daudon M, Bruyere F, et al. Impact of fluid intake in the prevention of urinary system diseases: a brief review[J]. Curr Opin Nephrol Hypertens, 2013, 22(Suppl 1): S1-10. |
| [24] |
Casteleijn NF, Blais JD, Chapman A, et al. Tolvaptan and kidney pain in patients with autosomal dominant polycystic kidney disease: secondary analysis from a randomized controlled trial[J]. Am J Kidney Dis, 2017, 69(2): 210-9. DOI:10.1053/j.ajkd.2016.08.028 |
| [25] |
Suwabe T, Araoka H, Ubara Y, et al. Cyst infection in autosomal dominant polycystic kidney disease: causative microorganisms and susceptibility to lipid-soluble antibiotics[J]. Eur J Clin Microbiol Infect Dis, 2015, 34(7): 1369-79. DOI:10.1007/s10096-015-2361-6 |
 2020, Vol. 40
2020, Vol. 40

