2. 广州医科大学 附属第五医院检验科, 广东 广州 510700;
3. 昆明市儿童医院 云南省儿科研究所//昆明市儿童感染与免疫重点实验室, 云南 昆明 650228;
4. 南加州大学洛杉矶儿童医院, 美国 洛杉矶 90027
2. Clinical Laboratory, Fifth Affiliated Hospital of Guangzhou Medical University, Guangzhou 510700, China;
3. Kunming Key Laboratory of Children Infection and Immunity, Yunnan Institute of Pediatrics, Kunming Children's Hospital, Kunming 650228, China;
4. Saban Research Institute, Children's Hospital Los Angeles, University of Southern California, Los Angeles 90027, USA
人类免疫缺陷病毒1型(HIV-1)可入侵中枢神经系统, 引起HIV-1相关神经认知紊乱(HAND)[1-2]。目前治疗HIV-1感染最有效的方法是高效联合抗逆转录病毒疗法(HAART), 但是HAART并无明显的神经保护作用, HAND继而成为现阶段严重影响HIV患者生活质量的并发症。目前研究认为, HAND将在全球范围内成为40岁左右人群痴呆的主要原因, 并成为艾滋病者一个重要的独立死亡因素[3-4]。近年来, 我国HIV-1感染病例报告数迅速上升, 截至2017年底, 报告现存活感染者75.48万[5]。据调查, 目前我国HIV-1感染者中HAND的患病率约为37%, 由于HAART能延长HIV-1感染者生存期, HAND患病率还将继续上升[6]。因此, 亟待阐明HAND的发病机制并开发有效治疗药物。
研究表明, HIV-1的包膜蛋白gp120具有显著的神经毒性, 是引起神经认知紊乱的主要毒力因子[7-11], 其神经毒性作用与其诱发的神经炎症反应密切相关。然而, gp120引发神经炎症的机制目前并不清楚。波形蛋白(VIM)是Ⅲ型中间丝蛋白, 是近几年发现的一种新的神经炎症调节因子, 参与了多种神经认知紊乱疾病的发生和发展过程[12-15]。在临床研究中发现, HAND病人脑组织中VIM的表达水平显著高于HIV-1阳性但未并发HAND的病人[16]。此外, Thomas等[17]研究发现gp120可以通过其第三可变区(V3 loop)与VIM结合, 而V3 loop正是gp120诱导产生神经炎症的主要结构域, 但VIM是否参与gp120引发的神经炎症和神经认知紊乱目前并没有报道。本研究的目的是构建既敲除VIM又过表达gp120的新型小鼠模型, 为深入研究VIM在gp120所致神经炎症和神经认知紊乱中的作用和机制提供动物模型。
1 材料和方法 1.1 实验小鼠及其饲养环境本研究所用gp120转基因(gp120 Tg)小鼠及其对照野生型小鼠(WT)的来源如以前所述[10, 18], gp120 Tg小鼠以GFAP为启动子, 在中枢神经系统过表达可溶性gp120 LAV亚型。VIM基因敲除小鼠(VIM-/-)及其对照野生型(VIM+/+)小鼠由威斯康星大学Albee Messing博士馈赠;该基因敲除小鼠模型最初来源于巴斯德研究所Charles Babinet教授[19-20]。以上小鼠饲养于SPF级的洁净环境中, 室温控制为18~22 ℃, 湿度控制在50%~ 70%, 噪音小于60 dB, 自动光控(12 h明/12 h暗)。鼠笼盒、垫料及饲料均经过灭菌, 饮水经过高温高压灭菌处理。饲养室每日经紫外灯照射消毒, 确保各项饲养指标符合SPF级动物环境及设施要求。饲养过程中, 饲料、水及时补充, 垫料每3 d更换1次。
1.2 仪器及试剂超微量紫外可见分光光度计DS-11 (美国丹诺尔Denovix);PCR仪(广州博乐生物技术有限公司、上海安捷伦科技有限公司);琼脂糖凝胶电泳仪(北京六一仪器厂);Tanon-1600凝胶成像仪(上海天能科技有限公司);蛋白质电泳及电转装置(美国伯乐生命医学产品有限公司)。独立送回风净化设备购于苏杭实验动物设备厂;DNA扩增的rTaq酶购于宝生物公司;PCR引物由上海生工有限公司合成。兔抗VIM单克隆抗体, 兔抗β-actin和大鼠抗gp120抗体购买于Abcam。
1.3 小鼠的基因型鉴定 1.3.1 鼠尾DNA提取用酚/氯仿法提取鼠尾DNA, 剪取约0.5 cm的鼠尾到一个已编号的EP管中, 加入500 μL消化缓冲液, 再加入500 μL蛋白酶K, 将EP管放入55 ℃的水浴中, 消化过夜(12~16 h)。后将消化好的鼠尾组织摇匀, 每管加入500 mL酚/氯仿, 混匀, 12 000 r/min离心10 min。转移400 μL上清至新标记好的1.5 mL的EP管内。加入800 μL无水乙醇, 颠倒混匀, 12 000 r/min离心5 min。弃去上清, 加入800 μL 70%的乙醇, 12 000 r/min, 离心5 min, 弃上清, 空气干燥30 min。每管加入200 μL的TE缓冲液, 于37 ℃水浴助溶1 h。DNA样品放置于4 ℃冰箱备用。
1.3.2 PCR步骤Gp120转基因小鼠基因型鉴定引物序列:
Gp120 F:GCGGGAGAATGATAATGGAG
Gp120 R:TATGGGAATTGGCTCAAAGG
VIM基因敲除小鼠基因型鉴定引物序列:
VIM 1:TGTCCTCGTCCTCCTACCGC
VIM 2:AGCTGCTCGAGCTCAGCCAGC
VIM 3:CTGTTCGCCAGGCTCAAGGC
扩增反应总体积为20 μL, 其中, 2×Taq MIX缓冲液10 μL、无RNA酶水2 μL、DNA模板2 μL、每种引物各2 μL。Gp120反应条件:94 ℃ 3 min, 94 ℃ 30 s, 53 ℃ 30 s, 72 ℃ 30 s, 重复后3个步骤35次, 72 ℃ 10 min, 12 ℃维持。Vim反应条件:94 ℃ 3 min, 94 ℃ 30 s, 68 ℃ 30 s, 72 ℃ 45 s, 重复后3个步骤35次, 72 ℃ 10 min, 12 ℃维持。
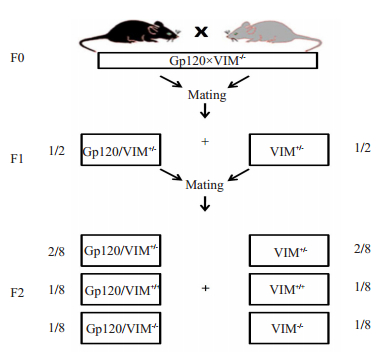
1.3.3 琼脂糖凝胶电泳PCR扩增产物经1.5%的琼脂糖凝胶电泳, 结果判定:出现约200 bp条带的为gp120转基因小鼠, 无条带的为野生型小鼠。VIM基因敲除结果判定:出现1条约530 bp条带为VIM-/-, 一条约398 bp为VIM+/+, 同时出现以上两条条带为杂合子VIM+/-。分别取2只雌性gp120转基因小鼠和1只雄性VIM-/-小鼠杂交, 得到F1代基因型为VIM+/-/gp120Tg和VIM+/-两种(图 1)。分别取这两种基因型小鼠一公和一母杂交, 得到F2代基因型为VIM+/+、VIM+/-、VIM-/-和VIM+/+/ gp120Tg、VIM+/-/gp120Tg、VIM-/-/gp120Tg。其中VIM+/+、VIM-/-、VIM+/+/gp120Tg和VIM-/-/gp120Tg四种小鼠互为对照, 用于研究VIM敲除对gp120转基因小鼠中枢神经系统损伤和神经认知障碍的影响, 杂交流程如下:
|
图 1 VIM敲除gp120转基因小鼠杂交流程 Fig.1 Establishment of the vimentin knockout and HIV-1 gp120 transgenic mouse model. |
小鼠经戊巴比妥麻醉, 开颅取得脑组织, 常规分子生物学方法提取脑组织蛋白, 用BCA法测定蛋白质浓度。行SDS-PAGE分离蛋白样品, 转移至PVDF膜, 5%脱脂奶粉封闭。分别加入VIM (Abcam)、gp120 (Abcam)、Iba-1 (Proteintech)和GFAP (Proteintech)抗体, 4 ℃过夜孵育, 加入抗对应种属的HRP二抗, 室温孵育1 h。TBST洗膜3次, 利用ECL化学发光液(Bio-Rad)检测蛋白条带。各组蛋白均以β-actin作为内参校正。
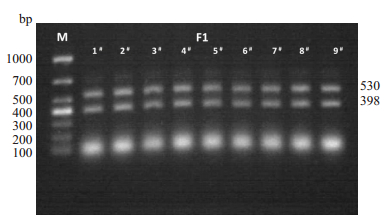
2 结果 2.1 F1基因型鉴定F0在自然交配下共生产子鼠F1代共9只, 编号为F1-1#-F1-9#, 对F1进行相应的基因型测定, VIM基因型检测结果如图 2所示:
|
图 2 F1小鼠VIM基因型鉴定 Fig.2 Genotyping of VIM in F1 mice by PCR. |
鉴定结果显示, F1-1#-9#子代全部为398 bp和530 bp双条带, 即F1全部为VIM的杂合子基因型鼠(VIM-/-)。
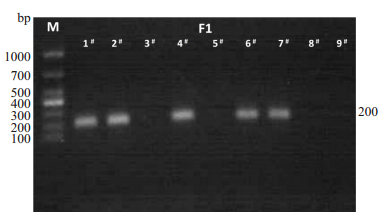
对F1子代的进gp120进行基因测定, 检测结果如下图 3所示:
|
图 3 F1小鼠gp120基因型鉴定 Fig.3 Genotyping of gp120 in F1 mice by PCR. |
鉴定结果显示, F1-1#-9#子代中, F1-3#、F1-5#、F1-8#、F1-9#小鼠未显示200 bp条带, 即F1-3#、F1-5#、F1-8#、F1-9#小鼠不表达gp120, 而其余出现200 bp的小鼠为gp120 Tg小鼠。综合图 2与图 3的鉴定结果, 本实验采取F1-2#小鼠(基因型为VIM+/-/gp120Tg)和F1-5#小鼠(基因型为VIM+/-/gp120 Tg)杂交, 进行繁育培养, 获取F2。
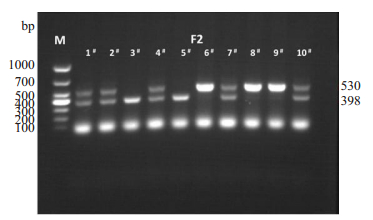
2.2 F2基因型鉴定F1中2#小鼠与5#小鼠自由交配后, 共生产F2代小鼠10只, 编号为F2-1#- F2-10#, 对F2进行相应基因型鉴定, 其中VIM基因型检测结果如下图 4所示:
|
图 4 F2小鼠VIM基因型鉴定. Fig.4 Genotyping VIM in F2 mice by PCR. |
从鉴定结果可知, F2-1#、F2-2#、F2-4#、F2-7#、F2-10#均显示398 bp和530 bp双条带, 即F2-1#、F2-2#、F2-4#、F2-7#、F2-10#小鼠均为VIM+/-杂合子小鼠;F2-3#、F2-5#仅显示398 bp条带, 表示F2-3#、F2-5#基因型为VIM+/+的野生型小鼠;F2-6#、F2-8#、F2-9#仅显示530 bp, 表示F2-6#、F2-8#、F2-9#基因型为VIM-/-基因敲除纯合子小鼠。
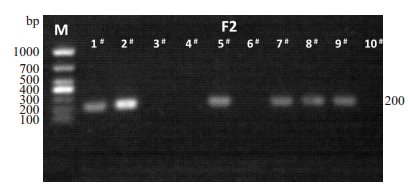
对F2中1#-10#小鼠gp120基因型的鉴定结果如图 5所示:
|
图 5 F2小鼠gp120基因型鉴定. Fig.5 Genotyping of gp120 in F2 mice by PCR. |
从鉴定结果可知, F2-1#、F2-2#、F2-5#、F2-7#、F2-8#、F2-9#小鼠均存在200 bp条带, 提示F2-1#、F2-2#、F2-5#、F2-7#、F2-8#、F2-9#是基因型为gp120Tg小鼠, F2-3#、F2- 4#、F2-6#、F2-10#未显示200 bp条带, 提示F2-3#、F2-4#、F2-6#、F2-10#是野生型小鼠。
综合图 4、图 5鉴定结果, 编号为F2-3#小鼠基因型为VIM+/+;F2-6#小鼠基因型为VIM-/-;F2-5#小鼠基因型为VIM+/+/gp120 Tg;F2- 8#、F2- 9#小鼠基因型VIM-/-/ gp120 Tg, 其余小鼠基因型为VIM+/-/gp120 Tg。其中F2-8#、F2-9#小鼠表现为VIM敲除和gp120过表达。
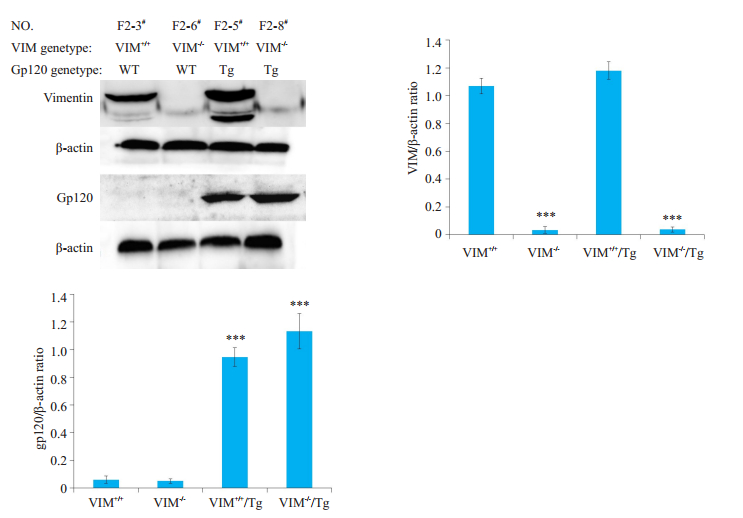
2.3 免疫印迹鉴定小鼠经0.5%戊巴比妥麻醉, 开颅取得脑组织, 常规分子生物学方法提取脑组织蛋白, 用BCA法测定蛋白质浓度。行SDS-PAGE分离蛋白样品, 转移至PVDF膜, 5%脱脂奶粉封闭。分别加入兔抗VIM (Abcam)和大鼠抗gp120 (Abcam)抗体进行免疫印迹检测。ECL化学发光液检测蛋白条带。结果显示, 在β-actin一致的情况下, F2-6#与F2-8#基因型为VIM-/-小鼠没有出现VIM对应的条带, 与基因型为VIM+/+的F2-3#与F2-5#小鼠对比明显, 敲除基因型在三代小鼠中保留完好。
Gp120的免疫印迹结果显示(图 6), 在β-actin一致的情况下, F2-3#与F2-6#基因型小鼠未观察到相应的gp120条带, 与F2-5#与F2-8#小鼠对比明显, 证明gp120基因在三代小鼠中保持稳定遗传。通过免疫印迹验证, 可确定经过三代小鼠筛选交配, 从gp120 Tg与VIM-/-的亲代小鼠杂交中, 获得目的基因型为VIM-/-/gp120 Tg的小鼠F2-8#与F2-9#。
|
图 6 指定小鼠vimentin的免疫印迹检测和半定量分析 Fig.6 Expression of VIM and gp120 detected using immunoblotting. ***P < 0.001 group VIM+/+/Tg vs VIM+/+; group VIM-/-/Tg vs VIM-/-. |
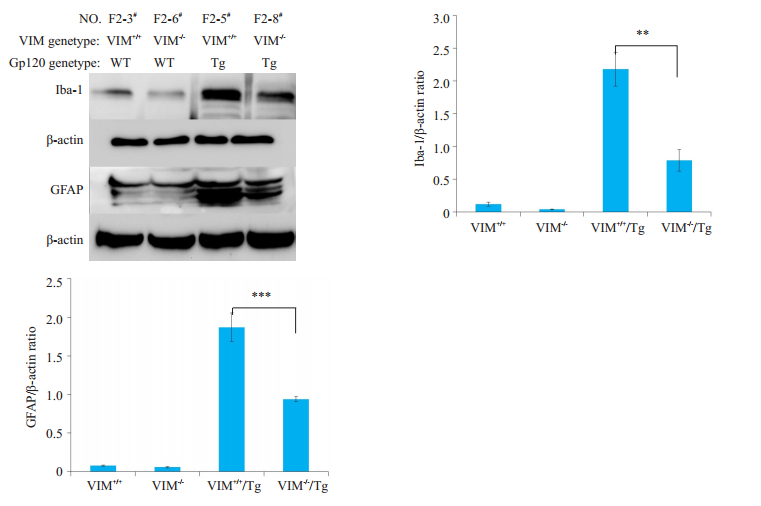
小胶质细胞和星形胶质细胞激活是中枢神经系统炎症反应的关键事件, 我们进一步通过免疫印迹检测了Iba-1 (小胶质细胞激活标记物)和GFAP (星形胶质细胞激活标记物)在四种小鼠中的表达情况。实验结果显示, 在β-actin一致的情况下, F2-5#基因型小鼠Iba-1和GFAP的表达水平均明显的高于F2-8(# P<0.01, 图 7)。蛋白条带的半定量统计学分析显示该表达差异具有统计学意义(P<60;0.01, 图 7)。
|
图 7 指定小鼠Iba-1和GFAP的免疫印迹检测和半定量分析 Fig.7 Expression of Iba-1 and GFAP detected using immunoblotting. **P < 0.01, ***P < 0.001. |
HAND是现阶段严重影响艾滋病患者生活质量的艾滋病并发症。研究表明, HIV-1包膜蛋白gp120诱导的神经炎症是引导HAND发生和发展的重要因素。因此, 寻找治疗HAND有效靶点的关键在于阐明gp120的神经炎症机制。然而, 尽管已有大量研究证实了gp120的神经毒性, 但其确切的机制仍未研究清楚。基于体外实验和体内实验(包括gp120转基因小鼠)的研究, 提出许多gp120的神经毒性机制, 如诱导钙稳态失调、神经兴奋性毒性、氧化应激、线粒体损伤和自噬等, 但是无一理论能准确解释gp120的神经毒性机制及其与HAND发生和发展的关系[21-25]。损伤神经元是gp120诱导认知行为障碍的关键, 目前的研究提出gp120有“直接损伤”和“间接损伤”两种损伤神经元的方式[21, 23]。直接损伤指gp120直接作用于神经元引起的损伤或死亡, 主要由神经元的表面受体CXCR4或CCR5介导;间接损伤指gp120作为外来刺激物引起神经系统免疫应答, 激活巨噬细胞/小胶质细胞, 诱导释放炎症因子和神经毒性物质如IL-1β、TNF-α、喹啉酸、自由基和兴奋性氨基酸等, 间接损伤神经元。尽管这两种作用方式并不完全孤立, 但是诱导炎症反应更可能是gp120发挥神经毒性的关键, 其理由有:(1)尽管gp120可直接损伤神经元, 但是研究发现在神经元/胶质细胞混合培养下, gp120神经毒性要显著强于神经元单独培养[26-27];(2)神经元不表达CD4, gp120主要是通过辅受体CXCR4介导神经元损伤, 但是从HAND病人中枢神经系统分离到的HIV病毒株大多数是CCR5嗜性而非CXCR4[3, 28-29];(3)尸检发现HAND病人受损神经元的周围存在大范围的神经胶质细胞激活, 同时伴有单核细胞浸润、外周血管炎症和高水平的促炎因子表达[10-11]。由此可见, 介导炎症反应是gp120引发行为认知缺陷的关键, 从诱发神经炎症的角度来解释gp120的神经毒性机制是HAND发病机制研究的一个新途径。抑制gp120诱导的炎症反应成为预防和治疗HAND的一个重要方向, 但迄今尚未发现有效靶点。
神经炎症是以小胶质细胞活化为特征的炎症反应, 活化的小胶质细胞参与中枢神经系统免疫应答, 表现为吞噬、抗原递呈和释放炎性因子等作用, 维持着中枢神经系统稳态。但是, 研究发现小胶质细胞激活在老年痴呆、帕金森病、多发性硬化症等神经退行性病变发生和发展中也起着关键作用[30]。VIM是Ⅲ型中间丝蛋白, 主要表达于中胚层起源的间充质细胞, 是近几年发现的一种新的炎症调节因子, 参与了多种炎性疾病的发生和发展过程。研究表明, VIM可参与调节NF-κB信号通路和炎症小体的活化, 此两者均是固有免疫系统的重要组成[20, 31];可溶性VIM还可分泌至胞外, 以危险相关模式分子的形式被模式识别受体所识别, 介导下游的免疫反应[32]。VIM在胶质细胞和神经元中均有高表达, 预示该蛋白可能在中枢神经系统功能中起很重要的作用。研究发现VIM与多种应激状态下胶质细胞的活化和中枢神经炎症相关, 如缺血性脑病、压迫性脑损伤和氧化应激等, 用化学抑制剂或基因敲除方法阻断VIM的功能或表达可有效抑制这些应激引起的胶质细胞活化及神经损伤[32-34], 表明VIM可能起着调控中枢神经炎症的重要作用。此外, 在临床研究中发现, HAND病人脑组织中VIM的表达水平显著高于HIV-1阳性但未并发HAND的病人[16], 该结果提示VIM可能与HAND的发生相关。鉴于gp120在HAND发病中的重要作用, 我们推测VIM可能参与了gp120介导的中枢神经炎症反应。在本研究中, 通过利用VIM敲除小鼠和gp120转基因小鼠杂交, 我们首次成功构建了既敲除VIM又过表达gp120的新型动物模型。这一模型的建立为研究VIM在gp120介导神经炎症和中枢神经毒性中的作用和分子机制提供了坚实的实验基础。
在以前的研究中, Maung R等认为gp120的辅受体CCR5可能在其引发神经炎症中起着关键作用[35-36]。但是, 后续研究发现敲除CCR5只能在一定程度上抑制星形胶质细胞激活, 并没有阻断促炎介质的主要来源细胞-小胶质细胞的激活[35-36]。这一研究结果说明, CCR5并不是调控gp120相关神经炎症反应的重要蛋白。在本研究中, 我们发现, 敲除VIM可同时阻断gp120转基因小鼠脑组织中小胶质细胞和星形胶质细胞的激活, 提示VIM可能才是调节gp120引发神经炎症反应的关键蛋白。综上所述, 本研究成功构建了VIM基因敲除gp120转基因小鼠模型, 且初步证明敲除VIM可显著抑制gp120介导的神经炎症反应, 这一研究结果为阐明HAND的发病机制提供了新的思路, 也为寻找HAND的新型治疗靶点提供了坚实的实验基础。
| [1] |
Saylor D, Dickens AM, Sacktor N, et al. HIV-associated neurocognitive disorder-pathogenesis and prospects for treatment[J]. Nat Rev Neurol, 2016, 12(4): 234-48. DOI:10.1038/nrneurol.2016.27 |
| [2] |
Evering TH. Molecular signatures of HIV-1 envelope associated with HIV-Associated neurocognitive disorders[J]. Curr HIV/AIDS Rep, 2018, 15(1): 72-83. DOI:10.1007/s11904-018-0374-3 |
| [3] |
Kaul M, Zheng J, Okamoto S, et al. HIV-1 infection and AIDS: Consequences for the central nervous system[J]. Cell Death Differ, 2005(6): 878-92. |
| [4] |
Stoff DM, Goodkin K, Jeste D, et al. Redefining aging in HIV infection using phenotypes[J]. Curr HIV/AIDS Rep, 2017, 14(5): 184-99. DOI:10.1007/s11904-017-0364-x |
| [5] |
中国疾病预防控制中心.性病艾滋病预防控制中心. 2017年11月全国艾滋病性病疫情[J].中国艾滋病性病, 2018, 24(1): 1-1.
|
| [6] |
宋凤丽, 张玉林, 乔录新, 等. 中国HIV-1感染人群神经认知损害初步筛查[J]. 首都医科大学学报, 2012, 33(5): 610-5. DOI:10.3969/j.issn.1006-7795.2012.05.011 |
| [7] |
Mocchetti I, Bachis A, Avdoshina V. Neurotoxicity of human immunodeficiency virus-1: viral proteins and axonal transport[J]. Neurotox Res, 2012, 21(1): 79-89. DOI:10.1007/s12640-011-9279-2 |
| [8] |
Brenneman DE, Westbrook GL, Fitzgerald SP, et al. Neuronal cell killing by the envelope protein of HIV and its prevention by vasoactive intestinal peptide[J]. Nature, 1988, 335(6191): 639-42. DOI:10.1038/335639a0 |
| [9] |
Glowa JR, Panlilio LV, Brenneman DE, et al. Learning impairment following intracerebral administration of the HIV envelope protein gp120 or a VIP antagonist[J]. Brain Res, 1992, 570(1/2): 49-53. |
| [10] |
Toggas SM, Masliah E, Rockenstein EM, et al. Central nervous system damage produced by expression of the HIV-1 coat protein gpl20 in transgenic mice[J]. Nature, 1994, 367(6459): 188-93. DOI:10.1038/367188a0 |
| [11] |
Thaney VE, Sanchez AB, Fields JA, et al. Transgenic mice expressing HIV-1 envelope protein gp120 in the brain as an animal model in neuroAIDS research[J]. J Neurovirol, 2017, 24(2): 156-167. |
| [12] |
Chi F BT, PSF act in concert to regulate IbeA+E. coli K1 induced activation and nuclear translocation of NF-κBin human brain endothelial cells[J]. PLoS One, 2012, 7(4): 0035862. DOI:10.1371/journal.pone.0035862 |
| [13] |
Tong J, Ang LC, Williams B, et al. Low levels of astroglial markers in Parkinson's disease: relationship to α-synuclein accumulation[J]. Neurobiol Dis, 2015, 82(2015): 243-53. |
| [14] |
Thiagarajan PS, Yakubenko VP, Elsori DH, et al. Vimentin is an endogenous ligand for the pattern recognition receptor Dectin-1[J]. Cardiovasc Res, 2013, 99(3): 494-504. DOI:10.1093/cvr/cvt117 |
| [15] |
Mathsson L, Mullazehi M, Wick MC, et al. Antibodies against citrullinated vimentin in rheumatoid arthritis: higher sensitivity and extended prognostic value concerning future radiographic progression as compared with antibodies against cyclic citrullinated peptides[J]. Arthritis Rheum, 2008, 58(1): 36-45. DOI:10.1002/art.23188 |
| [16] |
Tavazzi E, Morrison D, Sullivan P, et al. Brain inflammation is a common feature of HIV-infected patients without HIV encephalitis or productive brain infection[J]. Curr HIV Res, 2014, 12(2): 97-110. DOI:10.2174/1570162X12666140526114956 |
| [17] |
Thomas EK, Connelly RJ, Pennathur S, et al. Anti-idiotypic antibody to the V3 domain of gp120 binds to vimentin: a possible role of intermediate filaments in the early steps of HIV-1 infection cycle[J]. Viral Immunol, 1996, 9(2): 73-87. |
| [18] |
Xiaolong He, Weijun Yang, Zhijie Zeng, et al. NLRP3-dependent pyroptosis is required for HIV-1 gp120-induced neuropathology[J]. Cellular & molecular immunology, 2020, 17(3): 283-99. |
| [19] |
Colucci-Guyon E, Portier MM, Dunia I, et al. Mice lacking vimentin develop and reproduce without an obvious phenotype[J]. Cell, 1994, 79(4): 679-94. |
| [20] |
Huang SH, Chi F, Peng L, et al. A novel NF-κB regulator, is required for meningitic Escherichia coli K1-Induced pathogen invasion and PMN transmigration across the Blood-Brain barrier[J]. PLoS One, 2016, 11(9): e0162641. DOI:10.1371/journal.pone.0162641 |
| [21] |
Kaul M, Garden GA, Lipton SA. Pathways to neuronal injury and apoptosis in HIV-associated dementia[J]. Nature, 2001, 410(6831): 988-94. DOI:10.1038/35073667 |
| [22] |
Lipton SA, Rosenberg PA. Excitatory amino acids as a final common pathway for neurologic disorders[J]. N Engl J Med, 1994, 330(9): 613-22. DOI:10.1056/NEJM199403033300907 |
| [23] |
Zhou Y, Liu J, Xiong H. HIV-1 glycoprotein 120 enhancement of N-Methyl-D-Aspartate NMDA Receptor-Mediated excitatory postsynaptic currents:implications for HIV-1-Associated neural injury[J]. J Neuroimmune Pharmacol, 2017, 12(2): 314-26. DOI:10.1007/s11481-016-9719-0 |
| [24] |
Rozzi SJ, Avdoshina V, Fields JA, et al. Human immunomodulatory virus promotes mitochondrial toxicity[J]. Neurotox Res, 2017, 32(4): 723-33. DOI:10.1007/s12640-017-9776-z |
| [25] |
Fields JA, Overk C, Adame A, et al. Neuroprotective effects of the immunomodulatory drug FK506 in a model of HIV1-gp120 neurotoxicity[J]. J Neuroinflamm, 2016, 13(1): 120. DOI:10.1186/s12974-016-0585-8 |
| [26] |
Kaul M, Lipton SA. Chemokines and activated macrophages in HIV gp120-Induced neuronal apoptosis[J]. Proc Natl Acad Sci USA, 1999, 96(14): 8212-6. DOI:10.1073/pnas.96.14.8212 |
| [27] |
Garden GA, Guo W, Jayadev S, et al. HIV associated neurodegeneration requires p53 in neurons and microglia[J]. FASEB J, 2004, 18(10): 1141-3. DOI:10.1096/fj.04-1676fje |
| [28] |
Bachis A, Mocchetti I. The chemokine receptor CXCR4 and not the N-methyl-D-aspartate receptor mediates gp120 neurotoxicity in cerebellar granule cells[J]. J Neurosci Res, 2004, 75(1): 75-82. |
| [29] |
Chen NC, Partridge AT, Sell C, et al. Fate of microglia during HIV- 1 infection: From activation to senescence[J]. Glia, 2017, 65(3): 431-46. DOI:10.1002/glia.23081 |
| [30] |
Perry VH, Holmes C. Microglial priming in neurodegenerative disease[J]. Nat Rev Neurol, 2014, 10(4): 217-24. DOI:10.1038/nrneurol.2014.38 |
| [31] |
Santos GD, Rogel MR, Baker MA, et al. Vimentin regulates activation of the NLRP3 inflammasome[J]. Nature Communications, 2015, 6: 6574. DOI:10.1038/ncomms7574 |
| [32] |
Jiang SX, Slinn J, Aylsworth A, et al. Vimentin participates in microglia activation and neurotoxicity in cerebral ischemia[J]. J Neurochem, 2012, 122(4): 764-74. DOI:10.1111/j.1471-4159.2012.07823.x |
| [33] |
Xue P, Chen L, Lu X, et al. Vimentin promotes astrocyte activation after chronic constriction injury[J]. J MolNeurosci, 2017, 63(1): 91-9. |
| [34] |
Livne-Bar I, Lam S, Chan D, et al. Pharmacologic inhibition of reactive gliosis blocks TNF-α-mediated neuronal apoptosis[J]. Cell Death Dis, 2016, 7(9): e2386. DOI:10.1038/cddis.2016.277 |
| [35] |
Maung R, Hoefer MM, Sanchez AB, et al. CCR5 knockout prevents neuronal injury and behavioral impairment induced in a transgenic mouse model by a CXCR4-using HIV-1 glycoprotein 120[J]. J Immunol, 2014, 193(4): 1895-910. DOI:10.4049/jimmunol.1302915 |
| [36] |
Maung R, Medders KE, Sejbuk NE, et al. Genetic knockouts suggest a critical role for HIV co-receptors in models of HIV gp120- induced brain injury[J]. J Neuroimmune Pharm, 2012, 7(2): 306-18. DOI:10.1007/s11481-011-9328-x |
 2020, Vol. 40
2020, Vol. 40

