血管老化是全身衰老的基石,伴随分子和细胞功能紊乱的血管衰老被认为是心血管疾病的一个特殊危险因素,可导致动脉粥样硬化和高血压等[1-2]。报道指出近似85%的心血管疾病死亡患者发生于65岁或以上[3]。血管平滑肌细胞(VSMCs)是血管壁中的主要细胞,在维持血管结构和稳定血管功能中起着不可或缺的作用[2]。衰老时血管壁发生重构,这一过程中VSMCs的不正常迁移和侵袭可引起血管内膜弥漫性增厚,进一步促进心血管疾病的发生和发展[2, 4]。研究发现,干预衰老相关的VSMC迁移和侵袭可减少及延缓严重心血管疾病的发生和发展[4]。但目前研究仅能量限制具明确延缓衰老及抑制衰老相关的VSMCs迁移和侵袭作用[5-6]。寻求其他干预手段以抑制衰老相关的VSMCs迁移和侵袭,进而减少严重心血管疾病的发生率和死亡率具有重要的意义。
血管紧张素Ⅱ(Ang Ⅱ)信号在血管衰老相关的重构中起重要作用,可诱导动脉血管壁重构,包括内膜-中膜增厚、介导衰老相关的VSMCs迁移/侵袭能力等[7-8]。另外,衰老VSMCs分泌金属基质蛋白酶-2(MMP-2)活性增强,MMP-2能够在VSMC周围裂解细胞基底膜和弹性纤维,从而导致细胞外基质降解,使VSMC发生迁移、侵袭和扩散[9-10]。研究发现,激活的AngⅡ信号通过增加MMP-2的活性诱导VSMCs衰老,且增加VSMCs的迁移/侵袭能力[11-13]。AngⅡ水平的升高对血管重构的影响是衰老相关心血管疾病的重要表现,因此抑制Ang Ⅱ信号可能成为抑制衰老相关VSMCs迁移/侵袭的新手段。奥美沙坦酯(OMST)是AngⅡ受体拮抗剂,其抗血管重构作用已被证实,但目前无OMST对血管衰老及衰老相关VSMCs迁移/侵袭影响的研究。
小分子RNA中的微RNA (miRNAs)是目前在不同状态不同疾病中研究较多的非编码RNAs,研究发现miRNAs功能的改变(其表达上调或下调)通过调节关键分子通路影响衰老相关基因表达,与衰老引起的各种心血管疾病的发生与发展密切相关[14-15]。那么,通过基因芯片技术获得的特定的miRNA是否参与衰老相关的VSMC迁移和侵袭?本研究拟通过在VSMCs中改变特定的miRNA表达初步研究OMST对衰老相关的VSMCs迁移/侵袭的影响。
1 材料和方法 1.1 材料人主动脉血管平滑肌细胞(HA-VSMCs)(ATCC,美国)。F-12K培养基(ATCC)。博莱霉素(BLM)(美国Selleckchem),OMST (美国Selleckchem),衰老相关β半乳糖苷酶(SA-β-gal)染色液(C0602,碧云天生物科技),24孔板伤口愈合实验试剂盒(深圳欣博盛生物科技),BD基底胶(356234,北京索莱宝科技有限公司),10% Novex明胶酶谱实验预制胶(美国Invitrogen),Qiagen RNeasy mini试剂盒(上海宾智生物科技有限公司),Exiqon miRCURYTM LNA microRNA芯片(康成生物),GeneChip Scanner 3000扫描仪(美国Affymetrix)。
1.2 方法 1.2.1 细胞培养HA-VSMCs在含10%胎牛血清的F-12K培养基中培养。培养基中补充0.05 mg/mL抗坏血酸,0.01 mg/mL胰岛素,0.01 mg/mL转铁蛋白,10 ng/mL亚硒酸钠、0.03 mg/mL内皮细胞生长添加剂、10 mmol/L羟乙基哌嗪乙磺酸和10 mmol/L三(羟甲基) -甲基氨基-乙基磺酸。研究分为3组:BLM组:HA-VSMCs培养、传代(少于3~5代),用BLM (0.5 μg/mL)处理48 h,诱导衰老。OMST组:OMST (2 mmol/L)在BLM干预前预处理2 h。未干预的为对照组。培养基每2 d更换1次。
1.2.2 SA-β-gal染色SA-β-gal是鉴定衰老细胞的生物学标志物。HA-VSMCs接种于6孔板中,待细胞生长至50%时,用PBS清洗两次后,4%多聚甲醛固定5 min,然后用SA-β-gal染色液染色。随机选取4个视野在显微镜下观察并计数胞浆内有蓝染物质的细胞(SA-β-gal阳性细胞)的百分数,判断细胞哀老的情况。
1.2.3 伤口愈合/细胞划痕实验3~5代2×104经各种干预措施处理的HA-VSMCs接种于预先放置好用于产生伤口gap插槽的24孔培养板中,细胞生长至100%融合形成单层后移动插槽,从而形成1个均一的0.9 mm伤口。随后细胞生长48 h后,经染色观察伤口周围细胞的愈合及转移现象。通过计算再填充细胞面积占初始无细胞伤口面积的百分比,评价伤口愈合程度。
1.2.4 改良Boyden小室侵袭实验用改良的Boyden小室测定血清趋化的侵袭实验。8.0 μm孔径的聚碳酸脂膜Boyden小室的上室用BD基底胶包被形成基质屏障。将3~5代2×105经各种干预措施处理的无血清F-12K培养基培养的HA-VSMCs悬液100 μL加入Boyden小室的上室。下室则加入600 μL含10% FBS的F-12K培养基。将Boyden小室置于37 ℃,5% CO2培养箱中孵育4 h后,干棉签吸附上室内液体、湿棉签轻轻擦去BD基底胶上室面的细胞,穿过基质屏障且迁移至BD基底胶下室面的细胞进行4%甲醛固定及0.02%结晶紫染色。高倍镜下计数随机选取的4个视野,取平均值代表细胞侵袭力。
1.2.5 明胶酶谱分析3~5代HA-VSMCs经各种干预措施处理后,收集上清液,将上清液移入离心管500×g离心10 min,-70 ℃储存备用。同等量蛋白上样于10% Novex明胶酶谱实验预制胶在4 ℃进行电泳(90 V,3 h)。电泳后取下凝胶,用蒸馏水冲洗干净后浸入复性缓冲液,振荡30 min (以去除SDS及使MMP2酶复性,期间可更换1次缓冲液)倒掉复性缓冲液加入改为孵育缓冲液,37 ℃温浴约3 h或过夜。孵育结束后经0.2%的考马斯蓝染色3 h后脱色,显示出MMP-2 (72 kD)为位于蓝色背景上的透亮带,拍摄凝胶的照片,并用ImageJ进行量化。
1.2.6 miRNA生物芯片及数据分析首先用TRIzol从HA-VSMCs中提取总RNA,进一步用RNeasy试剂盒高效纯化。紫外分光光度仪上测RNA浓度。按照miRCURYTM LNA microRNA Array (Ex标记试剂盒检测方法,使用by miRCURY Power labeling kit对细胞样品的总RNA进行标记,杂交后,芯片结果采用GeneChip Scanner 3000系统进行扫描,用Command Console software (version 4.0; Affymetrix)读取原始数据。归一化处理后,两组间差异表达miRNAs筛选采用Fold-change (表达差异倍数>2.0)以及t-test检验方法进行。将筛选得到的不同组间的差异表达miRNAs通过聚类图进行直观的图形展示。
1.2.7 实时定量PCR(qRT- PCR)检测差异表达之miRNAs表达水平,用TRIzol从HA-VSMCs中提取总RNA。紫外分光光度仪上测RNA浓度,500 ng RNA用第一链合成试剂盒反转录成cDNA。采用染料法(SYBR Green I)用ABI Prism 7900实时定量PCR系统(Applied Biosystems)进行Real-time定量PCR分析,U6用作内参。所有引物由引物设计软件3.0 (Applied Biosystems)设计并由Invitrogen公司合成(表 1)。
| 表 1 qRT-PCR对差异表达miRNA的引物序列 Tab.1 Primer sequence of qRT-PCR for differentially expressed miRNAs |
3~5代2×105HA-VSMCs转染前1 d传代至6孔板,第2天细胞生长约50%~60%,用Lipofectamin 2000进行has-miR-3133 inhibitor及has-miR-3133 NC (阴性对照)序列(上海英骏生物)转染,转染终浓度为50 nmol/L。转染48 h后,进行细胞相关测定。
1.3 统计学分析采用SPSS17.0软件进行统计处理,各指标以均数±标准差表示,多组采用单因素方差分析,以P < 0.05为差异有统计学意义。所有的实验都是独立重复3次。
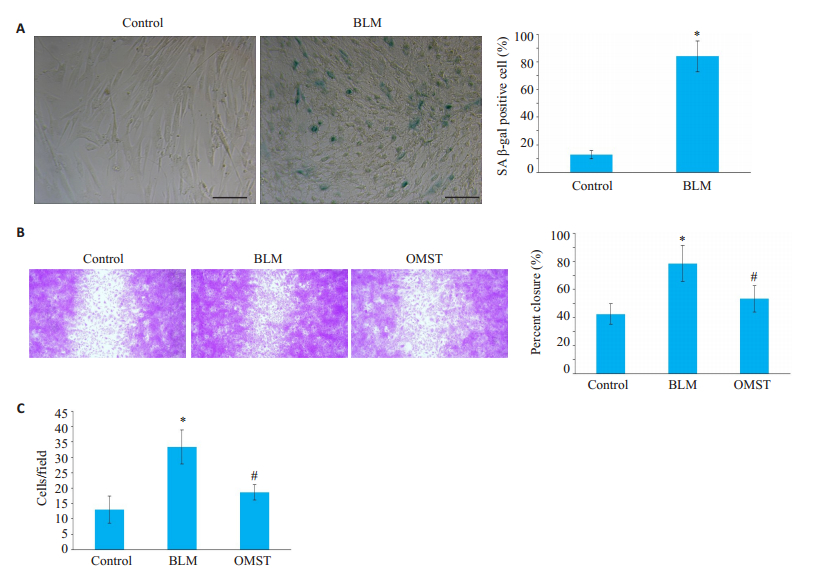
2 结果 2.1 OMST对衰老相关HA-VSMC迁移和侵袭能力的影响应用BLM诱导建立HA-VSMC衰老模型,结果显示,与对照组相比,BLM组可使SA-β-Gal蓝染阳性细胞增多[(84.00±11.23) % vs(12.83±2.91) %,P < 0.05,图 1A]。划痕实验和侵袭实验证实,与对照组相比,BLM组增加伤口周围再填充细胞面积百分比和细胞侵袭力[(78.43±12.76) % vs(42.47±7.22) %;33.33±5.51 vs 13.00±4.36,P < 0.05]。而与BLM组相比,OMST组伤口周围再填充细胞面积百分比和细胞侵袭力减少[(53.23 ± 9.20) % vs(78.43 ± 12.76) %;18.67 ± 2.52 vs 33.33±5.51,P < 0.05,图 1B、C]。
|
图 1 OMST对衰老HA-VSMCs迁移和侵袭能力的影响 Fig.1 Effects of olmesartan treatment on age-associated migration and invasion of HA-VSMCs. A: SA-β-gal staining (Scale bar=50 μm); B: Photomicrographs of wound healing assay (Original magnification: × 40). C: Average data of invasion analysis. SA-β-Gal: Senescence-associated β-galactosidase; BLM: Bleomycin; OMST: Olmesartan. *P < 0.05 vs control group, #P < 0.05 vs BLM group. |
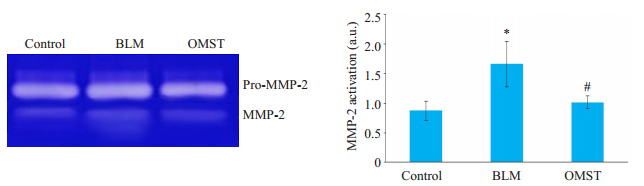
与对照组比,BLM组中MMP-2分泌水平增加(1.66±0.27 vs 0.87±0.13,P < 0.05,图 2)。然而,与BLM组相比,OMST组的MMP-2分泌水平则降低(1.01± 0.08 vs 1.66±0.27,P < 0.05)。
|
图 2 OMST抑制衰老HA-VSMC中MMP-2的分泌 Fig.2 Olmesartan treatment reduces MMP-2 secretion in senescent HA-VSMC. BLM: Bleomycin; OMST: Olmesartan. *P < 0.05 vs control group, #P < 0.05 vs BLM group. |
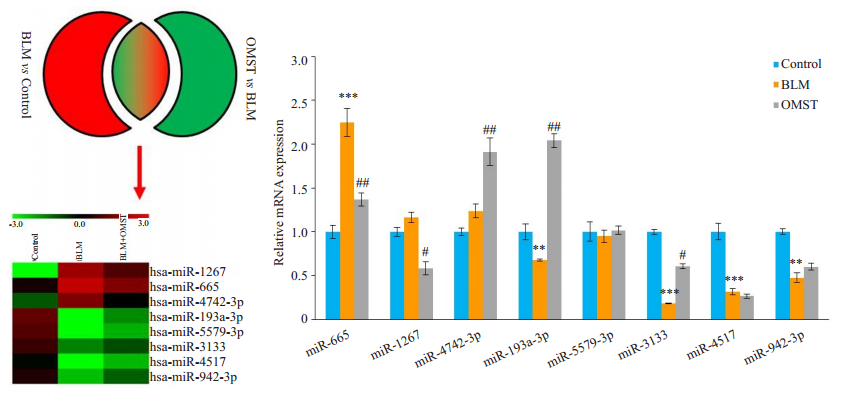
对照组、BLM组和OMST组HA-VSMCs行生物芯片检测,分析差异miRNAs表达,选取Top 8差异表达miRNAs,结果显示,3组差异表达miRNAs包括hasmiR-1267、has-miR-665、has-miR-4742-3p、has-miR- 193a-3p、has-miR-5579-3p、has-miR-3133、has-miR- 4517、has-miR-942-3p。
qRT-PCR结果显示,BLM组中miR-665表达上调(P < 0.05),而miR-193a-3p、miR-3133、miR-4517和miR-942-3p表达下调;然而OMST仅逆转了miR-665和miR-3133的表达(图 3)。
|
图 3 miRNA芯片及qRT-PCR检测不同干预HA-VSMC的差异表达miRNAs Fig.3 Differential expression of miRNAs in the 3 groups determined using microarray analysis and qRT-PCR assay. BLM: Bleomycin; OMST: Olmesartan. **P < 0.05 vs control group, ***P < 0.01 vs control group, #P < 0.05 vs BLM group, ##P < 0.01 vs BLM group. |
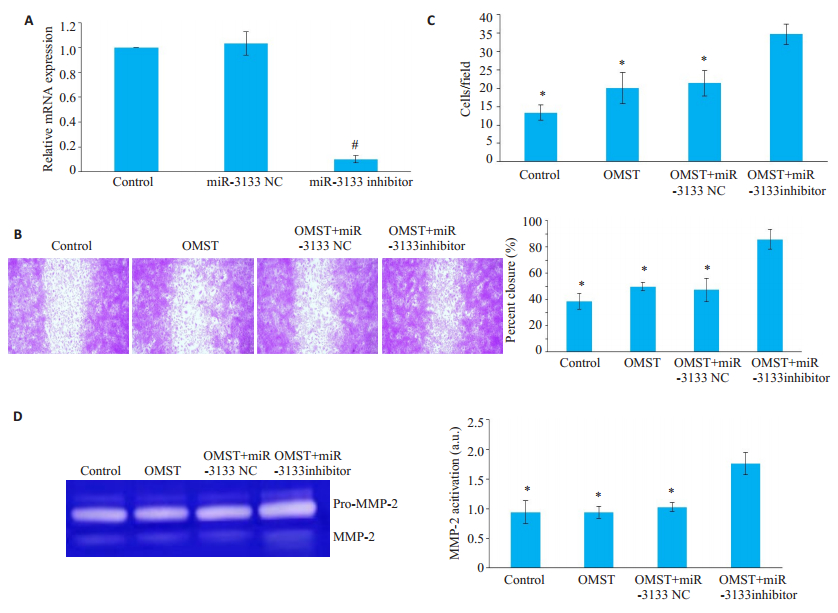
qRT-PCR结果显示,与对照组及miR-3133 NC组相比,miR-3133 inhibitor组miR-3133表达水平下调(P < 0.05)。检测联合miR-3133 inhibitor和OMST后HA-VSMC迁移和侵袭能力,实验分为4组:对照组、OMST组、OMST+miR-3133 NC组(OMST联合转染miR-3133 NC干预BLM诱导的衰老HA-VSMCs)和OMST+miR-3133 inhibitor组(OMST联合转染miR- 3133 inhibitor干预BLM诱导的衰老HA-VSMCs)。与OMST组相比,OMST+miR-3133 inhibitor组HA-VSMC迁移和侵袭能力增加[(85.87 ± 7.39) % vs(49.77 ± 3.05) %;34.67±2.31 vs 20.00±4.58,P < 0.05];而OMST+ miR-3133 NC组与OMST相比HA-VSMC迁移和侵袭能力差异无统计学意义(P>0.05,图 4)。
|
图 4 miR-3133 inhibitor逆转OMST抑制HA-VSMC迁移/侵袭力及MMP-2分泌的作用 Fig.4 MiR-3133 inhibitor reverses the effects of olmesartan on age-associated migration, invasion and MMP-2 secretion of HAVSMC. A: mRNA expression; B: Photomicrographs of wound healing assay (Original magnification: ×40); C: Average data of invasion analysis; D: MMP-2 activition. *P < 0.05 vs OMST+miR-3133 inhibitor group. |
最后检测联合miR-3133 inhibitor和OMST后MMP-2水平变化。与OMST组相比,OMST + miR- 3133 inhibitor组MMP-2分泌水平增加(1.76±0.19 vs 0.94 ± 0.10,P < 0.05);而OMST + miR-3133 NC组与OMST组相比HA-VSMC中MMP-2分泌水平差异无统计学意义(P>0.05,图 4)。
3 讨论药物干预衰老相关迁移和侵袭的细胞过程很难通过体内实验研究来实现。BLM是一种常用的硬化剂,其生物化学作用包括诱导细胞周期G2/M期阻滞和降解细胞DNA。BLM可剂量依赖地增加VSMC的SA-β-Gal活性,诱导细胞衰老[16]。因此,我们利用BLM诱导的HA-VSMCs衰老模型进行OMST对这一细胞过程影响的体外研究。本研究结果显示,OMST能显著改善衰老增加的HA-VSMC的迁移和侵袭能力,同时可抑制MMP-2的分泌,这一过程可能是通过上调miR-3133表达实现的。研究发现动脉内膜增厚与年龄呈线性相关,主要是由于VSMCs从血管中膜向内膜的迁移和侵袭[2, 17]。虽然有研究表明衰老VSMCs表现为其迁移和侵袭能力下降[18-19],但本研究用BLM诱导的衰老模型发现衰老HA-VSMCs迁移和侵袭能力增强,这与之前的研究报道衰老VSMCs较年轻VSMCs迁移/侵袭能力增加一致[7-8, 11, 20]。年轻VSMCs经多次传代后侵袭能力增加,可达衰老VSMCs水平,这一过程由激活的AngⅡ信号通过增加MMP-2活性所致[13]。不受控制的MMPs能够在VSMC周围裂解细胞基底膜和弹性纤维,从而导致细胞外基质降解,使VSMC发生衰老相关的迁移、侵袭和扩散。而衰老相关的迁移/侵袭特性可被MMP抑制剂GM6001逆转[11, 13]。衰老VSMCs中MMP-2和MMP-9的产生增加,且均与VSMCs的迁移和侵袭有关[21-22]。而研究发现MMP-2是一衰老相关的标志物,在老化的动脉壁内,MMP-2的表达明显增加,尤其是在增厚的内膜中[21]。此外,有研究发现MMP-9在体外诱导冠状动脉环内膜增厚的作用明显低于MMP-2[23]。故本研究用MMP-2作为与细胞迁移/侵袭相关的MMPs。当然需进一步应用特异的MMP-2/MMP-9抑制剂,及联合观察MMP-2和MMP-9以确定不同MMPs在衰老相关VSMCs迁移和侵袭中的作用。
虽然OMST的抗动脉粥样硬化和降压作用已被充分证实,OMST也呈现抗炎作用及抗氧化特性[24],但其影响衰老相关VSMCs迁移和侵袭的作用及机制仍未被阐述。本研究发现OMST抑制衰老增加的HA-VSMCs迁移和侵袭能力。有报道其他AngⅡ受体拮抗剂可影响VSMCs迁移和侵袭能力,发现氯沙坦可抑制AngⅡ诱导的VSMCs增殖和迁移[25]。有学者也发现缬沙坦可激活AMPK通路,抑制VSMCs增殖和迁移[26]。目前没有直接OMST调节MMP-2水平影响细胞迁移/侵袭的研究,但已有研究发现OMST可通过降低MMP-2活化抑制内膜新生血管和粥样硬化斑块的形成[27],以及成纤维细胞增殖[28]。我们前期研究发现氯沙坦干预可减少衰老VSMCs的MMP-2活性,MMP-2活性的下降可减少对Vasorin的降解,进而抑制AngⅡ介导的衰老相关VSMCs侵袭[9]。
miRNAs在细胞及组织衰老的进程中起关键作用[29]。基因芯片可以高通量的研究miRNAs,对相关疾病发病机制的探讨具有明显的优势。本研究通过观察OMST干预后miRNAs表达改变,提出差异表达miRNAs可能参与衰老相关HA-VSMC迁移和侵袭过程的假设。研究发现对照组、BLM组和OMST组经基因芯片检测存在差异表达miRNAs;经qRT-PCR验证BLM组中miR-665表达上调、miR-3133表达下调,而OMST组miR-665表达下调、miR-3133表达上调。国内外许多研究也证实,miRNAs在衰老相关疾病的细胞迁移和侵袭方面发挥重要作用[30-31]。因已有研究证实miR-3133可影响肾癌细胞迁移和侵袭能力[32],因此选择miR-3133进行进一步研究。本研究也发现miR-3133影响衰老VSMCs迁移/侵袭,miR-3133抑制可抵销OMST减少衰老VSMCs迁移/侵袭力及MMP-2的作用,提示OMST通过miR-3133通路影响衰老相关VSMCs迁移和侵袭。MiR-3133是新近发现的一个基因,来源于2q37.3号染色体,目前鲜有相关文献报道。唯一相关miR-3133的报道就是其与细胞及血管迁移/侵袭的研究。研究发现肾透明细胞癌患者miR-3133表达水平下调,其水平与血管侵袭呈负相关[32];同时体外研究发现miR-3133过表达或抑制可减弱或增强肾透明细胞癌细胞的侵袭力和迁移力。
综上所述,本研究表明OMST干预衰老HA-VSMCs不仅可导致细胞迁移和侵袭能力减弱,MMP-2分泌减少,而且可上调miR-3133表达;同时发现抑制miR-3133可逆转OMST对HA-VSMCs迁移和侵袭作用的影响。因此,OMST干预及上调miR-3133可能成为治疗衰老相关血管内膜增厚的手段。
| [1] |
Harvey A, Montezano AC, Touyz RM. Vascular biology of ageingImplications in hypertension[J]. J Mol Cell Cardiol, 2015, 83(3): 112-21. |
| [2] |
Wang M, Jiang L, Monticone RE, et al. Proinflammation: the key to arterial aging[J]. Trends Endocrinol Metab, 2014, 25(2): 72-9. DOI:10.1016/j.tem.2013.10.002 |
| [3] |
Karuppagounder V, Giridharan VV, Arumugam S, et al. Modulation of macrophage polarization and HMGB1-TLR2/TLR4 cascade plays a crucial role for cardiac remodeling in senescence-accelerated prone mice[J]. PLoS One, 2016, 11(4): e0152922-33. DOI:10.1371/journal.pone.0152922 |
| [4] |
Lakatta EG. So what's aging? Is cardiovascular aging a disease[J]. J Mol Cell Cardiol, 2015, 83(10): 1-13. |
| [5] |
Al-Regaiey KA. The effects of calorie restriction on aging: a brief review[J]. Eur Rev Med Pharmacol Sci, 2016, 20(11): 2468-73. |
| [6] |
Wang M, Zhang L, Zhu W, et al. Calorie restriction curbs proinflammation that accompanies arterial aging, preserving a youthful phenotype[J]. J Am Heart Assoc, 2018, 7(18): e009112-20. |
| [7] |
Chiang HY, Chu PH, Lee TH. MFG-E8 mediates arterial aging by promoting the proinflammatory phenotype of vascular smooth muscle cells[J]. J Biomed Sci, 2019, 26(1): 61-72. DOI:10.1186/s12929-019-0559-0 |
| [8] |
Zhang L, Wei C, Ruan Y, et al. Serum containing Buyang Huanwu decoction prevents age-associated migration and invasion of human vascular smooth muscle cells by up regulating SIRT1 expression[J]. Biosci Trends, 2018, 12(3): 282-90. DOI:10.5582/bst.2018.01063 |
| [9] |
Pintus G, Giordo R, Wang Y, et al. Reduced vasorin enhances angiotensin Ⅱ signaling within the aging arterial wall[J]. Oncotarget, 2018, 9(43): 27117-32. DOI:10.18632/oncotarget.25499 |
| [10] |
Jiang L, Zhang J, Monticone RE, et al. Calpain-1 regulation of matrix metalloproteinase 2 activity in vascular smooth muscle cells facilitates age- associated aortic wall calcification and fibrosis[J]. Hypertension, 2012, 60(5): 1192-9. |
| [11] |
Fu Z, Wang M, Gucek M, et al. Milk fat globule protein epidermal growth factor-8: a pivotal relay element within the angiotensin Ⅱ and monocyte chemoattractant protein-1 signaling cascade mediating vascular smooth muscle cells invasion[J]. Circ Res, 2009, 104(12): 1337-46. DOI:10.1161/CIRCRESAHA.108.187088 |
| [12] |
Wang M, Khazan B, Lakatta EG. Central arterial aging and angiotensin Ⅱ signaling[J]. Curr Hypertens Rev, 2010, 6(4): 266-81. |
| [13] |
张莉, 王宇石, 刘彧, 等. 炎症与血管老化炎症与血管老化[J]. 中华老年医学杂志, 2016, 10(35): 1038-41. |
| [14] |
Li Y, Zhu Y, Li G, Xiao J. Noncoding RNAs in cardiovascular aging[J]. Adv Exp Med Biol, 2018, 1086(2): 37-53. |
| [15] |
Lee S, Choi E, Cha MJ, et al. Impact of miRNAs on cardiovascular aging[J]. J Geriatr Cardiol, 2015, 12(5): 569-74. |
| [16] |
Gardner SE, Humphry M, Bennett MR, et al. Senescent vascular smooth muscle cells drive inflammation through an interleukin-1α- dependent senescence-associated secretory phenotype[J]. Arterioscler Thromb Vasc Biol, 2015, 35(9): 1963-74. DOI:10.1161/ATVBAHA.115.305896 |
| [17] |
Schmidt- Trucksass A, Grathwohl D, Schmid A, et al. Structural, functional, and hemodynamic changes of the common carotid artery with age in male subjects[J]. Arterioscler Thromb Vasc Biol, 1999, 19(4): 1091-7. DOI:10.1161/01.ATV.19.4.1091 |
| [18] |
Thompson AM, Wagner R, Rzucidlo EM. Age-related loss of SirT1 expression results in dysregulated human vascular smooth muscle cell function[J]. Am J Physiol Heart Circ Physiol, 2014, 307(4): H533-41. DOI:10.1152/ajpheart.00871.2013 |
| [19] |
Zhao W, Zheng XL, Peng DQ, et al. Myocyte enhancer factor 2A regulates hydrogen peroxide-induced senescence of vascular smooth muscle cells via microRNA-143[J]. J Cell Physiol, 2015, 230(9): 2202-11. DOI:10.1002/jcp.24948 |
| [20] |
Wang M, Spinetti G, Monticone RE, et al. A local proinflammatory signalling loop facilitates adverse age-associated arterial remodeling[J]. PLoS One, 2011, 6(2): e16653-63. DOI:10.1371/journal.pone.0016653 |
| [21] |
Wang M, Monticone RE, McGraw KR. Proinflammation arterial stiffness syndrome:a signature of large arterial aging[J]. J Vasc Res, 2018, 55(4): 210-23. DOI:10.1159/000490244 |
| [22] |
Wang M, Kim SH, Monticone RE, et al. Matrix metalloproteinases promote arterial remodeling in aging, hypertension, and atherosclerosis[J]. Hypertension, 2015, 65(4): 698-703. |
| [23] |
Louis SF, Zahradka P. Vascular smooth muscle cell motility: from migration to invasion[J]. Exp Clin Cardiol, 2010, 15(3): e75-85. |
| [24] |
Takiguchi S, Ayaori M, Uto-Kondo H, et al. Olmesartan improves endothelial function in hypertensive patients: link with extracellular superoxide dismutase[J]. Hypertens Res, 2011, 34(6): 686-92. |
| [25] |
Dong X, Yu LG, Sun R, et al. Inhibition of PTEN expression and activity by angiotensin Ⅱ induces proliferation and migration of vascular smooth muscle cells[J]. J Cell Biochem, 2013, 114(1): 174-82. |
| [26] |
Zhao Y, Shang F, Shi W, et al. Angiotensin Ⅱ receptor type 1 antagonists modulate vascular smooth muscle cell proliferation and migration via AMPK/mTOR[J]. Cardiology, 2019, 143(1): 1-10. DOI:10.1159/000500038 |
| [27] |
Wang X, Fan YZ, Yao L, Wang JM. Anti-proliferative effect of olmesartan on Tenon's capsule fibroblasts[J]. Int J Ophthalmol, 2016, 9(5): 669-76. |
| [28] |
Cheng XW, Song H, Sasaki T, et al. Angiotensin type 1 receptor blocker reduces intimal neovascularization and plaque growth in apolipoprotein E-deficient mice[J]. Hypertension, 2011, 57(5): 981-9. |
| [29] |
梁景南, 朱文思, 张灼, 等. miR-199a-3p靶向Smad1促进小鼠心肌纤维化相关基因的表达[J]. 南方医科大学学报, 2018, 38(10): 1203-8. |
| [30] |
Yu C, Wang Y. MicroRNA-19a promotes cell viability and migration of chondrocytes via up-regulating SOX9 through NF-κB pathway[J]. Biomed Pharmacother, 2018, 9(12): 746-53. |
| [31] |
Li X, Song Y, Liu D, et al. MiR- 495 promotes senescence of mesenchymal stem cells by targeting Bmi-1[J]. Cell Physiol Biochem, 2017, 42(2): 780-96. |
| [32] |
Chen X. Expression of microRNA-3133 correlates with the prognosis in patients with clear cell renal cell carcinoma[J]. Medicine (Baltimore), 2019, 98(24): e16008-17. DOI:10.1097/MD.0000000000016008 |
 2020, Vol. 40
2020, Vol. 40

