2. 蚌埠医学院药学院药理学教研室, 安徽 蚌埠 233030;
3. 蚌埠医学院药学院2018级本科, 安徽 蚌埠 233030
2. Department of Pharmacology, School of Pharmacy, Bengbu Medical College, Bengbu 233030, China;
3. Grade 2018, School of Pharmacy, Bengbu Medical College, Bengbu 233030, China
脑卒中在全世界范围内已成为致残的首要因素及致死的第二大因素[1-2]。脑卒中分为出血性脑卒中和缺血性脑卒中两种类型, 其中缺血性脑卒中约占85%[3]。临床上治疗缺血性脑卒中主要采用静脉溶栓等方法恢复血液再灌注, 而治疗过程中往往会出现脑缺血/再灌注损伤[4], 如何减轻脑缺血/再灌注损伤这一病理生理过程已成为目前国内外研究的热点。
线粒体是细胞内产生能量的重要细胞器, 生理状态下, 线粒体处于融合与裂变的动态平衡中。文献报道[5-6]在脑缺血/再灌注损伤的动物模型中, 线粒体的动态平衡被破坏并趋向于裂变, 阻断线粒体的分裂具有保护作用。AMP活化蛋白激酶(AMPK), 是一个高度保守的丝氨酸/苏氨酸蛋白激酶, 广泛分布于各种细胞和器官中。AMPK能够调节细胞内的能量变化, 可对脑缺血、脑出血、神经退行性疾病等有害刺激做出反应[7]。激活AMPK可以抑制炎症因子和活性氧的产生从而减轻脑/缺血再灌注损伤[8]。而激活AMPK对脑缺血/再灌注损伤的保护作用是否与线粒体的功能有关, 尚不清楚。
右美托咪定(DEX)是选择性的α2肾上腺素受体激动剂, 因具有良好的镇静、镇痛作用而被广泛用于围手术期各个过程中[9]。近年来, 有研究表明右美托咪定对包括缺血性脑损伤在内的多个身体器官的缺血/再灌注损伤具有保护作用[10-11], 但其能否通过激活AMPK通路调节线粒体的融合与裂变来发挥抗脑缺血/再灌注损伤的作用仍需进一步探究。本实验采用小鼠MCAO模型, 用右美托咪定进行预处理, 探究其对脑缺血/再灌注损伤的保护作用与AMPK以及线粒体的融合与裂变的关系及其机制。
1 材料和方法 1.1 实验动物无特定病原体(SPF级)雄性ICR小鼠, 8~12周龄, 体质量25~32 g, 购于山东朋悦实验动物公司。每组10只, 统一标准饲养, 恒温22~24℃, 人工光照, 明暗各12 h, 自由饮水及摄食。所有实验程序经实验动物伦理委员会批准(伦动科批字[2019]第107号)。
1.2 主要试剂盐酸右美托咪定注射液(恩华); 2, 3, 5-氯化三苯基四氮唑(TTC, Sigma); 水合氯醛、多聚甲醛(Macklin); AMPK抑制剂(dorsomorphin, MedChemExpress); p-AMPK、p-Drp1单克隆抗体(Cell Signaling Technology); Mfn2单克隆抗体(Abcam), GAPDH单克隆抗体、山羊抗小鼠IgG二抗、山羊抗兔IgG二抗(Proteintech)。
1.3 小鼠MCAO模型制备及分组雄性ICR小鼠随机分为假手术(sham)组、缺血/再灌注(I/R)组、缺血/再灌注+右美托咪定(I/R+DEX)组、缺血/再灌注+右美托咪定+dorsomorphin(I/R+DEX+ dorsomorphin)组, 每组10只。参照改良线栓法制作小鼠MCAO模型。用10%水合氯醛(0.04 mL/10 g)腹腔注射对小鼠进行麻醉, 麻醉完成后使其仰卧位固定于操作台上。完成消毒处理后, 在颈部做正中切口, 钝性分离出右侧颈总动脉、颈外动脉和颈内动脉, 用手术缝合线将颈外动脉远心端结扎。在颈总动脉近心端和颈外动脉近心端用活结结扎, 用小动脉夹夹住颈内动脉后, 在颈外动脉两线之间剪一小口, 将尼龙线栓插入, 取下动脉夹, 线栓经颈内动脉进入右侧大脑中动脉, 用手术缝合线将线栓固定。缺血1 h后将线栓拔出, 缝合皮肤, 维持血液再灌注24 h。其中sham组线栓只插进颈内动脉, 不造成缺血。右美托咪定(50 μg/kg)在缺血前30 min腹腔注射给药[12], dorsomorphin (0.01 mg/g)在再灌注时立即腹腔注射给药[13]。
1.4 神经功能行为学评价采用Longa[14]五分法对缺血1 h再灌注24 h的小鼠神经功能进行评分。评分标准为:0分:小鼠无神经功能缺失, 活动无障碍; 1分:小鼠对侧前肢、前爪不能充分伸展; 2分:小鼠行走时不自主的向手术对侧转圈; 3分:小鼠行走时不自主的向手术对侧倾倒; 4分:小鼠行走出现严重障碍, 意识水平下降或者处于昏迷状态。其中, 神经行为学评分≥ 1分为成功模型。
1.5 脑梗死体积测定采用TTC染色法检测小鼠脑梗死体积。小鼠再灌注24 h后立即处死, 取出小鼠的大脑在-20℃冰箱放置10~12 min, 随后将小鼠脑组织从距额极3 mm处开始, 从前向后作冠状位连续切片, 等距离切成4片。将小鼠脑片置于37℃恒温水浴锅中的1% TTC染液中, 避光染色20 min后, 弃TTC染液, 加入4%的多聚甲醛固定脑片, 24 h后将固定好的脑片按从前至后的顺序排列好后进行拍照。用Image J软件扫描小鼠脑片并计算梗死体积占对侧大脑体积百分率。
1.6 透射电子显微镜观察线粒体形态再灌注24 h, 处死小鼠后取出大脑, 切取右侧大脑梗死周围半暗带脑组织, 大小约1 mm3。置于2.5%的戊二醛固定过夜, 1%锇酸后固定后用梯度浓度的乙醇脱水, 环氧树脂包埋、超薄切片、染色, 继而使用日立7700型透射电镜观察, 并采集图片。采用Image J扫描10~ 15个视野中的线粒体, 通过计算线粒体周长、径长比和圆度对线粒体大小和形态变化进行量化分析。线粒体圆度为(周长)2/4π, 线粒体径长比为线粒体长径与短径的比值[15]。
1.7 免疫印迹法检测p-AMPK、p-Drp1、Mfn2蛋白的表达在缺血1 h再灌注24 h后, 立即处死小鼠并取出脑组织, 取右侧大脑梗死周围半暗带脑组织用于免疫印迹检测, 具体步骤如下。首先, 将样品置于玻璃研磨器中并加入裂解液, 在冰上充分研磨使其成为匀浆。然后将蛋白匀浆转移至1.5 mL EP管中, 置冰上裂解30 min。将裂解后的蛋白匀浆于4℃、12 000 r/min的条件下离心30 min, 吸取蛋白上清液, 按BCA法进行蛋白定量测定。制备10% SDS-PAGE凝胶, 将蛋白样品上样后进行电泳, 转膜, 封闭。封闭结束后用TPBS将膜洗3遍, 每次5 min。随后将PVDF膜分别与p-AMPK (1:1000), p-Drp1 (1:1000), Mfn2 (1:1000), GAPDH (1:2000)等一抗4℃孵育过夜, 洗膜后二抗室温孵育2 h。在暗室中, 将ECL显影液与膜充分接触, 使膜发光, 显影, 使用Bio-Rad凝胶成像系统采集图像, 用Bio Imaging System (Gene Genius)对图像进行灰度扫描分析。
1.8 统计学分析采用SPSS 16.0软件进行统计学分析, 计量资料以均数±标准差表示神经行为学评分采用非参数(Mann-Whitney) U检验分析, 多组之间的数据比较采用单因素方差分析, P < 0.05认为差异有统计学意义。
2 结果 2.1 右美托咪定对脑缺血/再灌注损伤小鼠神经功能的影响再灌注24 h时对小鼠进行神经行为学评分。结果如表 1所示, 除sham组小鼠无神经功能障碍的症状外, 其余各组小鼠均表现出不同程度的神经功能障碍。与sham组相比, I/R组小鼠神经行为学评分显著升高(P < 0.001)。但在使用DEX处理后, I/R+DEX组小鼠神经行为学评分明显低于I/R组(P < 0.001)。而与I/R+DEX组相比, 在使用DEX的基础上进一步使用AMPK抑制剂, 小鼠脑缺血/再灌注损伤加重, 神经行为学评分明显升高(P < 0.01)。
| 表 1 右美托咪定对脑缺血/再灌注损伤小鼠神经功能的影响 Tab.1 Effects of dexmedetomidine on neurobehavioral scores in mice with cerebral ischemia/reperfusion injury (Mean±SD, n=10) |
采用TTC染色法测定各组小鼠脑梗死体积, 红色区域为正常脑组织而白色区域为缺血脑组织。结果如图 1所示, 除sham组染色无梗死区外, 其余组均出现不同范围的梗死区。与sham组相比, I/R组小鼠脑梗死体积显著增加(P < 0.001);与I/R组相比, I/R+DEX组小鼠脑梗死体积明显降低(P < 0.001);与I/R+DEX组相比, I/ R+DEX+dorsomorphin组小鼠脑梗死体积增加(P < 0.01)。
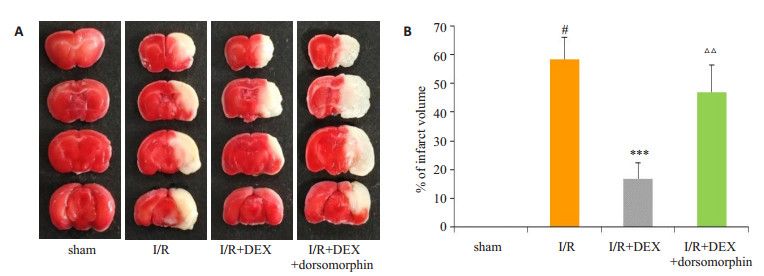
|
图 1 右美托咪定对脑缺血/再灌注损伤小鼠脑梗死体积的影响 Fig.1 Effects of dexmedetomidine on brain infarct volume in mice with cerebral ischemia/reperfusion injury. A: Slices of brain tissue; B: Quantitative analysis of brain infarct volume (Mean±SD, n=6). #P < 0.001 vs sham group; ***P < 0.001 vs I/ R group; △△P < 0.001 vs I/R+DEX group. |
用透射电子显微镜观察小鼠脑组织中线粒体的形态变化, 结果如图 2所示, sham组镜下可观察到线粒体结构完整、呈长棒状; 与sham组相比, I/R组线粒体损伤严重, 线粒体明显变短、变圆, 其周长、圆度、径长比均降低(P < 0.001);使用DEX后, 与I/R组相比, 线粒体形态趋于正常, 其周长、圆度、径长比增加(P < 0.01, P < 0.001, P < 0.001);而在使用DEX的基础上使用dorsomorphin抑制AMPK后, 线粒体的周长、圆度、径长比又有所降低(P < 0.01, P < 0.01, P < 0.001)。
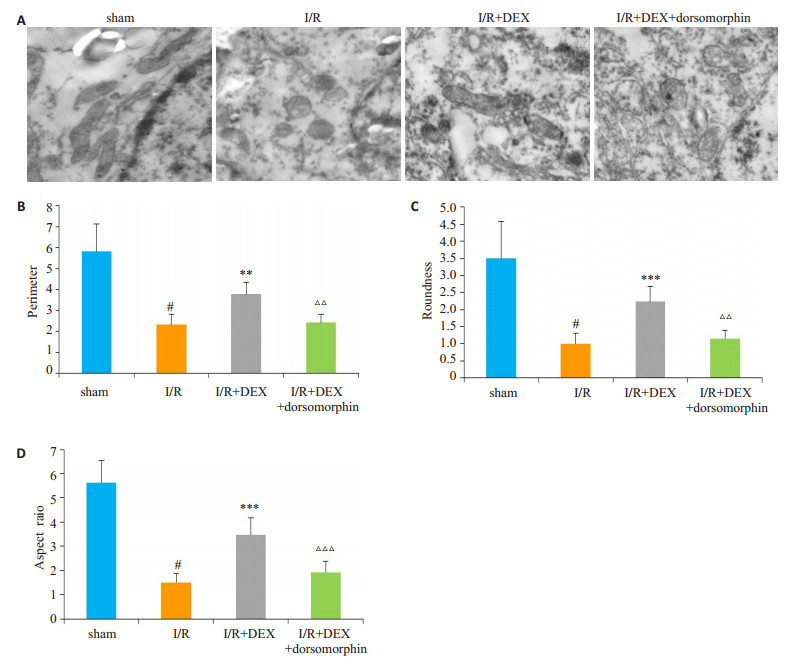
|
图 2 右美托咪定对脑缺血/再灌注损伤小鼠线粒体形态的影响 Fig.2 Effects of dexmedetomidine on mitochondrial morphology in the brain cells of mice with cerebral ischemia/reperfusion injury. A: Morphology of the mitochondria under transmission electron microscopy (Original magnification: × 3000); B-D: Quantitative analysis of mitochondrial perimeter, aspect ratio, and roundness (Mean±SD, n=4). #P < 0.001 vs sham group, **P < 0.01, ***P < 0.001 vs IR group, △△P < 0.01, △△△P < 0.001 vs I/R+DEX group. |
采用免疫印迹法检测p-AMPK蛋白的表达变化, 结果如图 3所示:与sham组相比, I/R组小鼠脑组织中的p-AMPK蛋白表达量降低(P < 0.001);使用DEX预处理后, p-AMPK蛋白表达升高(P < 0.001);在使用DEX的基础上进一步使用dorsomorphin后, p-AMPK蛋白的表达量与I/R+DEX组相比显著减少(P < 0.01)。
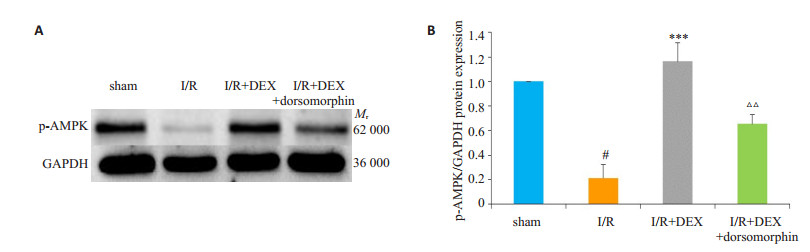
|
图 3 右美托咪定对脑缺血/再灌注损伤小鼠脑组织中p-AMPK蛋白表达的影响 Fig.3 Effects of dexmedetomidine on expression of p-AMPK protein in brain tissues of mice with cerebral ischemia/reperfusion injury. A: Western blotting of the expression of p-AMPK; B: Quantitative analysis of p-AMPK protein level normalized to that in the sham group (Mean±SD, n=3). #P < 0.001 vs sham group, ***P < 0.001 vs I/R group, △△P < 0.01 vs I/R+DEX group. |
采用免疫印迹法检测线粒体裂变蛋白p-Drp1蛋白及线粒体融合蛋白Mfn2蛋白的表达变化, 结果如图 4所示:与sham组相比, I/R组p-Drp1蛋白表达显著升高(P < 0.001), Mfn2蛋白表达降低(P < 0.001);使用DEX预处理后, 与I/R组相比, p-Drp1蛋白表达明显降低(P < 0.001), Mfn2蛋白表达升高(P < 0.01);且dorsomorphin可使I/R+DEX组p-Drp1蛋白表达升高(P < 0.001), Mfn2蛋白表达降低(P < 0.01)。
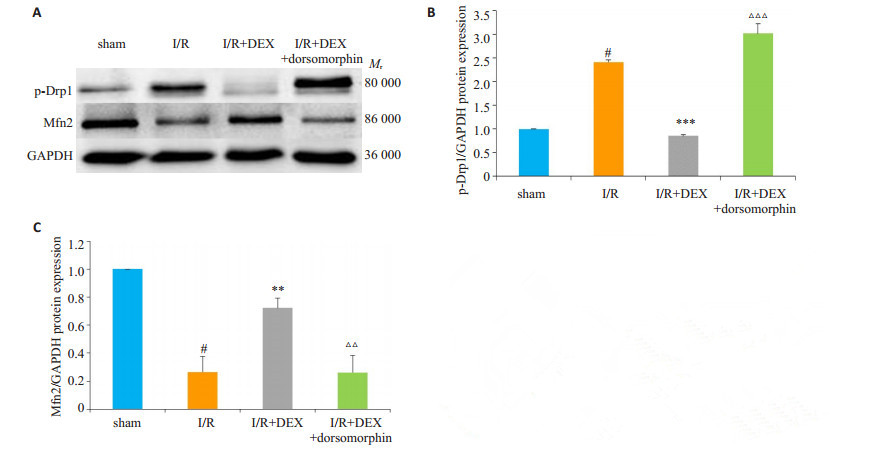
|
图 4 右美托咪定对脑缺血/再灌注损伤小鼠脑组织中p-Drp1蛋白和Mfn2蛋白表达的影响 Fig.4 Effects of dexmedetomidine on expressions of p-Drp1 pand Mfn2 protein in the brain tissue of mice with cerebral ischemia/reperfusion injury. A: Western blot analysis for the expressions of p-Drp1 and Mfn2; B: Quantitative analysis of p-Drp1 protein level normalized to that of the sham group (Mean±SD, n=3). #P < 0.001 vs sham group, ***P < 0.001 vs I/R group, △ △ △P < 0.001 vs I/R + DEX group; C: Quantitative analysis of Mfn2 protein level normalized to sham group (Mean±SD, n=3). #P < 0.001 vs sham group, **P < 0.01 vs I/R group, △△P < 0.01 vs I/R+DEX group. |
缺血性脑损伤为神经内科及临床围术期常见的病理损伤, 具有较高的致死及致残风险。因此寻找安全高效的脑保护药具有重要的临床意义。近年来, DEX作为临床麻醉过程中常用辅助用药, 被发现可以发挥抗脑缺血/再灌注损伤的作用[12, 16], 但其作用机制尚未完全阐明。本研究通过制备小鼠MCAO模型, 发现DEX可以改善脑缺血/再灌注损伤导致的小鼠神经功能缺失, 降低小鼠脑梗死体积百分率, 证实DEX对脑缺血/再灌注损伤有一定的保护作用。
线粒体是细胞内氧化磷酸化和合成ATP的主要场所, 是为细胞生命活动提供能量的重要细胞器。正常细胞内线粒体处于不断分裂与融合的动力学平衡中, 这种平衡对维持线粒体的正常形态、分布和功能十分重要。文献报道[17-19]线粒体的融合与裂变功能紊乱会导致各种疾病, 如阿尔茨海默症、心肌病、缺血性脑损伤等。线粒体裂变时线粒体变短, 呈线粒体球样改变, 而线粒体的融合会促进长丝状线粒体的产生[20]。本研究通过电镜观察线粒体形态发现缺血/再灌注时线粒体变短, 变圆, 裂变增多。DEX预处理可以改善脑缺血/再灌注造成的上述线粒体损伤, 使线粒体形态向正常状态恢复。此外, 我们进一步检测了线粒体融合与裂变的相关蛋白的变化。其中, 线粒融合与裂变的改变主要受线粒体融合蛋白Mfn2和线粒体裂变蛋白Drp1的调控[21-22]。研究表明[23], 抑制Drp1的表达可以减少缺氧预处理的神经元细胞死亡。Klacanova等[24]通过研究发现, 在脑缺血/再灌注损伤的大鼠脑组织中线粒体功能障碍, Mfn2蛋白表达降低。本实验通过检测线粒体融合与裂变相关蛋白表达发现, 在缺血/再灌注损伤的小鼠脑组织中线粒体裂变蛋白p-Drp1表达升高, 线粒体融合蛋白Mfn2蛋白表达降低。使用DEX后Mfn2蛋白表达明显增加, 而p-Drp1蛋白表达明显下降。证实DEX可以通过调节线粒体融合与裂变的平衡减轻脑缺血/再灌注损伤。
进一步探讨DEX抗脑缺血/再灌注损伤作用中线粒体融合与裂变的机制, 研究中使用了与脑缺血再灌注损伤密切相关的AMPK的抑制剂dorsomorphin。AMPK是一个高度保守的能量平衡调节器, 可协调体内多种代谢路径, 平衡能量的供需关系。研究表明[25], 在治疗脑缺血/再灌注损伤时, 激活AMPK通路可以降低氧化应激反应减轻脑损伤。在Sun等[26]的研究中发现, DEX可以通过激活AMPK/PI3K/Akt/eNOS信号通路, 保护小鼠心肌缺血再灌注损伤。而线粒体作为能量产生的重要细胞器, 被发现与AMPK之间存在着密切的联系。糖尿病肾病及肾脏缺血再灌注损伤方面的研究发现[27-28], 激活AMPK能抑制线粒体的裂变、维持线粒体的功能。从本实验的神经行为学评分和TTC染色结果可以看出, 使用dorsomorphin抑制AMPK后减弱了DEX对脑缺血/再灌注损伤小鼠的保护作用, 表明DEX抗小鼠脑缺血/再灌注损伤可能与激活AMPK通路有关; 免疫印迹检测结果显示, 当小鼠发生脑缺血/再灌注损伤后p-AMPK蛋白表达明显减少。同时, p-Drp1蛋白表达增多, Mfn2蛋白表达减少; 使用DEX后p-AMPK表达明显增加, 与此同时Mfn2的表达也增加而p-Drp1表达则减少; 但在DEX预处理的基础上进一步使用dorsomorphin抑制AMPK后, 我们发现p-AMPK表达显著降低, 同时Mfn2的表达也降低而p-Drp1表达则增加, 表明激活AMPK可促进线粒体融合抑制线粒体裂变。
综上所述, 我们的研究初步证实了DEX预处理可以减轻小鼠脑缺血/再灌注损伤, 其机制可能与激活AMPK信号通路从而调节线粒体的融合与裂变有关。
| [1] |
Wu SM, Wu B, Liu M, et al. Stroke in China:advances and challenges in epidemiology, prevention, and management[J]. Lancet Neurol, 2019, 18(4): 394-405. DOI:10.1016/S1474-4422(18)30500-3 |
| [2] |
Li SY, Jiang DW, Rosenkrans ZT, et al. Aptamer-Conjugated framework nucleic acids for the repair of cerebral Ischemia-Reperfusion injury[J]. Nano Lett, 2019, 19(10): 7334-41. |
| [3] |
Hong L, Zhong L, Zhang YW, et al. Rutin attenuates cerebral ischemia-reperfusion injury in ovariectomized rats via estrogenreceptor-mediated BDNF-TrkB and NGF-TrkA signaling[J]. Biochem Cell Biol, 2018, 96(5): 672-81. DOI:10.1139/bcb-2017-0209 |
| [4] |
Wu MY, Yiang GT, Liao WT, et al. Current mechanistic concepts in ischemia and reperfusion injury[J]. Cell Physiol Biochem, 2018, 46(4): 1650-67. DOI:10.1159/000489241 |
| [5] |
Wang MS, Zhang GF, Pei Y, et al. Electroacupuncture preconditioning protects against focal cerebral ischemia/reperfusion injury via suppression of dynamin-related protein 1[J]. Neural Regen Res, 2018, 13(1): 86. DOI:10.4103/1673-5374.224373 |
| [6] |
Wu Q, Xia SX, Li QQ, et al. Mitochondrial division inhibitor 1(Mdivi-1) offers neuroprotection through diminishing cell death and improving functional outcome in a mouse model of traumatic brain injury[J]. Brain Res, 2016, 1630: 134-43. DOI:10.1016/j.brainres.2015.11.016 |
| [7] |
Shuai J, Tian L, Ji T, et al. AMPK:potential therapeutic target for ischemic stroke[J]. Theranostics, 2018, 8(16): 4535-51. DOI:10.7150/thno.25674 |
| [8] |
Duan JL, Jia C, Yang ZF, et al. Neuroprotective effect of Apelin 13 on ischemic stroke by activating AMPK/GSK-3β/Nrf2 signaling[J]. J Neuroinflammation, 2019, 16(1): 24. DOI:10.1186/s12974-019-1406-7 |
| [9] |
农丽丹, 邓春玉, 邝素娟, 等. 右美托咪定抑制五羟色胺诱导的人离体肺内小动脉收缩[J]. 南方医科大学学报, 2014, 34(3): 303-7. DOI:10.3969/j.issn.1673-4254.2014.03.03 |
| [10] |
Cong L, Ouyang MW, Fang YY, et al. Dexmedetomidine protects mouse brain from Ischemia-Reperfusion injury via inhibiting neuronal autophagy through Up-Regulating HIF-1α[J]. Front Cell Neurosci, 2017, 11: 197. |
| [11] |
Akpinar H, Naziroglu M, Ovey IS, et al. The neuroprotective action of dexmedetomidine on apoptosis, Calcium entry and oxidative stress in cerebral ischemia-induced rats:Contribution of TRPM2 and TRPV1 channels[J]. Sci Rep, 2016, 6: 37196. DOI:10.1038/srep37196 |
| [12] |
Sheng L, Zhou GL, Wei S, et al. Impact of dexmedetomidine on amino acid contents and the cerebral ultrastructure of rats with cerebral ischemia-reperfusion injury[J]. Acta Cir Bras, 2017, 32(6): 459-66. DOI:10.1590/s0102-865020170060000006 |
| [13] |
Yang Y, Zhang XJ, Li LT, et al. Apelin-13 protects against apoptosis by activating AMP-activated protein kinase pathway in ischemia stroke[J]. Peptides, 2016, 75: 96-100. DOI:10.1016/j.peptides.2015.11.002 |
| [14] |
Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. DOI:10.1161/01.STR.20.1.84 |
| [15] |
Zhao YX, Mei C, Chen SF, et al. Amelioration of ischemic mitochondrial injury and Bax-Dependent outer membrane permeabilization by mdivi-1[J]. CNS Neurosci Ther, 2014, 20(6): 528-38. DOI:10.1111/cns.12266 |
| [16] |
Wang SL, Lian D, Bin X, et al. Dexmedetomidine preconditioning plays a neuroprotective role and suppresses TLR4/NF-κB pathways model of cerebral ischemia reperfusion[J]. Biomed Pharmacother, 2017, 93: 1337-42. DOI:10.1016/j.biopha.2017.06.051 |
| [17] |
Simon MB, Barnes K, Clemmens H, et al. Ursodeoxycholic acid improves mitochondrial function and redistributes Drp1 in fibroblasts from patients with either sporadic or familial alzheimer's disease[J]. J Mol Biol, 2018, 430(21): 3942-53. DOI:10.1016/j.jmb.2018.08.019 |
| [18] |
Liu WJ, Jiang HF, Faisal UR, et al. Lycium barbarum polysaccharides decrease Hyperglycemia-Aggravated ischemic brain injury through maintaining mitochondrial fission and fusion balance[J]. Int J Biol Sci, 2017, 13(7): 901-10. DOI:10.7150/ijbs.18404 |
| [19] |
Morales PE, Arias-Durán C, Ávalos-Guajardo Y, et al. Emerging role of mitophagy in cardiovascular physiology and pathology[J]. Mol Aspects Med, 2020, 71: 100822. DOI:10.1016/j.mam.2019.09.006 |
| [20] |
Ming Z, Craig B, Liu FY, et al. Mitochondrial dynamics:regulatory mechanisms and emerging role in renal pathophysiology[J]. Kidney Int, 2013, 83(4): 568-81. DOI:10.1038/ki.2012.441 |
| [21] |
Chih-Yang H, Chao-Hung L, Chia-Hua K, et al. Inhibition of ERK-Drp1 signaling and mitochondria fragmentation alleviates IGF-IIR-induced mitochondria dysfunction during heart failure[J]. J Mol Cell Cardiol, 2018, 122: 58-68. DOI:10.1016/j.yjmcc.2018.08.006 |
| [22] |
David CC. Mitochondrial dynamics and its involvement in disease[J]. Ann Rev Pathol Mechani Dis, 2020, 15(1): 235-59. DOI:10.1146/annurev-pathmechdis-012419-032711 |
| [23] |
Zhan LX, Lu ZW, Zhu XY, et al. Hypoxic preconditioning attenuates necroptotic neuronal death induced by global cerebral ischemia via Drp1-dependent signaling pathway mediated by CaMKIIα inactivation in adult rats[J]. FASEB J, 2019, 33(1): 1313-29. DOI:10.1096/fj.201800111RR |
| [24] |
Klacanova K, Kovalska M, Chomova M, et al. Global brain ischemia in rats is associated with mitochondrial release and downregulation of Mfn2 in the cerebral cortex, but not the hippocampus[J]. Int J Mol Med, 2019, 43(6): 2420-8. |
| [25] |
Choi IY, Ju C, Anthony Jalin AM, et al. Activation of cannabinoid CB2 receptor-mediated AMPK/CREB pathway reduces cerebral ischemic injury[J]. Am J Pathol, 2013, 182(3): 928-39. DOI:10.1016/j.ajpath.2012.11.024 |
| [26] |
Sun Y, Jiang C, Jiang J, et al. Dexmedetomidine protects mice against myocardium ischaemic/reperfusion injury by activating an AMPK/PI3K/Akt/eNOS pathway[J]. Clin Exp Pharmacol Physiol, 2017, 44(9): 946-53. DOI:10.1111/1440-1681.12791 |
| [27] |
Jeong HY, Jun MK, Hak HJ, et al. Chloroquine and amodiaquine enhance AMPK phosphorylation and improve mitochondrial fragmentation in diabetic tubulopathy[J]. Sci Rep, 2018, 8(1): 8774. DOI:10.1038/s41598-018-26858-8 |
| [28] |
Peerapanyasut W, Kobroob A, Palee S, et al. Bisphenol a aggravates renal ischemia-reperfusion injury by disrupting mitochondrial homeostasis and N-acetylcysteine mitigates the injurious outcomes[J]. IUBMB Life, 2020, 72(4): 758-70. DOI:10.1002/iub.2175 |
 2020, Vol. 40
2020, Vol. 40

