联合学习是一种常见的信息获取方式,联合记忆是逻辑推理、联想思维、比较和计算的基础[1-3]。目前的报道显示了小鼠跨模态反射的相互作用形式,即配对气味和胡须刺激会引起气味诱导的胡须运动和胡须诱导的嗅觉反应[4-5]。这种相互检索相关联的信号可以用来解释联合记忆,在对两个信号进行联合学习后,一个信号通过表现其各自的行为或反过来诱导对其相关信号的回忆,从而使个体能够以向前和向后的方式完成逻辑推理和联想思维。从感觉皮层到行为和情绪控制的大脑核,对神经回路中任何一个区域的刺激都可以诱导记忆呈现[6]。这些跨模式信号是可以相互获取的,而且在提取的过程中任意一种信号都能诱发其它相关联信息的回忆[2],那么这种信息联合记忆的原理是什么?
本课题组前期研究发现,配对的胡须和气味刺激能够建立嗅觉诱导的胡须摆动情况。与未配对训练组相比,配对训练组的小鼠桶状皮层谷氨酸能神经元功能上调,γ-氨基丁酸能神经元功能下调;且学习效率高的小鼠这种上调和下调比学习效率低的小鼠更显著[7]。但单一神经通路中神经元和突触可塑性的上调或下调不足以对联合记忆的原理进行解释,需要通过构建联合式学习记忆模型,通过药物调控相关递质,使用场电位记录、神经示踪、活细胞电生理等生物技术探究联合学习记忆的机制以及各种神经递质在其中发挥的作用。目前已有研究表明,5-羟色胺参与温度调节、情感、疼痛、睡眠与觉醒、记忆与认知等多种生理功能的调节[8],5-羟色胺受体(5-HTR)的部分亚型与焦虑、抑郁和认知功能发展中情感学习和记忆的机制有关[9]。在行为方面,已有研究表明,情绪强烈的事件往往会造成深刻且长期的记忆[10-11]。在此基础上我们将通过5-HT的再摄取抑制剂——氟西汀来进一步了解5-HT在联合学习记忆中的作用,为之后有关脑的学习记忆的研究提供帮助。
1 材料和方法 1.1 试剂盐酸氟西汀注射液:20 mg盐酸氟西汀加入0.4 mL的DMSO、39.6 mL的生理盐水,制成0.5 mg/mL的氟西汀工作液;储液:72.466 g NaCl(国药集团化学试剂有限公司)、21.843 g NaHCO3(国药集团化学试剂有限公司)、11.915 g HEPES(sigma)、2.237 g KCl(上海化学制剂厂)、2.028 g NaH2PO4·2H2O(国药集团化学试剂有限公司),用ddH2O定容至1 L,调节pH值至7.35。电极液:1.9816 g葡萄糖(国药集团化学试剂有限公司),加入100 mL储液和900 mL双蒸水中,在通入95% O2+5%CO2混合气体的同时,缓慢滴加入1 mol/LMgSO4 1.3 mL,1 mol/L CaCl2 2.4 mL,以避免产生沉淀。
1.2 实验动物及分组本次实验动物选用的出生后16 d的C57小鼠。随机分为2组,第1组小鼠作为对照组,同时进行嗅觉刺激和胡须刺激,训练前注射生理盐水(0.1 mL/10 g);第2组小鼠进行嗅觉刺激和胡须刺激联合训练,并提前腹腔注射氟西汀(0.1 mL/10 g),用法用量参考了先前的研究[12]。
1.3 实验方法 1.3.1 行为学实验方法联合式学习记忆模型的建立选择的实验动物是出生后16 d的C57小鼠分为对照组(n= 13只)、氟西汀组(n=13只)。在开始联合式记忆训练之前,先进行3 d的适应性训练,即每天将小鼠置于固定器上5次,5 min/次,间隔2 h。然后在每天刺激训练开始的3 h前,对各组小鼠进行相应药物的腹腔注射,再将小鼠放置于刺激模拟器上进行胡须触觉及嗅觉刺激。小鼠联合训练的模式为:在进行小鼠右侧胡须振幅为1 cm、频率为5 Hz的机械振动刺激的同时进行乙酸丁酯气味刺激,5次/d,20 s/次,连续10 d的联合式训练。之后对小鼠进行7 d的遗忘训练,期间保持相应药物的腹腔注射,但不进行胡须及嗅觉刺激。7 d遗忘后在第18天对小鼠进行联合训练。每天最后一次训练结束后,在给予小鼠乙酸丁酯气味刺激(小鼠对醛类和酯类物质的敏感度较高,嗅球具有相应的气味感受区域,且这种特性不受气味浓度的影响[13]),对小鼠胡须的摆动情况进行拍摄记录。使用Matlab分析视频,得到相应角度及频率数据。
1.3.2 场电位区域的选定与记录实验选择的脑区是小鼠左侧桶状皮层。桶状皮层是小鼠初级记忆的一个重要部分,是小鼠胡须触觉信息在脑部的投射区。由相似结构功能的神经元会聚集在一起,形成排列的功能柱,俗称“桶”(barrel),其与面部的胡须具有一一对应的关系,每个barrel区中的神经元接收来自于相对应的胡须传入的信息,并由此引发相应的反应,即经由一侧胡须产生的刺激,会转换为神经信号到达对侧的桶状皮层[14]。已有研究表明小鼠胡须触觉信息与控制该反应的脑区具有交叉结构特点,因为训练时刺激的是小鼠右侧胡须,所以开颅部位选择小鼠左侧脑部。位置约在小鼠前囟后1 mm,左侧距矢状缝3 mm,下针深度在0.3~0.8 mm。
分别取对照组训练第10天和第17天的小鼠,场电位记录时对右侧胡须进行5 Hz的机械振动刺激,持续10 s,记录场电位信号。再分别取氟西汀组训练第10天和第17天的小鼠,按相同的方法记录场电位信号变化。实验方法通过动物实验伦理审查。
1.4 统计学处理和分析胡须摆动的视频需要使用Matlab、Fiji ImageJ分析,统计数据为胡须摆动的角度和频率,统计图表使用GraphPad Prism 6.0绘制。实验相关数据的分析用SPSS16.0统计软件进行,实验结果以均数±标准误表示。两组数据间均数的比较采用的是两样本t检验,两组以上均数的比较采用单因素方差分析和SNK-q检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 行为学实验结果氟西汀组(绿色)小鼠胡须摆动角度值在第1~10天,及第18天都在增加且均大于对照组(黑色),第1~7天氟西汀组角度值增加的趋势高于对照组;第10~17天氟西汀组的消退趋势低于对照组,角度值高于对照组(图 1A)。在乙酸丁酯气味刺激下,氟西汀组小鼠第5、10、17、18天的胡须摆动角度值与对照组小鼠相比增加明显(n=13,P < 0.05,图 1B)。训练第5、10、17、18天氟西汀组小鼠角度值的净增加百分比高于对照组小鼠(n= 13,P < 0.05,图 1C)。
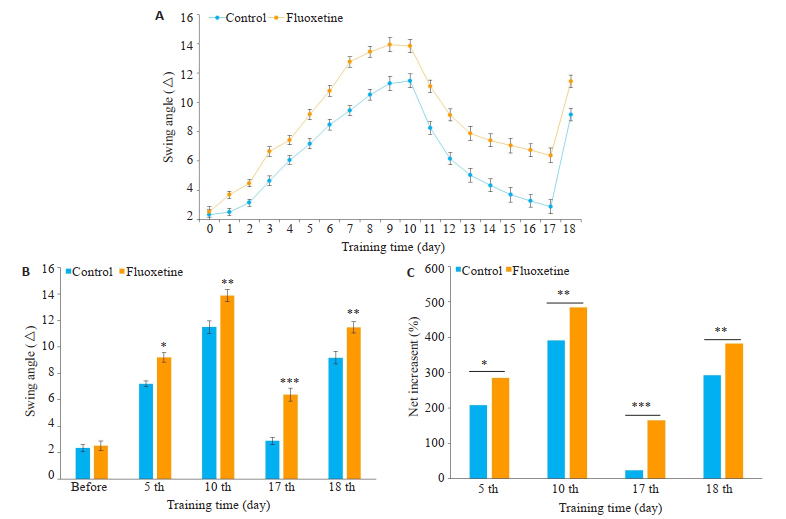
|
图 1 小鼠胡须摆动角度结果 Fig.1 Measurement of the angle of whisker deflection of the mice (n=13). A: Daily recording of the angle of whisker deflection; B: Mean angle of whisker deflection at different time points in the two groups; C: Net increase (percentage) of the angle of whisker deflection in the two groups. *P < 0.05, **P < 0.01, ***P < 0.001 vs control. |
氟西汀组(绿色)小鼠胡须摆动频率在第1~10天,及第18天都在增加且均大于对照组(黑色),第10~17天氟西汀组的消退趋势低于对照组,但频率高于对照组(图 2A)。在乙酸丁酯气味刺激下,氟西汀组小鼠第5、10、17、18天的胡须摆动频率与对照组小鼠相比增加明显(n=13,P < 0.05,图 2B)。训练第5、10、17、18天氟西汀组小鼠胡须摆动频率的净增加值高于对照组小鼠(n= 13,P < 0.01,图 2C)。
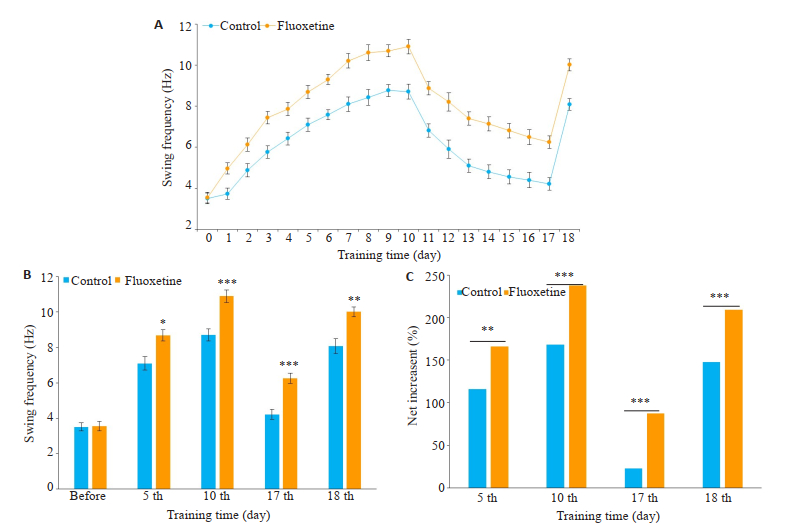
|
图 2 小鼠胡须摆动频率结果 Fig.2 Frequency of whisker deflection in the two groups (n=13). A: Dynamic diagram of whisker deflection frequency; B: Statistics of whisker deflection frequency; C: Net increase (percentage) of whisker deflection frequency. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group. |
训练第10天时对氟西汀组和对照组小鼠左侧桶状皮层进行场电位信号记录,在给予小鼠右侧胡须5 Hz机械振动、持续10 s情况下,记录到刺激诱发的场电位信号(图 3)。对记录信号进行统计分析可以得出,在训练第10天时,给予小鼠10 s的5 Hz机械振动刺激,氟西汀组及对照组所记录到的局部场电位信号的频率分别为5.08±0.48 Hz和3.54±0.43 Hz(n=12),差异有统计学意义(P < 0.05)。
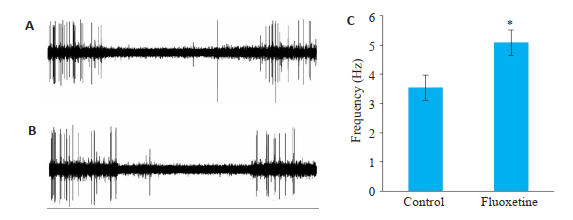
|
图 3 训练第10天小鼠场电位信号 Fig.3 Field potential signal recording on the 10th day of training (n=12). A: Fluoxetine group; B: Control group; C: On the 10th day of training, the frequency of the field potential signal was recorded in the left barreled cortex of the two groups after right whisker stimulation. *P < 0.05 vs control group. |
训练第17天时对氟西汀组和对照组小鼠左侧桶状皮层以相同的方法进行场电位信号记录(图 4)。对记录信号进行统计分析可以得出,在训练第17天时,给予小鼠10 s的5 Hz机械振动刺激,氟西汀组及对照组所记录到的局部场电位信号的频率分别为3.08±0.36 Hz和1.83±0.32 Hz(n=12),氟西汀组高于对照组(图 4C,P < 0.05)。
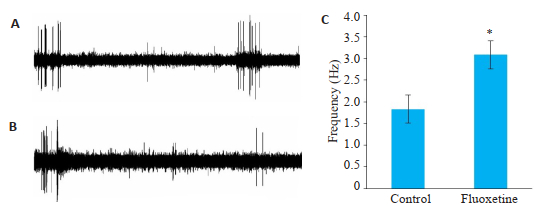
|
图 4 训练第17天小鼠场电位信号 Fig.4 Field potential signal recording on the 17th day of training (n=12). A: Fluoxetine group; B: Control group; C: On the 17th day of training, the frequency of the field potential signal was recorded in the left barreled cortex of the two groups after right whisker stimulation. *P < 0.05 vs control group. |
联合式学习是同一生物体反复受到2种或2种以上、在时间上很靠近的刺激,最终使得大脑内部逐渐形成相互联系[15]。就整个生命中的认知而言联合式学习和记忆是一种常见的信息获得和存储方式[16-17]。已有的研究表明突触连接和神经元活动强度的可塑性可能是学习和记忆的细胞机制[18-19],但通路中突触和神经元活动的增强或抑制不能解释相关信号的整合存储。为此新的假说被提了出来,认为神经细胞被改造修饰成了基于受到共同激活感觉皮层新突触神经支配的联合式记忆细胞,大脑皮层区域之间这种新突触的交互联系驱动了联合记忆细胞的产生,能够对多信息进行整合记忆[20-21]。
有研究认为人的学习记忆能力、反映的快慢可能与不同递质的释放及浓度有关[22]。为了对联合式记忆细胞的假说进行探究,一种新型的联合式学习记忆的动物模型被建立起来,通过对胡须触觉、嗅觉和尾部温度的共同刺激来激活多种感觉系统的大脑皮层,以此在不同刺激之间建立交互的联系。脑内5-羟色胺受体系统对学习、记忆、认知等脑功能的调节与胆碱、谷氨酸、多巴胺和去甲肾上腺素能受体系统密切相关[23]。本实验将小鼠嗅觉与触觉联系起来,通过使用5-羟色胺来控制递质水平的改变,从而使试验组与对照组形成差异,证明了联合式训练与该药物的作用下,皮层之间的联系变得更加紧密。5-羟色胺神经元活性的增强和减弱会对记忆及认知能力产生双向的影响[24-25]。图 1、2中小鼠胡须摆动角度及频率结果表明,在氟西汀的作用下,小鼠联合式学习记忆的建立得到加强;对比第10~17天,氟西汀组小鼠的下降趋势放缓,表明氟西汀对记忆的遗忘具有延缓作用;同时在第18天给与训练后胡须频率和角度迅速回复接近峰值,表明氟西汀有助于记忆的重建。场电位实验中小鼠数量减少是由于测量场电位的方法是需将小鼠麻醉后将头皮打开,使用钻孔器在小鼠头骨上的相应位置打孔,再将电极插入相应脑区进行场电位记录,所以小鼠有死亡损失在所难免。本研究结果显示在桶状皮层记录到嗅觉诱导的信号,表明在经过联合式学习记忆训练后,胡须对应的桶状皮层与嗅觉对应的梨状皮层之间建立了联系。且与对照组相比,氟西汀组学习记忆建立的速度及程度明显更高,其机制氟西汀诱发的5-HT水平改变可能是递质增强了联合记忆细胞和突触的功能,或是加速了相关脑区轴突的交互投射和突触联系以及联合记忆细胞的形成[21]。联想记忆细胞可能是综合储存相关信号[26]。场电位结果证明了联合式训练使皮层之间形成了联系,在表达这种联想记忆的小鼠中,部分桶状和梨状皮层神经元接受新的突触输入,这是基于它们与先天突触输入的相互影响,因此这些神经元编码相关的新的和先天的信号,即联想记忆细胞。
记忆形成和消退的机制涉及神经细胞的修饰重塑、新的突触联系、神经递质及其受体等多方面的影响,现在为止仍然不够明确[27-30]。对联合式学习记忆确切机制的研究可能为日常学习能力的提升、记忆的延缓提供帮助。在后续的实验过程中,我们将利用各种生物技术进一步探究药物在学习记忆中对联合记忆细胞及新突触联系作用的确切机制。
| [1] |
Zilong G, Lei C, Ruicheng F, et al. Associations of unilateral whisker and olfactory signals induce synapse formation and memory cell recruitment in bilateral barrel cortices: cellular mechanism for unilateral training toward bilateral memory[J]. Front Cell Neurosci, 2016, 10(3): 457-65. |
| [2] |
Dangui W, Jun Z, Zilong G, et al. Neurons in the barrel cortex turn into processing whisker and odor signals: a cellular mechanism for the storage and retrieval of associative signals[J]. Front Cell Neurosci, 2015, 9(7): 1015-26. |
| [3] |
Kandel ER, Pittenger C. The past, the future and the biology of memory storage[J]. Biol Sci, 1999, 354(1392): 2027-52. DOI:10.1098/rstb.1999.0542 |
| [4] |
Wang JH, Chen N, Gao Z, et al. Upregulation of glutamatergic receptor-channels is associated with cross-modal reflexes encoded in barrel cortex and piriform cortex[J]. Biophys J, 2014, 106(2): 191-9. |
| [5] |
Liu Y, Gao Z, Chen C, et al. Piriform cortical glutamatergic and GABAergic neurons express coordinated plasticity for whiskerinduced odor recall[J]. Oncotarget, 2017, 8(56): 95719-40. |
| [6] |
Xu W, Sudhof TC. A neural circuit for memory specificity and generalization[J]. Science, 2013, 339(6125): 1290-5. DOI:10.1126/science.1229534 |
| [7] |
赵欣.皮层谷氨酸能和GABA能神经元可塑性与学习效率相关[D].蚌埠, 蚌埠医学院, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10367-1017211320.htm
|
| [8] |
Artigas F. Developments in the field of antidepressants, where do we go now[J]. Eur Neuropsychopharmacol, 2015, 25(5): 657-70. DOI:10.1016/j.euroneuro.2013.04.013 |
| [9] |
Meneses A, Liy-Salmeron G. Serotonin and emotion, learning and memory[J]. Rev Neurosci, 2012, 23(5): 543-53. |
| [10] |
Cahill L, Mcgaugh JL, Cahill L, et al. Mechanisms of emotional arousal and lasting declarative memory (review). Trends Neurosci 21: 294-299[J]. Trends Neurosci, 1998, 21(7): 294-9. DOI:10.1016/S0166-2236(97)01214-9 |
| [11] |
Mcgaugh JL. The amygdala modulates the consolidation of memories of emotionally arousing experiences[J]. Annual Rev Neurosci, 2004, 27(1): 1-28. DOI:10.1146/annurev.neuro.27.070203.144157 |
| [12] |
Olivares-Nazario M, Alonso F, Lucía M. Age-related changes in the antidepressant-like effect of desipramine and fluoxetine in the rat forced-swim test[J]. Behaviour Pharmacol, 2015, 27(1): 22-9. |
| [13] |
Ding L, Zhang S, Chen S, et al. Effect and medchanism of lentivirusmediated silencing of TPX2 gene on proliferation and apoptosis of human hepatoma cells[J]. J Cell Biochem, 2018, 51(6): 717-26. |
| [14] |
Fenxia Y, Zilong G, Pin C, et al. Coordinated plasticity between barrel cortical glutamatergic and GABA ergic neurons during associative memory[J]. Neural Plasticity, 2016, 26(3): 1-20. |
| [15] |
Carl CH, Petersen J. The barrel cortex-integrating molecular, cellular and systems physiology[J]. Physiol, 2003, 447(2): 126-34. |
| [16] |
Sara SJ. The locus coeruleus and noradrenergic modulation of cognition[J]. Nat Rev Neurosci, 2009, 10(3): 211-23. DOI:10.1038/nrn2573 |
| [17] |
Ventura R. Prefrontal norepinephrine determines attribution of "high" motivational salience[J]. PLoS One, 2008, 3(8): e3044-53. DOI:10.1371/journal.pone.0003044 |
| [18] |
Bouret S, Sara J. Reward expectation, orientation of attention and locus coeruleus-medial frontal cortex interplay during learning[J]. Europ J Neurosci, 1997, 80(3): 697-715. DOI:10.1016/S0306-4522(97)00060-2 |
| [19] |
Aston G, Rajkowski J, Kubiak M. Conditioned responses of monkey locus coeruleus neurons anticipate acquisition of discriminative behavior in a vigilance task[J]. Neuroscience, 1997, 80(3): 697-715. |
| [20] |
Takehara-Nishiuchi K, Mcnaughton BL. Spontaneous changes of neocortical code for associative memory during consolidation[J]. Neurosci Res, 2008, 322(5903): 960-3. |
| [21] |
Wang JH, Cui S. Associative memory cells and their working principle in the brain[J]. F1000 Res, 2018, 7(2): 108-17. |
| [22] |
范瑞晨.信息在双侧大脑半球不对称储存的神经基础[D].蚌埠, 蚌埠医学院, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10367-1015320714.htm
|
| [23] |
张玉向, 梁峰, 汤政, 等. 脑内5-羟色胺受体6对学习记忆和药物成瘾的调节作用[J]. 中国药物依赖性杂志, 2016, 25(4): 346-50. |
| [24] |
Wagatsuma A, Okuyama T, Sun C, et al. Locus coeruleus input to hippocampal CA3 drives single-trial learning of a novel context[J]. Proc NatlAcad Sci USA, 2017, 115(2): E310-8. |
| [25] |
Xu S, Das G, Hueske E, et al. Dorsal raphe serotonergic neurons control intertemporal choice under trade-off[J]. Curr Biol, 2017, 9098(217): 311727-36. |
| [26] |
Malenka RC, Nicoll RA. Long-term potentiation-a decade of progress[J]. Science, 1999, 285(5435): 1870-4. DOI:10.1126/science.285.5435.1870 |
| [27] |
Nicoll RA, Kauer JA, Malenka RC. The current excitement in long term potentiation[J]. Neuron, 1988, 1(2): 97-103. DOI:10.1016/0896-6273(88)90193-6 |
| [28] |
Poo MM, Pignatelli M, Ryan J, et al. What is memory? The present state of the engram[J]. BMC Biology, 2016, 14(1): 40-5. DOI:10.1186/s12915-016-0261-6 |
| [29] |
Rui G, Rongjing G, Shidi Z, et al. Associative memory extinction is accompanied by decayed plasticity at motor cortical neurons and persistent plasticity at sensory cortical neurons[J]. Front Cell Neurosci, 2017, 11(5): 168-79. |
 2020, Vol. 40
2020, Vol. 40

