2. 重庆市人民医院内分泌//中西医结合科,重庆 400013
2. Department of Endocrinology/Integrated Chinese and Western Medicine, Chongqing General Hospital, Chongqing 400013, China
肌肉减少症,简称肌少症,是近年来定义的新的老年综合征,以肌量减少、肌力减弱和活动能力下降为主要特征,既可以是增龄性骨骼肌退行性变化,也可以继发于营养不良、缺乏运动、肿瘤或内分泌疾病等[1-3]。研究证实2型糖尿病(T2DM)老年患者发生肌少症的概率为正常人群的2~3倍[4-5]。白蛋白尿是糖尿病肾脏疾病的特征性改变,与终末期肾病(ESRD)发病率、死亡率及心血管疾病风险有显著相关性[6-8]。尽管研究证实ESRD患者与早期CKD患者相比,肌量减少程度更重,发生更早[9-10],然而,尚无研究证实2型糖尿病患者中肌少症与2型糖尿病并发白蛋白尿的关系。双能X线吸收法(DEXA)是目前国际上评价身体成分的可靠指标[11]。本研究旨在利用DEXA测定T2DM患者的身体成分,探究肌少症与2型糖尿病并发白蛋白尿的关系。
1 资料和方法 1.1 研究对象收集2015年1月~ 2018年12月于我院肾脏内科或内分泌内科住院治疗且临床生化资料完整的360例T2DM患者,入选标准:(1)符合2014年美国糖尿病协会(ADA)提出的T2DM诊断标准[12];(2)完成T2DM并发症筛查;(3)年龄20~80岁。排除标准(1)严重心血管疾病;(2)严重肝损害;(3)已诊断恶性肿瘤;(4)急性感染期,白细胞≥10×109/L或高敏C反应蛋白≥10 mg/L;(5)同时使用利尿剂、激素等影响水钠潴留的药物;(6)伴有引起水钠潴留的各种疾病;(7)急性肾损伤。本研究经重庆市人民医院伦理委员会批准,批文号为2013年科伦药审查(12)号,受试者均签署知情同意书。所有随访及记录均由重庆市人民医院肾脏内科住院医师完成。
1.2 方法 1.2.1 肾病指标定义(1)白蛋白尿诊断标准:3月内3次检查中伴2次以上随机尿微量白蛋白肌酐比(UACR) > 30 mg/g Cr,排除尿路感染、尿路梗阻、肾炎、发热等对尿白蛋白有影响的因素,即诊断为白蛋白尿;(2)CKD:估计的肾小球滤过率(eGFR)使用肾脏病饮食改良研究公式(MDRD公式)计算,慢性肾脏病(CKD)定义为eGFR小于60 mL/min/1.73 m2,本研究中无eGFR小于30 mL/min/1.73 m2的受试者,且无白蛋白尿同时合并eGFR小于60 mL/min/1.73 m2的受试者。
1.2.2 基本资料(1)基本信息:性别、年龄、吸烟史、饮酒史;(2)人体测量学指标:体质指数(BMI),研究对象清晨空腹,测量腰围(精确到0.1 cm),脱鞋测量身高(精确到0.5 cm)、体质量(精确到0.1 kg),计算BMI(BMI=体质量/身高2)。
1.2.3 DEXADEXA扫描仪为Hologic scanner(Bedford, )。所有操作均按照仪器说明书的规范进行:被检测者平卧,采用标准模式由头部向足部进行扫描。扫描范围宽度固定为60 cm,扫描时间大约20 min。采用Hologic全身DXEA参考数据库对计算相应数据。测定指标包括骨骼肌指数(SMI)、附肢肌质量(ALM),肌肉指数(ALMH),总体脂(TBF),骨矿含量(BMC)、骨密度(BMD)。DEXA由本院老年病科1名熟练技师操作。肌肉减少症定义为SMI小于35.9%(男性)或30.6%(女性)[3]。
1.2.4 实验室检测糖化血红蛋白(HbA1c)采用我院内分泌实验室高压液相HbA1c测定仪检测。空腹静脉血浆血糖(FPG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、甘油三酯(TG)及尿酸(UA)采用我院医学检验科全自动生化分析仪测定。按WHO标准测定患者血压。
1.3 统计学分析采用SPSS 22.0软件进行资料分析。均进行方差齐性检验及正态性分布检验,计量资料若服从正态分布用均数±标准差表示,若非正态分布用中位数(上下四分位数)表示。正态分布计量资料进行t检验,非正态分布计量资料进行秩和检验(u检验),计数资料采用率来描述并进行卡方检验(χ2检验)。相关性分析采用多元Logistic回归分析,计算OR值。并计算95%可信区间(95%CI)。P < 0.05为差异有统计学意义。
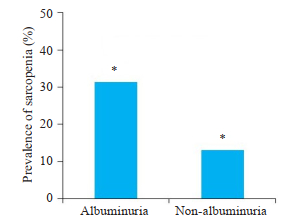
2 结果 2.1 临床特征及实验室检查结果比较患者的临床特征及实验室检查结果(表 1)。122例2型糖尿病伴有白蛋白尿患者,238例2型糖尿病不伴白蛋白尿患者。两组间的T2DM病程、高血压病史、年龄、SBP、LDL-C、TG、UA、WC、UACR、Scr及eGFR的差异有统计学意义(P < 0.05),余指标两组间差异无统计学意义。白蛋白尿组(31.4% vs 13.1%,χ2值=16.207,P < 0.01)肌少症患病率较对照组显著升高(图 1)。
| 表 1 白蛋白尿组与非白蛋白尿组临床特征比较 Tab.1 Comparison of clinical characteristics between patients with albuminuria and those without albuminuria |
|
图 1 肌少症患病率 Fig.1 Prevalence of sarcopenia (%). *P < 0.001. |
白蛋白尿组中SMI为(36.2±5.23)%,无白蛋白尿组中SMI为(37.5±4.98)%,两组间有显著差异(t=-2.304,P=0.021)。与无白蛋白尿组相比,白蛋白尿组BMI [24.24(22.27-26.18)比25.44(23.42-27.66)kg/m2,Z=-5.534,P < 0.01]显著降低,而TBF(Z=-2.838,P < 0.01)显著增高,ALM、ALMH、BMC及BMD及TLM差异无统计学意义(表 2)。
| 表 2 白蛋白尿组与非白蛋白尿组体质分布特征比较 Tab.2 Comparison of body composition parameters between albuminuria group and non-albuminuria group |
2型糖尿病未并发白蛋白患者中共筛选CKD(eGFR小于60 mL/min/1.73 m2)患者55名(23%)。分别以是否伴有白蛋白尿或CKD为因变量,分别以性别、年龄、T2DM病程、高血压病史、SBP、HbA1c、ALM、ALMH、BMI及SMI三分位为自变量,进行单因素logistic回归分析。白蛋白尿与年龄[OR 1.05(95% CI 1.03,1.06)]、T2DM病程[OR 1.06(95% CI 1.04,1.08)]、高血压病史[OR 3.39(95% CI 2.53,4.53)]、SBP[OR 1.12(95% CI 1.03,1.68)]、BMI [OR 1.06(95% CI 1.03,1.12)]、SMI中分位[OR 1.85(95%CI 1.05,3.27)]、SMI低分位[OR 1.87(95%CI 1.06,3.31)]有关(P < 0.05)。CKD与年龄[OR 1.06(95% CI 1.04,1.12)]、T2DM病程[OR 1.08(95%CI 1.06,1.10)]、高血压病史[OR 3.89(95%CI 2.45,4.98)]、SBP[OR 1.19(95%CI 1.05,1.72)]、BMI[OR 1.10(95%CI 1.02,1.14)]有关(P < 0.05),而与SMI中分位[OR 1.11(95%CI 0.80,1.55)]、SMI低分位[OR 1.21(95%CI 0.69,1.44)]无关(表 3)。
| 表 3 单因素Logistic回归 Tab.3 Univariate logistic regression |
分别以是否伴有白蛋白尿或CKD为因变量,将单因素分析中有统计学意义的年龄、T2DM病程、高血压病史、SBP、BMI和SMI三分位纳入多因素logistic回归分析。同时校正性别、TBF、吸烟史、饮酒史、HbA1c、LDL-C、HDL-C与TG。与SMI高分位相比,SMI中分位、SMI低分位患白蛋白尿的风险显著升高[高分位为参照,中分位OR:2.27(95%CI:1.20,4.29),P=0.011;低分位OR2.97(95%CI:1.32,6.36),P=0.010]。而SMI中分位和低分位均与CKD无显著相关(P > 0.05,表 4)。
| 表 4 多因素Logistic回归 Tab.4 Multivariate logistic regression |
T2DM并发白蛋白尿或CKD患者中,肌少症患病率均显著增高。本研究首次证实发现肌少症(SMI降低)与T2DM并发白蛋白尿发生密切相关,校正年龄、性别、糖尿病病程等多种混杂因素后,SMI减低仍是T2DM并发白蛋白尿的独立危险因素。以上结果提示,当在T2DM患者中发现肌肉减少时,即SMI降低时,应考虑T2DM并发白蛋白尿发生的可能。
身体成分主要包含脂肪、肌肉和骨组织,其与肾脏疾病的关系受到了国内外多项研究的关注[4, 13-14]。本研究使用双能X射线吸收测定法(DEXA)评估肌肉质量,尽管MRI为身体成分测定的金标准,但DEXA在肌肉测定方面与MRI相比有较好的一致性[15]。其次,本研究将T2DM并发白蛋白尿与CKD(以eGFR变化为临床变化特征)进行比较,旨在比较肌肉减少对2型糖尿病并发白蛋白尿患者的特征性影响。最后,本研究校正包括年龄,性别,生活方式,人体测量结果和实验室检测结果等常见混杂因素,结论更加可信。
既往刘志红院士团队确证,ESRD患者的骨骼肌质量和强度的下降,同时发现接受维持性血液透析患者的肌少症发病率显著升高,并且随着年龄的增长而逐渐增加,且肌少症患者的死亡风险高于无肌少症的患者[16]。Noori等证实,中臂肌围(MAMC)与瘦体重(LBM)的一致性良好,且为接受维持性血液透析的患者生存率和心理健康改善情况的独立预测因子[17]。另有研究证实,在ESRD患者中,糖尿病是LBM丢失的有效预测因素[18]。多项研究证实在慢性血液透析的非糖尿病患者中,胰岛素抵抗与骨骼肌蛋白的分解有关[19]。对于CKD而言,Foley等首次报道了美国第三次全国健康和营养检查调查(NHANES Ⅲ)中eGFR降低与肌少症患病率增加之间的关联,该项研究中,大多数(76.9%)参与者是白种人,并且使用生物电阻抗分析方程计算骨骼肌质量,研究结果显示,CKD 1期、2期和3期及以上患者的肌少症患病率分别为3.8%,5.3%和9.4%[4]。此外,韩国国家健康和营养检查调查研究(KNHANES)证实,CKD分期与男性肌少症患病率增加显著相关,但与女性肌少症患病率无关,可能与女性家务劳作增多有关[20]。进一步研究证实,2011年KNHANES调查显示在SMI降低患者中白蛋白尿的患病率在显著高于正常SMI患者[21]。此外,Han等[22]报道,KNHANES的总人口中白蛋白尿的总患病率为16.5%,肌肉减少症与发生白蛋白尿的风险增加有关(OR 1.76~2.88,P < 0.05),而与其余合并症无关。Moon等[20]报道,在包括2型糖尿病患者的社区人群中,校正的偏相关分析显示SMI值与男性白蛋白尿发生率相关,但与女性无关,与既往报道一致。而本研究显示,白蛋白尿组中TBF显著高于对照组,而BMI显著低于对照组,与既往研究结论一致。同时,白蛋白尿组中SMI显著低于对照组,提示肌肉含量减少可能是白蛋白尿的独立危险因素;而ALM、ALMH未见明显差异,提示四肢肌肉组织可能与白蛋白尿的风险没有显著相关性。此外SMI可能与CKD无关。与CKD相比,白蛋白尿的发生可能更具有特殊性,如胰岛素抵抗、内皮细胞功能异常等多种病理过程均可能影响肌肉含量与白蛋白尿的关系[23]。
肌少症和白蛋白尿的发生有较相似的的病理生理机制,包括胰岛素抵抗,内皮功能障碍,炎症,氧化应激和RAS的激活等[24-25]。骨骼肌是负责胰岛素介导的人体葡萄糖处理的最大器官[26-27]。既往研究报道,在韩国人群中,肌少症与胰岛素抵抗,糖尿病和代谢综合征有关[28]。此外,骨骼肌减少可能导致胰岛素抵抗,促进白蛋白尿和心血管疾病的发生[29]。且胰岛素抵抗已被证明可使肾小球内皮细胞功能障碍,肾小球高滤过以及肾小管通透性增加,从而导致白蛋白尿[30-31]。同时,既往研究证实白蛋白尿患者中,肾小球内皮细胞功能障碍可导致血管舒张异常和炎症细胞浸润增强进而升高白蛋白尿的发生风险[32]。以上均可能是肌少症导致白蛋白尿发生的机制原因,但仍需进一步试验证实。
本研究的主要不足包括:研究对象仅来源于我院住院患者,样本的代表性有一定限制。其次,本研究采用横断面设计,难以确定明确的因果关系。
综上所述,在调整混杂因素后,肌少症(SMI降低)在2型糖尿病并发白蛋白尿患者中的患病率高于2型糖尿病并发CKD(eGFR < 60 mL/min/1.73 m2)的患者,肌少症与2型糖尿病患者白蛋白尿的发生独立相关。肌少症与肾脏疾病的关系有待更多不同人群的大样本、前瞻性研究验证。
| [1] |
Chun SW, Kim W, Choi KH. Comparison between grip strength and grip strength divided by body weight in their relationship with metabolic syndrome and quality of life in the elderly[J]. PLoS One, 2019, 14(9): e0222040. DOI:10.1371/journal.pone.0222040 |
| [2] |
Clark BC, Woods AJ, Clark LA, et al. The aging brain & the dorsal basal ganglia: implications for age-related limitations of mobility[J]. Adv Geriatr Med Res, 2019, 1. |
| [3] |
Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: european consensus on definition and diagnosis: report of the european working group on sarcopenia in older people[J]. Age Ageing, 2010, 39(4): 412-23. DOI:10.1093/ageing/afq034 |
| [4] |
Foley RN, Wang C, Ishani A, et al. Kidney function and sarcopenia in the United States general population: NHANES Ⅲ[J]. Am J Nephrol, 2007, 27(3): 279-86. DOI:10.1159/000101827 |
| [5] |
Mesinovic J, Zengin A, De Courten B, et al. Sarcopenia and type 2 diabetes mellitus: a bidirectional relationship[J]. Diabetes Metab Syndr Obes, 2019, 12: 1057-72. DOI:10.2147/DMSO.S186600 |
| [6] |
Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9): 948-59. DOI:10.1001/jama.2013.168118 |
| [7] |
Guo K, Zhang L, Zhao F, et al. Prevalence of chronic kidney disease and associated factors in Chinese individuals with type 2 diabetes: Cross-sectional study[J]. J Diabetes Complications, 2016, 30(5): 803-10. DOI:10.1016/j.jdiacomp.2016.03.020 |
| [8] |
Afkarian M, Sachs MC, Kestenbaum B, et al. Kidney disease and increased mortality risk in type 2 diabetes[J]. J Am Soc Nephrol, 2013, 24(2): 302-8. DOI:10.1681/ASN.2012070718 |
| [9] |
Qureshi AR, Alvestrand A, Danielsson A, et al. Factors predicting malnutrition in hemodialysis patients: a cross-sectional study[J]. Kidney Int, 1998, 53(3): 773-82. DOI:10.1046/j.1523-1755.1998.00812.x |
| [10] |
Domanski M, Ciechanowski K. Sarcopenia: a major challenge in elderly patients with end-stage renal disease[J]. J Aging Res, 2012, 2012: 754739. |
| [11] |
Salamone LM, Fuerst T, Visser M, et al. Measurement of fat mass using DEXA: a validation study in elderly adults[J]. J Appl Physiol (1985), 2000, 89(1): 345-52. DOI:10.1152/jappl.2000.89.1.345 |
| [12] |
American Diabetes A. Standards of medical care in diabetes--2014[J]. Diabetes Care, 2014, 37(Suppl 1): S14-80. |
| [13] |
Hori S, Morizawa Y, Gotoh D, et al. Evaluation of preoperative abdominal adipose tissue-, Inflammation-, Muscle Mass-, and nutritional status-based prognostic markers to assess renal dysfunction in living kidney donors[J]. Transplant Proc, 2019, 51(6): 1706-16. DOI:10.1016/j.transproceed.2019.04.057 |
| [14] |
Karava V, Printza N, Dotis J, et al. Body composition and arterial stiffness in pediatric patients with chronic kidney disease[J]. Pediatr Nephrol, 2019, 34(7): 1253-60. DOI:10.1007/s00467-019-04224-8 |
| [15] |
Karlsson AK, Kullberg J, Stokland E, et al. Measurements of total and regional body composition in preschool children: a comparison of MRI, DXA, and anthropometric data[J]. Obesity (Silver Spring), 2013, 21(5): 1018-24. DOI:10.1002/oby.20205 |
| [16] |
Ren H, Gong D, Jia F, et al. Sarcopenia in patients undergoing maintenance hemodialysis: incidence rate, risk factors and its effect on survival risk[J]. Ren Fail, 2016, 38(3): 364-71. DOI:10.3109/0886022X.2015.1132173 |
| [17] |
Noori N, Kopple JD, Kovesdy CP, et al. Mid-arm muscle circumference and quality of life and survival in maintenance hemodialysis patients[J]. Clin J Am Soc Nephrol, 2010, 5(12): 2258-68. DOI:10.2215/CJN.02080310 |
| [18] |
Pupim LB, Heimburger O, Qureshi AR, et al. Accelerated lean body mass loss in incident chronic dialysis patients with diabetes mellitus[J]. Kidney Int, 2005, 68(5): 2368-74. DOI:10.1111/j.1523-1755.2005.00699.x |
| [19] |
O'Sullivan AJ, Kelly JJ. Insulin resistance and protein catabolism in non-diabetic hemodialysis patients[J]. Kidney Int, 2007, 71(2): 98-100. DOI:10.1038/sj.ki.5002045 |
| [20] |
Moon SJ, Kim TH, Yoon SY, et al. Relationship between stage of chronic kidney disease and sarcopenia in korean aged 40 years and older using the korea national health and nutrition examination surveys (KNHANES Ⅳ-2, 3, and Ⅴ-1, 2), 2008-2011[J]. PLoS One, 2015, 10(6): e0130740. DOI:10.1371/journal.pone.0130740 |
| [21] |
Kim JH, Park KS, Hong AR, et al. Diagnostic role of captopril challenge test in korean subjects with high aldosterone-to-renin Ratios[J]. Endocrinol Metab (Seoul), 2016, 31(2): 277-83. DOI:10.3803/EnM.2016.31.2.277 |
| [22] |
Han E, Lee YH, Kim G, et al. Sarcopenia is associated with albuminuria independently of hypertension and diabetes: KNHANES 2008-2011[J]. Metabolism, 2016, 65(10): 1531-40. DOI:10.1016/j.metabol.2016.07.003 |
| [23] |
Timmerman KL, Volpi E. Endothelial function and the regulation of muscle protein anabolism in older adults[J]. Nutr Metab Cardiovasc Dis, 2013, 23(Suppl 1): S44-50. |
| [24] |
Carre JE, Affourtit C. Mitochondrial activity and skeletal muscle insulin resistance in kidney disease[J]. Int J Mol Sci, 2019, 20(11): 2751-66. DOI:10.3390/ijms20112751 |
| [25] |
Kitada M, Ogura Y, Monno I, et al. A Low-protein diet for diabetic kidney disease: its effect and molecular mechanism, an approach from animal studies[J]. Nutrients, 2018, 10(5): 544-55. DOI:10.3390/nu10050544 |
| [26] |
Mizgier ML, Fernandez-Verdejo R, Cherfan J, et al. Insights on the role of putative muscle-derived factors on pancreatic beta cell function[J]. Front Physiol, 2019, 10: 1024. DOI:10.3389/fphys.2019.01024 |
| [27] |
Hernandez MAG, Canfora EE, Jocken JWE, et al. The short-chain fatty acid acetate in body weight control and insulin sensitivity[J]. Nutrients, 2019, 11(8): 1943-75. DOI:10.3390/nu11081943 |
| [28] |
Moon SS. Low skeletal muscle mass is associated with insulin resistance, diabetes, and metabolic syndrome in the korean population: the korea national health and nutrition examination survey (KNHANES) 2009-2010[J]. Endocr J, 2014, 61(1): 61-70. |
| [29] |
Pryzbek M, MacDonald M, Stratford P, et al. Long-term enrollment in cardiac rehabilitation benefits cardiorespiratory fitness and skeletal muscle strength in men with cardiovascular disease[J]. Can J Cardiol, 2019, 1359-65. |
| [30] |
Groop PH, Forsblom C, Thomas MC. Mechanisms of disease: pathway-selective insulin resistance and microvascular complications of diabetes[J]. Nat Clin Pract Endocrinol Metab, 2005, 1(2): 100-10. DOI:10.1038/ncpendmet0046 |
| [31] |
De Cosmo S, Menzaghi C, Prudente S, et al. Role of insulin resistance in kidney dysfunction: insights into the mechanism and epidemiological evidence[J]. Nephrol Dial Transplant, 2013, 28(1): 29-36. DOI:10.1093/ndt/gfs290 |
| [32] |
Feldt-Rasmussen B. Microalbuminuria, endothelial dysfunction and cardiovascular risk[J]. Diabetes Metab, 2000, 26(Suppl 4): 64-6. |
 2020, Vol. 40
2020, Vol. 40

