2. 广东省人民医院//广东省医学科学院超声科,广东 广州 510080
2. Department of Ultrasound, Guangdong Provincial People's Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
甲状腺结节是甲状腺常见疾病,近年来发病率呈显著上升的趋势[1-3],研究显示高分辨率彩色多普勒超声检查甲状腺结节患病率高达68%[4],但多数甲状腺结节为良性病变[5-6],仅约5%为恶性病变[7-9]。如何简便、无创、经济且准确地鉴别甲状腺结节良恶性指导后续治疗是临床医生关注的重点问题[10-11]。然而恶性甲状腺结节并无典型的临床特征,通过临床表现难以与良性甲状腺结节相鉴别。超声作为甲状腺疾病首选的检查方式,其对甲状腺结节良恶性的鉴别诊断具有独特的优势;但恶性甲状腺结节的彩超征象并不具有特异性,根据单一的彩超征象难以准确的鉴别甲状腺结节的性质。
近年多项研究通过组合彩超征象建立甲状腺结节恶性风险分级系统(TI-RADS)。Kwak等[12-14]建立的5级法TI-RADS分级系统是目前临床上使用较为广泛,指南中推荐且具有显著临床价值的甲状腺结节良恶性风险评估工具。研究显示含有该系统5个恶性征象的甲状腺结节其恶性率为87.5%,而含有4个恶性征象的甲状腺结节其恶性率为72.4%[15]。ATA、AACE以及BTA等多个国际权威学会均推荐根据彩超征象对甲状腺结节进行恶性风险评估和分层管理[16-19]。但由于不同学者建立的分级系统对结节彩超征象描述和定义具有一定的差别,缺乏统一的术语和标准,至今仍无被广泛接受和使用的甲状腺结节恶性风险彩超分级系统[12, 17, 19-20]。
美国放射科学会于2017年推荐了ACR TI-RADS甲状腺结节恶性风险评估分级系统[20-21]。但该系统在临床中的诊断价值以及其与传统Kwak TI-RADS诊断效能的对比尚未明确。本研究拟利用我们既往的数据分析最新的ACR TI-RADS分级系统在甲状腺结节良恶性鉴别的临床价值,对比ACR TI-RADS分级系统与Kwak TI-RADS分级系统在鉴别诊断甲状腺结节良恶性中的准确性。
1 资料和方法 1.1 研究资料选取于2016年2月~2018年2月在广东省人民医院内分泌科行甲状腺结节细针穿刺检查(FNA)的患者作为研究对象,共纳入331名患者,350个结节。纳入标准:该期间所有已行FNA且贝塞斯达系统为Ⅱ~Ⅵ类甲状腺结节;排除标准:该期间已行FNA但不能获得明确病理诊断的甲状腺结节,即甲状腺FNA细胞学分类-贝塞斯达系统为Ⅰ类的结节。详细入组筛选路径标准(图 1)。
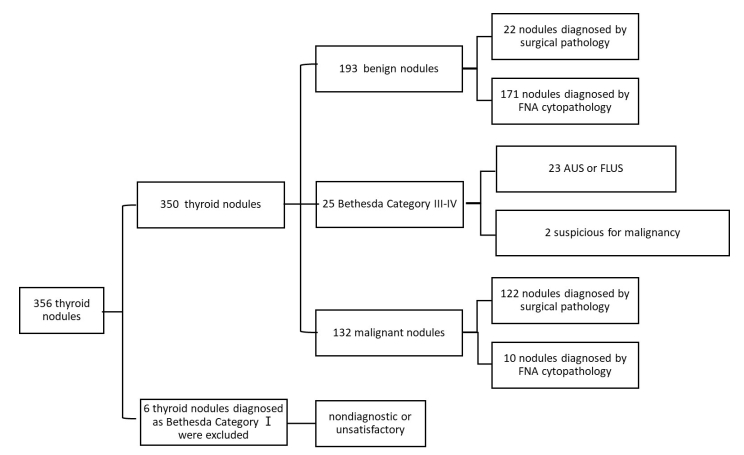
|
图 1 甲状腺结节入组筛选路径 Fig.1 Workflow of the enrollment of the thyroid nodules in this study. |
所有患者FNA检查前均进行超声检查,由经验丰富的医生回顾超声检查数据获得Kwak TI-RADS分级和ACR TI-RADS分级。本研究经广东省人民医院(广东省医学科学研究院)伦理委员会批准(伦理编号:GDREC2018536H(R1))。根据FNA细胞病理或手术组织病理判断甲状腺结节良恶性;进行外科手术的患者以手术病理为诊断标准;未进行手术的患者以FNA细胞病理为诊断标准。手术病理诊断根据WHO诊断标准[22]。细胞病理分类参照美国国家癌症研究所提出的甲状腺FNA细胞学分类-贝塞斯达系统[23],并将Ⅰ类不能诊断的分类排除在外,Ⅲ类和Ⅳ类2种为不能明确诊断的类型,Ⅱ类为良性病变,Ⅴ类和Ⅵ类为恶性病变,最大直径小于1 cm的甲状腺恶性肿瘤定义为微小癌。
1.2 仪器和方法采用彩色多普勒超声诊断仪(加拿大优胜医疗有限公司,型号Sonix SP),采用高频探头(10 MHz)进行甲状腺超声检查。检查时患者取仰卧位,头后仰,充分暴露颈部,对甲状腺进行横断面和纵断面扫查,观察甲状腺结节的形态、边界、大小、纵横比、内部成分、回声、后面回声衰减以及钙化等声像。参考以下ACRTI-RADS和Kwak TI-RADS系统对甲状腺结节恶性风险进行分级。
1.2.1 ACR TI-RADS系统[21]ACR TI-RADS系统共评估下列5个彩超恶性征象,每个征象根据其特征进行评分,计算总积分进行分级。其中0分为TR1级、2分为TR2级、3分为TR3级、4~6分为TR4级、7分及以上为TR5级。组成:囊性或者几乎全部囊性,0分,海绵状0分,囊实性1分,实性或者几乎全部实性2分;回声:无回声0分,高回声或等回声1分,低回声2分,极低回声3分;形态:纵横比 < 10分,纵横比 > 13分;边缘:平滑0分,模糊0分,分叶或不规则2分,浸润到甲状腺包膜外3分;局部回声:没有钙化或钙化伴彗星尾0分,粗大钙化1分,环状钙化2分,点状钙化3分。
1.2.2 Kwak TI-RADS系统[15]Kwak TI-RADS系统包括5个彩超征象:分叶状边缘或边界不规整;纵横比 > 1;实性结节;低回声或者显著低回声;微小钙化。1级:未探及甲状腺结节,正常甲状腺;2级:良性病灶:如单纯囊性、胶质结构等;3级:无上述五种恶性征象;4级:4a具有上述1项恶性征象,4b具有上述2项恶性征象,4c具有上述3~4项恶性征象;5级:具有上述5项恶性征象。
1.3 统计学分析统计学方法采用SPSS 22.0软件,正态分布方差齐计量资料以均数±标准差表示。各系统的诊断效能采用ROC曲线下面积(AUC)评估,同时计算敏感性、特异性、阳性预测值、阴性预测值、阳性似然比、阴性似然比、诊断比值比、约登指数和诊断准确性;通过卡方检验判断两种评分系统诊断的一致性。P < 0.05为差异有统计学意义。
2 结果 2.1 基线资料共收集356例甲状腺结节为研究对象,甲状腺FNA细胞学分类-贝塞斯达系统Ⅰ类不能诊断的病例(6例)排除在外,共入组350例(图 1)。入组350例结节中良性结节193例,恶性结节132例,Ⅲ~Ⅳ类诊断不明结节为25例;良性结节中有22例(11.4%)通过手术病理诊断,171例(88.6%)通过FNA细胞病理诊断;而恶性结节中122例(92.4%)FNA细胞病理提示恶性或可疑恶性并通过手术病理诊断,10例(7.6%)通过FNA细胞病理诊断(表 1)。男性患者79人,女性患者252人;恶性结节男性年龄43.5±11.7岁,女性40.6±11.3岁;Ⅲ~Ⅳ诊断不明结节男性年龄56.5±10.3岁,女性46.7±11.2岁;良性结节男性年龄48.5±15.2岁,女性45.1±14.4岁。在甲状腺恶性结节中,女性患者微小癌的比例为37.6%,而男性患者微小癌的比例为29.0%。临床资料显示恶性甲状腺结节病例中女性患者FT3显著低于男性患者,且女性患者TGAb显著高于男性患者。
| 表 1 甲状腺结节的基本临床特征 Tab.1 Baseline clinical data of patients with thyroid nodules |
根据甲状腺结节的ACR TI-RADS分级和Kwak TI-RADS分级进行了分类(表 2)。其中ACR TI-RADS分级中,TR2级、TR3级、TR4级以及TR5级甲状腺结节恶性率分别为0%、7.1%、28.8%以及83.0%;Kwak TI-RADS分级中3级、4a级、4b级、4c级以及5级甲状腺结节的恶性率分别为3.5%、5.0%、38.2%、78.1%以及78.7%。
| 表 2 两种系统不同各个分级甲状腺结节性质构成比、诊断敏感性、特异性及准确性 Tab.2 Sensitivity, specificity and accuracy of the two TI-RADS classification systems |
两种分级系统的诊断敏感性、特异性、阳性预测值和阴性预测值等分析(表 2),以准确性最高作为诊断最佳阈值。ACR TI-RADS系统以TR5级为最佳阈值,诊断准确率为84.3%,最佳阈值诊断甲状腺恶性结节的敏感性为77.3%,特异性为89.1%,阳性预测值为83.0%,阴性预测值为85.1%。而Kwak TI-RADS分级系统以4c级为最佳阈值,诊断准确性同样为84.3%,其最佳阈值诊断甲状腺恶性结节的敏感性为84.8%,特异性为84.0%,阳性预测值为78.3%,阴性预测值为89.0%。
ACR TI-RADS分级系统ROC曲线AUC为0.879(95% CI 0.841~0.918),Kwak TI-RADS分级系统ROC曲线AUC为0.879(95% CI 0.839~0.918),两者与AUC为0.5的参考曲线对比,差异具有统计学意义(P < 0.05)。两个系统ROC曲线AUC相同,两种系统在甲状腺结节良恶性鉴别诊断效能上差异无统计学意义(图 2)。
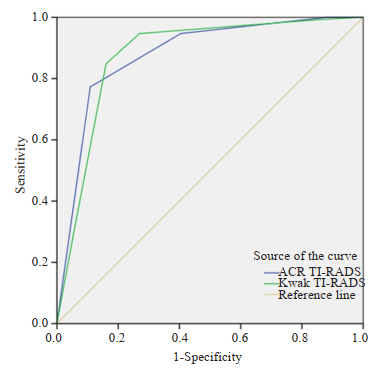
|
图 2 两种分级系统诊断恶性甲状腺结节的ROC曲线 Fig.2 ROC curve of two TI-RADS classification systems. |
两种分级系统逐个分级一致性比较显示ACR TI-RADS系统TR2级中所有结节均分布Kwak TIRADS系统3级;TR3级中93.9%的结节分布Kwak TIRADS 4a级,仅有4%的结节分布Kwak TI-RADS系统3级和2%分布Kwak TI-RADS的4b级,且良性结节中两个系统的一致性更好。TR5级的甲状腺结节中有98.4%分布Kwak TI-RADS分级4c级或5级,且在恶性结节中两个系统一致性更好,TR5级的恶性甲状腺结节全部分布于Kwak TI-RADS 4c级或5级。但TR4级无论是良性结节还是恶性结节其对应的Kwak TI-RADS系统分散于4a-5级之间,两者一致性相对较差(表 3)。
| 表 3 ACR TI-RAD系统和Kwak系统的一致性比较 Tab.3 The consistency comparison of two TI-RADS classification systems |
随着高分辨率彩色多普勒超声技术的成熟和广泛应用以及生活环境和生活方式的改变,甲状腺结节的检出率和发生率显著增加[4, 24]。甲状腺结节治疗方案的确定关键在于结节良恶性鉴别;对于不产生压迫症状且不影响美观的良性甲状腺结节治疗上以随访为主;但恶性病变则以外科手术为主[25]。彩超作为甲状腺结节的首选筛查手段,如何更好的利用超声声像特征进行初步的良恶性鉴别,有着重要的临床价值。由于甲状腺结节的恶性声像图表现多样,良恶性结节超声征象存在部分重叠,单个超声声像特征难以有效的反映结节的恶性风险[26]。
为更好的通过彩超征象鉴别甲状腺结节的良恶性,多个学者提出来甲状腺结节恶性风险分级系统[15, 27-29]。2009年Horvath等首次组合12个超声征象建立TI-RADS系统对甲状腺结节恶性风险进行分级评估[27],但该系统较为复杂在临床上难以展开使用。随后Kwak等对分级系统进行简化,组合5个常见彩超征象将甲状腺结节恶性风险分为5级,操作相对简便,Kwak TI-RADS是至今使用相对广泛的甲状腺结节恶性风险分级系统[15]。本研究结果显示该分级系统对甲状腺结节的良恶性鉴别诊断具有较高的临床意义,其3级、4a级、4b级、4c级以及5级甲状腺结节的恶性率分别为3.5%、5.0%、38.2%、78.1%、78.7%。以4c级作为诊断阈值,Kwak TI-RADS分级诊断甲状腺恶性结节的敏感性为84.8%,特异性为84.0%。
TI-RADS系统对甲状腺结节的诊断和鉴别诊断具有显著价值,但由于各个系统术语和定义的使用不统一,这给临床医生对甲状腺结节诊断、随访和交流带来困难。比如常用的术语“微小钙化”其定义其实是不明确的,Kim等[30]定义为微小的或者点状的高回声病灶伴或不伴声影;而Russ等[31]定义为圆的偶有线性的微小点状高回声病灶且直径小于0.5 mm不伴随声影。美国放射协会为进一步规范甲状腺恶性结节征象超声描述、提高甲状腺恶性结节诊断的敏感性和特异性,指导甲状腺结节规范化诊疗,提出甲状腺结节彩超征象规范化描述[20],并于2017年提出了根据此规范化描述建立的ACR TI-RADS系统[21]。与Kwak TI-RADS系统相比,ACR TI-RADS系统对甲状腺结节5个常见恶性征象进行了更加详细的阐述、定义和分类[20],每个征象根据其彩超特征进行评分;如局部病灶,对于恶性风险较高的征象点状钙化评分最高,为3分,而带有彗星尾表现的大钙化恶性风险较低,评0分。因此ACR TI-RADS系统在结节彩超征象的描述上更加明确、细致和清晰,方便不同医生之间的交流,而且更符合临床实际情况,具有较好的临床实用性。
研究不仅比较了ACR TI-RADS与Kwak TI-RADS两种分级系统对甲状腺结节良恶性诊断的一致性,还分别找出了ACR TI-RADS系统和Kwak TI-RADS分级系统的诊断最佳阈值;并将分级系统中的每个级别的结节作为分层,分别计算各个级别两个系统分级的一致性(表 3),对于每个分级的恶性率以每个分级作为切点诊断的敏感性和特异性。ACR TI-RADS系统和Kwak TI-RADS系统的ROC曲线下面积均为0.879,因此两者在甲状腺结节良恶性鉴别方面的诊断效能类似。ACR TI-RADS诊断甲状腺恶性结节最佳阈值是TR5级,而Kwak TI-RADS诊断甲状腺恶性结节最佳阈值是4c;在最佳阈值时,ACR TI-RADS系统诊断敏感性和阴性预测值略低于Kwak TI-RADS,但其诊断特异性和阳性预测值较Kwak TI-RADS高。ACR TI-RADS系统和Kwak TI-RADS系统诊断一致性检验提示ACR TI-RADS和Kwak TI-RADS鉴别甲状腺结节良恶性具有较高的一致性;这可能是因为两个系统使用相似的彩超征象。另外本组数据还显示在PTC患者中,女性患者FT3血浆水平显著男性患者FT3血浆水平,而女性患者TGAb显著高于女性患者TGAb;但是在良性甲状腺结节患者中,并未观察到类似改变。由此可见PTC男性患者和女性患者甲状腺功能和甲状腺炎性改变是不完全一样,这提示他们可能具有不同的发病机制和病理生理过程。
综上所述,两种超声影像TI-RADS系统在鉴别甲状腺结节良恶性上均有较好的诊断效能,对比Kwak TIRADS,ACR TI-RADS以TR5为诊断阈值具有更高的诊断特异性和较低的诊断敏感性。本研究甲状腺恶性肿瘤患者均局限为甲状腺乳头状癌,甲状腺髓样癌、甲状腺未分化癌等其他甲状腺恶性肿瘤在本文中未有涉及。目前仍需甲状腺其他恶性肿瘤分类的数据进一步验证该研究结论在其他甲状腺恶性肿瘤中是否同样适用。
| [1] |
Rothberger GD, Cohen M, Sahay P, et al. Method of detection of thyroid nodules: correlation with frequency of fine-needle aspiration and malignancy rate[J]. Head Neck, 2020, 42(2): 210-6. DOI:10.1002/hed.25984 |
| [2] |
Ding J, Jiang L, Fang J, et al. Predictors for malignancy risk in subcentimeter thyroid nodules categorized as atypia/follicular lesion of undetermined significance by fine needle aspiration[J]. Sci Rep, 2019, 9(1): 14973. DOI:10.1038/s41598-019-50597-z |
| [3] |
Bauer AJ. Thyroid nodules in children and adolescents[J]. Current opinion in endocrinology, diabetes, and obesity, 2019, 26(5): 266-74. DOI:10.1097/MED.0000000000000495 |
| [4] |
Guth S, Theune U, Aberle J, et al. Very high prevalence of thyroid nodules detected by high frequency (13 MHz) ultrasound examination[J]. Eur J Clin Invest, 2009, 39(8): 699-706. DOI:10.1111/j.1365-2362.2009.02162.x |
| [5] |
Smith-Bindman R, Lebda P, Feldstein VA, et al. Risk of thyroid cancer based on thyroid ultrasound imaging characteristics: results of a population-based study[J]. JAMA Intern Med, 2013, 173(19): 1788-96. DOI:10.1001/jamainternmed.2013.9245 |
| [6] |
Ozgursoy OB, Eisele DW, Tufano RP. The prognostic implications from molecular testing of thyroid cancer[J]. Otolaryngol Clin North Am, 2014, 47(4): 595-607. DOI:10.1016/j.otc.2014.04.010 |
| [7] |
李琦, 沈建国. 细针穿刺细胞学与甲状腺结节鉴别诊断[J]. 国际内分泌代谢杂志, 2010, 30(3): 159-61. DOI:10.3760/cma.j.issn.1673-4157.2010.03.005 |
| [8] |
Kitahara CM, Sosa JA. The changing incidence of thyroid cancer[J]. Nat Rev Endocrinol, 2016, 12(11): 646-53. DOI:10.1038/nrendo.2016.110 |
| [9] |
Morris L, Tuttle RM, Davies L. Changing trends in the incidence of thyroid cancer in the united states[J]. JAMA Otolaryngol Head Neck Surg, 2016, 142(7): 709-11. DOI:10.1001/jamaoto.2016.0230 |
| [10] |
Maia F, Zantutwittmann DE. Thyroid nodule management:clinical, ultrasound and cytopathological parameters for predicting malignancy[J]. Clinics, 2012, 67(8): 945-54. DOI:10.6061/clinics/2012(08)15 |
| [11] |
Paschke R, Cantara S, Crescenzi A, et al. European thyroid association guidelines regarding thyroid nodule molecular fineneedle aspiration cytology diagnostics[J]. Eur Thyroid J, 2017, 6(3): 115-29. DOI:10.1159/000468519 |
| [12] |
Haugen BR. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: what is new and what has changed[J]. ? Cancer, 2017, 123(3): 372-81. DOI:10.1002/cncr.30360 |
| [13] |
Migda B, Migda M, Migda AM, et al. Evaluation of four variants of the thyroid imaging reporting and data system (TIRADS) classification in patients with multinodular goiter[J]. Endokrynol Pol, 2018, 69(2): 156-62. |
| [14] |
Migda B, Migda M, Migda MS, et al. Use of the Kwak thyroid image reporting and data system (K-TIRADS) in differential diagnosis of thyroid nodules:systematic review and meta-analysis[J]. Eur Radiol, 2018, 28(6): 2380-8. DOI:10.1007/s00330-017-5230-0 |
| [15] |
Kwak JY, Han KH, Yoon JH, et al. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk[J]. Radiology, 2011, 260(3): 892-9. |
| [16] |
Md HB, Alexander EK, Bible KC, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133. |
| [17] |
Gharib H, Papini E, Garber JR, et al. American association of clinical endocrinologists, american college of endocrinology, and associazione medici endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules-2016 update[J]. Endocr Pract, 2016, 22(1): 1-60. |
| [18] |
Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association (ATA) guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2009, 19(11): 1167-214. DOI:10.1089/thy.2009.0110 |
| [19] |
Watkinson JC. The British thyroid association guidelines for the management of thyroid cancer in adults[J]. Nucl Med Commun, 2004, 25(9): 897-900. DOI:10.1097/00006231-200409000-00006 |
| [20] |
Grant EG, Tessler FN, Hoang JK, et al. Thyroid ultrasound reporting lexicon: white paper of the ACR thyroid imaging, reporting and data system (TIRADS) committee[J]. J Am Coll Radiol, 2015, 12(12): 1272-9. DOI:10.1016/j.jacr.2015.07.011 |
| [21] |
Tessler FN, Middleton WD, Grant EG, et al. ACR thyroid imaging, reporting and data system (TI-RADS): white paper of the ACR TI-RADS committee[J]. JAm Coll Radiol, 2017, 14(5): 587-95. DOI:10.1016/j.jacr.2017.01.046 |
| [22] |
Delellis RA, Lloyd RV, Heitz P, et al. WHO classification of tumours. Pathology and genetics of tumours of endocrine organs[J]. Anaesthesist, 1979, 28(12): 578-83. |
| [23] |
Ali SZ, Cibas ES. The bethesda system for reporting thyroid cytopathology[Z]. 2009, 132: 658-65.
|
| [24] |
Aschebrook-Kilfoy B, Ward MH, Sabra MM. Thyroid cancer incidence patterns in the united states by histologic type, 1992-2006[J]. Thyroid, 2011, 21(2): 125-34. DOI:10.1089/thy.2010.0021 |
| [25] |
Hoang JK, Langer JE, Middleton WD, et al. Managing incidental thyroid nodules detected on imaging: white paper of the ACR incidental thyroid findings committee[J]. J Am Coll Radiol, 2015, 12(2): 143-50. DOI:10.1016/j.jacr.2014.09.038 |
| [26] |
Singh ON, Brito JP, Maraka S, et al. Diagnostic accuracy of ultrasound-guided fine needle aspiration biopsy for thyroid malignancy: systematic review and meta-analysis[J]. Endocrine, 2016, 53(3): 1-11. |
| [27] |
Horvath E, Majlis S, Rossi R, et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management[J]. J Clin Endocrinol Metab, 2009, 94(5): 1748-51. DOI:10.1210/jc.2008-1724 |
| [28] |
Park JY, Lee HJ, Jang HW, et al. A proposal for a thyroid imaging reporting and data system for ultrasound features of thyroid carcinoma[J]. Thyroid, 2009, 19(11): 1257-64. DOI:10.1089/thy.2008.0021 |
| [29] |
Park VY, Kim EK, Jy K, et al. Thyroid imaging reporting and data system and ultrasound elastography: diagnostic accuracy as a Tool in recommending repeat fine-needle aspiration for solid thyroid nodules with non-diagnostic fine-needle aspiration cytology[J]. Ultrasound Med Biol, 2016, 42(2): 399-406. DOI:10.1016/j.ultrasmedbio.2015.10.011 |
| [30] |
Kim EK, Park CS, Chung WY, et al. New sonographic criteria for recommending fine-needle aspiration biopsy of nonpalpable solid nodules of the thyroid[J]. American J Roentgen, 2002, 178(3): 687-91. DOI:10.2214/ajr.178.3.1780687 |
| [31] |
Russ G, Royer B, Bigorgne C, et al. Prospective evaluation of thyroid imaging reporting and data system on 4550 nodules with and without elastography[J]. Eur J Endocrinol, 2013, 168(5): 649-55. DOI:10.1530/EJE-12-0936 |
 2020, Vol. 40
2020, Vol. 40

