目前心脑血管疾病仍是我国人民健康的最大威胁,其中冠状动脉粥样硬化心脏病(CAD)的发病率及死亡率呈逐年上升趋势[1]。在冠心病的发生及发展过程中,脂质代谢、炎症及氧化应激发挥至关重要作用[2-4]。我们先前的研究发现,脯氨酸/丝氨酸丰富卷曲螺旋蛋白1(PSRC1)能够调节巨噬细胞和肝脏中的胆固醇转运和炎症,从而延缓动脉粥样硬化的进展[5],并且在ox-LDL刺激下,血清膜联蛋白A2(AnnexinⅡ)与巨噬细胞过表达的PSRC1结合的明显增加。血清膜联蛋白A2是一种钙依赖性磷脂结合蛋白,可抑制PCSK9对LDLR降解,从而加速低密度脂蛋白胆固醇(LDL-C)代谢[6-8]。同时其又可诱导炎性细胞因子的产生,增强巨噬细胞吞噬能力,参与炎症反应的过程[9-10]。髓过氧化酶(MPO)可通过氧化低密度脂蛋白(LDL)颗粒和高密度脂蛋白颗粒(HDL),促进内皮下泡沫细胞形成,在动脉粥样硬化过程中发挥作用[11]。相反,对氧磷酶1(PON1)通过与MPO、HDL结合形成三元复合物,发挥抗氧化作用,延缓动脉动脉动脉粥样硬化发展[12]。虽然,血清膜联蛋白A2在脂质代谢及炎症反应过程中起重要作用,但目前国内外仍无相关的研究证实其与冠心病的关系,其是否影响冠心病的发展仍尚无定论。因此本研究通过分析AnnexinⅡ等炎症介质表达水平与CAD、冠脉狭窄程度及Gensini相关性,探讨其与CAD的关系。
1 资料和方法 1.1 研究对象研究纳入于2017年8月~2019年8月在南方医科大学南方医院心血管内科住院,且首次行冠脉造影患者,共200例,包括非冠心病人群(NON-CAD)50例、稳定性心绞痛人群(SAP)50例及急性冠脉综合征人群(ACS)100例。排除标准:重症心肌炎、严重肝功能损害、严重感染性疾病、血液系统性疾病、自身免疫系统疾病、以及临床数据缺失的患者。
1.2 研究方法 1.2.1 病史采集收集所有研究对象包括年龄、性别、临床表现(主要症状及体征),询问吸烟史、糖尿病史,测量身高、质量并计算身体质量指数(BMI)。所有患者入院后均行血常规、血肌酐(Scr)、尿酸(UA)、血脂四项、C反应蛋白(CRP)等检查。其中血脂四项包括:甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.2.2 标本采集所有患者行冠脉造影后,于次日清晨抽空腹静脉血5 mL,肝素抗凝,1000 r/min离心10 min,收集血清备用。应用双抗体夹心法分别测定标本中人膜联蛋白A2(AnnexinⅡ)、人髓过氧化酶(MPO)及人对氧磷酶-1(PON-1)水平,试剂盒均有广州祺正生物科技有限公司提供。
1.2.3冠脉造影冠状动脉造影由心内科导管室专业医师在标准导管室完成,采用Judkins法进行冠状动脉造影,由股动脉或桡动脉路径,送入造影导管行左、右冠状动脉造影,评估冠状动脉狭窄程度,并由另外2名经验丰富的医师进行再次评估并确认。所需评估的冠状动脉包括:左主干、左前降支、左回旋支及右冠状动脉、第1对角支、第2对角支、钝缘支、左室后支、后降支。
1.2.4 诊断标准依据卫生部2010年11月发布的冠心病诊断标准,结合患者的病史、临床表现、辅助检查(心电图、心电图运动负荷试验、超声心动图、核素心肌显像、冠脉CT、冠脉造影)及血清心肌损伤标志物(cTnT、cTnI、CK-MB)等准确诊断冠心病。其中冠心病人群按临床的稳定性分为稳定性心绞痛(SAP)组和急性冠脉综合征(ACS)组[13]。采用Gensini评分系统评估患者冠脉病变的严重程度:直径狭窄≤25%计1分,26%~50%计2分,51%~75%计4分,76%~90%计8分,91%~99%计16分,完全闭塞计32分。根据冠状动脉节段乘以相应系数,左主干病变×5;左前降支病变:近端× 2.5,中端× 1.5,远端×1;对角支病变:D1×1,D2×0.5,左旋回支病变:近端×2.5,远端×1;后降支×1,后侧支×0.5;右冠状动脉病变:近、中、远和后降支均×1,各狭窄冠脉评分之和即为Gensini积分[14]。
1.2.5 统计学分析软件对数据进行统计分析。采用统计软件SPSS 22.0对数据进行统计分析。各组数据均进行正态性检验。计量资料采用均数±标准差表示,正态分布数据两组间比较采用独立样本t检验。非正态分布数据两组间比较采用mann-whitney u秩和检验,多组间比较采用kruskal-wallis秩和检验,相关性分析采用Spearman相关分析。计数资料组间以%表示,采用χ2检验;采用单因素和多因素Logistic回归分析冠心病的危险因素。采用受试者工作特征曲线(ROC曲线)分析不同因素对急性冠脉综合征的预测价值。所有P值采用双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 冠心病组与非冠心病组的相关指标比较根据是否罹患冠心病将研究人群分为CAD组合NON-CAD组。两组人群在性别、糖尿病、吸烟、Scr、LDL-C、HDL-C、CRP、NEU/LYM、MPO、MPO/PON1差异均具有统计学意义(P < 0.05)。CAD组AnnexinⅡ、MPO水平明显高于NON-CAD组(2.20±1.62 vs 1.59± 1.34 ng/L,91.56±42.90 vs 74.45±21.61 ng/L),而在PON1水平低于NON-CAD组(207.82 ± 81.01 vs 189.27 ± 88.01 nmol/L),差异具有统计学意义(P < 0.05,表 1)。单因素回归分析提示AnnexinⅡ、MPO、LDL-C、HDLC、DM、SEX、Smoke、Scr、CRP等为冠心病的危险因素。在调整混杂因素之后,多因素回归分析仍提示AnnexinⅡ为罹患冠心病的危险因素(表 2)。
| 表 1 入组患者临床及实验室检测基线指标比较 Tab.1 Baseline clinical data and laboratory test results of the enrolled patients |
| 表 2 冠心病患者的危险因素的logistic回归分析 Tab.2 Logistic regression analysis of the risk factors of CAD |
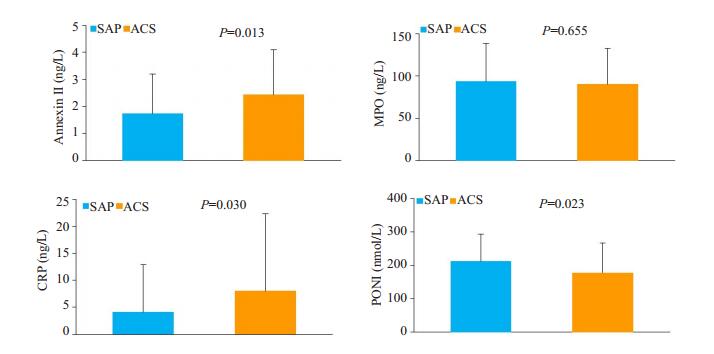
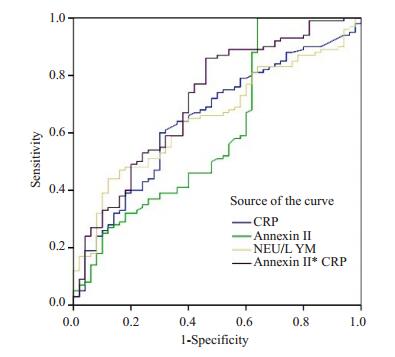
将冠心病患者按照临床稳定性分成稳定性心绞痛组(SAP)和急性冠脉综合征组(ACS)。急性冠脉综合征组患者血清膜联蛋白A2水平(2.43±1.66 vs 1.74± 1.47 ng/L,P=0.013)及CRP水平(4.13±8.73 vs 8.27± 14.24 mg/L,P=0. 030)明显高于稳定性心绞痛组患者,而PON1水平低于稳定性心绞痛组(177.88±89.37 vs 212.05±81.38 nmol/L,P=0.024)(图 1)。ROC曲线分析显示:AnnexinⅡ联合CRP曲线下面积为0.714(95%CI:0.625-0.803,P < 0.001),两者联合可提高对冠心病患者临床稳定性的预测(图 2)。
|
图 1 SAP与ACS患者炎症因子比较 Fig.1 Comparison of inflammatory factors between SAP and ACS patients. SAP: Stable angina pectoris; ACS: Acute coronary syndrome; CRP: C-reactive protein; MPO: Myeloperoxidase; PON1: Paraoxonase-1. |
|
图 2 各项指标预测ACS的ROC曲线 Fig.2 ROC curve of different indicators for predicting ACS. |
将Annexin Ⅱ水平按照三分位法分为C1组(≤1.36 ng/L)、C2组(1.37~2.42 ng/L)、C3组(≥2.43 ng/L),三组患者组间冠脉病变支数及Gensini积分比较差异无统计学意义(表 3)。
| 表 3 AnnexinⅡ与冠脉病变支数及Gensini积分关系 Tab.3 Relationship between Annexin II and coronary lesion count and Gensini score |
依据是否合并糖尿病将冠心病人群分成冠心病糖尿病组和冠心病非糖尿病组。AnnexinⅡ水平在冠心病糖尿病组患者中为2.41±1.72 ng/L,在冠心病非糖尿病组中为2.09±1.57 ng/L,差异无统计学意义(P>0.05)。冠心病亚组分析同样可见合并糖尿病的患者血清AnnexinⅡ水平明显高于不合并糖尿病患者,但差异均无统计学意义(P>0.05,表 4)。
| 表 4 冠心病合并糖尿病与冠心病不合并糖尿病AnnexinⅡ水平比较 Tab.4 Comparison ofAnnexin II levels between the patients with diabetes and those without |
动脉粥样硬化是冠心病发病及死亡的主要原因,其主要病理机制涉及脂质浸入学说、损伤应答学说、血栓形成学说、炎症反应学说等。目前认为炎症反应在粥样硬化斑块发生、演变和破裂的过程中发挥了至关重要作用[15-16]。血清膜联蛋白A2是一种钙依赖性磷脂结合蛋白,可在肺,主动脉,心脏,肾上腺和小肠中高度表达,广泛参与炎症反应,血管增殖、病原菌感染等过程[17]。Jennifer等[9]研究发现,AnnexinⅡ可引起MAP激酶的活化和NF-κB的核转位,导致TNF-α,IL-1β和IL-6等多种炎性细胞因子和趋化因子的产生,多个研究提示,这些炎症因子水平的升高可增加冠心病的风险[18-20]。Wang等[21]还发现AnnexinⅡ可促进巨噬细胞迁移,增加炎症反应;此外Song等[22]研究发现AnnexinⅡ可增加基质金属蛋白酶-2和基质金属蛋白酶-9的表达,在斑块不稳定方面方面发挥重要作用。本研究中,我们首次发现CAD人群较NON-CAD人群血液中存在较高水平的AnnexinⅡ,这种差异在急性冠脉综合征人群中更加明显(P < 0.05)。提示随着冠心病病情的发展,冠心病患者体内炎症反应逐渐加重。这可能与斑块破裂,心肌梗死后炎症因子大量释放和激活有关。CRP作为全身性炎症反应急性期非特异性标志物,在ACS人群中也明显升高。ROC曲线中AnnexinⅡ联合CRP曲线下面积0.714,其与CRP联合可高对ACS的预测价值。
LDL颗粒在动脉粥样硬化形成过程中起核心作用,并且LDL-C水平与冠脉病变严重程度密切相关[23]。在小鼠水平研究发现,AnnexinⅡ敲除的小鼠血浆中LDL-C及PCSK9S水平明显升高,并且AnnexinⅡ的衍生合成肽可在体外阻断PCSK9与LDLR的作用,增加LDLR水平,提示AnnexinⅡ作为LDLR降解的内源性调节剂,可抑制PCSK9对LDLR的降解,从而降低LDL-C水平[7],但一直未见在人体水平的报道。本研究为国内外第一项人体水平的研究,发现冠心病人群AnnexinⅡ水平与冠脉病变支数及Gensini积分并无明显相关性(P>0.05),这可能体内较低的AnnexinⅡ水平虽然可以影响巨噬细胞炎症因子的表达,但不足以引起体内LDL-C水平改变及斑块形成,其与斑块性质的关系还值得进一步研究。
髓过氧化酶是一种存在于巨噬细胞、中性粒细胞内的效应蛋白,可催化多种活性氧的形成,可通过氧化脂蛋白、损害内皮功能、降解细胞外基质等作用,影响斑块形成及性质,因而与冠心病密切相关[11, 24]。本研究中,冠心病患者血清髓过氧化酶水平明显高于非冠心病患者(P < 0.05),这与国外相关研究结果基本一致[25]。而在亚组分析中,SAP组与ACS组MPO水平无统计学差异,说明其可能在急性心血管事件中作用不大。对氧磷酶-1:是一种Ca2+依赖性酯酶,可与HDL-C结合,通过阻止LDL-C过氧化来预防动脉粥化[26]。本研究中,冠心病患者体内PON1水平较非冠心病患者无统计学差异,而ACS组的PON1水平低于SAP组,反应出随着冠心病病情进展呈逐渐降低趋势。既往研究表明血清PON1活性与ACS患者的动脉粥样硬化程度呈负相关[27]。此外PON1剂量依赖性地减弱自发和M1诱导的TNFα和IL-6分泌,PON1减弱M1诱导的活性氧(ROS),并有助于HDL的抗炎活性,从而减轻斑块的进展[28]。除了防止过氧化外,它还可以水解氧化的LDL,降低冠心病的风险[29-30]。传统观点认为,HDL-C水平升高有助于抗动脉粥样硬化,但随着CETP抑制剂的临床研究的失败,因此目前更侧重于HDL功能对心血管保护的作用。Haraguchi等[31]提出将MPO/PON1比值作为反应HDL功能的指标,本研究,冠心病组血清MPO/PON1明显高于与非冠心病组,这种差异在冠心病亚组分析中更加明显,提示其可能是冠心病的危险因素。
糖尿病与动脉粥样硬化的发生关系密切,糖尿病患者体内常存在较高水平的炎症因子[32]。本研究提示,糖尿病患者血清AnnexinⅡ水平稍高于非糖尿病患者,但可能由于样本量较少,这些差异并无统计学意义。
本研究尚存在以下不足之处:首先,本研究单中心研究,样本量较小,代表性不足,结果可能存在偏倚,仍需扩大样本人群予以证实。此外,本研究为病例对照研究,其中混杂了较多变量对研究因素的干扰,需进一步深入研究。
综上所述,本研究首次证明了AnnexinⅡ与罹患冠心病密切相关,尤其在斑块破裂,冠脉阻塞等急性冠脉事件中可明显升高,其联合CRP可作为临床医生预测ACS的简便指标。这些炎症因子水平等升高,提示冠心病与炎症反应存在密切的关系,因此,抗炎治疗有可能是未来干预冠心病的措施之一,有必要进行更深入的研究。此外,本研究发现AnnexinⅡ与冠脉狭窄程度及Gensini积分并无明确关系,其与斑块形成,血脂代谢的关系需要更进一步研究。
| [1] |
胡盛寿, 高润霖, 刘力生, 等. 《中国心血管病报告2018》概要[J]. 中国循环杂志, 2019, 34(3): 209-20. DOI:10.3969/j.issn.1000-3614.2019.03.001 |
| [2] |
Geovanini GR, Libby P. Atherosclerosis and inflammation: overview and updates[J]. Clin Sci (Lond), 2018, 132(12): 1243-52. DOI:10.1042/CS20180306 |
| [3] |
Kattoor A J, Pothineni N, Palagiri D, et al. Oxidative stress in atherosclerosis[J]. CurrAtheroscler Rep, 2017, 19(11): 42. |
| [4] |
Sinning D, Leistner DM, Landmesser U. Impact of lipid metabolism parameters on the development and progression of coronary artery disease:An update[J]. Herz, 2016, 41(4): 273-80. DOI:10.1007/s00059-016-4430-8 |
| [5] |
Guo K, Hu L, Xi D, et al. PSRC1 overexpression attenuates atherosclerosis progression in apoE(-/-) mice by modulating cholesterol transportation and inflammation[J]. J Mol Cell Cardiol, 2018, 116: 69-80. DOI:10.1016/j.yjmcc.2018.01.013 |
| [6] |
Fairoozy RH, Cooper J, White J, et al. Identifying low density lipoprotein cholesterol associated variants in the Annexin A2 (ANXA2) gene[J]. Atherosclerosis, 2017, 261: 60-8. DOI:10.1016/j.atherosclerosis.2017.04.010 |
| [7] |
Seidah N G, Poirier S, Denis M, et al. Annexin A2 is a natural extrahepatic inhibitor of the PCSK9-induced LDL receptor degradation[J]. PLOS ONE, 2012, 7(7): e41865. DOI:10.1371/journal.pone.0041865 |
| [8] |
Kitamura K, Okada Y, Okada K, et al. Epigallocatechin gallate induces an up-regulation of LDL receptor accompanied by a reduction of PCSK9 via the annexin A2-independent pathway in HepG2 cells[J]. Mol Nutr Food Res, 2017, 61(8): 1-12. |
| [9] |
Swisher JF, Khatri U, Feldman GM. Annexin A2 is a soluble mediator of macrophage activation[J]. J Leukoc Biol, 2007, 82(5): 1174-84. DOI:10.1189/jlb.0307154 |
| [10] |
Lin L, Hu K. Tissue-type plasminogen activator modulates macrophage M2 to M1 phenotypic change through annexin A2- mediated NF-kappaB pathway[J]. Oncotarget, 2017, 8(50): 88094-103. |
| [11] |
Teng N, Maghzal G J, Talib J, et al. The roles of myeloperoxidase in coronary artery disease and its potential implication in plaque rupture[J]. Redox Rep, 2017, 22(2): 51-73. DOI:10.1080/13510002.2016.1256119 |
| [12] |
Huang Y, Wu Z, Riwanto M, et al. Myeloperoxidase, paraoxonase-1, and HDL form a functional ternary complex[J]. J Clin Invest, 2013, 123(9): 3815-28. DOI:10.1172/JCI67478 |
| [13] |
Cannon CP, Brindis RG, Chaitman BR, et al. 2013 ACCF/AHA key data elements and definitions for measuring the clinical management and outcomes of patients with acute coronary syndromes and coronary artery disease: a report of the american college of cardiology foundation/american heart association task force on clinical data standards (writing committee to develop acute coronary syndromes and coronary artery disease clinical data standards)[J]. Crit Pathw Cardiol, 2013, 12(2): 65-105. DOI:10.1097/HPC.0b013e3182846e16 |
| [14] |
Gensini GG. A more meaningful scoring system for determining the severity of coronary heart disease[J]. AM J Cardiol, 1983, 51(3): 606. |
| [15] |
Back M, Hansson GK. Anti-inflammatory therapies for atherosclerosis[J]. Nat Rev Cardiol, 2015, 12(4): 199-211. DOI:10.1038/nrcardio.2015.5 |
| [16] |
de Vries MR, Quax PH. Plaque angiogenesis and its relation to inflammation and atherosclerotic plaque destabilization[J]. Curr Opin Lipidol, 2016, 27(5): 499-506. DOI:10.1097/MOL.0000000000000339 |
| [17] |
Bharadwaj A, Bydoun M, Holloway R, et al. Annexin A2 heterotetramer: structure and function[J]. Int J Mol Sci, 2013, 14(3): 6259-305. DOI:10.3390/ijms14036259 |
| [18] |
Xing J, Liu Y, Chen T. Correlations of chemokine CXCL16 and TNFalpha with coronary atherosclerotic heart disease[J]. Exp Ther Med, 2018, 15(1): 773-76. |
| [19] |
de Mello VD, Lankinen M, Schwab U, et al. Link between plasma ceramides, inflammation and insulin resistance: association with serum IL-6 concentration in patients with coronary heart disease[J]. Diabetologia, 2009, 52(12): 2612-15. DOI:10.1007/s00125-009-1482-9 |
| [20] |
Interleukin 1 Genetics Consortium. Cardiometabolic effects of genetic upregulation of the interleukin 1 receptor antagonist: a Mendelian randomisation analysis[J]. Lancet Diabetes Endocrinol, 2015, 3(4): 243-53. DOI:10.1016/S2213-8587(15)00034-0 |
| [21] |
Wang Z, Wei Q, Han L, et al. Tenascin-c renders a proangiogenic phenotype in macrophage via annexin Ⅱ[J]. J Cell Mol Med, 2018, 22(1): 429-38. DOI:10.1111/jcmm.13332 |
| [22] |
Song H, Pan D, Sun W, et al. SiRNA directed against annexin Ⅱ receptor inhibits angiogenesis via suppressing MMP2 and MMP9 expression[J]. Cell Physiol Biochem, 2015, 35(3): 875-84. DOI:10.1159/000369745 |
| [23] |
陈思, 赵金珍, 胡晶, 等. apoB与LDL-C评估冠心病风险的临床价值比较[J]. 南方医科大学学报, 2017, 37(7): 938-42. |
| [24] |
Vanhamme L, Zouaoui BK, Van Antwerpen P, et al. The other myeloperoxidase: Emerging functions[J]. Arch Biochem Biophys, 2018, 649: 1-14. |
| [25] |
Alipour A, Ribalta J, Njo TL, et al. Trans-vessel gradient of myeloperoxidase in coronary artery disease[J]. Eur J Clin Invest, 2013, 43(9): 920-25. DOI:10.1111/eci.12121 |
| [26] |
Mackness B, Durrington PN, Mackness MI. The paraoxonase gene family and coronary heart disease[J]. Curr Opin Lipidol, 2002, 13(4): 357-62. DOI:10.1097/00041433-200208000-00002 |
| [27] |
Gocmen AY, Gumuslu S, Semiz E. Association between paraoxonase-1 activity and lipid peroxidation indicator levels in people living in the Antalya region with angiographically documented coronary artery disease[J]. CLin Cardiol, 2004, 27(7): 426-30. DOI:10.1002/clc.4960270714 |
| [28] |
Aharoni S, Aviram M, Fuhrman B. Paraoxonase 1 (PON1) reduces macrophage inflammatory responses[J]. Atherosclerosis, 2013, 228(2): 353-61. DOI:10.1016/j.atherosclerosis.2013.03.005 |
| [29] |
Shih DM, Gu L, Xia YR, et al. Mice lacking serum paraoxonase are susceptible to organophosphate toxicity and atherosclerosis[J]. Nature, 1998, 394(6690): 284-87. DOI:10.1038/28406 |
| [30] |
Shih DM, Xia YR, Wang XP, et al. Combined serum paraoxonase knockout/apolipoprotein E knockout mice exhibit increased lipoprotein oxidation and atherosclerosis[J]. J Biol Chem, 2000, 275(23): 17527-35. DOI:10.1074/jbc.M910376199 |
| [31] |
Haraguchi Y, Toh R, Hasokawa M, et al. Serum myeloperoxidase/ paraoxonase 1 ratio as potential indicator of dysfunctional highdensity lipoprotein and risk stratification in coronary artery disease[J]. Atherosclersois, 2014, 234(2): 288-94. DOI:10.1016/j.atherosclerosis.2014.03.009 |
| [32] |
Tong HV, Luu NK, Son HA, et al. Adiponectin and pro-inflammatory cytokines are modulated in Vietnamese patients with type 2 diabetes mellitus[J]. J Diabetes Investig, 2017, 8(3): 295-305. DOI:10.1111/jdi.12579 |
 2020, Vol. 40
2020, Vol. 40

