新型冠状病毒肺炎(COVID-19)具有强烈的传染性及家族聚集性, 已在我国多个地区流行。截止至2020年2月29日, 全国31个省市自治区、直辖市累计确诊人数已逾7万人, 累计死亡人数2873人。COVID-19分为轻型、普通型、重型和危重型, 其中重型和危重型死亡率高,住院时间长,临床治疗难度大。临床上若能早期识别重型COVID-19的预警信号,及时进行干预及治疗,可能有助于降低死亡率,提高治愈率,缩短住院时间。因此,本研究通过回顾性分析来自湖北中西医结合医院呼吸四病区及一病区收治的63例COVID-19患者的临床资料,旨在探寻重型COVID-19的危险因素,以期找到重型COVID-19的预警信号, 更好地帮助临床医生早期识别, 及时进行干预和治疗, 以降低死亡率, 提高治愈率, 缩短住院时间。
1 资料和方法 1.1 研究对象收集2020年1月26日~2020年2月20日在湖北武汉中西医结合医院呼吸四病区及一病区住院的COVID-19患者。根据国家卫生与健康委员会办公厅《新型冠状病毒感染的肺炎诊疗方案》(试行第5版)的诊断标准与分型标准,将所入选的患者分为2组:普通型组32例,重型组31例。纳入标准:符合国家卫生与健康委员会办公厅《新型冠状病毒感染的肺炎诊疗方案》(试行第5版)[4]诊断标准的患者。诊断标准如下:临床表现符合发热或和呼吸道症状, 发病早期白细胞总数正常或降低, 淋巴细胞计数减少; 胸部CT提示肺炎影像学表现; 呼吸道标本或血液标本实时荧光RT-PCR检测新型冠状病毒核酸阳性。普通型诊断标准:具有发热、呼吸道症状, 影像学可见肺炎表现; 重型诊断标准:符合上述诊断标准并具有下列任何一条:呼吸窘迫, 呼吸频率(RR)≥30次/min; 静息状态下, 指脉氧饱和度(SPO2)≤93%;动脉氧分压(PaO2)/吸氧浓度(FIO2) ≤300 mmHg。排除标准如下:包括不局限其他类型的细菌性肺炎, 间质性肺炎, 心力衰竭合并肺水肿, 过敏性肺炎, 活动性肿瘤, 服用免疫抑制剂治疗患者; 新型冠状病毒核酸检测阴性患者; 未完成胸部CT检查患者; 未做血氧饱和度监测者; 轻型、危重型患者。共筛选病例63例。
1.2 研究方法本研究为回顾性研究, 所入选的患者在入院24 h内根据标准操作规程抽血, 收集患者的实验室检查指标:中性粒细胞/淋巴细胞比值(NLR)、血清淀粉样蛋白A(SSA)、C反应蛋白(CRP)、血清白蛋白(ALB); 同时收集患者入院时的一般资料(性别、年龄), 基础疾病(高血压、糖尿病、冠心病、肿瘤、肺部疾病), 临床表现(发热、咳嗽、胸闷、喘憋、肺部啰音)。比较两组患者在一般资料、基础疾病、临床表现及实验室检查指标的差异, 采用相关和回归分析其与重型COVID-19的相关性, 并采用ROC曲线评估其在COVID-19的预测效能。
1.3 统计学处理采用SPSS25.0统计学软件进行数据分析。计量资料组间比较, 符合正态分布的数据采用两独立样本t检验, 不符合正态分布的数据采用非参数检验; 计数资料组间比较采用卡方检验; 线性相关性分析采用Pearson相关性分析, 秩相关分析采用Spearman相关性分析, ROC曲线AUC比较采用Z检验, 回归分析采用多元Logistic回归分析, 检验水准α=0.05, 以P < 0.05为差异具有统计学意义。
2 结果 2.1 两组患者比较一般资料比较:普通型组男性15例, 女性17例, 年龄62.25±15.07岁; 重型组男性18例, 女性13例, 年龄64.55±14.88岁, 两组患者在年龄和性别的组间比较差异均无统计学意义(P > 0.05)。基础病史比较:两组患者在糖尿病方面差异有统计学意义(P < 0.05), 而在高血压、冠心病、肿瘤、肺部疾病方面的差异无统计学意义(P > 0.05, 表 1)。临床症状比较:两组患者在发热、咳嗽、胸闷、喘憋、肺部啰音方面的差异无统计学意义(P > 0.05, 表 2)。实验室检查比较:两组患者在FIB指标比较差异无统计学意义(P > 0.05), 在NLR、SSA、CRP、ALB指标比较差异具有统计学意义(P < 0.05, 表 3)。
| 表 1 基础病史比较 Tab.1 Comparison of underlying diseases of the patients |
| 表 2 临床表现比较 Tab.2 Comparison of clinical manifestations of the patients |
| 表 3 实验室检查比较[均数±标准差或中位数(四分位数间距)] Tab.3 Comparison of laboratory test results of the patients [Mean±SD or M(QR)] |
通过将糖尿病、NLR、SSA、CRP、ALB指标与重型COVID-19进行相关性分析显示:糖尿病、NLR、SSA、CRP、ALB与重型新冠状病毒肺炎具有明显相关性(P < 0.05), 其中糖尿病、NLR、SSA、CRP与重型新冠状病毒肺炎呈正相关, ALB与重型新冠状病毒肺炎呈负相关(表 4)。
| 表 4 糖尿病、NLR、SSA、CRP、ALB与重型COVID-19的相关性分析 Tab.4 Correlation analysis of diabetes, NLR, SSA, CRP, ALB with severe COVID-19 |
通过将糖尿病、NLR、SSA、CRP、ALB指标与重型COVID-19进行多因素Logistic回归分析发现, NLR是重型新冠状病毒肺炎的独立危险因素(表 5)。
| 表 5 重型新冠状病毒肺炎危险因素的回归分析 Tab.5 Regression analysis of risk factors of severe COVID-19 |
采用ROC曲线计算NLR曲线下面积, 结果显示: AUC为0.831(95% CI:0.730~0.932), 约登指数最大0.589, 相对应最佳界值4.795, 敏感度为0.839, 特异性为0.750(图 1)。
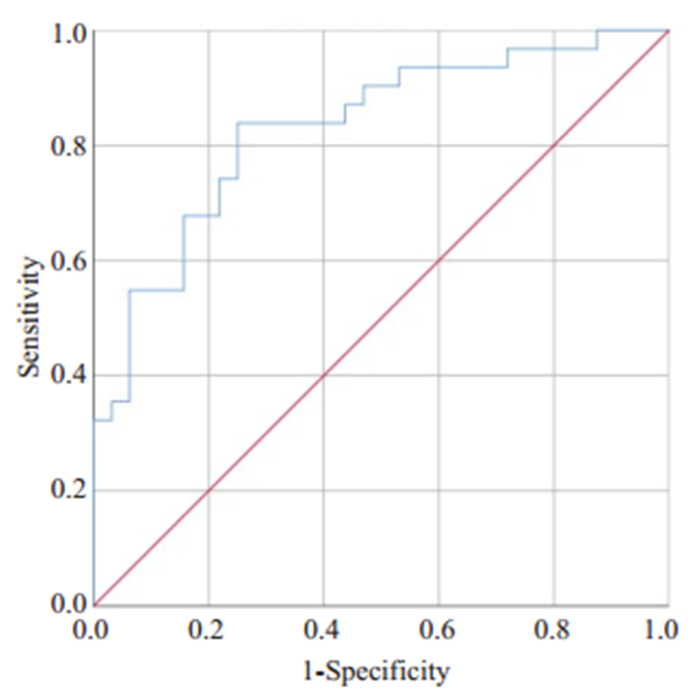
|
图 1 NLR预测重型COVID-19的ROC曲线 Fig.1 Receiver-operating characteristic curve of NLR for predicting severe COVID-19. |
研究结果显示, 两组患者在糖尿病、NLR、SSA、CRP、ALB具有显著性差异(P < 0.05);且糖尿病、NLR、SSA、CRP与重型COVID-19存在正相关(P < 0.05), ALB与重型COVID-19存在负相关(P < 0.05);但通过多因素Logistic回归分析发现, 仅NLR为重型COVID-19的独立危险因素(OR=1.264, 95%CI:1.046~1.526, P= 0.015)。中性粒细胞是机体的重要免疫细胞之一, 在机体被感染因素侵袭时, 能快速趋化聚集至感染部位, 发挥宿主防御、免疫调节等作用[5]。当机体中性粒细胞显著减少时, 发生感染的风险明显升高[6]。淋巴细胞是人体免疫应答的主要效应细胞, 淋巴细胞的数量与机体的免疫力及防御力密切相关, 且机体淋巴细胞数量与炎症程度呈负性相关[7]。NLR同时涵盖两类白细胞亚型的信息, 反映机体中性粒细胞计数和淋巴细胞计数水平的平衡状态及全身性的炎症反应程度, 更加准确地反映炎症反应严重程度与机体免疫状态的平衡关系[8], 被认为是全身炎症反应的重要标志物。据此, 我们推测重型COVID-19可能存在明显的全身炎症反应。
本次暴发流行的COVID-19是由SARS-CoV-2病毒感染所致, 临床上主要以轻型、普通型患者为主。临床观察发现, 部分轻症患者从轻型、普通型转重型、危重型, 过程短, 变化快, 死亡率高, 具体病理生理机制未明。有专家认为, 病情的突然加重, 后期快速出现呼吸窘迫综合征和多器官功能衰竭可能与"炎症因子风暴"相关。炎症因子风暴概念在1993年首次被提出[9], 在2003年非典疫情SARS-CoV病毒感染中因造成急性呼吸窘迫综合征和多器官功能衰竭, 导致极高死亡率而逐步被大家关注[10-12]。SARS-CoV-2病毒与SARS-CoV病毒具有较强的相关性, 在病毒谱上, 两者同属β-CoV冠状病毒[13]; 在基因特征上, 两者具有79.5%的序列相似性[14]; 在临床表现上, 均容易导致多器官衰竭和急性呼吸窘迫综合征。因此, 基于两个病毒较强的相关性, COVID-19患者由轻型、普通型转重型、危重型, 可能与"炎症因子风暴"相关。Huang等[2]研究发现, 与非入住ICU相比, 入住ICU的COVID-19患者血浆中的IL2、IL7、IL10、GSCF、IP10、MCP1、MIP1A、TNFα等炎症因子水平更高, 从侧面反映了重型、危重型患者机体存在明显的炎症反应, 这与我们的研究结果是一致的。
综上, 本研究通过对临床常见危险因素、容易获得的实验室指标进行回顾性分析, 初步研究发现NLR在普通型与重型COVID-19之间存在显著性差异(Z= - 4.510, P < 0.05), 与重型COVID-19存在正性相关(r= 0.495, P < 0.05), 且为重型COVID-19的独立危险因素(OR=1.264, 95%CI:1.046~1.526, P=0.015);应用ROC曲线计算AUC为0.831(95%CI:0.730~0.932), 相对应的NLR最佳界值为4.795, 敏感度为0.839, 特异性为0.750, 具有较高的预测价值。基于本研究结果, 我们认为NLR可以作为重型COVID-19的预警信号, 对重型COVID-19的早期识别能提供一定的客观依据, 同时也能为探索后续治疗机制和临床用药提供一定的参考。但本次研究具有一定的局限性, 如研究样本量较少, 研究性质属于回顾性研究。更加准确与精确的结果, 仍需前瞻性多中心、大样本量的临床研究。
| [1] |
Li Q, Guan X, Wu P, et al. Early transmission dynamics in wuhan, China, of novel Coronavirus-Infected pneumonia[J]. N Engl J Med, 2020. DOI:10.1056/NEJMoa2001316 |
| [2] |
Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [3] |
国家卫生健康委员会卫生应急办公室.截至2月29日24时新型冠状病毒感染的肺炎疫情最新情况[EB/OL]. (2020-02-29)[2020-03-16]. http://www.nhc.gov.cn/xcs/yqtb/202002/4ef8b5221b4d740bda3145ac37e68ed.shtml.
|
| [4] |
国家卫生健康委员会.国家中医药管理局. 新型冠状病毒感染的肺炎诊疗方案(试行第五版)[J]. 中国中西医结合杂志, 2020, 1: 1-3. |
| [5] |
Davalyn RP, Huttenlocher A. Neutrophils in the tumor micro-environment[J]. Trends Immunol, 2016, 37(1): 41-52. DOI:10.1016/j.it.2015.11.008 |
| [6] |
Abrey JY, Henningham A, Fantino E, et al. Increased susceptibility of airway epithelial cells from ataxia-telangiectasia to S. pneumoniae infection due to oxidative damage and impaired innate immunity[J]. Sci Rep, 2019, 9(1): 2627. |
| [7] |
卓超洲, 沈观乐, 余瑞林, 等. NLR、PLR在慢性阻塞性肺疾病合并肺间质纤维化中的临床应用价值[J]. 临床肺科杂志, 2019, 24(12): 2161-5. DOI:10.3969/j.issn.1009-6663.2019.12.006 |
| [8] |
安艳晓, 柳克晔, 王洋, 等. 中性粒细胞与淋巴细胞比值和非瓣膜性房颤患者左房血栓之间的关系研究[J]. 医学研究与教育, 2014, 31(4): 34-7. DOI:10.3969/j.issn.1674-490X.2014.04.009 |
| [9] |
Ferrara JL, Abhyankar S, Gilliland DG. Cytokine storm of graft-versus-host disease: a critical effector role for interleukin-1[J]. Transplant Proc, 1993, 25(1 Pt 2): 1216-7. |
| [10] |
Menno DJ, Cameron PS, Thanh TT, et al. Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia[J]. Nat Med, 2006, 12(10): 1203-7. DOI:10.1038/nm1477 |
| [11] |
Yoshikawa T, Hill T, Li K, et al. Severe acute respiratory syndrome (SARS) coronavirus-induced lung epithelial cytokines exacerbate SARS pathogenesis by modulating intrinsic functions of monocyte-derived macrophages and dendritic cells[J]. J Virol, 2009, 83(7): 3039-48. DOI:10.1128/JVI.01792-08 |
| [12] |
Kao-Jean H, Ih-Jen S, Theron M, et al. An interferon-?-related cytokine storm in SARS patients[J]. J Med Virol, 2005, 75(2): 185-94. DOI:10.1002/jmv.20255 |
| [13] |
叶耀臻, 罗璐婷, 曹劲, 等. 21世纪新兴的三大冠状病毒:SARS-CoV、MERS-CoV和2019-nCoV[J]. 中国人兽共患病学报, 2020, 2. |
| [14] |
Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579(7798): 270-3. DOI:10.1038/s41586-020-2012-7 |
 2020, Vol. 40
2020, Vol. 40

