2. 广州中医药大学顺德医院医学检验中心, 广东 佛山 528333
2. Medical Laboratory Center, Shunde Hospital of Guangzhou University of Chinese Medicine, Foshan 528333, China
2019新型冠状病毒(SARS-CoV-2)可引起新型冠状病毒性肺炎(新冠肺炎), 对我国人民的健康造成了巨大的威胁[1-2], 已作为急性呼吸道传染病已被我国纳入《中华人民共和国传染病防治法》规定的乙类传染病, 按照甲类传染病管理。由于SARS-CoV-2主要通过呼吸道飞沫和密切接触传播, 早发现传染源并进行隔离治疗, 是防治新冠肺炎的重要手段[3]。目前实验室检测仍是诊断新冠肺炎的重要依据, 但由于其传染性强, 检验人员在进行样本检测时将面临极大的风险[4], 而在检验前将样本进行病毒灭活则能大大降低风险。目前已有文献报道使用56 ℃ 30 min和75%乙醇处理咽拭子标本对后续SARS-CoV-2核酸检测无明显影响[5], 而灭活样本对SARS-CoV-2抗体检测是否存在影响尚未见报道。因此本研究探讨56 ℃ 30 min灭活方式对不同方法检测SARS-CoV-2抗体的结果是否存在影响, 报道如下。
1 资料和方法 1.1 研究资料血液样本来自于我院急诊科、感染科及重症医学科的住院患者, 收集日期为2020年2月12~18日。其中阳性样本来源于新型冠状病毒性肺炎确诊患者, 确诊标准为《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》[6], 阴性样本来源于同期非新冠肺炎患者, 并排除免疫功能障碍、恶性肿瘤及使用肝素治疗等患者。所有病例入院时同时采集3管血:黄色带促凝胶采血管采集静脉血3 mL, 3000 r/min离心15 min后分离血清备用; 紫色EDTA-K2抗凝管采集静脉血2 mL, 3000 r/min离心15 min后分离血浆备用; 紫色EDTA-K2抗凝管采集静脉血2 mL为全血标本。所有研究对象或家属均签署知情同意书。
1.2 检测原理及判读标准免疫层析法SARS-CoV-2新型冠状病毒抗体检测试剂(免疫层析法)试剂盒购自广州万孚生物技术股份有限公司, 检测原理是采用免疫层析技术, 应用捕获法检测人血清、血浆、全血中的2019新型冠状病毒总抗体。当检测区及质控区各出现一条红色反应线为阳性, 质控区出现一条红色反应线为阴性。
荧光免疫层析法SARS-CoV-2新型冠状病毒IgM抗体检测试剂(荧光免疫层析法)试剂盒购自广州万孚生物技术股份有限公司, 检测原理是采用捕获法及荧光免疫层析技术, 检测人血清、血浆、全血中的2019新型冠状病毒IgM抗体, 采用免疫荧光检测仪扫描荧光信号。仪器结果显示界面直接显示"阳性""、疑似阳性"及"阴性"。
化学发光免疫分析法新型冠状病毒SARS-CoV-2 IgM抗体检测试剂盒(化学发光免疫分析法)及新型冠状病毒SARS-CoV-2 IgG抗体检测试剂盒(化学发光免疫分析法)试剂盒购自深圳市新产业生物医学工程股份有限公司, 检测原理是化学发光免疫间接法, 采用SARS-CoV-2重组抗原包被磁性微球, 小分子发光标记物标记抗人IgM或IgG单克隆抗体, 利用底物液启动化学发光反应并产生光信号, 检测相对光强度并计算出待测抗体浓度。检测结果 < 0.900 AU/mL为无反应性, 检测结果在0.900~1.10 AU/mL判断为可疑, 检测结果≥1.10 AU/mL为有反应性。IgM检测范围为0.050~30.0 AU/mL, IgG检测范围为0.020~30.0 AU/mL。
1.3 检测方案所有样本均同时采用免疫层析法及荧光免疫层析法检测SARS-CoV-2抗体, 由于全血样本不能用于化学发光免疫分析法, 因此血清和血浆样本采用化学发光免疫分析法检测SARS-CoV-2 IgM和IgG抗体。检测完毕后, 所有样本置于56 ℃水浴箱放置30 min灭活病毒。灭活后样本按原来检测方案全部复测1次, 比较灭活前与灭活处理后抗体检测结果。所有操作符合生物安全要求。
1.4 统计学分析免疫层析法及荧光免疫层析法为定性试验, 检测结果为分类变量, 采用"阴性""、疑似"或"阳性"表示。化学发光免疫分析法为半定量实验, 根据检测数值判定为"有反应性""、可疑"或"无反应性"。分别计算样本灭活前后检测结果的阳性符合率、阴性符合率及总符合率, 采用Pearson相关分析灭活前后血清及血浆样本IgM和IgG半定量检测结果。采用GraphPad Prism 5.0软件进行绘图及统计学分析, P < 0.05认为差异有统计学意义。
2 结果 2.1 灭活前与灭活处理后免疫层析法检测结果采用免疫层析法检测灭活前后样本中SARS-CoV-2总抗体, 比较结果发现, 血清与血浆阳性各11例灭活前为阳性的样本, 经56 ℃ 30 min灭活后处理后, 各有1例变为阴性, 而灭活前为阴性的血清及血浆样本各10例, 阳性样本符合率为90.9%。灭活处理后全部均为阴性, 阴性符合率为100.0%。血清样本及血浆样本灭活前与灭活处理后的总符合率均为95.2%(κ= 0.905, P < 0.001)。全血11例阳性样本与10例阴性样本灭活前与灭活后检测结果完全一致, 总符合率为100.0%(κ=1.000, P < 0.001, 表 1)。
| 表 1 灭活前与灭活处理后免疫层析法检测结果 Tab.1 Immunochromatographic results before and after heat inactivation of the samples |
| 表 2 灭活前与灭活处理后荧光免疫层析法检测结果 Tab.2 Fluorescence immunochromatographic results before and after heat inactivation of the samples |
采用荧光免疫层析法检测灭活前后样本中SARS-CoV-2 IgM抗体, 比较结果发现, 血清、血浆及全血样本经56 ℃ 30 min灭活处理后, 所有样本的检测结果均为阳性, 其中阳性符合率为100.0%, 但阴性符合率为0%, 总符合率为47.6%。
2.3 灭活前与灭活处理后化学发光免疫分析法检测结果采用化学发光免疫分析法检测灭活前后血清及血浆样本中SARS-CoV-2 IgM及IgG抗体, 经56 ℃ 30 min灭活处理后再检测, 其中血清IgM、IgG及血浆IgG检测结果与灭活前一致, 阳性符合率、阴性符合率及总符合率为100.0%(κ=1.000, P < 0.001), 1例血浆IgM灭活前为可疑(1.079 U/mL), 灭活后检测结果为无反应性(0.889 U/mL), 因此血浆IgM总符合率为95.2%(κ= 0.881, P < 0.001, 表 3)。
| 表 3 灭活前与灭活处理后化学发光免疫分析法检测结果 Tab.3 Chemiluminescence immunoassay results before and after heat inactivation of the samples |
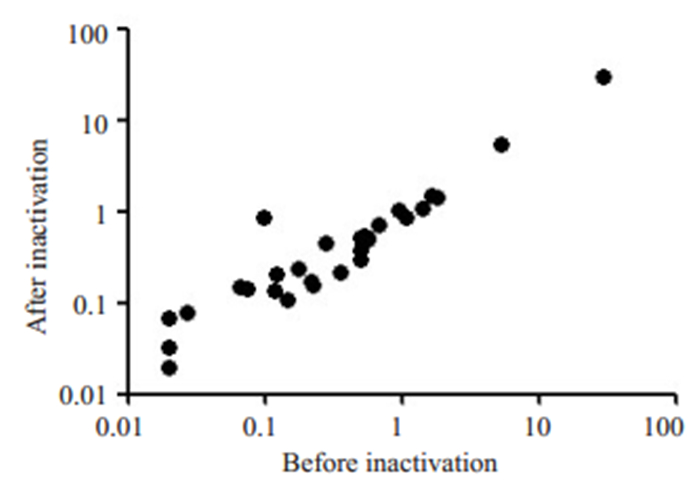
采用Pearson相关对灭活前后血清及血浆样本IgM和IgG检测结果进行相关性分析, 其中IgM灭活前后结果的相关系数为0.9999(95% CI:0.9998~1.000, P < 0.001), IgG灭活前后结果的相关系数为0.9999(95% CI:0.9998~1.000, P < 0.001, 图 1)。
|
图 1 灭活前后化学发光法检测IgM结果相关性 Fig.1 Correlation between chemiluminescence immunoassay results before and after heat inactivation of the samples. |
SARS-CoV-2属于β属冠状病毒, 与蝙蝠SARS样冠状病毒同源性超过85%, 具有高度的传染性, 可引起新冠肺炎[7]。SARS-CoV-2对紫外线和热敏感, 56 ℃ 30min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒[8]。SARS-CoV-2核酸检测阳性是确诊新冠肺炎的主要实验室依据[9], 然而, 核酸检测耗时较长, 且易受到取材等因素的影响存在一定的假阴性, 因此, SARS-CoV-2抗体检测是诊断新冠肺炎的重要辅助手段, 是核酸检测的良好补充。由于已确证医学实验室人员在接触患者血液、尿液、粪便等样本时可产生气溶胶, 造成检验人员的感染[4], 除了做好生物安全防护外, 在不影响检测结果的前提下, 若能在检测前将样本进行灭活处理, 将大大降低感染的几率。因此, 本研究通过比较不同方法检测灭活前与灭活处理后样本的结果差异, 探讨56 ℃ 30 min灭活处理对不同方法测定SARS-CoV-2抗体检测结果的影响。
本研究发现, 免疫层析法检测SARS-CoV-2总抗体的结果基本不受样本灭活的影响, 其所有样本类型的阴性符合率均达到100%, 而11例灭活前检测结果为阳性的血清及血浆样本中, 只有1例在灭活后转变成阴性, 阳性符合率为90.9%。采用化学发光免疫分析法检测血清IgM、IgG及血浆IgG的结果与灭活前一致, 阳性符合率、阴性符合率及总符合率为100.0%, 血浆IgM 1例灭活前为可疑阳性, 灭活后检测结果为无反应性, 因此血浆IgM总符合率为95.2%。提示灭活处理对检测结果影响较小, 对化学发光免疫分析法检测血清IgM、IgG结果基本无影响。采用荧光免疫分析法检测SARS-CoV-2 IgM, 灭活前结果为阴性的标本, 灭活处理后所有检测结果均为阳性, 阴性符合率为0, 表明此方法不可采用56 ℃ 30 min灭活处理后的样本进行检测。
针对免疫层析法1例在经灭活处理后变成阴性的阳性样本, 结合化学发光免疫分析法检测IgM及IgG结果进行进一步分析, 发现两种方法前后不一致的样本来源于同一例患者。查阅其病历资料, 发现此患者处于感染初期, 化学发光免疫分析法检测血浆IgM检测结果为1.079 U/mL, 处于灰区0.9~1.10 U/mL, 经灭活处理后结果为0.889 U/mL, 变为无反应性, IgG在灭活前后结果均为无反应性, 考虑由于本身抗体滴度较低, 处于临床诊断的临界值附近, 需复查或结合临床症状综合判断。
化学发光免疫分析法检测SARS-CoV-2 IgM或IgG为半定量方法, 通过光电倍增管测出相对光强度, 与样本中的待测抗体呈一定正相关比例关系, 可在一定程度上反应患者体内IgM及IgG浓度的变化, 可用于SARS-CoV-2感染的辅助诊断。最近有文献报道, 患者恢复期血清可能用于新冠肺炎的治疗[10-11], IgM及IgG半定量检测有助于了解患者体内抗体水平, 对临床上开展抗体的采集有一定的指导意义。采用Pearson相关性分析灭活前后血清及血浆样本IgM和IgG检测结果, IgM及IgG灭活前后结果的相关性良好, 相关系数均达到0.9999(95%CI:0.9998~1.000, P < 0.001), 进一步证明56 ℃ 30 min灭活处理不会对化学发光免疫分析法检测SARS-CoV-2 IgM或IgG结果造成影响, 为了降低检验人员感染风险, 可在检测前对标本进行灭活处理。
综上所述, 56 ℃ 30 min灭活处理血液样本对免疫层析法及化学发光免疫分析法检测SARS-CoV-2抗体结果几乎无影响, 可在检测前先进行灭活以降低检验人员感染风险, 荧光免疫层析法不可使用灭活后样本进行检测。然而, 本研究存在一些不足:由于时间紧迫且样本来源较少, 本次纳入研究的总样本量较小, 且仅有1例抗体水平处于临床诊断灰区。在后续研究中应加大样本量, 并增加灰区样本量, 将有助于进一步明确灭活处理对检测结果的影响, 为降低临床检验人员的感染风险提供新策略。
| [1] |
Nishiura H, Jung SM, Linton NM, et al. The extent of transmission of novel coronavirus in wuhan, China, 2020[J]. J Clin Med, 2020, 24(9): pii: E330. DOI:10.3390/jcm9020330 |
| [2] |
HuiDS, I AzharE, MadaniTA, et al. The continuing 2019-nCoV epi-demic threat of novel coronaviruses to global health-the latest 2019 novel coronavirus outbreak in Wuhan, China[J]. Int J Infect Dis, 2020, 91: 264-6. DOI:10.1016/j.ijid.2020.01.009 |
| [3] |
关于印发医疗机构内新型冠状病毒感染预防与控制技术指南(第一版)的通知(.国卫办医函[2020]65号)[EB/OL].2020. http://www.nhc.gov.cn/yzygj/s7659/202001/b91fdab7c304431eb082d67847d27e14.shtml.
|
| [4] |
华文浩, 盛琳君, 宋丽红, 等. 生物安全Ⅱ级实验室开展新型冠状病毒感染患者实验检测的风险评估与防控[J]. 中华检验医学杂志, 2020, 43(00): E007-E007. DOI:10.3760/cma.j.issn.1009-9158.2010.0007 |
| [5] |
陈培松, 何宇婷, 黄裕立, 等. 不同方式灭活口咽拭子标本对2019新型冠状病毒实时荧光定量PCR检测结果的影响[J]. 中华检验医学杂志, 2020, 43(00): E004-E004. DOI:10.3760/cma.j.issn.1009-9158.2020.0004 |
| [6] |
国家卫生健康委".新型冠状病毒感染的肺炎诊疗方案"(试行第五版)[EB/OL]. 2020. http://www.nhc.gov.cn/yzygj/s7653p/202002/3b09b894ac9b4204a79db5b8912d4440.shtml.
|
| [7] |
Chu DKW, Pan Y, Cheng SMS, et al. Molecular diagnosis of a novel coronavirus (2019- nCoV) causing an outbreak of pneumonia[J]. Clin Chem, 2020, pii: hvaa029. DOI:10.1093/clinchem/hvaa029 |
| [8] |
中华人民共和国卫生健康委员会.国卫办医函[2020]109号.新型冠状病毒肺炎实验室检测技术指南(第四版). http://www.nhc.gov.cn/jkj/s3577/202002/573340613ab243b3a7f61df260551dd4.shtml.
|
| [9] |
Corman VM, Landt O, Kaiser M, et al. Detection of 2019 novel coro-navirus (2019-nCoV) by real-time RT-PCR[J]. Euro Surveill, 2020, 25(3). DOI:10.2807/1560-7917.ES.2020.25.3.2000045 |
| [10] |
Mair-Jenkins J, Saavedra-Campos M, Baillie JK, et al. The effec-tiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis[J]. J Infect Dis, 2015, 211(1): 80-90. DOI:10.1093/infdis/jiu396 |
| [11] |
李辉, 王业明, 徐九洋, 等. 2019新型冠状病毒抗病毒治疗有药可期[J]. 中华结核和呼吸杂志, 2020, 43(00): E002-E002. DOI:10.3760/cma.j.issn.1001-0939.2020.0002 |
 2020, Vol. 40
2020, Vol. 40

